CKD 3 ~5 期患者外周血T 淋巴细胞CD154 表达能力的变化
杨 涛 王惠明 颜 奇 丁国华
慢性肾脏病(CKD)患者随着肾功能的减退,将不可逆的向终末期肾病进展,需肾脏替代治疗。研究显示CKD 3 期后的患者病死率逐渐升高,死亡原因中感染占第2 位[1]。慢性肾脏病患者感染呈现发生率高、易反复、病情重、病死率高等特点,免疫功能紊乱是患者感染的重要因素。尿毒症患者的免疫功能下降与尿毒症状态下各种免疫细胞的功能异常相关,这些免疫细胞包括:中性粒细胞、单核细胞、巨噬细胞、NK 细胞、T/B 淋巴细胞等[2]。这些免疫细胞可表现为绝对数量的异常、分泌各种细胞因子的异常、表面受体/配体的表达异常,它们之间的相互影响、相互作用促成尿毒症患者免疫功能的异常。
CD40 分子属于肿瘤坏死因子受体(TNFR)超家族的Ⅰ型跨膜糖蛋白,主要表达于不同分化阶段的B细胞、造血前体细胞、单核- 吞噬细胞、树突状细胞(DC)和多种不同组织来源的肿瘤细胞等。CD154 是CD40 分子的配体(CD40L),CD154 也称gp39、肿瘤坏死因子相关激活蛋白(TRAP)、T 细胞-B 细胞活化分子(T-BAM),为33kDa 的Ⅱ型跨膜糖蛋白,共有266aa,其中胞膜外区214 个氨基酸,与TNF 在氨基酸水平具有较高的同源性。CD154 主要表达于活化的CD4+T 淋巴细胞,部分活化的CD8+T 细胞、嗜碱性粒细胞、肥大细胞、NK 细胞也有表达。活化T细胞膜表达CD154 与CD40 的结合,为T/B 细胞活化提供必需的第二信号,对B 细胞的激活、增殖、同型转换、浆细胞抗体的表达,对T 细胞活化增殖,对抗原递呈细胞的成熟等均有有着重要的临床意义[3~6]。Contin 等[7]研究显示抑制B 细胞上CD40 与配体CD154 的结合,可导致B 细胞分泌的免疫球蛋白减少。目前尚无CKD 3 ~5 期患者T 细胞CD154 表达变化的相关报道。本研究针对慢性肾脏病患者T 细胞上CD154 的表达,从T 细胞角度探讨了CKD 3 ~5期患者的免疫功能紊乱。
资料与方法
1.一般资料:选取健康人为对照组,CKD 3 ~5 期未透析患者、CKD5 期透析患者为实验组,检测各组受试者外周血T细胞比例、活化T 细胞CD154 的表达。实验组纳入标准:慢性肾脏病3 ~5 期未透析患者;透析组选取血液透析或腹膜透析超过6 个月患者。实验组排除标准:①合并有糖尿病或原发病为糖尿病肾病患者,系统性红斑狼疮等风湿性疾病所致肾衰竭患者,肾脏淀粉样变患者,肿瘤患者;②近期合并感染性疾病、消化道出血、严重心脑血管疾病患者;③CKD 并发急性肾损伤患者。健康人群17 人(男性/女性为10/7),患者平均年龄50.18±3.36 岁;未透析组30 人(男性/女性为19/11),患者平均年龄56.10±3.06 岁;透析组20 人(男性/女性为12/8),患者平均年龄53.10±3.78 岁,年龄、性别比较差异无统计学意义(P <0.05)。
2.主要试剂及仪器:红细胞裂解液购自美国Biolegend 公司;淋巴细胞分离液购自中国达科为公司;鼠抗人的PE antihuman CD40L、FITC anti - human CD3、APC anti -human CD8及同型对照购自美国Biolegend 公司;离子霉素(Inomycin)及佛波酯(PMA)购自美国Alexis 公司;流式细胞仪为BD Accuri C6。
3.检测方法:活化CD4+T 淋巴细胞及表面CD154 的检测:采用肝素抗凝管留取受试者外周血,取全血200μl 加入RPMI 1640 培养基800μl,加入离子霉素(1μg)+佛波酯(50ng),孵育5h,采用红细胞裂解液裂解红细胞后,运用Biolegend 公司的PE anti-human CD154、FITC anti -human CD3、APC anti -human CD8 及同型对照染色,流式细胞仪分析。取2ml 全血运用淋巴细胞分离液获取PBMC,一部分同上直接染色,流式细胞仪分析,另一部分运用流式细胞仪计数,按2 ×106/ml 比例加入1640 完全培养基(加有10% 的小牛血清),加入离子霉素(1μg)+佛波酯(50ng),孵育5h,染色后流式细胞仪分析。
4.统计学方法:采用SPSS 17.0、GraphPad Prism、BD Accuri C6 自带软件进行数据处理、做图,多组间比较采用单因素方差分析,两变量之间的相关关系采用一元线性相关分析,实验组与正常组配对做t 检验,以P <0.05 为差异有统计学意义。
结 果
1.各组外周血T 细胞频率比较:相对于对照组,CKD 3 ~5 期未透析组患者外周血淋巴细胞中T 细胞频率下降,差异有统计学意义(P <0.05);CKD5 期透析组较对照组及未透析组差异均无统计学意义(对照组为72.05% ±2.65%;未透析组为63.06% ±3.37%;透析组为68.92% ±3.22%)(P <0.05,图1)。
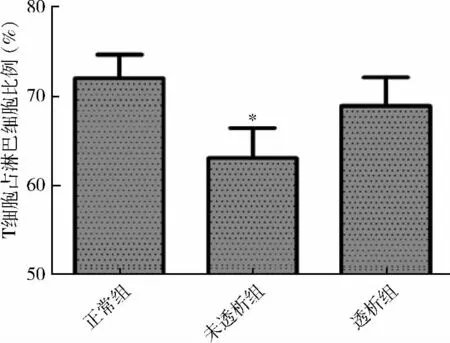
图1 各组外周血淋巴细胞中T 淋巴细胞表达频率
2. 各组受试者外周血CD3+CD8-T 细胞上CD154 的比较:未活化的T 细胞在各组均未见CD154明显表达;运用离子霉素联合佛波脂刺激T 细胞后可见CD154 的表达上调。各组全血提取PBMC 后再刺激,实验组CD3+CD8-T 细胞上CD154 表达较对照组差异无统计学意义(对照组65.33% ±3.00%;未透析组59.72% ±3.01%;透析组65.53% ±1.63%);各组全血刺激后,CKD 3 ~5 期未透析组CD3+CD8-T 细胞CD154 表达下降(P = 0. 037),维持性透析组CD3+CD8-T 细胞上CD154 的表达较对照组差异无统计学意义(对照组79.78% ± 2. 00%;未透析组73.61% ± 1. 91%;透析组78. 94% ± 2.47%,P <0.05,详见图2、图3。
讨 论
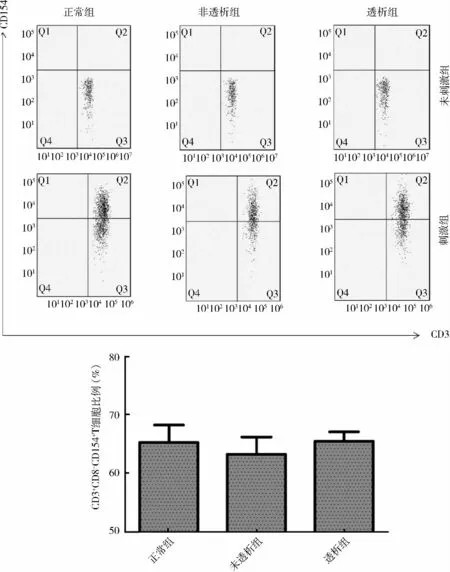
图2 各组PBMC 刺激后CD3 +CD8 - CD154 + T 细胞占CD3 +CD8 - T 细胞频率
健康人外周血淋巴细胞中T 细胞比例为70% ~80%。本研究显示,相对于对照组CKD 3 ~5 期未透析患者存在淋巴细胞比例下降,透析后比例恢复正常,说明在非透析患者中存在影响T 细胞比例的因素。在运用离子霉素及佛波酯激活T 细胞过程中,CD4+T 细胞表面的CD4 的表达下调,故本研究检测CD8-T 细胞代表CD4+T 细胞。实验中可见各组外周血在去除血浆及其他细胞的影响后(提取PBMC),其活化的CD3+CD8-T 淋巴细胞上CD154 表达差异无统计学意义;而在全血刺激后,CKD 3 ~5 期未透析组CD3+CD8-T 细胞CD154 表达明显下调,维持性组CD154 表达恢复。此现象说明,在CKD 3 ~5 期未透析患者中,存在抑制CD154 表达的因素。
Yoon 等[8]报道尿毒症患者毒素蓄积(如氮质血症、氧化应激、糖基化终末产物、铁的超负荷、炎症)所致幼稚T 细胞、记忆T 细胞凋亡、耗损增加。本实验中CKD 3 ~5 期患者外周血T 细胞频率下降与之相关。CKD 3 ~5 期未透析患者外周血同时存在T 细胞比例下降,膜表面CD154 的表达下调,可能影响了患者T 细胞介导的细胞免疫和体液免疫功能。透析后患者T 细胞表达频率及膜表面CD154 表达恢复可能与相关抑制因素清除相关。有研究显示,炎性细胞中也可见CD154 与CD40 的表达,这些炎性细胞也可能会影响到细胞活化,刺激CD154 的表达;维持性透析中,机体会接触各种异体物质,可能刺激炎症产生,上调了T 细胞上CD154 的表达[9]。本实验中未明确影响T 细胞CD154 表达能力的具体因素,但慢性肾脏病患者存在各种尿毒症毒素的蓄积,推测其表达下调可能为各种毒素协同所致。
综上所述,CKD 3 ~5 期未透析患者存在T 细胞的频率下降,同时伴有CD3+CD4+T 细胞CD154 的表达能力下降,可能是患者免疫力下降、容易感染的重要原因。
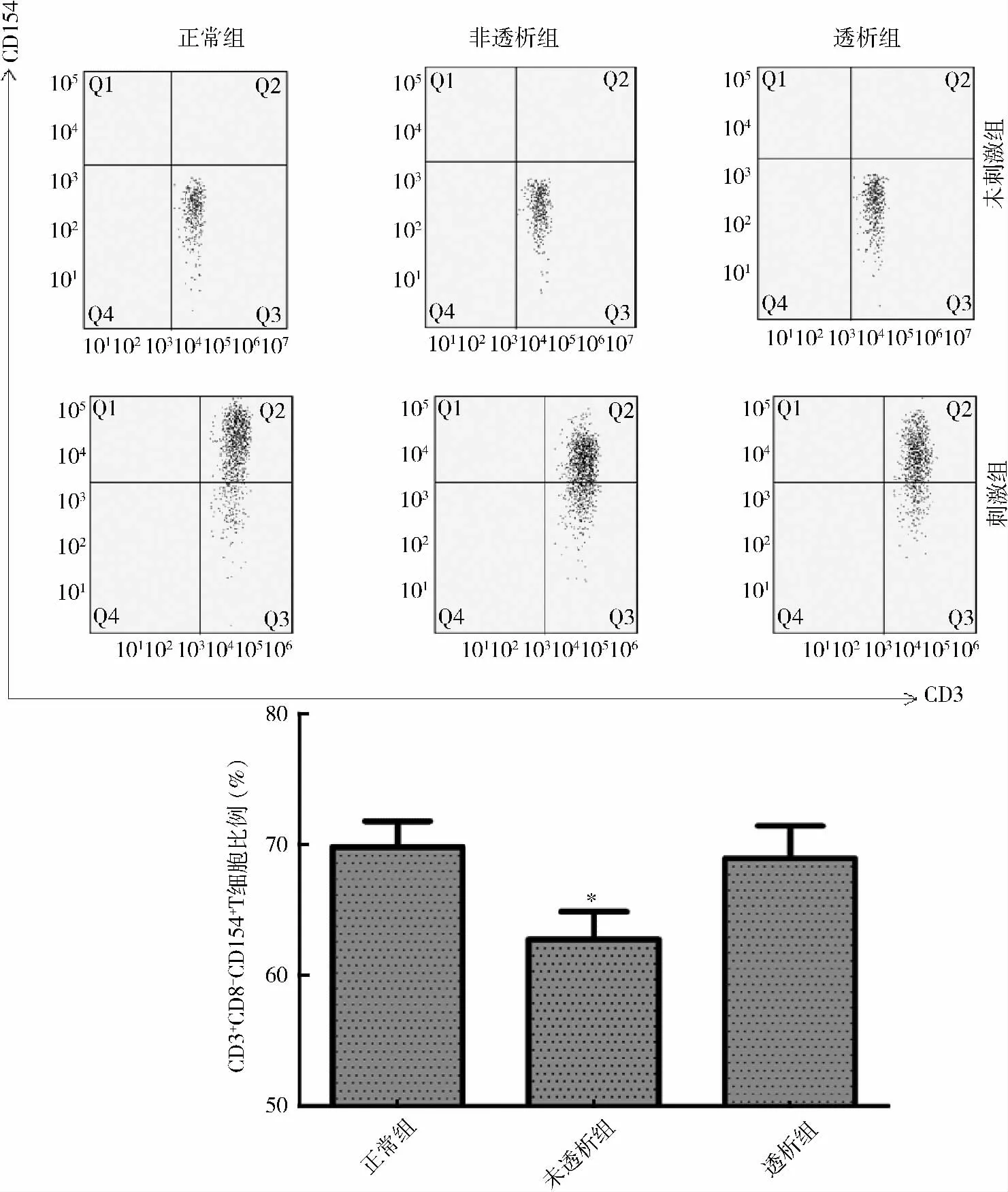
图3 全血刺激后各组CD3 +CD8 - CD154 + T 细胞占CD3 +CD8 - T 细胞频率
1 Kato S,Chmielewski M,Honda H,et al.Aspects of immune dysfunction in end- stage renal disease[J]. Clin J Am Soc Nephrol,2008,3:1526 -1533
2 Eleftheriadis T,Antoniadi G,Liakopoulos V,et al. Disturbances of acquired immunity in hemodialysis patients[J]. Semin Dial,2007,20:440 -451
3 Durie FH,Foy TM,Masters SR,et al. The role of CD40 in the regulation of humoral and cell - mediated immunity[J]. Immunol Today,1994,15:406 -411
4 Klaus SJ,Berberich I,Shu G,et al. CD40 and its ligand in the regulation of humoral immunity[J]. Semin Immunol,1994,6:279 -286
5 Schonbeck U,Libby P. The CD40/CD40L receptor/ligand dyad[J].Cell Mol Life Sci,2001,58 (1):4 -43
6 O'Sullivan B,Thomas R. CD40 and dendritic cell function[J]. Crit Rev Immunol,2003,23:83 -107
7 Contin C,Pitard V,Delmas Y,et al. Potential role of soluble CD40 in the humoral immune response impairment of uraemic patients[J]. Immunology,2003,11:131 -140
8 Yoon J,Gollapudi S,Pahl M,et al. Naïve and Central Memory T -cell lymphopenia in endstage renal disease[J]. Kidney Int,2006,70:371 -376
9 Rizvi M,Pathak D,Freedman JE,et al. CD40 -CD40 ligand interactions in oxidative stress,inflammation and vascular disease[J]. Trends Mol Med,2008,14:530 -538

