射频消融治疗复发性肝癌24例临床分析
应立平,冯济业,王金波,吴宗杨,李元洪
(宁波市鄞州人民医院 肝胆外科,浙江 宁波 315040)
肝癌术后3年的复发率可高达57%~81%,小肝癌根治性切除后5年复发率亦在50%以上[1]。手术再切除是复发性肝癌再治疗的首选手段,但是由于肝癌复发时往往为多个病灶,不适宜再次手术切除,或由于肝癌患者的肝炎、肝硬化背景,复发时余肝储备功能不足等原因,目前复发性肝癌患者只有10.4%~27.4%能接受再次手术切除治疗。对于复发间隔时间较短(≤1年)的肝癌患者,由于再次切除后复发可能性较大,预后较差,这部分患者同样不适合再次手术切除。因此非手术治疗手段逐渐成为新的治疗肝癌切除术,其中射频消融术(radiaofrequency ablation,RFA)是近年来发展迅速的一种热消融手段,已广泛应用于肝脏[2]、肾脏[3]、胰腺[4]等肿瘤的局部治疗,并且取得较好的疗效。它借助热效应使癌灶发生凝固性坏死以达到清除肿瘤的目的,随着设备、技术的不断完善和经验积累,其治疗肝癌的有效性已被广泛接受。RFA消融的对象主要是直径≤5.0 cm的癌结节,尤其是对直径≤3.0 cm的癌结节其疗效可以与手术切除相媲美[5-6]。
1 资料和方法
1.1 一般资料
2012年6 月至2013年6月在我院行肝脏肿瘤射频消融术24例患者,均为病理学确诊为肝癌,其中单发病灶16例,2个或2个以上病灶8例,共计34个肿块。其中男17例,女7例。肿块直径平均(3.8±1.6)cm,其中肿块直径≤3 cm 25例,≥5 cm 3例,3~5 cm 6例。患者术前肝功能Child分级:A级22例,B级2例;其中AFP升高的患者12例,无心、肺、肾等主要脏器损伤。
1.2 术前准备
术前常规行AFP、肝脏彩超、肝脏增强螺旋CT、肝功能和凝血功能等检查,明确肝脏肿块的位置、大小、是否合并肝硬化及程度及肝功能的Child-Pugh分级;术前积极予护肝治疗,改善凝血功能和肝脏储备功能,必要的营养支持治疗,改善营养状态;术前与患者充分沟通交流病情,消除患者紧张、焦虑等情绪。
1.3 治疗方法
采用Cool-Tip冷循环射频治疗仪(美国Radionics公司)和Tyco中空冷循环穿刺针。经皮超声定位下射频消融包括:术前禁食12 h,禁水4 h,待全身麻醉后,利用B超穿刺架精确定位,在B超引导下准确穿刺突破肿瘤后界0.5~1.0 cm,开动冷循环泵,使冰纯净水在针体内流动,保持针尖温度在15~25℃,自动射频消融12 min。其功率在 80~200 W之间,时间到后关闭冷循环,加热针道至90 ℃以上,毁损针道。
1.4 疗效评估
术后随访术后3个月追踪观察患者B超、增强CT、超声造影、血清肿瘤标记物(AFP)等,观察病灶的回声、大小、是否有强化以及血清肿瘤标记物的变化。术前后监测血常规、肝肾功能、电解质等实验室数据变化以及体温、有无疼痛、恶心等。
2 结果
2.1 消融率
所有患者均在B超引导下完成射频治疗,肿块直径≤3 cm的完全消融率(CA)为96.00%(24/25),3~5 cm为66.67%(4/6),≥5 cm为66.67%(2/3)。肿块直径≤3 cm射频治疗疗效确切,其中6个不完全消融肿块分别在术后3~6个月再次行射频治疗。详见表1。
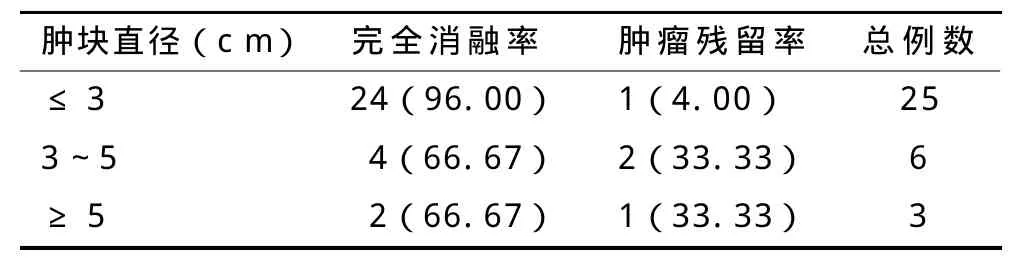
表1 射频消融术后的肿块消融率(例,%)
2.2AFP变化
24例患者共有12例术前AFP升高,术后11例下降,其中转阴6例;另有1例升高,经影像学检查,该例AFP升高患者出现肝内转移灶。
2.3 术中及术后并发症
术中及术后出现腹痛7例(29.17%),恶心3例(12.50%),发热10例(41.67%),肝功能异常9例(37.50%),经过护肝等治疗一周后基本恢复术前水平。全组无术中死亡,无中转开腹,无术后出血。
3 讨论
近年来,RFA技术因其具有创伤小、痛苦轻、恢复快、安全等特点在国内外得到了广泛的开展。研究表明,射频消融对于直径3 cm及以下的肝癌治疗效果最佳,5年生存率与局部肝切除相当[7-8],也有报道指出射频消融治疗可改善肝癌患者机体的免疫功能[9]。据Rossis等[10]报道,RFA治疗小肝癌,肿瘤的完全消融率为95%。本研究中,25个≤3 cm的肿块中其中24个肿块(96.00%)达到了病灶完全灭活,与文献报道相似。对于肿块≤3 cm的患者,射频消融与再次手术切除的效果相当,且射频消融术在出血、住院时间、费用等方面要优于手术组,并发症少[11],而且对于很多因各种原因无法进行手术的患者仍可行射频治疗。因此,对于最大径≤3 cm的患者,RFA可作为首选治疗方式之一。但是对于直径为3~5 cm和>5 cm的复发性肝癌,单次RFA后影像学癌灶残留发生率分别高达17.5%~38.7%和50.0%~76.1%[12-13]。这些患者未能达到病灶完全消融,主要是由于射频电极单次热凝最大有效范围直径约为3~5 cm。B超的二维图像往往不能真实的反映肿瘤的三维结构,即使多次消融,也可能遗漏肿瘤,对于直径超过3 cm的肝癌病灶,则需要联合其它治疗手段以提高疗效,如联合PEI、经导管肝动脉栓塞化疗等。
另外对于射频后是否存在残余的评价中由于超声造影可显示微血管特性,对于富血供型肝癌射频消融治疗后肿瘤是否灭活的评断相比于增强CT更敏感。因此,超声造影可作为肝癌射频消融后检测疗效的常规工具[14]。
在临床肝癌诊治过程中,血清AFP的动态变化,结合影像定位检查,有助于肝癌治疗的疗效观察及监测肝癌术后的复发与转移[15]。术后血清AFP一般在肿瘤切除60 d内降至正常范围(平均5.6 d为一个半衰期)[16],而AFP的再次升高通常表示肝癌术后的复发或转移。本研究中12例患者术前AFP升高,术后11例下降,其中转阴6例,另有1例升高,经影像学检查,该AFP升高例患者出现肝内转移灶。
近年来,随着RFA方法的广泛应用和治疗病例的增加,有关RFA治疗引起的并发症的报道也逐渐增多。有文献报道射频治疗肝肿瘤的严重并发症发生率约为2.2%~8.9%,病死率为0.09%~1.60%。经过术前完善准备,术中仔细操作,术后严密监测下,本次研究术中及术后出现腹痛7例(29.17%),恶心3例(12.50%),发热10例(41.67%),肝功能异常9例(37.50%),未出现严重并发症及病死患者。掌握并发症发生的原因及处理方法,有助于更好的选择适应证,提高射频消融的安全性。
本研究结果提示射频消融治疗复发性肝癌近期疗效确切,安全性高,尤其对于小病灶(直径≤3 cm)疗效更佳,是可行、有效和安全的,与手术切除效果接近,且术后并发症要比手术明显减少。但是对于3~5 cm尤其是≥5 cm的肿块,单纯依靠射频治疗的效果就明显下降,此时联合TACE、PEI等联合治疗可提高治疗效果。近年来随着射频技术的逐步改进,临床经验的逐步累积,治疗效果令人满意,射频消融治疗在肝癌治疗上的地位逐年提高。
[1] 黄洁夫. 肝脏胆道肿瘤外科学 [M]. 北京: 人民卫生出版社, 1999:168-171.
[2] Aslinia F, Mindikoglu AL. Radiofrequency ablation in patients with hepatocellular carcinoma [J]. Hepatology, 2009, 50(6):2053-2054.
[3] del Cura JL, Zabala R, Iriarte JI, et al. Treatment of renal tumors by percutaneous ultrasound-guided radiofrequency ablation using a multitined electrode: effectiveness and complications [J]. Eur Urol, 2010, 57(3): 459-465.
[4] Hadjicostas P, Malakounides N, Varianos C, et al. Radiofrequency ablation in pancreatic cancer [J]. HPB(Oxford), 2006, 8(1):61-64.
[5] 陈敏山, 李锦清, 梁惠宏, 等. 经皮射频消融与手术切除治疗小肝癌的疗效比较 [J]. 中华医学杂志, 2005, 85(2): 80-83.
[6] 吕明德, 匡铭, 梁力建, 等. 手术切除和经皮热消融治疗早期肝癌的随机对照临床研究 [J]. 中华医学杂志, 2006, 86(12): 801-805.
[7] Chen MS, Li JQ, Zheng Y, et a1. A prospective randomized trial comparing percutaneous local ablative therapy and partial hepatectomy for small hepatocellular carcinoma [J]. Ann Surg,2006, 243(3): 321-328.
[8] Solbiati L, Livraghi T, Goldberg SN, et a1. Pereutaneous radiofrequency ablation of hepatic metastases from colorectal cancer long-term results in 177 patients [J]. Radiology, 2001, 221(1): 159-166.
[9] 李刚, 寸英丽, 杨丽春. 肝癌患者射频消融后血清Th1、Th2型细胞因子的变化 [J]. 肝胆胰外科杂志, 2010, 22(2): 94-96.
[10]Rossi S, Di Stasi M, Buscarini E, et a1. Pereutaneous RF interstitial thermal ablation in the treatment of hepatic cancer [J].AJR Am J Roentgenol, 1996, 167(3): 759-768.
[11]Liang HH, Chen MS, Peng ZW, et a1. Percutaneous radiofrcqueney ablation versus repeat hepaleclomy for recurrent hepatocellular carcinoma: a retrospective study [J]. Ann Surg Oneol, 2008, 15(12): 3484-3493.
[12] Rodríguez-Sanjuán JC, González F, Juanco C, et a1. Radiological and pathological assessment of hepatocellular carcinoma response to radiofrequency. A study on removed liver after transplantation [J]. World J Surg, 2008, 32(7): 1489-1494.
[13]Lam VW, Ng KK, Chok KS, et a1. Incomplete ablation after radiofrequency ablation of hepatocellular carcinoma: analysis of risk factors and prognostic factors [J]. Ann Surg Oncol,2008, 15(3): 782-790.
[14]Hu HX, Xie XY, Lu MD, et a1. Ultrasound-guilded pereutaneous thermal ablation of imptocellular carcinoma using microwave and radiofrequency ablation [J]. Clin Radiol, 2004, 59(1): 53-61.
[15] 吴孟超. 肝脏外科学 [M]. 2版. 上海: 上海科学技术文献出版社, 2000: 185-186.
[16] 万德森, 李锦清, 陈敏山. 原发性肝癌切除术后血清甲胎蛋白半衰期的测定及其临床意义 [J]. 中华消化杂志, 1995, 15(4): 206-208.

