大脑中动脉栓塞大鼠缺血半暗区神经可塑性蛋白及神经因子的表达☆
田甜车念聪龙建飞王蕾邹海艳赵晖
·论 著·
大脑中动脉栓塞大鼠缺血半暗区神经可塑性蛋白及神经因子的表达☆
田甜*车念聪*龙建飞*王蕾*邹海艳*赵晖*
目的观察缺血半暗区神经生长营养因子和抑制因子的表达变化,探讨微环境改变对神经元轴突再生、突触重建的影响。方法线栓法建立大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)大鼠模型,HE染色观察脑组织病理改变;Western blot方法检测轴突再生标志蛋白生长相关蛋白-43(growth associated protein, GAP-43)及突触可塑性蛋白突触素(synaptophysin,SYN)的表达;Western blot方法检测脑源性神经营养因子(brain-derived neurotrophic factor,BDNF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、血管生成素1(angiopoietin-1,Ang1)及抑制因子NogoA(neurite outgrowth inhibitor-A)、Nogo受体(Nogo receptor,NgR)、RhoA(ras homolog gene family member A)的表达。结果大脑中动脉栓塞15 d大鼠缺血半暗区皮层神经元数目低于假手术组(P<0.01),GAP-43表达较假手术组下调(P<0.05),神经生长抑制因子NogoA、NogoR、RhoA表达高于假手术组(均P<0.05);二组大鼠缺血半暗区皮层SYN及营养因子BDNF、VEGF、Ang1表达水平无明显差异(均P>0.05)。结论神经生长抑制因子分泌增多可能与大脑中动脉栓塞导致缺血半暗区神经元轴突再生障碍发生机制相关。
大脑中动脉栓塞模型缺血半暗区 神经营养因子 抑制因子
缺血性脑卒中为脑血管疾病中最为常见的临床类型[1],其病灶由缺血中心区和周围低灌区,即缺血半影区组成[2]。半暗带区的损伤是可逆的,拯救半暗区神经细胞,促进损伤神经元轴突的延长与神经突触的重塑是脑缺血临床治疗的主要目的[3]。越来越多的研究表明,中枢神经系统损伤后不能有效再生除与成熟神经元可塑性降低还与再生微环境关系密切[4]。本文通过观察缺血半暗区神经生长营养因子及抑制相关因子的表达变化,分析再生微环境对神经元轴突再生、突触重建的影响。
1 材料与方法
1.1 实验动物SPF级雄性SD大鼠25只,体质量350~370 g,由北京维通利华实验动物技术有限公司提供,合格证号:SCXK(京)2012-0001。动物饲养在首都医科大学实验动物中心SPF级实验室,动物实验设施许可证号:SYXK(JING)2010-0020。动物在实验室适应1周后正式进行实验。开始实验时,动物随机分为中动脉栓塞组(模型组)15只、假手术组10只。
1.2 实验方法
1.2.1 中动脉栓塞大鼠模型制备[5]采用SPF级雄性SD大鼠,体质量350~370 g,线栓法复制大脑中动脉栓塞(middle cerebral artery occlusion,MCAO)模型。待大鼠麻醉清醒后即刻观察其活动状态,术后出现明显左侧偏瘫体征(不能完全伸展左前肢、行走时向左侧倾倒或转圈者)纳入实验对象。假手术组大鼠麻醉后,仅暴露颈内外动脉分支,不闭塞大脑中动脉。
1.2.2 取材与标本处理 各组随机取5只动物,4%多聚甲醛心内灌注固定,待固定充分后,开颅取脑,切取视交叉后4 mm组织块,于4℃外固定1周后,常规石蜡包埋,连续切片,用于HE染色、免疫组织化学染色使用。各组另取5只动物,冰浴上分离脑组织,用于Western blot检测。
1.2.3 HE染色检测病理改变切片脱蜡,常规苏木精-伊红染色,光学显微镜下观察脑组织病理形态学改变。在半暗区顶叶皮层选取5个视野,利用NIS-Elem ents Basic Research图像采集分析系统统计缺血半暗区皮层神经元细胞数。
1.2.4 Western blot方法检测样品蛋白电泳分离,转印到PVDF膜,放入5%脱脂奶粉封闭60 min,将膜与一抗GAP-43(EPITOMIC1:50000)、Synapto⁃physin(EPITOMICS 1:100000)、BDNF(Epitomics 1:10000)、VEGF(abcam 1:7000)、Ang-1(MILL⁃PORE 1:2000)、NogoA (abcam1:20000)、NogoR (MILLPORE 1:2000)、RhoA (Cell Signaling 1:2000)、β-tublin(康为1:50000)、GAPDH(康为1:10000)4℃孵育过夜;二抗(山羊抗兔IgG-辣根过氧化物酶;Abcam公司1:20000)室温孵育1 h;化学发光、显影、定影、曝光,洗片。扫描胶片,Im⁃age J软件分析特异性条带,读取条带积分光密度值(IOD)。目的蛋白数值除以内参蛋白GAPDH、Tublin数值以校正误差,所得结果代表目的蛋白相对含量。
1.3 统计学方法数据进行正态性检验,服从正态分布的定量资料用(±s)表示,采用SPSS11.5执行Independent-Samples T Test,进行Levene方差齐性检验,若总体方差齐同采用双侧检验比较组间差异,方差不齐采用单侧检验比较组间差异。检验水准α=0.05。
2 结果
2.1 中动脉栓塞大鼠缺血半暗区皮层病理改变HE染色显示,假手术组大鼠脑组织结构完整,神经元密集,胞浆丰富,胞核居中染色清楚(见图1A)。中动脉栓塞后,缺血中心区神经元大量变性坏死,缺血半暗区部分神经元变性坏死,胞体皱缩,胞核不清,核染色质固缩,嗜酸性增加见(图1)。
统计结果显示,缺血半暗区顶叶皮层神经元计数(21.86±6.47)较假手术组皮层神经元(64.17±4.02)明显减少(t=10.025,P<0.01)。
2.2 中动脉栓塞大鼠缺血半暗区皮层轴突再生标志蛋白GAP-43及突触可塑性蛋白SYN表达Western blot检测结果如图2、表1所示。中动脉栓塞15天大鼠缺血半暗区皮层GAP-43表达较假手术组明显降低(P<0.05),而SYN的表达较假手术组无统计学差异(P>0.05)。
2.3 中动脉栓塞大鼠缺血半暗区皮层神经生长营养因子BDNF、VEGF、Ang1蛋白的表达Western blot检测结果如图4、5所示。中动脉栓塞15 d大鼠缺血半暗区皮层BDNF、VEGF、Ang1表达较假手术组无统计学差异(P>0.05)。
2.4 中动脉栓塞大鼠缺血半暗区皮层神经生长抑制因子NogoA、NgR、RhoA蛋白的表达Western blot检测结果如图6、7所示。中动脉栓塞15 d大鼠缺血半暗区皮层NogoA、NgR、RhoA蛋白表达均较假手术组明显增强(P<0.05)。
3 讨论

表1 中动脉栓塞大鼠缺血半暗区皮层GAP-43、SYN表达(IOD比值)
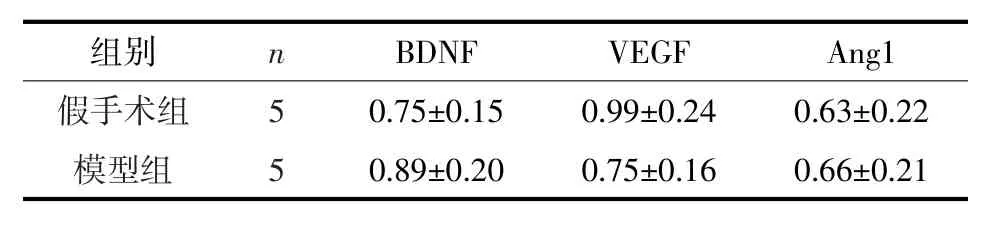
表2 中动脉栓塞大鼠缺血半暗区皮层BDNF、VEGF、Ang1表达(IOD比值)

表3 中动脉栓塞大鼠缺血半暗区皮层NogoA、NgR、RhoA表达(IOD比值)
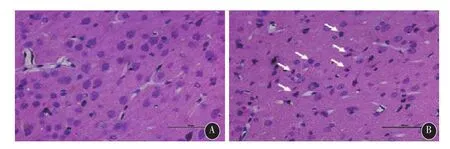
图1 HE染色假手术组:A组,中动脉栓塞模型组:B组(标尺:50μm)图中显示,缺血半暗区顶叶皮层部分神经元变性,细胞皱缩,核染色质固缩

图2 Western blot检测GAP-43、SYN表达 内参蛋白GAPDH为对照

图4 Western blot检测BDNF、VEGF、Ang-1表达 内参蛋白GAP⁃DH、Tublin为对照

图6 Western blot检测NogoA、NgR、RhoA表达 内参蛋白Tublin为对照
神经可塑性是脑功能康复的重要基础,神经元突起再生过程中合成的结构蛋白对轴突的生长、新突触形成及功能完善具有明显的调控作用,是影响神经元再生的内在因素。生长相关蛋白-43(growth associated protein,GAP-43)是一种特异性分布于生长锥和突触前膜上的磷酸蛋白,作为轴突再生的标记蛋白,在引导轴突生长、神经元细胞骨架的重新装配及维持突触功能等方面起着重要作用[6]。突触素(synaptophysin,Syn)是突触囊泡膜上的钙结合蛋白,是神经出芽的特异性分子标志物[7]与突触重建关系密切[8]。研究显示,脑缺血后,轴索损伤,轴突在失去靶器官后,会出现发芽,形成许多侧支,突触前囊泡数量增加,如果轴突末梢在缺血半暗区未找到靶器官,其生长自动停止,则突触前囊泡数量下降,因此在神经损伤修复过程中,GAP-43、SYN的表达常常出现逐渐增加,随后又降至正常水平的变化趋势[9]。在本次实验中,我们也注意到中动脉栓塞第15天,大鼠缺血半暗区皮层SYN蛋白表达较假手术组无明显增高。而GAP-43的蛋白表达较假手术组降低,结果表明,中枢神经损伤后,机体内源性修复能力有限,轴突再生困难,这与相关文献报道一致[8-10]。
研究表明,中枢微环境中营养因子、抑制因子可相互作用,影响神经元轴突的再生。Nogo蛋白(neurite outgrowth inhibitor)是中枢神经再生抑制作用最强的物质。相关研究表明,脑缺血所致神经损伤可迅速诱导NogoA mRNA表达[11]。NogoA蛋白活性片段Nogo-66的细胞表面受体(Nogo recep⁃tor,NgR),通过其N端功能区与NogoA特异性结合,激活细胞内RhoA-Rho激酶信号通路,引起神经元生长锥的溃变,抑制神经轴突生长[12]。
而脑源性神经营养因子(brain derived nerve raetor,BDNF)可通过提高cAMP水平,激活蛋白激酶A(protein kinase,PKA),抑制RhoA(Ras homolog gene family,member A)信号通路,促进轴突再生[13]。两种血管生长因子,血管内皮生长因子(vscu⁃lar endothelial growth factor,VEGF)和血管生成素(angiopoietin,Ang)相互协调[14],对新生血管形成[15],缺血脑区血液供应及神经元损伤后的修复具有重要的调节作用。
在实验中,我们发现中动脉栓塞15天后,缺血半暗区神经生长抑制因子NogoA、NogoR、RhoA表达明显增高,而营养因子BDNF、VEGF、Ang1表达较假手术组没有明显改变,提示,内源性神经营养因子的修复作用有限,随着缺血时间延长,半暗区神经生长抑制因子表达增加,可激活RhoA激酶信号,不利于神经再生。已有大量研究显示,药物、针刺、康复训练可促进神经再生营养因子分泌,拮抗轴突生长抑制蛋白,促进神经再生[16-18]。脑缺血损伤的修复再生是神经科学领域迫切需要解决的难题,深入研究神经生长营养/抑制因子的表达变化,探讨中药、康复治疗改善中枢微环境,提高内源性修复能力的作用及机制,将为脑缺血疾病提供新的治疗策略。
[1]Campard PK,Tasiaux B,Octave JN.The processing and biologi⁃cal function of the human amyloid precursor protein(APP):les⁃sons from different cellular models[J].Exp Geronto,2000,35 (6):843-850.
[2]Chen J1,Zhang C,Jiang H,Li Y,et al.Atorvastatin induction of VEGF and BDNF promotes brain plasticity after stroke in mice[J].Cereb Blood Flow Metab,2005,25(2):281-290.
[3]Heiss WD.The ischemic penumbra:correlates in imaging and implications for treatment of ischemic stroke[J].Cerebrovasc Dis,2011,32(4):307-320.
[4]Moon LD,Asher RA,Fawcett JW,et al.Limited growth of sev⁃ered CNS axons after treatment of adult rat brain with hyaluroni⁃dase[J].Neurosci Res,2003,71(1):23-37.
[5]许金秀,杨牧,周红.大鼠永久性大脑中动脉阻塞模型的建立[J].四川动物,2010,29(3):461-466.
[6]Zhang C,Guo Y,Slater B J,et al.Axonal degeneration,regener⁃ation and ganglion cell death in a rodent model of anterior isch⁃emic optic neuropathy(rAION)[J].Experimental eye research, 2010,91(2):286-292.
[7]刘广义.大鼠脑缺血再灌注损伤后GAP-43及IGF-1在神经系统中的表达[J].中华神经外科疾病研究杂志,2008,7(3): 223-224.
[8]Seo HG,Kim DY,Park HW,et al.Early motor balance and co⁃ordination training increased synaptophysin in subcortical re⁃gions of the ischemic rat brain[J].Journal of Korean medical sci⁃ence,2010,25(11):1638-1645.
[9]陈歆然,叶兰香,廖松洁,等.实验性脑梗死后硫酸软骨素蛋白多糖的表达[J].中国神经精神疾病杂志,2014,40(4): 209-212.
[10]王晓婷,梁志坚,陈莉,等.局灶性大脑皮层梗死后对侧皮质脊髓束纤维重塑的实验研究[J].中国神经精神疾病杂志,2013,39(5):279-283.
[11]Pourabdolhossein F,Mozafari S,Morvan-Dubois G,et al.No⁃go receptor inhibition enhances functional recovery following ly⁃solecithin-induced demyelination in mouse optic chiasm[J]. PLoS One,2014,9(9):e106378.
[12]Wälchli T,Pernet V,Weinmann O,et al.Nogo-A is a negative regulator of CNS angiogenesis[J].Proceedings of the National Academy of Sciences,2013,110(21):E1943-E1952.
[13]Baydyuk M,Xu B.BDNF signaling and survival of striatal neu⁃rons[J].Frontiers in cellular neuroscience,2014,28(8):25.
[14]Ergul A,Alhusban A,Fagan S C.Angiogenesis a harmonized targetforrecoveryafterstroke[J].Stroke,2012,43(8): 2270-2274.
[15]温红梅,黄如训.血管特异性生长因子与缺血性脑血管病的治疗[J].国外医学脑血管病分册,2004,12(3):204-207.
[16]吴晓莉,王宏涛,张会欣,等.大鼠脑缺血后缺血区BDNF表达变化及通心络的影响[J].疑难病杂志,2009,18(5): 265-267.
[17]翟志永,聂莹雪,赵传胜,等.强制性运动疗法对大鼠脑缺血再灌注后神经修复及Rho激酶表达的影响[J].中国医科大学学报,2008,37(3):295-298.
[18]王菲,耿鑫,陶华,等.重复经颅磁刺激对血管性痴呆大鼠海马CA1区BDNF、NMDAR1、SYN表达及超微结构的影响[J].中国神经精神疾病杂志,2010,36(7):397-400.
(责任编辑:李立)

图1 35岁男性患者,A,DSA显示瘘口位于T9平面,引流静脉迂曲走行;B,微导管到位后先行置入弹簧圈2个阻缓血流;C,术中注射Glubran胶并部分渗透至引流静脉起始端将瘘口完全闭塞;D,术后造影示SDAVF完全闭塞
SDAVF年发病率为5-10/100万[3],病因尚不明确,主要发病机制为脊髓静脉高压,其预后与患者术前病程长短联系紧密[4]。本病多见于中老年人,99%患者大于30岁,男性多发,瘘口分布常见于T6~L2[5]。本组病例与文献报道相近。
SDAVF检查方法主要有脊髓MR及DSA。脊髓MR可作为本病初筛检查,脊髓DSA为诊断本病金标准,可以确定瘘口所在部位并清晰地显示病变处的血管分布情况[1]。
SDAVF治疗关键在于闭塞瘘口,主要有手术及介入栓塞治疗。手术治疗效果明确,极少复发。随着栓塞材料的改进,介入栓塞治疗的复发率降低,且因其创伤小,术后无痛,住院周期短等优点而被广泛应用[6]。现栓塞材料最常用为液态栓塞剂Glubran胶和Onyx胶。Glubran胶的优点为栓塞作用持久,在使用胶时凭借微导管本身的占位作用部分/完全阻断供血动脉,产生一个类似“block”的效果,这样既能控制血流,利用注射推力使Glubran向前推进铸形到达SDAVF引流静脉起始端,又能防止Glubran胶逆流,以免造成正常血管误栓,但因其为黏附性材料,可发生“黏管”,注射后必要立即撤管;Onyx胶优点为不黏管,但有一定的潜在血管毒性。注射时要求Onyx胶围绕导管头端产生一个“block”,利用“等待”技巧提高Onyx的穿透力以更好地渗透进入SDAVF引流静脉起始端[7]。治疗时栓塞剂弥散到引流静脉起始端对于长久栓塞效果的保持尤为重要,但要注意避免栓塞剂飘进引流静脉。瘘口引流静脉有正常引流功能,一旦闭塞,脊髓静脉引流障碍,加重脊髓静脉高压,患者临床症状将难以改善甚至进一步加重。
Nogueira等[8]应用Onyx胶行介入栓塞治疗时发现其可以很好进入引流静脉起始段并闭塞瘘口,然而Black⁃burn等[9]发现NBCA较Onyx胶治疗效果更为明确。本组用Onyx胶栓塞6例,Glubran胶栓塞7例,弹簧圈+Glubran胶栓塞1例,栓塞后即刻造影均提示瘘口成功栓塞,引流静脉未见显影,14例患者随访未见复发。患者经血管内栓塞治疗术后改良Aminoff-Logue评分较术前减少,运动及排便功能术后未见病例加重。
综上所述,血管内栓塞治疗SDAVF疗效确切,其疗效与患者术前病程长短密切相关。
参考文献
[1]梁朝辉,张鸿祺,焦保华,等.硬脊膜动静脉瘘误诊误治33例报告[J].中国神经精神疾病杂志,2011,37(01):19,23,36.
[2]凌锋,张鸿祺,李萌,等.脊髓血管畸形的治疗和长期随访[J].中华神经外科杂志,2004,20(02):122-126.
[3]Clark S,Powell G,Kandasamy J,et al.Spinal dural arteriove⁃nous fistulas--presentation,management and outcome in a sin⁃gle neurosurgical institution[J].Br J Neurosurg,2013,27(4): 465-470.
[4]黄理金,冯文峰,彭林,等.硬脊膜动静脉瘘的诊断与显微手术治疗[J].中国神经精神疾病杂志,2007,33(5):306-308.
[5]Clark S,Powell G,Kandasamy J,et al.Spinal dural arteriove⁃nous fistulas--presentation,management and outcome in a sin⁃gle neurosurgical institution[J].Br J Neurosurg,2013,27(4): 465-470.
[6]Patsalides A,Santillan A,Knopman J,et al.Endovascular man⁃agement of spinal dural arteriovenous fistulas[J].J Neurointerv Surg,2011,3(1):80-84.
[7]段传志.实用神经介入放射学[M].广州:广东教育出版社,2012:118-126,249-254
[8]Nogueira RG,Dabus G,Rabinov JD,et al.Onyx embolization for the treatment of spinal dural arteriovenous fistulae:initial experi⁃ence with long-term follow-up.Technical case report[J].Neuro⁃surgery,2009,64(1):E197-198;discussion E8.
[9]Blackburn SL,Kadkhodayan Y,Ray WZ,et al.Onyx is associat⁃ed with poor venous penetration in the treatment of spinal dural arteriovenousfistulas[J].JNeurointerv Surg,2014,6(7): 536-540.
【中图分类号】R651.2 (收稿日期:2014-11-04)
Neuronal plasticity and the changes of microenvironment at the ischemic neocortical penumbra after cere⁃bral artery occlusion in rats.
TIAN Tian,CHE Niancong,LONG Jianfei,WANG Lei,ZOU Haiyan,ZHAO Hui.School of Chinese Medicine,Capital Medical University,Beijing 100069,China.Tel:010-83950159.
ObjectivesTo investigate the effects of nerve nutrient factors and inhibitory factors on neuronal regen⁃eration and axonal reconstruction at ischemic neocortical penumbra after focal cerebral ischemia in rats.MethodsThe rat model of middle cerebral artery ischemia was established using suture-occluded method.The pathological morpholo⁃gy of brain tissue was examined by using HE staining.The expression levels of GAP-43 SYN,nutrient factor(BDNF VEGF Ang1)and inhibitory factor(NogoA NogoR RhoA)were determined by using Western blotting technique.ResultsThe number of neurons in ischemic penumbra was significantly decreased in model group(P<0.01)than in sham-operat⁃ed group.The expression levels of GAP-43 were significantly decreased(P<0.05)while the expression levels of NogoA NgR and RhoA in the thalamus were significantly increased(P<0.05)in model group than in sham-operated group.The expression levels of SYN and nutrient factors(BDNF VEGF Ang1)were not different between the model group and sham-operated group.ConclusionThe increase in nerve inhibitory factors may contribute to the down-regulation of neu⁃rogenesis at ischemic neocortical penumbra after focal cerebral ischemia in rats.
Middle cerebral artery Ischemic penumbra Nutrient factor Inhibitory factor
R743.3
A
2014-07-02)
A (责任编辑:甘章平)
10.3936/j.issn.1002-0152.2015.01.004
☆ 国家自然科学基金(编号:30973782,81473745);北京市自然科学基金(编号:7122018);北京市属高等学校高层次人才引进与培养计划-长城学者项目(编号:CIT&TCD20140329);北京市属高等学校人才强教深化计划“中青年骨干人材培养计划”项目(编号:PXM-2011014226)
* 首都医科大学中医药学院(北京100069)

