长白山牛皮杜鹃凋落物分解及土壤动物的作用
包剑利, 殷秀琴, 李晓强
1 东北师范大学地理科学学院, 长春 130024 2 吉林省动物资源保护与利用重点实验室, 长春 130024
长白山牛皮杜鹃凋落物分解及土壤动物的作用
包剑利1, 殷秀琴1,2,*, 李晓强1
1 东北师范大学地理科学学院, 长春 130024 2 吉林省动物资源保护与利用重点实验室, 长春 130024
凋落物分解是生态系统养分循环的重要环节。土壤动物对凋落物分解具有重要作用。有关高山常绿小灌木凋落物分解及土壤动物作用的研究鲜有报道。采用凋落物网袋法对长白山北坡岳桦林带(42°03′41.23″ N,128°03′12.75″ E,1900 m)牛皮杜鹃(Rhododendronchrysanthum)凋落物的分解过程进行了为期1a的野外观测与室内试验研究,采用4、2 mm和0.01 mm三种网孔凋落物袋来控制不同体型的土壤动物的参与,以研究凋落物的分解率、养分动态及土壤动物在凋落物分解中的作用。结果表明,4、2 mm和0.01 mm网孔凋落物分解率分别为34.19%、31.22%和25.45%。分解率表现出显著的季节差异性。从总体上来看,网袋内凋落物的总氮含量先增后减;C/N呈下降趋势。对分解起主要作用的优势类群是甲螨亚目和等节跳科。土壤动物总个体数与养分元素的释放关系显著,中小型土壤动物对有机碳的释放起到重要作用。截至2012年10月末试验结束,全部土壤动物对牛皮杜鹃凋落物分解质量损失的贡献率为25.57%,中小型土壤动物贡献率(16.88%)> 大型土壤动物贡献率(8.69%)。大型土壤动物和中小型土壤动物在牛皮杜鹃凋落物分解过程中所起的作用,具有不同步性。
土壤动物; 牛皮杜鹃凋落物; 养分动态; 分解作用; 岳桦林; 长白山
凋落物分解是生态系统物质循环和能量流动的主要途径。其分解过程主要受到气候、土壤性质、凋落物质量和土壤生物的控制[1]。土壤动物是陆地生态系统的的组分之一,对生态系统功能和稳定性具有重要的意义[2]。土壤动物通过物理粉碎、化学消化以及刺激微生物的活性和活动方式等途径来调控分解过程[3- 10]。土壤动物在营养元素循环,尤其是N、P元素循环中具有重要作用[11]。近年来,森林凋落物分解的研究引起了国内外学者们的广泛关注,但是对于长白山垂直植被带凋落物的研究报道不多,尤其是对于岳桦林带灌木优势种牛皮杜鹃凋落物分解的研究还未见报道。本文通过野外调查及室内实验探究长白山牛皮杜鹃(Rhododendronchrysanthum) 凋落物分解及土壤动物在凋落物分解中的作用,旨在为长白山岳桦林带生态系统稳定及可持续发展提供土壤动物学依据。
1 研究区概况
本试验研究区设在长白山北坡岳桦林带(42°03′41.23″ N,128°03′12.75″ E,1900 m),其气候主要特点为冷而多强风,具体为冬季寒冷而多风,1月平均温度为-19—-20 ℃,夏季多雨而湿润,7月平均温度为10—14 ℃,年降水量为1000—1100 mm。岳桦林乔木优势种为岳桦(Betulaermanii),灌木优势种为牛皮杜鹃(Rhododendronchrysanthum),草本优势种为星叶蟹甲草(Paraseneciokomarovianus)等。土壤为亚高山森林草甸土[12]。
本试验选择长白山北坡岳桦林带灌木优势种牛皮杜鹃为研究对象。牛皮杜鹃,又名高山茶,为多年生常绿灌木。在我国主要生长于长白山岳桦林带和高山冻原带[13- 14],叶片具有较厚的角质层,栅栏组织厚,且根系十分发达[13, 15]。牛皮杜鹃是珍稀的高山常绿花卉,目前,牛皮杜鹃处于渐危状态,为国家三级保护植物。牛皮杜鹃对长白山国家自然保护区的水土保持与生态平衡起重要作用[15- 17]。
2 研究方法
2.1 凋落物的采集、处理和样地布设
2011年10月在长白山岳桦林带典型样地采集当年牛皮杜鹃新鲜叶片,置于60 ℃温度下烘干8 h,以模拟牛皮杜鹃凋落物自然状态。将干重8 g的凋落物分别放入4、2 mm和0.01 mm 3种网孔(4 mm网孔是大型、中小型土壤动物和微生物共同作用;2 mm网孔是中小型土壤动物和微生物共同作用;0.01 mm网孔仅微生物作用),规格为15 cm × 20 cm的凋落物网袋中。2011年10月末将分装好的牛皮杜鹃凋落物网袋分别摆放在事先选取的6个面积为10 m × 10 m的样地中,上覆少许凋落物。这6个样地条件均一,作为本试验的6个重复样地。
2.2 网袋凋落物样品、土壤动物样品的采集与处理
各网孔凋落物袋于2012年4月末、6月末、8月末和10月末分别取回,首先手捡凋落物中的大型土壤动物,然后采用Tullgren法收集中小型土壤动物。3个网孔和4个月份取样均设6个重复。收集的土壤动物,一般鉴定到科。
分离土壤动物后的凋落物样品在60 ℃温度下烘至恒重,并记录其干重,用于计算凋落物分解率。将凋落物样品粉碎机粉碎,采用重铬酸钾容量法测定有机碳含量,采用Smartchem140全自动化学分析仪测定全氮和全磷含量。
2.3数据统计处理与分析
(2)净分解率计算公式为Ln(%)=Lct-Lct(t-1),式中Ln(%)为凋落物在该段时间内的净分解率,Lct是t时间的分解率,Lc (t-1)为截止到时间t的上一次取样时间的分解率。

(4)对土壤动物群落特征进行分析时,主要采用Shannon-Wiener多样性指数(H′)、Margalef丰富度指数(D)、Pielou均匀度指数(E)和Simpson优势度指数(C)。
(6)统计分析方法:本文选用单因素方差分析(ANOVA)来研究不同网孔内的凋落物分解率之间的差异。本文选用F检验来研究凋落物分解率的衰减模型。为了解土壤动物与养分元素分解率之间的关系,本文采用Pearson相关系数进行相关分析。
3 研究结果
3.1 牛皮杜鹃凋落物分解率及其衰减模型
3.1.1 牛皮杜鹃凋落物分解率时间动态
经过一年的分解,4、2 mm和0.01 mm网袋内牛皮杜鹃凋落物的分解率分别为34.19%、31.22%和25.45%(图1)。由图可知,分解率的大小关系为:大型、中小型土壤动物和微生物共同作用 > 中小型土壤动物和微生物共同作用 > 仅微生物作用。
总体来看,各取样月份间的净分解率呈现明显的季节性,即水热条件配置良好的盛夏至初秋时节的净分解率较高,而水热条件配置比较差的初冬至春末夏初时节的净分解率较低。其中 6—8月最高(图2)。由于2012年4月是第1次取样,数据表示的是自2011年10月—2012年4月,6个月的净分解率,其净分解率大致与2012年6—8月的净分解率持平,均在10%左右,但不同网孔间存在一定差异。2012年4—6月的3种网孔中,2 mm网孔网袋内的凋落物净分解率最高。2012年8—10月的网孔间差异最为显著。
通过对不同网孔内的分解净分解率、分解率进行单因素方差分析(ANOVA),结果显示8—10月4 mm网袋与 0.01 mm网袋之间分解净分解率差异达到了显著水平(P<0.05),分解差异也达到了显著水平(P<0.05)。
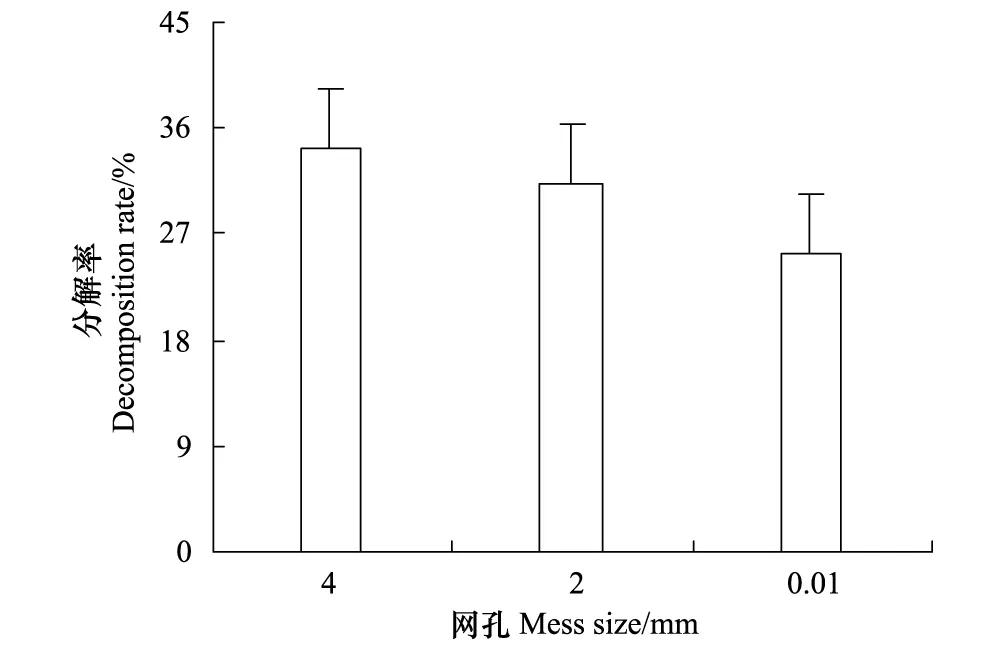
图1 分解一年时间不同网孔牛皮杜鹃凋落物分解率
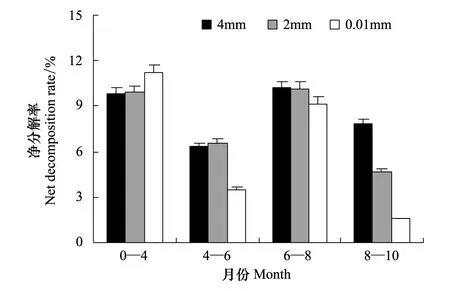
图2 不同网孔牛皮杜鹃凋落物净分解率时间动态
3.1.2 凋落物分解率的衰减模型
由模型可知,4 mm网孔凋落物袋内的凋落物分解最快,2 mm网孔次之,0.01 mm网孔最慢。其中4 mm网孔与2 mm网孔的分解率较为接近,而0.01 mm网孔分解率远落后于前两者。4 mm网孔分解常数k值为0.034是3个模型中的最大值,通过Olsen指数衰减模型可预测其凋落物分解至95%所需时间t0.95约为7a,2 mm网孔次之约为8a,而0.01 mm则约为10a。
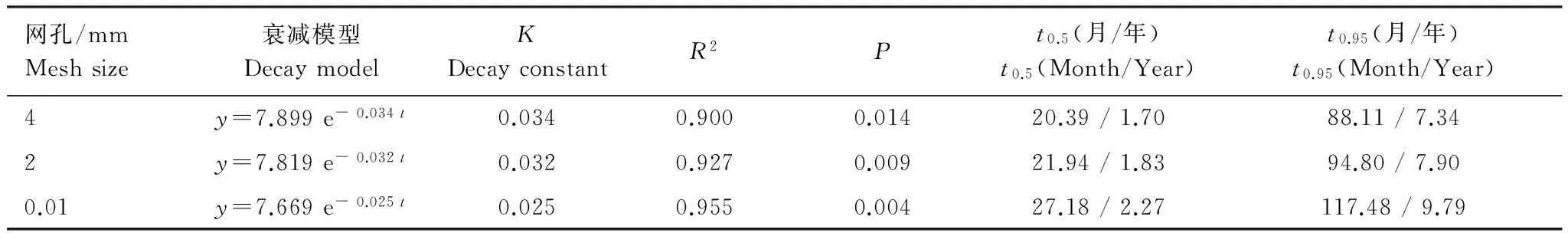
表1 凋落物残留率(y)与分解月数(t)的指数模型及相关参数Table 1 Parameters of decay model:an exponential function of litter remaining rate and time
3.2 凋落物分解过程中养分动态
分析凋落物的分解过程中的养分动态,全氮、全磷及C/N 是关键性的指标。表2为长白山岳桦林带牛皮杜鹃凋落物的初始化学性质的各参数。

表2 长白山岳桦林带牛皮杜鹃凋落物的初始化学性质Table 2 Concentrations of different chemicals in the initial litters
不同网孔凋落物,总体上全氮含量呈现先增后减的趋势(图3)。8月以前各网孔凋落物的全氮含量均呈上升趋势,8—10月,0.01 mm网孔凋落物的全氮含量持续增加,而4 mm网孔和2 mm网孔略有下降。
不同网孔凋落物的全磷含量动态变化趋势各不相同(图3)。4 mm网孔凋落物的全磷含量持续下降,2 mm网孔凋落物的全磷含量变化不大,比较稳定,0.01 mm网孔凋落物的全磷含量在4—6月基本保持不变,之后逐渐增加。
不同网孔凋落物的有机碳含量动态变化趋势有较大差异(图3)。总体而言,4 mm和2 mm网孔凋落物的有机碳含量在各月份间波动较大;0.01 mm网孔凋落物的有机碳含量相对前两者变化不大,在8月之前持续下降,8月之后有小幅上升。

图3 同网孔凋落物的全氮、全磷、有机碳含量及C/N、C/P时间动态
从C/N动态来看,除4 mm网孔凋落物的C/N 6月以后有小幅回升外,总体上呈现出下降趋势,各网孔在各月间的降幅略有差异(图3)。从C/P动态来看,除4 mm网孔呈上升趋势外,其余网孔均近乎直线下降。具体为:4 mm网孔凋落物的C/P呈上升趋势,各月间升幅较为接近,近乎直线上升;2 mm和0.01 mm网孔凋落物的C/P均呈现出下降趋势,其中2 mm网袋各月间的降幅较为接近,近乎直线下降(图3)。
3.3 凋落物分解过程中土壤动物群落特征及时间动态变化
由表3可知,试验期间牛皮杜鹃4 mm网孔凋落物袋中共收集到土壤动物908只,24个类群,其中优势类群为甲螨亚目和等节跳科,共占总个体数的73.02%;常见类群为革螨亚目、线蚓科、圆跳科、鳞跳科、双翅目幼虫、辐螨亚目、马陆目和山跳科,共占总个体数的22.58%;稀有类群为球角跳科、石蜈蚣科、隐翅虫科、隐翅虫科幼虫、疣跳亚科、缨甲科、鞘翅目幼虫、长角跳科、蜘蛛目、盲蛛目、地蜈蚣科、叶甲科、蚁科和短角跳科,共占总个体数的4.41%。
由表3亦可知,试验期间牛皮杜鹃2 mm网孔凋落物袋中共收集到土壤动物879只,22个类群,其中优势类群为甲螨亚目和等节跳科,共占总个体数的60.75%;常见类群为线蚓科、革螨亚目、双翅目幼虫、辐螨亚目、鳞跳科、圆跳科、马陆目、山跳科、球角跳科和缨甲科,共占总个体数的35.72%;稀有类群为隐翅虫科、鞘翅目幼虫、蜘蛛目、疣跳亚科、石蜈蚣科、隐翅虫科幼虫、鳞翅目幼虫、瓦娄蜗牛、长角跳科和步甲科,共占总个体数的3.53%。
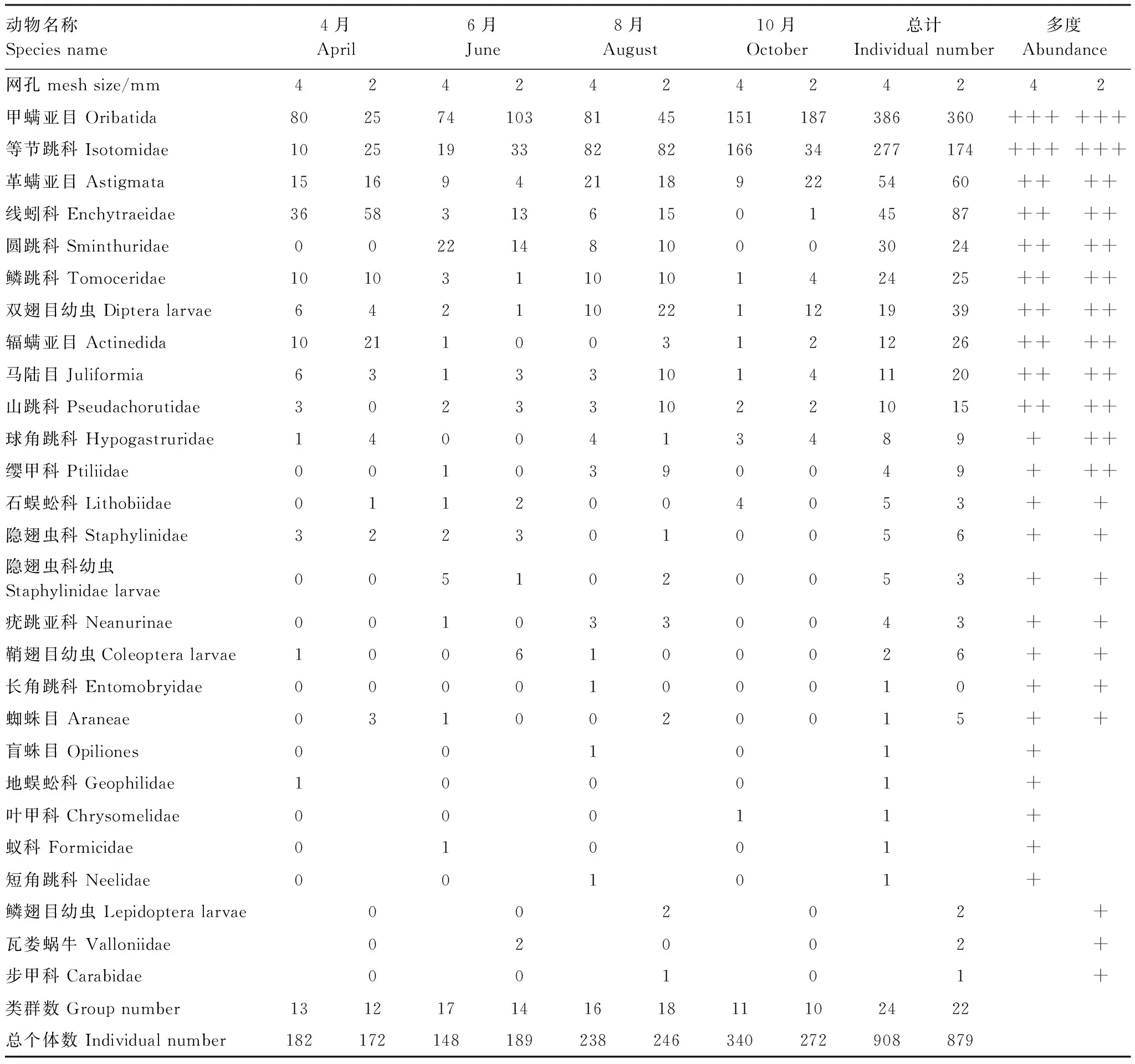
表3 4、2 mm 网孔凋落物袋主要土壤动物统计表Table 3 Dynamics of soil fauna in 4 mm litterbags and 2 mm litterbags
总体来看,4 mm和2 mm网袋土壤动物类群数比较接近,分别为24,22个类群。
从多样性指数来看,4 mm和2 mm网孔土壤动物Shannon-Wiener多样性指数与Pielou均匀度指数变化趋势均相同,即先降再升,最后又下降;而前两者与Simpson优势度指数的变化趋势恰好相反,即先升再降,最后又上升(图4)。

图4 不同网孔凋落物袋土壤动物多样性季节动态
3.4 土壤动物在凋落物分解过程中的作用
3.4.1 对凋落物分解起主要作用的土壤动物类群
基于网孔对不同体型土壤动物的筛选和控制,对凋落物分解起主要作用的优势类群(>10%)是甲螨亚目和等节跳科。常见类群主要有革螨亚目、线蚓科、圆跳科、鳞跳科、双翅目幼虫、辐螨亚目、马陆目、山跳科、球角跳科和缨甲科(1%—10%)。
3.4.2 土壤动物对凋落物分解过程中养分元素释放的影响
为了解土壤动物个体数和多样性指数与养分元素分解率之间的关系,本文采用Pearson相关系数进行相关关系分析,分析结果见表4。4 mm网孔凋落物袋的土壤动物的个体数与凋落物分解过程中全氮含量的相关系数达到了显著相关水平(P<0.05),2 mm网孔凋落物袋内的土壤动物的个体数与凋落物分解过程中全磷、有机碳含量均达到了显著相关水平,其中与有机碳含量达到了极显著相关水平(P<0.01)。两种网袋的土壤动物的多样性指数与全氮、全磷、有机碳的分解率之间的相关关系均未达到显著水平。
表4 不同网孔凋落物袋内的土壤动物个体数、多样性指数与分解过程中各养分元素分解率的Pearson相关分析
Table 4 Correlations between total number and diversity soil fauna & cumulative mass loss rate of nutrient elements in different-mesh-size litterbags

**: P<0.01(双侧检验),*: P<0.05(双侧检验)
3.4.3 土壤动物对凋落物分解的贡献
如表5所示,无论是全部土壤动物,还是大型、中小型土壤动物,总体上对长白山岳桦林带牛皮杜鹃凋落物分解的贡献率均随分解时间的延长呈现上升趋势。需要特殊说明的是,分解初期,均出现了负值。具体而言,全部土壤动物的贡献率在分解8个月之前大幅上升,分解8—10个月基本保持稳定,10—12个月再次大幅上升。大型土壤动物的贡献率,在分解前10个月均为负值,分解10个月以后其贡献率大幅上升。中小型土壤动物的贡献率,分解8个月以前保持大幅上升趋势,8—10个月之间基本保持稳定,10—12个月之间有所上升。由此可知,大型土壤动物对分解的贡献在10个月后刚刚发挥出来,且贡献率除初期外基本始终小于中小型土壤动物。土壤动物对凋落物分解的贡献率基本体现在中小型土壤动物上。在8—10个月之间土壤动物的贡献率基本保持稳定。总而言之,对于一年中牛皮杜鹃凋落物的分解的总的贡献率,全部土壤动物为25.57%,其中,中小型土壤动物(16.88%)> 大型土壤动物为(8.69%)。
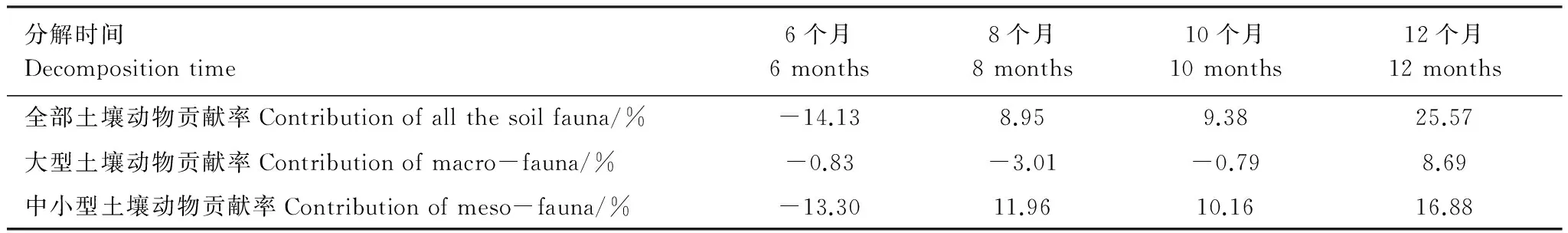
表5 土壤动物对长白山岳桦林带牛皮杜鹃凋落物分解的贡献率动态比较表Table 5 Dynamic contrast of contribution of soil fauna to litter decomposition
4 结论与讨论
4.1 结论
(1)经过1a的分解,4、2 mm和0.01 mm网孔凋落物分解率分别为34.19%、31.22%和25.45%。净分解率表现出显著的季节差异性。
(2)总体上总氮含量动态,先增后减;总磷含量与有机碳含量动态,各网孔凋落物袋间差异较大;C/N时间动态,总体呈下降趋势,各网孔在各月间的降幅略有差异;C/P时间动态,除4 mm网孔呈上升趋势外,其余网孔均近乎直线下降。
(3)对分解起主要作用的是优势类群甲螨亚目和等节跳科。土壤动物总个体数与养分元素的释放关系显著,中小型土壤动物对有机碳的释放起到重要作用。第1年的分解过程中土壤动物对牛皮杜鹃凋落物分解的贡献率随分解时间的延长而增大,全部土壤动物贡献率为25.57%,其中,中小型土壤动物贡献率为16.88%> 大型土壤动物贡献率为8.69%。
(4) 在干冷的冬春季节,土壤动物对凋落物分解起到了一定的抑制作用;暖湿的夏秋季节,土壤动物对分解起到了积极的促进作用。
4.2 讨论
凋落物的分解率受凋落物质量、环境条件和分解者群落3个因素控制[20]。分解前6个月时期,由于一直是积雪覆盖,温度较低,土壤动物的个体数量和类群数较低,其牛皮杜鹃的分解率较慢,而到了8个月和10个月时,整个夏季土壤动物个体数量和类群数最多,活性较强,分解作用明显,其牛皮杜鹃的分解率也较高,进一步证明了土壤动物与凋落叶分解率密切相关。牛皮杜鹃凋落物总氮含量动态总体上,先增后减的趋势与刘颖等对于长白山岳桦林带凋落物分解中养分动态变化研究中的总氮含量动态趋势大体一致[21]。原因是两者研究样地均位于长白山岳桦林带,所处环境一致;研究的物种均为岳桦林带具有代表性的物种。因此二者的总氮含量动态趋势大体一致。分解初期的总氮含量呈现上升趋势,这与Berg等人的研究结论及Tripathi等对于日本东北部次生林中岳桦林矮竹灌木——菲黄竹的地上地下不同部位凋落物分解的研究结果一致,这可能与易分解组分如,水溶性物质等物质的迅速损失有关[22- 24]。
经过一年的分解,分解率的变化趋势为:大型、中小型土壤动物和微生物共同作用 > 中小型土壤动物和微生物共同作用 > 仅微生物作用,这与小兴安岭研究结果一致[25]。经过一年的分解,土壤动物对长白山岳桦林带牛皮杜鹃凋落物分解质量损失的贡献率为25.57%,明显低于杨效东等关于西双版纳热带季节雨林凋落叶分解过程中土壤动物群落对凋落叶物分解率的贡献率46%[26]。这种明显的差异可以解释为,两地的纬度差异导致水热条件差异较大,进而影响了土壤动物及微生物的群落组成及其活动强度,结果贡献率不同。本研究中中小型土壤动物贡献率(16.88%)> 大型土壤动物贡献率(8.69%)。而夏磊等的研究结果土壤动物的贡献率为大型土壤动物 >中型土壤动物>微型土壤动物[27- 28],这与本研究的结果不一致,本研究中4 mm和2 mm网袋中的优势类群均为甲螨亚目和等节跳科中小型土壤动物,进而中小型土壤动物的分解作用较大,贡献率高。殷秀琴等研究表明土壤动物可以通过其新陈代谢活动加速凋落物—土壤动物—土壤系统中营养元素的循环速率[11]。本研究中4 mm网孔凋落物袋的土壤动物的个体数与凋落物分解过程中全氮的含量的达到了显著相关水平(P< 0.05),2 mm网孔凋落物袋内的土壤动物的个体数与凋落物分解过程中全磷、有机碳的含量达到了显著相关水平,其中与有机碳的含量达到了极显著相关水平(P< 0.01),表明土壤动物在营养元素循环中具有重要意义。
[1] Dias T, Oakley S, Alarcón-Gutiérrez E, Ziarelli F, Trindade H, Martins-Loução M A, Sheppard l, Ostle N, Cruz C. N-driven changes in a plant community affect leaf-litter traits and may delay organic matter decomposition in a Mediterranean maquis. Soil Biology and Biochemistry, 2013, 58: 163- 171.
[2] Yin X Q, Song B, Dong W H, Xin W D, Wang Y Q. A review on the eco-geography of soil fauna in China. Journal of Geographical Sciences, 2010, 20(3): 333- 346.
[3] 林波, 刘庆, 吴彦, 何海. 森林凋落物研究进展. 生态学杂志, 2004, 23(1): 60- 64.
[4] Anderson J M, Ineson P, Huish S A. Nitrogen and cation mobilization by soil fauna feeding on leaf litter and soil organic matter from deciduous woodlands. Soil Biology and Biochemistry, 1983, 15(4): 463- 467.
[5] Byzov B A, Chernjakovskaya T F, Zenova G M, Dobrovolskaya T G. Bacterial communities associated with soil diplopods. Pedobiologia, 1996, 40(1): 67- 79.
[6] Maraun M, Scheu S. Changes in microbial biomass, respiration and nutrient status of beech (Fagussylvatica) leaf litter processed by Millipedes (Glomerismarginata). Oecologia, 1996, 107(1): 131- 140.
[7] Petersen H, Luxton M. A comparative analysis of soil fauna populations and their role in decomposition processes. Oikos, 1982, 39(3): 288- 388.
[8] Bray J R, Gorham E. Litter Production in Forests of the World. New York: Academic Press, Inc., 1964: 101- 157.
[9] Robin L E. Production and Mineral Cycling in Terrestrial Vegetation, Transl, Scripat Technica. London: Oliver and Boyd, 1967.
[10] Edwards P J. Studies of mineral cycling in a montane rain forest in New Guinea: V. rates of cycling in throughfall and litter fall. Journal of Ecology, 1982, 70(3): 807- 827.
[11] 殷秀琴, 宋博, 邱丽丽. 红松阔叶混交林凋落物-土壤动物-土壤系统中 N、P、K 的动态特征. 生态学报, 2007, 27(1): 128- 134.
[12] 许林书. 曹龄月. 长白山火山活动与现代土壤垂直带谱的构成 // 长白山地理系统研究(第三辑). 长春: 东北师范大学出版社, 2010: 111- 122.
[13] 宫宇, 刘宪虎, 张春影, 李美善, 项美玲. 不同地区牛皮杜鹃叶片解剖结构比较分析. 延边大学农学学报, 2010, 32(1): 22- 25.
[14] 涂英芳. 长白山野生观赏植物. 北京: 中国林业出版社, 1993.
[15] 苏家乐, 李畅, 陈璐, 刘晓青, 陈尚平, 何丽斯. 不同预处理方法对牛皮杜鹃和小叶杜鹃种子萌发的影响. 植物资源与环境学报 2011, 20(4): 64- 69.
[16] 张淑梅, 王兴国, 郑成淑, 曹丽. 长白山杜鹃花科植物资源的园林应用. 中国野生植物资源, 2001, 20(2): 34- 34.
[17] 祝廷成, 严仲铠, 周守标. 中国长白山植物. 北京: 北京科学技术出版社, 2003: 495- 496.
[18] Xin W D, Yin X Q, Song B. Contribution of soil fauna to litter decomposition in Songnen sandy lands in northeastern China. Journal of Arid Environments, 2012, 77: 90- 95.
[19] Olsen J S. Energy storage and the balance of producers and decomposers in ecological systems. Ecology, 1963, 44(2): 322- 331.
[20] Cadish G, Giller K E. Driven by Nature: Plant Litter Quality and Decomposition. Wallingford: CAB International, 1997.
[21] 刘颖, 韩士杰, 林鹿. 长白山4种森林凋落物分解过程中养分动态变化. 东北林业大学学报, 2009, 37(8): 28- 30.
[22] Berg B. Litter decomposition and organic matter turnover in northern forest soils. Forest Ecology and Management, 2000, 133(1/2): 13- 22.
[23] Berg B, McClaugherty C, Johanasson M B. Chemical changes in decomposing plant litter can be systemized with respect to the litter’s initial chemical composition. Reports from the Departments of Forest Ecol and For Soils. Swed Univ Agric Sci, 1997, report 74.
[24] Tripathi S K, Sumida A, Shibata H, Ono K, Uemura S, Kodama Y, Hara T. Leaf litter fall and decomposition of different above- and belowground parts of birch (Betulaermanii) trees and dwarf bamboo (Sasakurilensis) shrubs in a young secondary forest in Northern Japan. Biology and Fertility of Soils, 2006, 43(2): 237- 246.
[25] 殷秀琴, 仲伟彦, 王海霞, 陈鹏. 小兴安岭森林落叶分解与土壤动物的作用. 地理研究, 2002, 21(6): 689- 699.
[26] 杨效东, 邹晓明. 西双版纳热带季节雨林凋落叶分解与土壤动物群落: 两种网孔分解袋的分解实验比较. 植物生态学报, 2006, 30(5): 791- 801.
[27] 夏磊, 吴福忠, 杨万勤. 季节性冻融期间土壤动物对岷江冷杉凋落叶质量损失的贡献. 植物生态学报, 2011, 35(11): 1127- 1135.
[28] 夏磊, 吴福忠, 杨万勤, 谭波. 川西亚高山森林凋落物分解初期土壤动物对红桦凋落叶质量损失的贡献. 应用生态学报, 2012, 23(2): 301- 306.
The contribution of soil fauna to litter decomposition ofRhododendronchrysanthumin the Changbai Mountains
BAO Jianli1, YIN Xiuqin1,2,*,LI Xiaoqiang1
1SchoolofGeographicalScience,NortheastNormalUniversity,Changchun130024,China2JilinProvincialKeyLaboratoryofAnimalResourceConservationandUtilization,Changchun130024,China
Decomposition of forest litter is one of the fundamental pathways for the flow of nutrients and energy in forest ecosystems and is an important component of the global carbon budget. Soil fauna plays a significant role in litter decomposition. However, the effect of soil fauna on alpine plant litter decomposition is poorly understood. In the present study, we have studied the dynamics of litter decomposition, nutrient-release, characteristics of the soil fauna community in litterbags, and the contribution of soil fauna in the process of litter decomposition ofRhododendronchrysanthumin theBetulaermaniiforest in the Changbai Mountains. Nylon litterbags (15 cm × 20 cm) with three mesh sizes (4 mm, 2 mm and 0.01 mm) were used in the experiment. Air-dried leaf litter ((8.00 ± 0.01) g) was kept in the nylon bags and these were placed on the forest floor. The remaining litterbags of each type were taken on the 6th, 8th, 10th and 12th month after field placement. Soil macrofauna were picked by hand from the litterbags (4 mm and 2 mm mesh). Subsequently, mesofauna and microfauna were collected and separated by Tullgren methods. The litter was rinsed with deionized water to remove soil particles, oven-dried at 60oC for 48 hours and weighed. Total nitrogen (TN), total carbon (TC) and total phosphorous (TP) contents were then tested. The results showed that the seasonal fluctuation and difference in decomposition rate ofRhododendronchrysanthumlitter in the three different mesh size litterbags was very obvious during the first year. At the end of the first year, the accumulated rate of loss of litter in 4 mm, 2 mm and 0.01 mm size litterbags reached 34.19%, 31.22% and 25.45%, respectively. The decomposition rate showed significant seasonal differences. In general, the concentration of N increased and then declined during litter decomposition. A downward trend was generally found in the ratio of C/N in the remaining litter. Oribatida and Isotomidae played a dominant role in the decomposition process. In the first half of the year the involvement of soil fauna slowed down the decomposition process, when the environment was much colder and drier, however, with the rise in temperature and moisture in the following six months, the contribution rates of macrofauna and mesofauna to litter decomposition increased greatly. The contribution rates of soil fauna to the litter mass loss increased with time in the first year. During the 12 month decomposition, the contribution rate of both macrofauna and mesofauna to litter decomposition was 25.57%, of which the contribution rate of mesofauna to litter decomposition was 16.88%, much higher than the contribution rate of macrofauna to litter decomposition (8.69%). Mesofauna play an important role in the release of organic carbon. These results suggest that during the seasons of winter and spring there is an antagonistic effect of soil fauna on litter decomposition, whilst in summer and autumn, there is a synergistic effect from soil fauna on litter decomposition.
soil fauna;Rhododendronchrysanthum; litter decomposition; nutrient dynamics;Betulaermaniiforest; Changbai Mountains
国家自然科学基金项目(41171207, 40871120)
2013- 06- 27;
2014- 05- 30
10.5846/stxb201306271788
*通讯作者Corresponding author.E-mail: yinxq773@nenu.edu.cn
包剑利, 殷秀琴, 李晓强.长白山牛皮杜鹃凋落物分解及土壤动物的作用.生态学报,2015,35(10):3320- 3328.
Bao J L, Yin X Q,Li X Q.The contribution of soil fauna to litter decomposition ofRhododendronchrysanthumin the Changbai Mountains.Acta Ecologica Sinica,2015,35(10):3320- 3328.

