利用荧光定量PCR检测禾谷丝核菌的相对生物量
洪彦涛, 张增艳
(中国农业科学院作物科学研究所/农作物基因资源与基因改良国家重大科学工程/农业部麦类生物学与遗传育种重点实验室,北京 100081)
利用荧光定量PCR检测禾谷丝核菌的相对生物量
洪彦涛, 张增艳*
(中国农业科学院作物科学研究所/农作物基因资源与基因改良国家重大科学工程/农业部麦类生物学与遗传育种重点实验室,北京 100081)
小麦纹枯病是以禾谷丝核菌(Rhizoctonia cerealis)侵染为主的小麦土传病害。为建立检测禾谷丝核菌在寄主小麦(Triticum aestivum)中的相对生物量的可靠方法,促进小麦抗纹枯病机制的研究,本研究克隆了禾谷丝核菌肌动蛋白基因RcActin的部分(3′端)cDNA,并设计了RcActin的特异引物。该引物不仅能区分禾谷丝核菌与寄主小麦,还能区分全蚀病菌(Gaeumannomyces graminis)、根腐病菌(Bipolarissorokiniana)和立枯丝核菌(Rhizoctonia solani)等常见小麦土传病害的病原菌,表明该引物能用于小麦纹枯病的分子检测,也能用于相对表达量的测定。利用相对定量法,以RcActin相对于寄主管家基因的相对表达量作为禾谷丝核菌相对生物量的指标,结果表明,此方法能准确反映禾谷丝核菌在寄主中的相对生物量和对小麦纹枯病抗性程度进行快速鉴定。
小麦纹枯病; 禾谷丝核菌; 肌动蛋白; 相对表达量; 生物量
小麦纹枯病又称小麦尖眼点病(wheat sharp eyespot),是小麦重要土传病害。我国小麦纹枯病主要由禾谷丝核菌(Rhizoctonia cerealis)侵染所引起[1]。禾谷丝核菌属于丝核菌属(Rhizoctonia)双核丝状真菌,不产生无性孢子,通过侵染小麦(Triticum aestivum)的叶鞘和茎部,引起小麦组织坏死,形成褐色云纹花秆状病斑[2]。严重情况下病株会因养分、水分供应不足而造成枯白穗[3]。近年来,纹枯病已经成为国内小麦生产的主要病害,造成严重的经济损失,如2005年我国小麦纹枯病发生面积就达到54万hm2,造成至少8万t的产量损失[4],可见纹枯病对我国粮食安全构成潜在威胁。因此,开展小麦抗纹枯病育种和小麦-禾谷丝核菌互作机制的研究迫在眉睫。
病原物的鉴定和定量检测对于病害管理和寄主-病原菌互作机制研究十分重要。传统方法主要基于形态学特性和致病力鉴定,费时费力,并且无法进行定量分析。传统的纹枯病抗性鉴定方法基于肉眼对病斑大小进行分级[5],各病级之间界限不明显,不同人判断时容易造成差异。相较于传统方法,实时荧光定量PCR(qPCR)因其灵敏度高、结果快速准确,在病原菌鉴定及生物量测定方面受到越来越多的关注[6-9]。寄主体内病原物的生物量是寄主抗病或者感病程度的一个考量,也是病原物侵染程度的一个反映[10-13]。目前,检测病原物生物量的方法有两种:1)绝对定量,即通过病原物在寄主中的DNA含量来反映其生物量[10-11]。首先将病原菌的基因组DNA梯度稀释后进行qPCR,根据Ct值和DNA浓度的关系制定标准曲线,然后对发病组织定量取样进行DNA提取,再进行qPCR,将所得到的Ct值代入标准曲线则可以得到病原物的DNA含量[14]。2)相对定量,即通过检测病原物相关基因的表达水平反映其生物量[12-13,15-16]。一般以寄主的管家基因作为内标,通过检测病原菌管家基因(如18S rRNA基因[12-13]和肌动蛋白基因[15-16])的表达量来反映病原菌的生物量。相对定量测定法的优势在于除了能反映病原菌的生物量外,还能检测寄主发病部位的其他基因表达量。
肌动蛋白(Actin)是细胞骨架的重要组成蛋白[17]。Actin基因为重要的管家基因,一般为组成型表达,因此常被作为基因表达分析的内参基因[18]。一些病原菌的Actin基因表达量也被用来检测病原物的生物量,如灰葡萄孢菌(Botrytis cinerea)[15]和立枯丝核菌(Rhizoctonia solani)[16]。目前,禾谷丝核菌的Actin基因还未得到克隆,也未有用相对定量的方法检测禾谷丝核菌相对生物量的报道。本研究克隆了禾谷丝核菌Actin基因RcActin3′端cDNA,并通过检测RcActin表达量分析检测禾谷丝核菌的相对生物量。结果表明,禾谷丝核菌Actin基因相对于寄主管家基因的相对表达量能反映该病原菌在寄主组织中的相对生物量和寄主的抗病程度。同时这种方法还可以用来检测其他基因在发病部位的表达情况。相对于绝对定量,该方法简便易行,更适合用于不同抗性材料间抗病和感病程度的比较。
1 材料和方法
1.1 材料
小麦品种或品系:‘CI12633’,‘山红麦’,‘Navit14’,‘山农0431’,‘扬麦158’,‘温麦6号’,‘周麦16号’和‘周麦18号’作为检测引物特异性的材料,‘CI12633’和‘温麦6号’作为接菌材料用于禾谷丝核菌Actin基因表达量检测。小麦纹枯病病原菌—禾谷丝核菌R0301由江苏省农业科学院植保所陈怀谷研究员提供,小麦全蚀病菌(Gaeumannomyces graminis)XNQS-2由西北农林科技大学植物保护学院王阳副教授提供,根腐病菌(Bipolaris sorokiniana)ACC30209由中国农业科学院作物科学研究所李洪杰惠赠。立枯丝核菌(Rhizoctonia solani)由本实验室保存。病原菌在PDA固体培养基培养,4℃保存备用。
1.2 接菌方法
参照蔡士宾等[19]的方法,将禾谷丝核菌R0301菌丝块移植到新的PDA固体培养基,25℃培养10 d,进行活化。将牙签剪成两段,再劈成两半,用清水清洗后装在烧杯中。往烧杯里加适量的PDA液体培养基,高压高温灭菌。将活化后的菌丝块放到灭过菌的牙签里,25℃培养30 d。待小麦拔节之后,将布满菌丝的牙签嵌入小麦叶鞘和茎部之间,使牙签顶部与茎节处齐平,在外层包裹一层脱脂棉,喷水保湿5 d。
茎部病斑大小(lesion size)测量:测量每个病斑纵向长度(L cm)和病斑弧长占茎周长的比例(R)。lesion size=L×R。如果茎部有多个病斑,计算每个病斑后累加。
1.3 RNA提取及cDNA第一链的合成
分别从接种禾谷丝核菌0、12 h,1、2、4和7 d的小麦叶鞘和茎部取样,取样时用酒精棉球擦去小麦组织表面残留的接菌菌丝,再剪下接病部位的茎节以下6 cm的茎部和叶鞘,用锡箔纸包裹后液氮冻存,-80℃保存。
用Trizol(Invitrogen)法进行RNA提取,用DNaseⅠ(TaKaRa)去除基因组DNA。利用AMV反转录酶(TaKaRa),以Oligo d T为引物反转录、合成单链cDNA。
1.4 禾谷丝核菌Actin基因3′端cDNA的克隆和特异引物设计
用小麦Actin基因Ta Actin的引物(TaAct A:5′-CACTGGAATGGTCAAGGCTG-3′/TaActB:5′-CTCCATGTCATCCCAGTTG-3′),以禾谷丝核菌cDNA为模板进行扩增。扩增条件为:94℃变性30 s,48℃退火30 s,72℃延伸20 s,35个循环。扩增产物经2%琼脂糖凝胶电泳检测。回收目的扩增带并克隆到pMD-18T(TaKaRa)载体后,进行测序。得到禾谷丝核菌Actin基因的片段。根据所获得的禾谷丝核菌Actin基因的特异片段设计用于3′RACE(rapidamplification of cDNA ends)的引物RC-ACT-3RACE:5′-TCTTCCCGTCCATTGTCG-3′。
利用TaKaRa RNA PCR Kit(AMV)ver.3.0(TaKaRa)进行禾谷丝核菌Actin基因3′RACE。以提取的禾谷丝核菌总RNA为模板,以Oligo d TAdaptor:5′-GTTTTCCCAGTCACGACTTTTTTTTTTTTTTTTTT-3′为起始引物,用AMV反转录酶(TaKaRa)进行cDNA第一链合成。以RC-ACT-3RACE和M13M-4:5′-GTTTTCCCAGTCACGAC-3′作为引物进行扩增。反应体系为50μL:包含10 ×LATaqPCR buffer 5μL,2.5 mol/L dNTP 4μL,10 pmol/L引物各2μL,cDNA模板2μL,LATaq聚合酶(TaKaRa)0.5μL。反应程序为:94℃变性30 s,55℃退火30 s,72℃延伸90 s,35个循环。扩增产物经1%琼脂糖凝胶电泳检测。将回收的目的带克隆到p MD-18T载体后双向测序。
用Primer 5.0进行引物设计,为保证引物的特异性,将上游引物设计在编码区,下游引物设计在3′UTR。引物序列为:Rc Actin-F:5′-GCATCCACGAGACCACTTAC-3′和Rc Actin-R:5′-GCGTCCCGCTGCTCAAGAT-3′。所设计的引物再经NCBI Primer BLAST(http:∥www.ncbi.nlm.nih.gov/ tools/primer-blast/)进行特异性检测。
1.5 实时定量RT-PCR(qPCR)检测
用天根生化科技有限公司的SuperReal PreMix Plus(SYBR Green)试剂盒进行实时定量RT-PCR。反应体系25μL。包含12.5μL的2×SuperReal Premix,引物(10 pmol/L)各0.75μL,5μL cDNA模板和0.5μL 50×ROX Reference Dye。反应条件为94℃预变性10 min;94℃变性15 s,61℃退火31 s,41个循环。用2-ΔΔCt方法[20]计算目标基因的相对表达量。以小麦Actin基因TaActin作为内参基因。以抗病相关基因TaPR1a的表达量来检测寄主对病原菌的反应,TaPR1aqPCR引物序列参照文献[12]。每个处理进行3次重复,每个样品qPCR检测时进行3个技术重复。
2 结果与分析
2.1 禾谷丝核菌Actin基因的cDNA 3′端的克隆
基于Actin基因在不同物种中的功能及序列保守性,利用小麦特异Actin基因引物,以禾谷丝核菌cDNA为模板,48℃退火温度扩增出约200 bp的片段。通过测序后得到禾谷丝核菌Actin基因的特异片段。以该特异片段为起始序列,以禾谷丝核菌RNA为模板进行3′RACE扩增,得到约1.2 kb的片段。经测序和比对分析表明,所获得序列为禾谷丝核菌特异的Actin基因序列。编码区预测表明,该序列包含1 070 bp的部分编码区和210 bp的3′非编码区(untranslated regions,UTR),将该序列命名为RcActin,GenBank登录号为KJ631110。RcActin与立枯丝核菌(Rhizoctonia solani)AG-3的Actin基因Gen-Bank登录号EVC56270有83%的一致性,编码的蛋白序列有99%的相似性。
2.2RcActin特异引物设计
根据RcActin序列,设计了特异引物用于检测RcActin的表达量。该对引物以禾谷丝核菌cDNA为模板可扩增出329 bp的片段(图1a);以禾谷丝核菌基因组DNA为模板可扩增得到436 bp的片段(图1b)。回收测序后发现,该436 bp的片段为RcActin的基因组部分序列,包含了2个内含子,表明该引物也可以用于禾谷丝核菌基因组DNA的检测。
为检测所设计引物的特异性,以不同品种或者品系的小麦、几种常见的小麦土传病害病原菌(G.graminis,B.sorokiniana,R.solani)和禾谷丝核菌的cDNA为模板,进行扩增。从图1a可以看出,只有禾谷丝核菌cDNA可以扩增出目的条带(329 bp),而健康小麦和其他3种病原菌cDNA中未扩增出片段(图中只显示小麦‘CI12633’的结果)。另外,以上述病原菌的基因组DNA为模板进行扩增,以真菌转录间隔区(internal transcribed spacer,ITS)通用引物作为对照,结果如图1b所示,该引物只能从禾谷丝核菌基因组DNA中扩增出目的条带(436 bp),而采用ITS通用引物均能扩增出条带。以上结果表明该引物是禾谷丝核菌特异的,可以区别寄主小麦和其他几种常见小麦土传病害病原菌。
2.3 相对定量能反映禾谷丝核菌的生物量变化
为了检测上述引物Rc Actin-F/Rc Atin-R是否能从受禾谷丝核菌侵染的小麦组织中扩增到目的片段,分别以未接种和接种禾谷丝核菌的小麦叶鞘组织的cDNA为模板进行RcActin的扩增。结果显示,该引物在感染禾谷丝核菌的小麦组织中可以扩增出单一的Rc Actin目的条带,而在未接种的小麦组织中没有扩增到该目的条带(图2),说明该引物可以用于qPCR检测。

图2RcActin基因在发病部位的表达Fig.2RcActinexpressed in the infected tissue of host
为分析禾谷丝核菌在侵染小麦后的扩展程度,以小麦的Actin基因Ta Actin为内标,利用qPCR分析了RcActin在接菌后不同时间点在寄主体内的表达量(以下所有RcActin表达量的表述都是以小麦Actin基因Ta Actin为内标的表达量)。qPCR结果显示,RcActin在侵染点的表达量随侵染时间的推移而逐渐增加。在叶鞘组织中,RcActin在接种12 h后就能检测到,而且它的表达模式在接种后0~7 d内呈S形曲线增加(图3a)。而在茎部组织中,RcActin在接种1 d后才可检测到,说明叶鞘相对于茎部更容易受禾谷丝核菌的侵染,而且RcActin在茎部的表达模式呈J形增长(图3b)。禾谷丝核菌侵入寄主细胞后会在受侵细胞内网状扩展,并逐渐向相邻细胞纵横扩展增殖[21],其生物量在寄主体内逐渐增加。RcActin表达量相对于0 h逐渐增加与禾谷丝核菌在寄主组织的扩展是相一致的。说明RcActin表达量变化可以反映侵入植物组织中禾谷丝核菌生物量的变化。另外qPCR的结果显示,虽然在接种早期(12 h~4 d)寄主小麦还未出现病斑,但已能检测到RcActin的表达,表明此方法也可以用于小麦纹枯病的早期诊断。
另外,分析了抗病相关的基因TaPR1a[12]在禾谷丝核菌侵染叶鞘中的表达量变化。从图3c可以看出,随着禾谷丝核菌生物量的增加,TaPR1a表达量逐渐上升,表明TaPR1a受禾谷丝核菌诱导表达。
2.4 利用荧光定量PCR对小麦纹枯病抗性进行鉴定
寄主被病原菌侵染后产生病斑的大小(lesion size)是寄主抗病性的一个指标,病斑越小表明寄主体内的病原菌生物量越少,抗性越好。通过选取纹枯病病斑大小不同的发病植株,并对茎部发病部位取样,检验RcActin的相对表达量与纹枯病抗性程度的关系。从图4a中可以看出,病斑大小与RcActin表达量呈正相关,即病斑大的部位,RcActin表达量也高。另外,以接种禾谷丝核菌的抗纹枯病小麦‘CI12633’和感病小麦‘温麦6号’为材料,分析了接种该病菌不同时段RcActin的表达量。结果如图4b所示,接种禾谷丝核菌2 d和4 d后,RcActin的表达量在两种小麦中没有差异,但在接种后7、14和21 d,RcActin在‘温麦6号’中的表达量显著高于在‘CI12633’中的表达量,这与两个小麦材料的纹枯病抗性是相对应的,表明用荧光定量PCR对禾谷丝核菌相对生物量进行检测是可靠的。以上结果还表明,能通过相对定量的方法对寄主的纹枯病抗性程度进行快速鉴定。
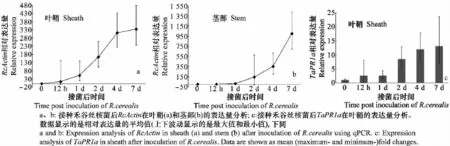
图3 接种禾谷丝核菌后不同时间RcActin和TaPR1a的qPCR分析Fig.3 Quantitative real-time PCR analysis ofRcActinandTaPR1aafter inoculation ofR.cerealis
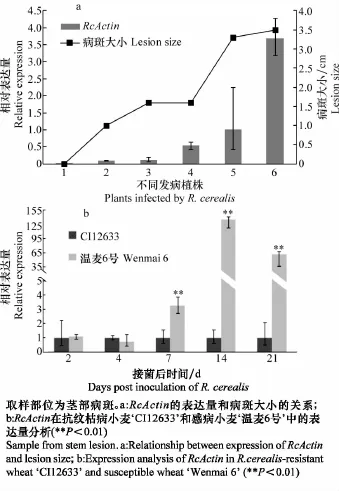
图4RcActin的表达量和寄主对纹枯病抗性的关系Fig.4 Relationship between expression ofRcActinand resistant degree againstR.cerealisin wheat
3 讨论
之前对禾谷丝核菌生物量的测定都是通过绝对定量测定病原物DNA的含量[22-23]。比如,Nicholson等[22]利用禾谷丝核菌特异的随机扩增多态性标记(random amplified polymorphic DNA,RAPD)引物通过竞争PCR对禾谷丝核菌进行定量测定。Gao等[23]利用禾谷丝核菌微管蛋白(tubulin)基因通过qPCR对土壤中的禾谷丝核菌进行检测和定量。但绝对定量对DNA质量要求很高(低质量DNA会影响DNA浓度的测定),另外每次检测时都需要重新制备标准曲线。而相对定量在病原菌生物量的平行比较方面能更简便快速。目前已有许多例子成功运用相对定量检测病原菌的相对生物量。比如,Liu等[12]通过分析全蚀病菌的18S基因在寄主根部的表达量来检测全蚀菌的相对生物量,从而分析转基因小麦对全蚀病的抗性。Mengiste等[24]通过RT-PCR检测灰葡萄孢菌Tubulin基因在寄主中的相对表达量来鉴定寄主对病原菌的抗性。然而,有关禾谷丝核菌相对生物量定量分析还未见报道,本研究首次通过基因表达水平来反映禾谷丝核菌相对生物量。
Actin基因为重要的管家基因,常被选为内参基因[18],同时也被用来反映病原菌生物量。比如,Chacón等[16]利用立枯丝核菌的Actin基因来对该病原菌的相对生物量进行测定。Abuqamar等[15]通过RT-PCR检测灰葡萄孢菌Actin基因的表达量来反映该病原菌在寄主体内的增殖和寄主对该病原菌的抗性。本研究利用3′RACE首次克隆到禾谷丝核菌Actin基因RcActin的部分编码区和3′UTR,虽然未得到其全长cDNA,但足以用来设计RcActinqPCR特异引物。
引物的特异性是qPCR成功与否的关键因素。本研究所设计的RcActinqPCR引物特异性强,能将禾谷丝核菌与寄主小麦区分开来,还能区分全蚀病菌、根腐病菌和立枯丝核菌等常见小麦土传病害的病原菌。另外该引物也能从禾谷丝核菌基因组DNA中扩增出特异片段,说明该引物也能够用于小麦纹枯病的分子检测。
研究禾谷丝核菌在小麦体内的扩展对小麦-禾谷丝核菌互作机制研究具有重要的意义。通过相对定量能直观地体现禾谷丝核菌在寄主体内扩展和生物量的变化。本研究结果显示,RcActin的表达量变化可以用来反映禾谷丝核菌在寄主体内的生物量变化。研究表明在受侵染的叶鞘组织中,接种12 h后禾谷丝核菌可能就能侵入到叶鞘细胞中,而且RcActin表达量的变化在接种0~7 d内呈S形增长,故该病原菌在寄主体内生物量的增长也可能为S形曲线增长。而在茎部组织中,相对于叶鞘禾谷丝核菌入侵到寄主细胞则较晚,在接种0~7 d内RcActin表达量的变化呈J形增长,说明叶鞘组织相对茎部更容易受禾谷丝核菌侵染。相对定量还可以同时分析其他基因的表达量。本研究结果显示,TaPR1a随着禾谷丝核菌生物量的增加表达量逐渐上调。这结果与之前的报道类似:灰葡萄孢菌侵染番茄叶片后,随着病原菌的扩展,寄主的PR-1的表达量也逐渐上升[25]。
通过检测禾谷丝核菌在小麦体内的相对生物量能对小麦的纹枯病抗性进行快速鉴定。本研究结果显示,RcActin的相对表达量与受侵染寄主的纹枯病病斑成正相关。另外,在接种禾谷丝核菌7 d后,RcActin的表达量在感纹枯病小麦‘温麦6号’和抗病小麦‘CI12633’体内的生物量就产生了差异——禾谷丝核菌生物量在‘温麦6号’中显著高于‘CI12633’。在发病后期(14 d和21 d)两者的差异则更大。表明用相对定量进行禾谷丝核菌生物量检测是可靠的,而且能用于抗病性的早期鉴定和后期验证。
本研究利用qPCR检测禾谷丝核菌的相对生物量来反映病原菌在寄主的扩展和寄主对其的抗病程度,能为小麦抗纹枯病育种和小麦-禾谷丝核菌互作机制的研究提供思路和方法,帮助人们更好地认识禾谷丝核菌和小麦纹枯病。
[1] 陈延熙,唐文华,张敦华,等.我国小麦纹枯病病原学的初步研究[J].植物保护学报,1986,13(1):39 44.
[2] 陈健华,张炽昌,徐东方,等.小麦纹枯病的研究进展[J].现代农业科技,2011(1):169 170.
[3] Hamada M S,Yin Y,Chen H,et al.The escalating threat ofRhizoctonia cerealis,the causal agent of sharp eyespot in wheat[J].Pest Management Science,2011,67(11):1411 1419.
[4] Mcbeath J H,Mcbeath J.Environmental change and food security in China[M].Springer,2010.
[5] 蒋彦婕,吴纪中,蔡士宾,等.小麦抗纹枯病种质资源的鉴定与评价[J].麦类作物学报,2013,33(3):589 594.
[6] Schaad N W,Frederick R D.Real-time PCR and its application for rapid plant disease diagnostics[J].Canadian Journal of Plant Pathology,2002,24(3):250 258.
[7] Lievens B,Brouwer M,Vanachter A C,et al.Real-time PCR for detection and quantification of fungal and oomycete tomato pathogens in plant and soil samples[J].Plant Science,2006,171(1):155 165.
[8] Alaei H,Baeyen S,Maes M,et al.Molecular detection ofPuccinia horianainChrysanthemum×morifoliumthrough conventional and real-time PCR[J].Journal of Microbiological Methods,2009,76(2):136 145.
[9] 孙宁,邓丛良,郑雪明,等.实时荧光RT-PCR技术检测南瓜花叶病毒[J].植物保护学报,2010,37(6):571 572.
[10]Jackson E W,Obert D E,Menz M,et al.Characterization and mapping of oat crown rust resistance genes using three assessment methods[J].Phytopathology,2007,97(9):1063 1070.
[11]Seyedmousavi S,Melchers W J,Verweij P E,et al.Assessment of efficacy of antifungals in experimental models of invasive aspergillosis in an era of emerging resistance:the value of real-time quantitative PCR[J].Current Opinion in Pharmacology,2011,11(5):486 493.
[12]Liu X,Yang L,Zhou X,et al.Transgenic wheat expressingThinopyrum intermediumMYB transcription factor TiMYB2R-1 shows enhanced resistance to the take-all disease[J].Journal of Experimental Botany,2013,64(8):2243 2253.
[13]杨坤,刘欣,杜丽璞,等.转AcAMP-sn基因抗全蚀病小麦新种质的创制与鉴定[J].作物学报,2013,40(1):22 28.
[14]Brouwer M,Lievens B,Van Hemelrijck W,et al.Quantification of disease progression of several microbial pathogens onArabidopsis thalianausing real-time fluorescence PCR[J]. FEMS Microbiology Letters,2003,228(2):241 248.
[15]Abuqamar S,Chai M F,Luo H,et al.Tomato protein kinase 1b mediates signaling of plant responses to necrotrophic fungi and insect herbivory[J].The Plant Cell,2008,20(7):1964 1983.
[16]Chacón O,González M,López Y,et al.Over-expression of a protein kinase gene enhances the defense of tobacco againstRhizoctonia solani[J].Gene,2010,452(2):54 62.
[17]Schmidt A,Hall M N.Signaling to the actin cytoskeleton[J].Annual Review of Cell and Developmental Biology,1998,14:305 338.
[18]Heid C A,Stevens J,Livak K J,et al.Real time quantitative PCR[J].Genome Research,1996,6(10):986 994.
[19]蔡士宾,任丽娟,颜伟,等.小麦抗纹枯病种质创新及QTL定位的初步研究[J].中国农业科学,2006,39(5):928 934.
[20]Livak K J,Schmittgen T D.Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T))method[J].Methods,2001,25(4):402 408.
[21]刘雪梅,肖建国.小麦纹枯病菌侵染过程的组织学研究[J].菌物系统,1999,18(3):288 293.
[22]Nicholson P,Turner A,Edwards S,et al.Development of stem-base pathogens on different cultivars of winter wheat determined by quantitative PCR[J].European Journal of Plant Pathology,2002,108(2):163 177.
[23]Guo Y P,Li W,Sun H Y,et al.Detection and quantification ofRhizoctonia cerealisin soil using real-time PCR[J].Journal of General Plant Pathology,2012,78(4):247 254.
[24]Mengiste T,Chen X,Salmeron J,et al.The BOTRYTISUSCEPTIBLE1 gene encodes an R2R3MYB transcription factor protein that is required for biotic and abiotic stress responses in Arabidopsis[J].The Plant Cell,2003,15(11):2551 2565.
[25]Benito E P,ten Have A,van′t Klooster J W,et al.Fungal and plant gene expression during synchronized infection of tomato leaves byBotrytis cinerea[J].European Journal of Plant Pathology,1998,104(2):207 220.
Relative quantification of biomass ofRhizoctonia cerealisusing real-time PCR
Hong Yantao, Zhang Zengyan
(National Key Facility for Crop Gene Resources and Genetic Improvement/Key Laboratory of
Biology and Genetic Improvement of Triticeae Crops,Ministry of Agriculture/Institute of
Crop Science,Chinese Academy of Agricultural Sciences,Beijing100081,China)
Wheat sharp eyespot,caused byRhizoctonia cerealis,is a devastating soil-borne disease.In order to quantify the relative biomass ofR.cerealisand propel the study about mechanism of resistance of wheat againstR.cerealis,we had cloned the partial cDNA of actin gene fromR.cerealis(named asRcActin).Then the specific primers ofRcActinwere designed for diagnosis of sharp eyespot and expression analysis ofRcActin.The primers could specifically distinguishR.cerealisfrom wheat,Gaeumannomyces graminis,Bipolaris sorokinianaandRhizoctonia solani.We had proofed that theRcActinexpression level can be used as an indicator of the fungal relative biomass and evaluation of resistant degree againstR.cerealisin wheat.
wheat sharp eyespot;Rhizoctonia cerealis; actin; relative expression; biomass
S 432.1
A
10.3969/j.issn.0529 1542.2015.01.022
2014 02 17
2014 05 28
国家自然科学基金(31271799)
*通信作者 Tel:010 82108781;E-mail:zhangzengyan@caas.cn

