肿瘤血管抑制剂XY-02与CA4P的组织分布比较研究
宁 欣,陈芙蓉,张玉霞,冯亚男,王梦丽,谢红英,雍智全,徐小平
(1.四川大学华西药学院,四川 成都 610041;2.广东达信生物科技有限公司,广东 东莞 523808)
肿瘤血管抑制剂XY-02与CA4P的组织分布比较研究
宁 欣1,陈芙蓉1,张玉霞1,冯亚男1,王梦丽1,谢红英1,雍智全2,徐小平1
(1.四川大学华西药学院,四川 成都 610041;2.广东达信生物科技有限公司,广东 东莞 523808)
建立HPLC对肿瘤血管抑制剂XY-02与CA4P在大鼠体内组织分布规律的研究方法,揭示两种药物靶组织的差异与潜在的治疗特征和安全性。SD大鼠分别静脉注射XY-02(80mg/kg)或CA4P(1mg/kg),于给药后15,40,90min采集大鼠心、肝、脾、肺、肾、胃、小肠、脑、子宫、睾丸等组织进行含量测定,以C18(250mm×4.6mm×5μm)为色谱柱,0.01%乙酸-甲醇(50∶50,ν/ν)为流动相,流量为1.0mL/min,检测波长为325nm。XY-02和CA4P分别在0.15~750μg/mL和0.03~60μg/mL范围内线性关系良好(r>0.9995),检测限分别为17ng/mL和4.93ng/mL。两种肿瘤血管抑制剂均在大鼠组织中有广泛分布和快速消除的特点,预示二者可对各种组织肿瘤具有潜在的治疗作用且体内产生蓄积的可能性小。特别是XY-02在肾脏和肝脏中分布较多,提示XY-02可对临床上较难治疗的肾癌和肝癌有更好的治疗价值;XY-02在心脏和肠道的分布较CA4P低,表明XY-02的心脏毒性和肠道的不良反应比CA4P更小,安全性更好。
XY-02;CA4P;静脉给药;HPLC;组织分布
0 引言
XY-02,化学名为(E)-3-(3′-羟基-4′-甲氧苯基)-2-(3′,4′,5′-三甲氧苯基)丙烯酸叔丁铵盐,中文名为康丁胺;CA4P,化学名为2-甲氧基-5-[(1Z)-2-(3,4,5-三甲氧基苯基)乙烯]苯酚磷酸酯二钠,中文名为康普瑞丁磷酸二钠盐[1-2]皆为肿瘤血管抑制剂Combretastatin类化合物的同系物。Combretastatin类化合物系从南非灌木Combretum Caffrum的树皮中分离得到的一类具有顺式二苯乙烯结构的天然产物[3-4],20世纪90年代,获得其全合成产品,后经结构修饰获得从CA1~CA32的系列化物,其中最具生物活性的主要有CA1和CA4。其作用原理为靶向作用于肿瘤血管异常增生的内皮细胞,诱导增生的内皮细胞出现炎症样反应,引起细胞凋亡和血管壁萎缩,切断通向肿瘤的血流供应,使肿瘤发生“饥饿性”坏死,达到抑制肿瘤生长的目的[5-6]。然而这类化合物最大的缺陷是水溶性极差,难以制剂成型,所以前期将CA4经磷酸酯化后形成二钠盐作为前体药物CA4P,CA4P在体内经磷酸酯酶水解出母体CA4而发挥抑瘤作用[7]。目前,CA4P已经进入临床II期试验,正在进行单独治疗或与紫杉醇、卡铂联合治疗晚期癌症的临床试验[8-10]。CA4P的结构如图1(a)所示。即使CA4P具有一定水溶性,其水解后仍然是不溶于水的CA4,而且CA4P在水溶液中易发生顺反式转化,因此CA4P仅能制剂成冻干注射剂,限制了其向其他给药途径的制剂开发。
为克服CA4P前体水解后的CA4水溶极差的问题,XY-02通过组合化学优化出水溶性更好的XY-02化合物,化学结构如图1(b)所示。药理毒理试验结果表明,XY-02与CA4P的疗效相当,体内平均抑瘤率约70%,安全性更好(LD50为2g/kg)。良好的水溶性,使得XY-02可更广泛地开发成各类制剂,特别是便于临床使用的口服制剂。虽然关于XY-02和CA4P的药物代谢动力学研究分别已有报道[11-13],但在动物体内的相关组织分布,特别是二者组织分布比较的研究尚未见报道。为此,本文通过高效液相色谱法(HPLC)分别检测XY-02和CA4P在大鼠各组织的浓度分布,比较其分布规律,并阐明其分布特征与药效学和毒理学之间的潜在关系,为进一步研究开发和临床应用提供组织分布的基础依据。
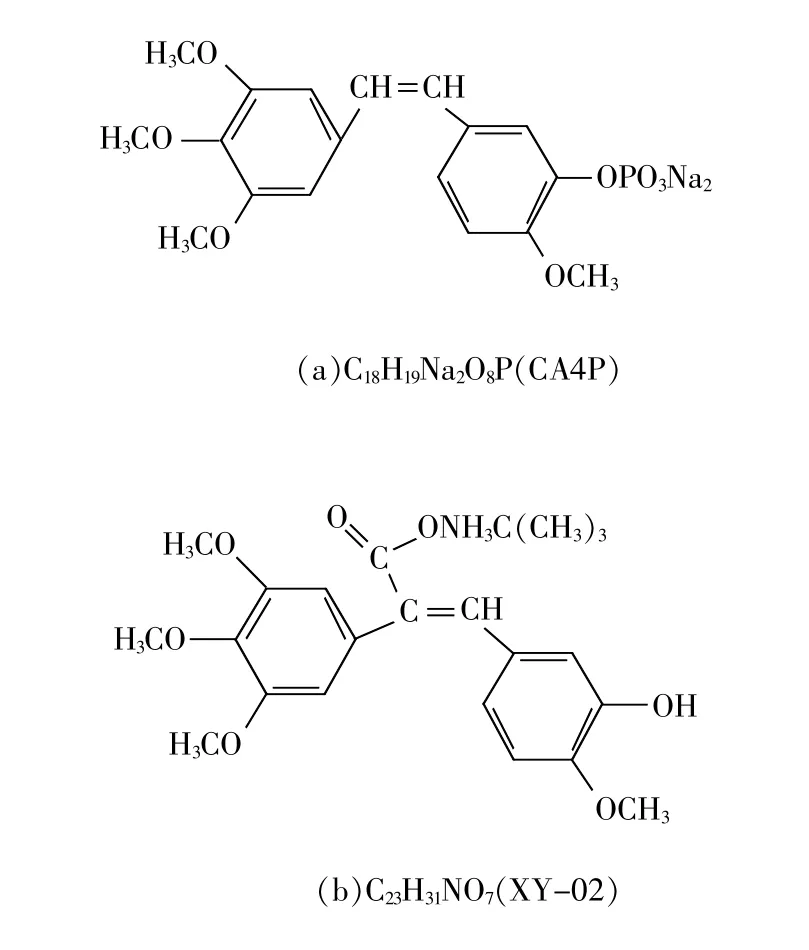
图1 XY-02和CA4P的化学结构图
1 实验部分
1.1 仪器与材料
液相色谱仪系统LC-2010A(日本岛津公司);可见-紫外分光光度仪UV2300(上海天美科学仪器有限公司);BT125D电子分析天平(Sartorius公司);TGL-16G Anke飞鸽牌高速离心机(上海安亭科学仪器厂);GL-88B旋涡振荡器(海门麒麟医用仪器厂);XHF-1内切式匀浆机(宁波新芝生物科技股份有限公司);纯水仪。XY-02对照品和供试品(质量分数≥99.50%,自制);内标1阿魏酸对照品(中国药品生物制品检定所);CA4对照品、CA4P对照品和供试品(99%,自制);内标2(E)-3-(4′-甲氧苯基)-2-(3′、4′、5′-三甲氧苯基)-2-丙烯酸(质量分数≥99%,自制);甲醇(色谱纯,FISHER);乙腈(色谱纯,FISHER);高氯酸、甲酸、乙酸、磷酸、三氟乙酸等其他化学试剂均为分析纯;超纯水(自制)。
1.2 动 物
成年健康SD大鼠,雌雄兼用,体重(170±20)g,由四川大学实验动物中心提供。饲养于四川大学实验动物中心普通小动物房,雌雄分笼;饲养条件符合GB 14925——2001《实验动物 环境及设施》。环境温度(19±3)℃,湿度55%±15%。
2 方法与结果
2.1 色谱条件
色谱柱:Aichrom band-AQ C18(250mm×4.6mm× 5μm);流动相:0.01%乙酸-甲醇(50∶50,ν/ν);流量为1.0 mL/min;检测波长为325 nm;柱温为35℃;进样量为20μL。
2.2 溶液的配制
2.2.1 XY-02、CA4P对照品储备溶液的制备
精密称取XY-02对照品18.8mg于25mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,制得质量浓度为750 μg/mL的XY-02对照品储备液。精密称取CA4P对照品15.0 mg于25 mL量瓶中,加甲醇溶液溶解稀释至刻度,摇匀,制得质量浓度为600 μg/mL的CA4P对照品储备液。于冰箱约4℃存放。
2.2.2 内标液的制备
精密称取内标1对照品13.1 mg于50 mL容量瓶中,加甲醇溶解稀释至刻度,摇匀,精密量取1mL置于50mL容量瓶中,加甲醇溶解稀释至刻度,摇匀,制得质量浓度为5.24μg/mL的内标1溶液。于冰箱约4℃存放。
精密称取内标2对照品10.3 mg,置于10 mL容量瓶加甲醇溶解稀释至刻度,摇匀,精密量取1mL于100 mL容量瓶中,加甲醇溶解稀释至刻度,摇匀,制得质量浓度为1.03μg/mL的内标2溶液。于冰箱约4℃存放。
2.3 样品的处理
取大鼠各组织匀浆100 μL,置于1.5 mL离心管中,加入内标1(5.24 μg/mL)100 μL或内标2(1.03 μg/mL)100 μL,加入10%高氯酸100 μL,涡旋混合3 min,静置,以12 000 r/min离心10 min,取上清液作为供试品溶液。
2.4 方法学验证
2.4.1 标准曲线
1)XY-02的标准曲线。取100μL空白心、肝、脾、肺、肾、胃、肠、脑、睾丸、子宫组织匀浆液各8份,均分别加入0.15,0.75,3,15,75,150,375,750μg/mL的XY-02对照品溶液100μL(含内标1,5.24μg/mL),加入10%高氯酸100 μL,按“2.3”项下方法操作,制备出标准曲线溶液。
2)CA4的标准曲线。取空白大鼠各组织匀浆液各6份,均分别加入0.03,0.06,0.3,3,6,60μg/mL的CA4对照品溶液100μL(含内标2,1.03μg/mL),加入10%高氯酸100 μL,按“2.3”项下方法操作,制备出标准曲线溶液。
精密量取上述标准曲线溶液各20μL,注入色谱仪,记录色谱图。以药物与内标峰面积比(Y)对组织中药物浓度(X)进行线性回归,分别得各组织溶液的标准曲线回归方程(见表1)。XY-02和CA4的线性范围分别为0.15~750 μg/mL和0.03~60 μg/mL,均具有良好的线性关系(r>0.9995)。
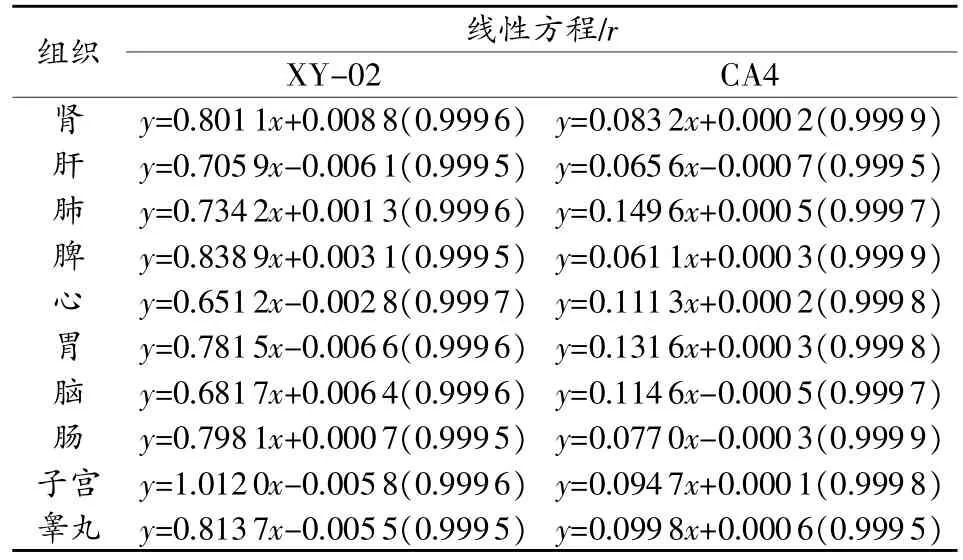
表1 XY-02和CA4的标准曲线
2.4.2 检测限
以XY-02和CA4标准曲线系列溶液中最低质量浓度不断稀释进样,按信噪比法,在S/N≥3时,XY-02和CA4检测的最低质量浓度分别为17ng/mL和4.93ng/mL。
2.4.3 提取回收率
按“2.4.1”项下方法制备XY-02在大鼠脾组织中的低、中、高(0.75,15,150μg/mL)3个质量浓度或CA4在大鼠脾组织样品中的低、中、高(0.03,3,6 μg/mL)3个质量浓度的QC样品,每一梯度各制备3份,以提取后的色谱峰面积与未经提取直接进样获得的色谱峰面积之比,考察样品的提取回收率。低、中、高3个质量浓度的脾组织匀浆液中XY-02的萃取回收率分别为98.72%,98.83%,99.69%,CA4的萃取回收率分别为96.39%,96.69%,97.66%,满足生物样品提取测定的要求。
2.4.4 准确度和精密度考察
取空白脾组织匀浆液30份,按“2.4.3”项下方法制备含XY-02或CA4低、中、高3个质量浓度的QC样品,每个梯度各5份,以标准曲线计算各样品中XY-02或CA4P的含量,并与加入量比较,计算组织中XY-02或CA4的加样回收率。于同一日内和不同日操作及测定,计算脾组织匀浆液中XY-02或CA4浓度的日内和日间精密度。
结果表明,高、中、低3组样品中XY-02或CA4的加样回收率均大于95%;XY-02的日内和日间精密度分别小于0.63%和0.57%,CA4日内和日间精密度分别小于2.42%和2.37%,测定结果的精密度良好。
2.4.5 稳定性考察
取组织样品,考察XY-02匀浆样品和CA4匀浆样品在-20℃冷冻14d、7次冻融循环和预处理后于室温下放置在进样架48h的稳定性。XY-02样品与CA4在这3种条件下的的剩余百分率分别依次为95.81%、94.52%、92.71%和99.50%、97.53%、93.23%。结果表明,XY-02和CA4组织样品于室温放置48h、-20℃下冷冻14d及冻融7次均稳定。
2.5 组织样品的采集
取SD大鼠,分为3个时间组,每组6只,给药前禁食12 h,静脉注射XY-02(80 mg/kg)或CA4P(1 mg/kg)。分别于给药后15,40,90 min时处死动物,采集大鼠各组织(心、肝、脾、肺、肾、胃、肠、脑、睾丸、子宫)。用纯水清洗组织表面血迹,用滤纸蘸干,称定各组织质量,再分取组织样品约0.6 g,精密称定,加2倍水制成各组织匀浆(剩余组织于-20℃冻存)。
2.6 组织样品的测定
取各组织匀浆适量,按“2.3”项下方法制备各组织供试品溶液,分别精密量取各组织供试品溶液20μL,注入液相色谱仪,记录色谱图。采用内标法,以随行标准曲线计算组织中XY-02或CA4的含量,并换算成每1g组织含XY-02或CA4的量。各组织中XY-02与CA4的含量(μg/g)测定结果见表2。XY-02与CA4分别在各组织中的分布情况如图2、图3所示。由于XY-02与CA4P的安全范围不同,CA4P的毒性较大,所以实验中二者的给药剂量不同,其中XY-02为80mg/kg,而CA4P为1mg/kg。为便于对两种药在同一剂量水平比较其组织中的分布规律,通过换算各组织中XY-02或CA4P的含量分别占给药量的百分比(%)来体现二者的分布特点,并对静脉注射给药15min后,XY-02与CA4P在大鼠各组织中的分布(%)结果进行比较,如图4所示。
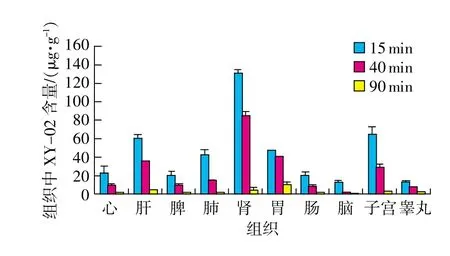
图2 大鼠注射80mg/kg XY-02组织分布图
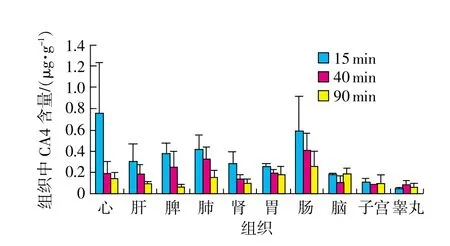
图3 大鼠注射1mg/kg CA4组织分布图
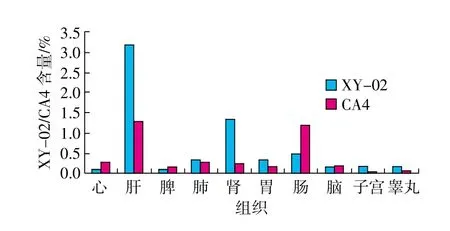
图4 15min大鼠各组织中XY-02与CA4分布比较
3 讨 论
根据CA4P为CA4的前体药物的性质,静脉注射CA4P后,在体内迅速脱磷酸酯成CA4,因此本实验通过测定CA4在各组织中的浓度,来考察CA4P在各组织中的分布规律。
结果表明,静脉注射XY-02或CA4P后,二者均具有分布广泛的特征,其中XY-02在15min内达到最大组织分布量,并且随着时间的增长,组织浓度逐渐下降,90min后接近或低于检测限。CA4P在15min内除睾丸未达到峰值,其他组织中CA4P的浓度均达到峰值,并且随之逐渐减少,到90 min后基本消除完全。提示二者的分布消除速度均较快,产生药物蓄积的可能性较小。
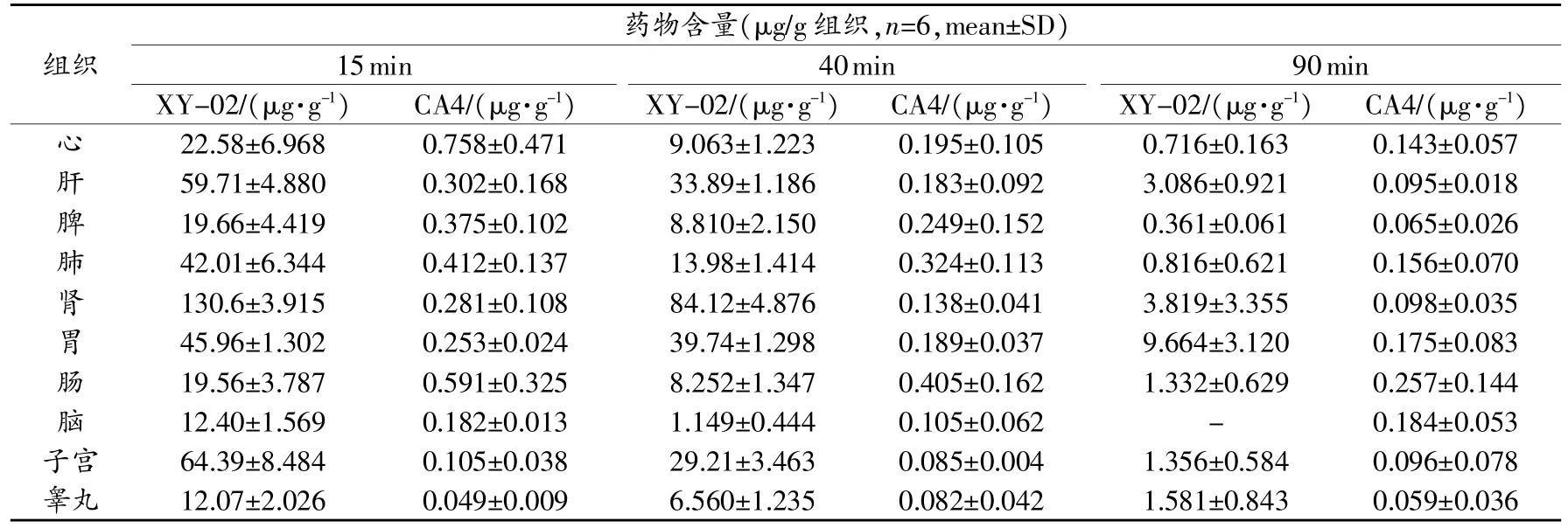
表2 不同时间XY-02与CA4的大鼠组织分布浓度
由图2可知,XY-02在大鼠各组织中分布顺序为肾>子宫>肝>胃>肺>心脏>脾>肠>脑>睾丸。其中肾脏分布最高,与XY-02以尿路排泄为主相吻合,其次是在子宫中也表现出较高的含量,同时肝脏中分布也较高,有利于肾癌、宫颈癌和肝癌的治疗。由图3可知,CA4P水解后的CA4在大鼠各组织中分布顺序为心脏>肠>肺>脾>肝>肾>胃>脑>子宫>睾丸。
由图4可知,XY-02在肝、肾、胃、肺、子宫、睾丸的分布明显高于CA4,提示XY-02对肝癌、肺癌和胃癌等实体瘤的治疗作用可能更优于CA4P。而值得注意的另一方面,CA4P在小肠中的分布明显高于XY-02,作为本类血管抑制剂的毒性靶器官,可预示CA4P引起肠道副反应,如腹泻、恶心、呕吐等将比XY-02更严重;同时CA4P在心脏中的分布明显高于XY-02,阐明了XY-02对心脏的毒性更小,由此引起的心悸和头晕等症状更轻。
4 结束语
本文在首次研究XY-02的大鼠组织分布中,发现XY-02在大鼠组织中广泛分布,在肾脏、子宫、肝脏、肺和胃组织中高分布特点,预示XY-02有利于临床上较难治疗肾癌、肝癌等的治疗;经与CA4P的组织分布比较,发现XY-02在心脏和肠道中的分布明显低于CA4P的分布,提示XY-02可减轻CA4P的心脏毒性和下消化道不良反应,具有更高的安全性。
[1]West C M,Price P.Combretastatin A4 phosphate[J]. Anti Cancer Drugs,2004(15):179-187.
[2]Siemann D W,Chaplin D J,Walicke P A.A review and update of the current status of the vasculature-disabling agent combretastatin-A4 phosphate(CA4P)[J]. Expert Opin Investig Drugs,2009,18(2):189-197.
[3]Pettit G R,Singh S B,Hamel E,et al.Isolation and structure of the strong cell growth and tubulin inhibitor combretastatin A4[J].Experientia,1989(45):205-211.
[4]Tozer G M,Kanthou C,Baguley B C.Disrupting tumour blood vessels[J].Nat Rev Cancer,2005(5):423-435.
[5]Parkins C S,Holder A J,Hill S A,et al.Determinants of anti-vascular action by combretastatin A-4 phosphate:role of nitric oxide[J].Br J Cancer,2008(3):811-816.
[6]Brooks A C,Kanthou C,Cook I H,et al.The vascular targeting agent combretastatin A-4-phosphate induces neutrophil recruitment to endothelial cells in vitro[J]. Anticancer Res,2003,23(4):3199-3206.
[7]Rustin G J,Galbraith S M,Anderson H,et al.Phase I clinical trial of weekly combretastatin A4 phosphate: clinical and pharmacokinetic results[J].J Clin Oncol,2003(21):2815-2822.
[8]Mooney C J,Nagaiah G,Fu P,et al.A Phase II trial of fosbretabulin in advanced anaplastic thyroid carcinoma and correlation of baseline serum-soluble intracellular adhesion molecule-1 with outcome[J].Thyroid,2009(19):233-240.
[9]Rustin G J,Shreeves G,Nathan P D,et al.A Phase Ib trial of CA4P(combretastatin A-4 phosphate),carboplatin,and paclitaxel in patients with advanced cancer[J].Br J Cancer,2010(102):1355-1360.
[10]Zweifel M,Jayson G C,Reed N S,et al.Phase II trial of combretastatin-A 4-phos phate,carboplatin,and paclitaxel in patients with platinum-resistant ovarian cancer[J].Ann Oncol,2011,22(9):2036-2041.
[11]何雯雯,刘静,张洁,等.抗癌药XY-02在大鼠体内的药物动力学[J].华西药学杂志,2008,23(5):577-579.
[12]Wang X,Chen Z,Che J,et al.Development of a rapid and sensitive LC-MS/MS assay for the determination of combretastatin A4 phosphate,combretastatin A4 and combretastatin A4 glucuronide in beagle dog plasma and its application to a pharmacokinetic study[J].Chromatogr B Analyt Technol Biomed Life Sci,2009(877):3813-3822.
[13]He X,Li S,Huang H,et al.A pharmacokinetic and safety study of single dose intravenous combretastatin A4 phosphate in Chinese patients with refractory solid tumours[J].Br J Clin Pharmacol,2011(71):860-870.
Comparisons of tissue distribution of tumor vascular inhibitors XY-02 and CA4P
NING Xin1,CHEN Furong1,ZHANG Yuxia1,FENG Ya’nan1,WANG Mengli1,XIE Hongying1,YONG Zhiquan2,XU Xiaoping1
(1.West China School of Pharmacy,Sichuan University,Chengdu 610041,China;2.Dongguan Daxin Biotech Co.,Ltd.,Dongguan 523808,China)
A HPLC method was developed for the comparative study of the tissue distribution of CA4P and XY-02 in rats.The test revealed the differences in target tissues as well as the potentialtreatmentand safety features ofthe two tumorvasculartargeting inhibitors.After intravenous administration of XY-02(80 mg/kg)or CA4P(1 mg/kg),samples like heart,liver,spleen,lung,stomach,intestine,brain,testis,uterus were taken at 15,40,and 90 min after dosing.The separation was performed on a ODS column(250 mm×4.6 mm×5 μm)with mobile phase methanol-0.01%acetic acid(50:50,ν/ν).The wavelength was set at 325nm and the flow rate was 1 ml/min.Calibration standards show that the excellent linearity range is 0.15-750 μg/mL for XY-02 and 0.03-60.0μg/mL for CA4P(r>0.9995).The lowest detectable concentration of XY-02 and CA4P is 17ng/mL and 4.93ng/mL,respectively.The results indicate that both XY-02 and CA4P are widely distributed and rapidly eliminated in tissues,suggesting that they may have potential treatment effect in vivo tumors in different tissues and the possibility of accumulation in vivo is little.The relatively high distribution of XY-02 in kidney and liver demonstrates that it may have a better value in treating kidney and liver cancers.Compared with CA4P,XY-02 is lower in cardiotoxicity and gastrointestinal adverse reaction and much safer.
XY-02;CA4P;intravenous administration;HPLC;tissue distribution
A
:1674-5124(2015)10-0053-05
10.11857/j.issn.1674-5124.2015.10.012
2015-04-15;
:2015-05-28
2014年东莞市引进创新创业领军人(201476815)
宁 欣(1991-),女,四川绵阳市人,硕士研究生,专业方向为药品质量控制和药物代谢分析。

