孕马尿中3种主要结合雌激素含量一测多评新方法研究
姚 军李东雨张煌涛鹿 毅高晓黎
(1.新疆医科大学药学院,新疆 乌鲁木齐 830054;2.新疆维吾尔自治区产品质量监督检验研究院,新疆 乌鲁木齐 830004)
孕马尿中3种主要结合雌激素含量一测多评新方法研究
姚 军1,2,李东雨1,张煌涛2,鹿 毅2,高晓黎1
(1.新疆医科大学药学院,新疆 乌鲁木齐 830054;2.新疆维吾尔自治区产品质量监督检验研究院,新疆 乌鲁木齐 830004)
建立基于质谱检测的一测多评(QAMS)测定孕马尿中3种主要结合雌激素方法。样品经大孔吸附树脂固相萃取小柱净化,利用HPLC-MS进行检测,以雌酮硫酸钠为内标,测定马烯雌酮硫酸钠及17α-双氢马烯雌酮硫酸钠的相对校正因子,进行3种成分的含量测定。结果表明,3种成分的线性、精密度、稳定性及回收率均较好。马烯雌酮硫酸钠及17α-双氢马烯雌酮硫酸钠的相对校正因子分别为0.8663和0.9884。色谱柱、碎片电压等均对校正因子影响较小,两种方法测定10批孕马尿样品中的3种结合雌激素含量,无显著性差异,该方法在测定孕马尿中3种主要结合雌激素方面有更大的优势。
结合雌激素;一测多评;LC-MS;相对校正因子
0 引 言
孕马结合雌激素作为激素补充疗法(hormonere placement therapy,HRT)的重要药物已经得到普遍应用[1],惠氏制药公司生成的倍美力、倍美安、倍美盈等药物中雌激素均为从孕马尿中获得。孕马雌激素是一类雌激素硫酸钠盐的混合物,被称为结合雌激素(conjugated estrogens,CE),种类较多,其中以雌酮硫酸钠(sodium estrone sulfate,ES)、马烯雌酮硫酸钠(sodium equilin sulfate,EqS)、17α-双氢马烯雌酮硫酸钠(sodium 17α-dihydroequilin sulfate,17α-EqS)为主,3者占结合雌激素总含量的90%以上,这3种成分是美国药典及欧盟药典作为孕马CE药物含量测定的质控成分[2]。
新疆伊犁河谷是我国马匹资源最为丰富的地区,当地数量众多的孕马资源使得提取孕马CE成为可能,在伊犁河谷已经有制药企业研发CE药物。在孕马尿原料、中间体、原料药及制剂等含量检测方面均需要测定其中主要的结合雌激素,但由于CE对照品合成困难,均需要从国外购买,售价高昂,尤其是EqS、17α-EqS的获得更为困难;因此,一测多评成为解决对照品短缺的方法之一。本课题组已经建立了一测多评HPLC-UV法测定孕马尿中主要CE的方法[3],但由于马尿样品成分复杂,在实际检测过程中发现部分马尿样品中这3种主要待测组分分离不佳,存在定量误差较大、定性不可靠的情况,使得该方法在实际应用方面受到限制,这也是复杂样品中利用HPLC-UV一测多评方法的不足之处。本实验建立的基于MS检测的一测多评新方法能够很好地解决以上问题,在实际检测过程具有更大的优势。
1 实验部分
1.1 仪器与试剂
1100型LC-MS联用仪(1100型高效液相系统,G1946C四级杆质谱检测器,配大气压电离源及电喷雾电离源,Agilent科技有限公司);AB135-S电子分析天平(梅特勒托利多公司);HERAEUS MULTIFUGE X3R高速冷冻离心机(Thermo scientific公司);Milli-Q超纯水处理系统(Millipore公司)。
乙腈为色谱纯;醋酸铵为优级纯;乙醇、氯化钠、氢氧化钠均为分析纯;超纯水(≥18.2mΩ);大孔树脂 (上海摩速公司,HPD-400型);ES、EqS及17α-EqS对照品(新疆新姿源生物制药公司提供,纯度≥99.0%);10批孕马尿样品来自新疆伊犁新源县土尔根乡牧户,均为怀孕母马尿液,编号1#~10#。
1.2 方法原理
一测多评法(quantitative analysis of multi-components with single marker,QAMS)是指在多指标质量评价时,以药材中某一典型组分为内标,测定该成分与其他成分间的相对校正因子,通过相对校正因子计算其他成分含量,各成分相对校正因子计算公式如下:fks=fk/fs=Wk×As/(Ws×Ak)(式中Wk为内标物浓度;Ak为内标物面积;Ws为组分S的浓度;As为组分S的峰面积)[4]。本实验采用MS作为检测器,以ES为内标,测定EqS及17α-EqS的相对校正因子并计算其含量。该方法测定的原理是基于3种CE化学结构相似,如图1所示,在一定碎片电压下采用ESI源、负离子模式,其产生准分子离子[M-Na+]的能力相似。在一定条件下各组分校正因子为一相对固定值。
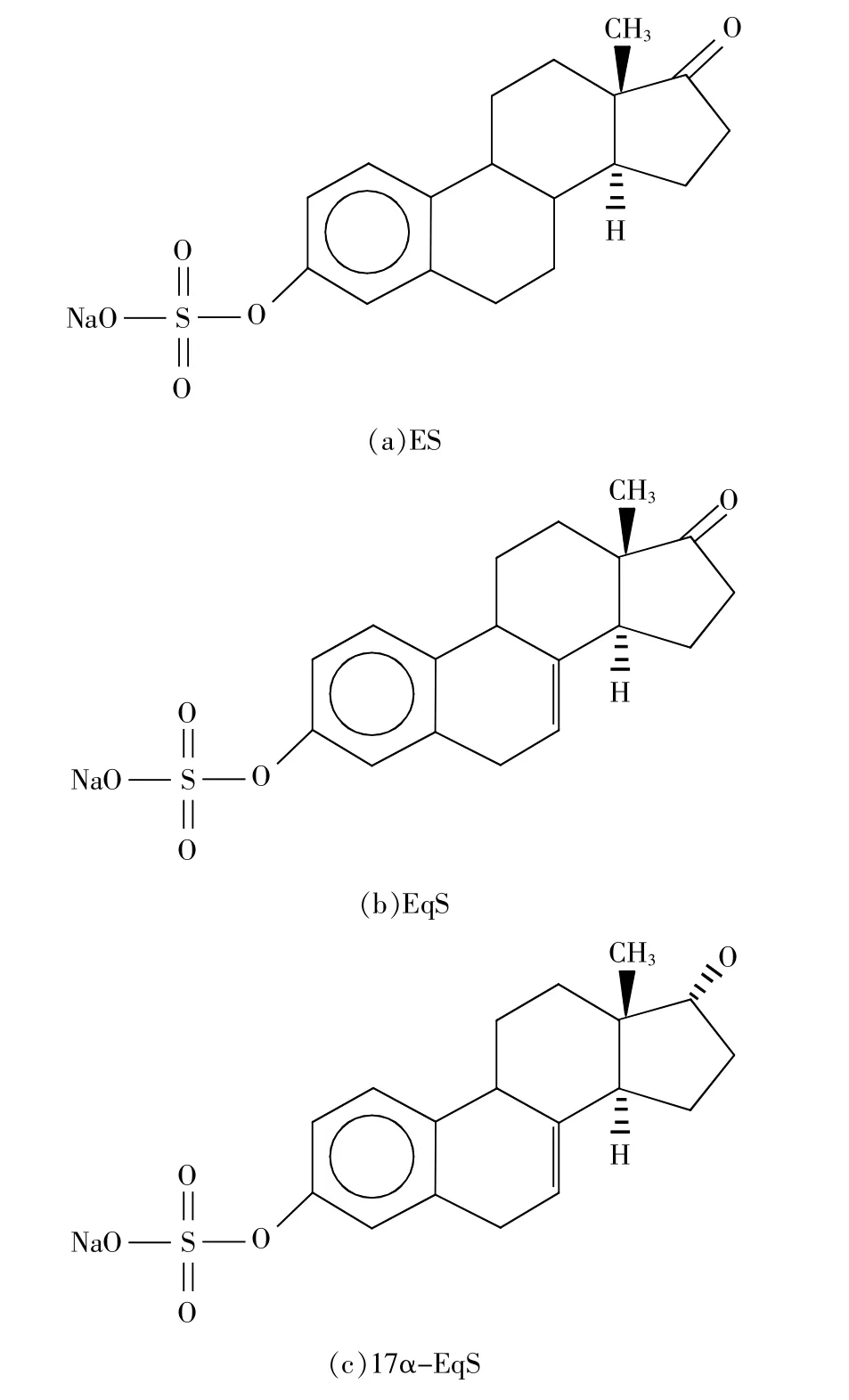
图1 ES、EqS、17α-EqS化学结构
1.3 溶液制备
1.3.1 结合雌激素对照品溶液制备
精密称取ES、EqS和17α-EqS对照品适量,用50%的甲醇水溶液配制成质量浓度分别为300,150,100μg/mL的储备液。精密吸取上述3种对照品储备液各2.00mL,置于同一50mL量瓶中,50%甲醇水溶液定容,制得ES、EqS、17α-EqS浓度分别为12.00,6.00,4.00 μg/mL的混合对照品溶液,分别精密吸取上述混合对照品溶液0.2,1.0,2.0,4.0,8.0,10.0 mL置于10mL量瓶中,50%甲醇水溶液定容,作为混合对照品系列标准溶液。
1.3.2 供试品溶液制备
固相萃取小柱:取5mL注射器管,1.0g HPD-400大孔吸附树脂干法装填,5 mL无水乙醇活化,之后5mL纯水,重力作用下洗脱。
取5 mL孕马尿于高速离心机5 000 r/min离心5min,精密吸取上清液1.00mL,缓慢滴入固相萃取小柱中,用4mL 5%NaCl溶液淋洗,再用4mL 1.5% NaOH溶液淋洗,弃去流出液,再用乙醇洗脱并收集流出液至10mL,摇匀,过0.22μm滤膜,作为孕马尿供试品溶液。
1.4 色谱、质谱检测条件
色谱柱:Agilent Eclipse XDB-C18色谱柱(4.6mm×150mm×5μm);以乙腈-0.01mol/L醋酸铵(30∶70,ν/ν)为流动相;柱温为35℃;流量为1.0mL/min,柱后分流:分流比2∶3,0.4 mL/min进质谱;进样体积:10μL。
采用选择离子(SIM)扫描模式,选择m/z349,347;ESI离子源;负离子检测;碎片电压:80V;雾化气(N2)压力为35 psi(1 psi=6.895 kPa),干燥气(N2)流量10.0 mL/min,干燥气温度350℃,毛细管电压3500V。
在该条件下,对照品溶液、供试品溶液及阴性样品(不含3种CE的马尿)的总离子流图(TIC)见图2,由SIM的总离子流图可以看出,由于只选择ES、EqS及17α-EqS的特征碎片离子的质荷比m/z为349、347、349,3种主要CE的分离情况较好,分离度>1.5,阴性样品无干扰。如果检测过程随柱效降低,EqS和ES无法基线分离,可以采用在TIC图中进行提取离子色谱(EIC)进行处理,能够得到各组分准确峰面积,而孕马尿中其他成分不会产生干扰。
2 结果与讨论
2.1 结果
2.1.1 线性方程
分别取“1.3.1”项下系列标准溶液10 μL进样,按“1.4”项下条件检测,以测得的峰面积与被测物的质量浓度(μg/mL)进行线性回归,得ES、EqS、17α-EqS的线性方程及线性范围如表1所示。结果表明3种CE线性良好。
2.1.2 精密度试验
另制备 ES、EqS、17α-EqS质量浓度分别为200,100,75μg/mL的混合储备液,稀释为质量浓度分别为8.00,4.00,3.00 μg/mL的ES、EqS、17α-EqS混合对照品溶液,进样5μL,重复进样6次,记录峰面积。结果ES、EqS、17α-EqS峰面积的RSD分别为1.18%,1.15%,1.08%。

表1 线性方程和线性范围
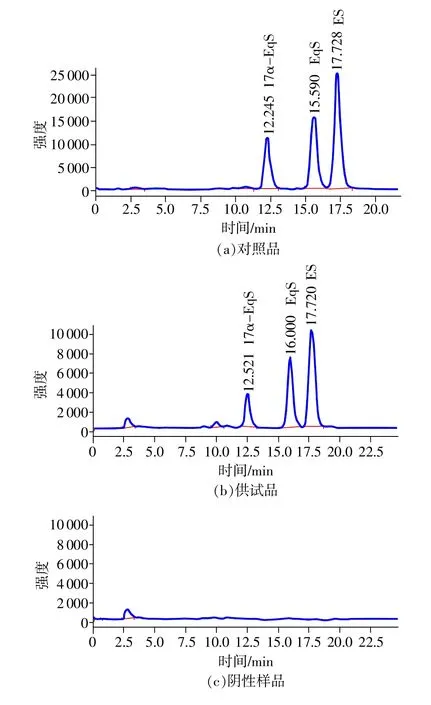
图2 对照品、供试品、阴性样品的总离子流(TIC)图
2.1.3 稳定性试验
取批号为1#孕马尿样品处理后的供试品溶液,分别于0,3,6,9,12,24h进样,记录峰面积。结果ES、EqS、17α-EqS峰面积的RSD分别为1.82%、2.11%、1.73%。
2.1.4 重复性试验
取批号为1#孕马尿样品按“1.3.2”项下方法制备供试品6份,分别进样5μL,记录峰面积,计算含量,结果ES、EqS、17α-EqS含量平均值(n=6)分别为89.8,23.5,15.7μg/mL;RSD分别为0.70%、2.18%、1.92%。
2.1.5 加样回收率试验
取已知含量批号为1#的孕马尿样品9份,每份5 mL,每3份为一组,置于10 mL容量瓶中,按高、中、低加入量分别加入ES、EqS、17α-EqS质量浓度为200,100,75μg/mL的储备液溶液各0.50,1.00,1.50mL后混匀,用纯水定容,混匀,在“1.4”项色谱条件下测定,计算ES、EqS、17α-EqS的平均回收率,平均回收率分别为96.3%、95.7%和94.9%。
2.1.6 基质效应的考察
取“2.1.2”中ES、EqS、17α-EqS分别为8.00,4.00,3.00μg/mL的待测液;按“1.4”方法下测定,3种CE在上述两种基质中的峰面积分别为A1、A2、A3和B1、B2、B3,机制效应ME(%)=A/B×100%,基质效应在93%~109%,说明基质效应影响较小。
2.1.7 相对校正因子的确定
1)CE相对校正因子的测定。取“1.3.1”项下系列标准溶液按“1.4”项下条件进样10μL,测定各组分的峰面积。分别测定10次,根据“1.2”项下公式分别计算EqS、17α-EqS与ES的相对校正因子,结果见表2。
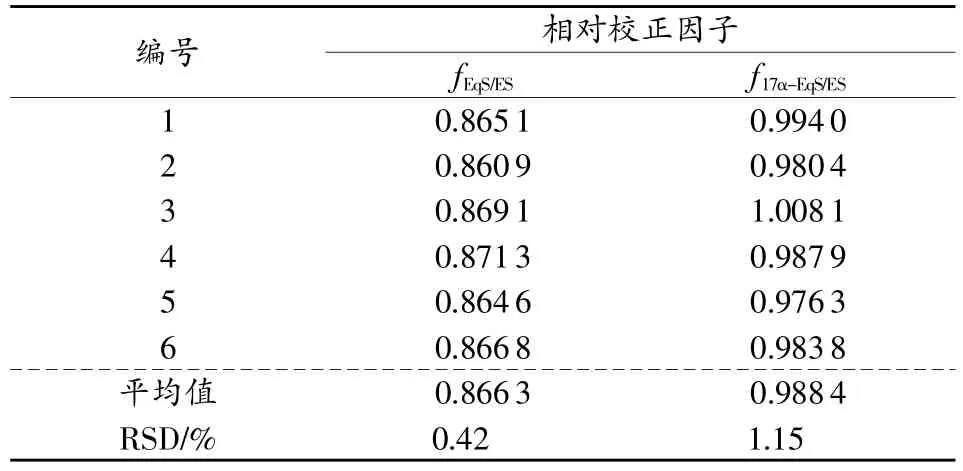
表2 EqS、17α-EqS与ES的相对校正因子
2)相对校正因子重复性考察。取“2.1.2”储备液制备ES、EqS、17α-EqS质量浓度为1.60,0.80,0.60μg/mL的CE对照品溶液6份,分别进样2,4,6,8,10μL,测定EqS、17α-EqS的相对校正因子分别为0.869 3,0.992 0,RSD分别为 1.20%、1.92%,表明 EqS、17α-EqS相对校正因子重复性良好。
3)不同色谱柱对校正因子的影响。采用Agilent Eclipse XDB-C18、DiKMA Diamonsil C18、YMC-Pack ODS,均为4.6mm×150mm×5μm色谱柱,取ES、EqS、17α-EqS浓度分别为1.60,0.80,0.60μg/mL的CE对照品溶液6份,进行测定,测得EqS、17α-EqS的相对校正因子分别为0.8618,0.9830,RSD分别为1.80%、2.20%,表明EqS、17α-EqS相对校正因子重复性良好。
4)LC-MS碎片电压对相对校正因子的影响。采用碎片电压分别为70,75,80,85,90 V,取ES、EqS、17α-EqS浓度分别为1.60,0.80,0.60μg/mL的CE对照品溶液,测定EqS、17α-EqS的相对校正因子分别为0.867 2,0.978 9,RSD分别为2.10%、2.30%,表明EqS、17α-EqS相对校正因子重复性良好。
5)两种方法的比较。取孕马尿样品1#~10#,共10批,采用本实验建立一测多评方法进行测定,同时采用3种待测物的对照品外标法测定,两种测定结果见表3,通过统计学检验,两种方法的检测结果无显著性差异。
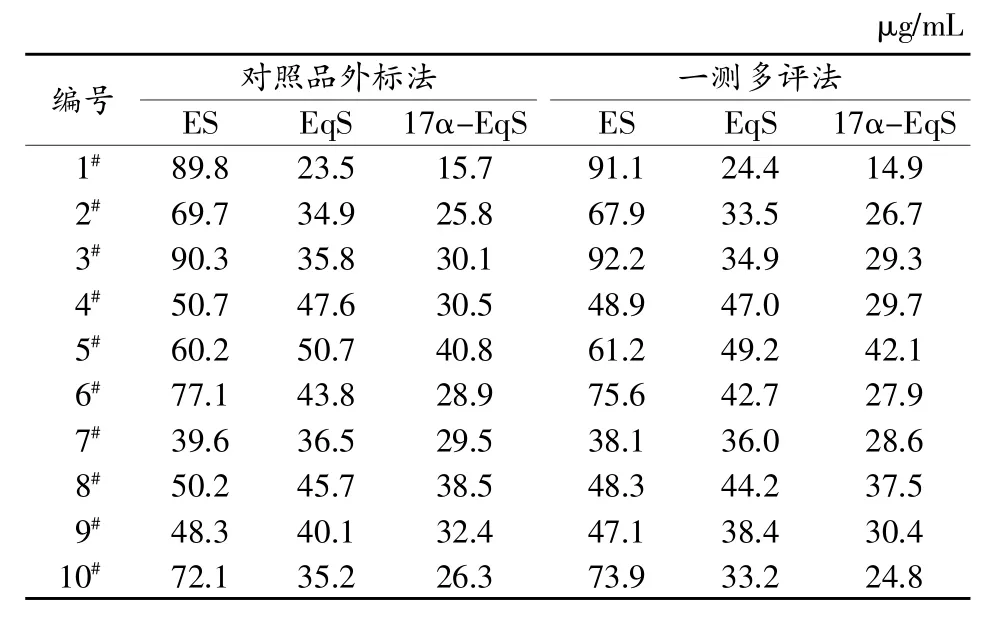
表3 10批样品中3种CE的测定结果
2.2 讨 论
2.2.1 前处理方法的建立
本实验建立的大孔吸附树脂为填料的SPE方法,适合孕马尿样品,加入5%的NaCl能够使CE通过盐析作用较好地被大孔吸附树脂吸附,1.5%的NaOH溶液可以将马尿中大量的酚类物质(如甲酚等)中和为盐,被提前洗脱出去,最后用乙醇(或甲醇)洗脱待测物。
2.2.2 HPLC-UV一测多评方法的不足
本课题组建立了孕马尿中3种结合雌激素的HPLC-UV一测多评方法[3],部分马尿样品色谱图见图3,由图可知3种主要CE对照品溶液色谱图分离效果较好,而对于供试品,由于孕马尿成分复杂,虽然经过SPE样品前处理,但采用UV检测,部分样品的色谱图中3种成分分离度不佳,无法进行准确的定性、定量,如果利用一测多评方法会产生较大的误差。
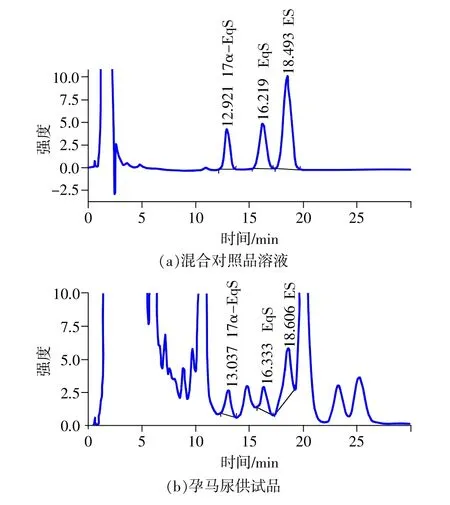
图3 HPLC-UV一测多评方法色谱图
本实验基于质谱检测的总离子流图(TIC)如图2所示,由于采用选择离子模式(SIM)扫描,只针对ES、EqS及17α-EqS进行测定,因此没有其他物质干扰,分离效果好,专属性强。
3 结束语
一测多评在中药材及复杂样品质量控制方面的应用越来越多[5],目前文献中采用的方法多基于HPLC-UV法进行测定,利用HPLC-UV方法进行一测多评所需仪器较为普及,测试成本较为低廉[6-8]。但定性方面采用相对保留时间进行定性,专属性方面存在一些困难,尽管可以采用PDA检测器进行验证,但由于通常检测的是一类化合物,紫外光谱差异较小,其作用有限。如果样品成分复杂,由于分离不佳,待测化合物的定量和定性都会影响一测多评的准确性。本文建立的基于MS检测的一测多评技术在样品的专属性、分离度方面有着明显的优势,对于复杂体系中结构较为相似的一类化合物采用一测多评方法提供了一种更为可靠的方法。
[1]Lindsay R,Gallagher J C,Kleerekoper M,et al.Bone response to treatment with lower doses of conjugated estrogens with and without medroxyprogesterone acetate in early postmenopausal women[J].Osteoporos Int,2005,16(4):372-379.
[2]木拉塔力·克里木,高晓黎,肖健民,等.孕马尿中雌激素成分研究[J].新疆医科大学学报,2009,32(4):403-405.
[3]赵倩,姚军,高晓黎.替代对照品法测定新疆孕马尿中3种主要结合雌激素含量 [J].中国现代应用药学杂志,2014,31(4):444-449.
[4]Gao X Y,Jiang Y,Lu J Q,et al.One single standard substance for the determination of multiple anthraquinone derivatives in rhubarb using high-performance liquid chromatography-diode array detection[J].J Chromatogr A,2009,1216(11):2118-2123.
[5]王智民,高慧敏,付雪涛,等.一测多评法中药质量评价模式方法学研究[J].中国中药杂志,2006,31(23):1925-1928.
[6]朱晶晶,王智民,匡艳辉,等.一测多评法同步测定人参和三七药材中多种人参皂苷的含量[J].药学学报,2008,43(12):1211-1216.
[7]王钰莹,冯伟红,杨菲,等.一测多评法测定三黄片中的大黄蒽醌类成分[J].中国中药杂志,2012,37(2):212-217.
[8]吴铁荣,许妍,罗跃华.一测多评法同步测定肿节风药材中6种成分[J].中药材,2011,34(11):1730-1734.
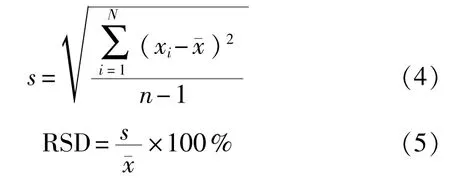
经过计算得到:测试压力为(300±5)kPa条件下,单件重复测量50次的平均值x¯=0.38006,标准偏差s=0.0081,相对标准偏差RSD=2.1%。其相对标准偏差<5%,证明该检测方法重复性好。
4 结束语
基于二氧化碳传感器的气密性检测方法,通过高准确度气敏传感器的浓度检测实现气体微量泄漏的快速、高效、高准确度检测,实验结果表明实测值与标准漏孔参考值误差均小于3%,检测结果准确可靠。在相同压力测试条件下,测试结果的相对标准偏差<5%,实验重复性好,提高了气密性检测方法的多样性和准确度。检测方法优良的设计和可靠的性能,为提高生产效率和提升气密性检测准确度发挥了重要作用,具有广阔的应用前景。
参考文献
[1]曾成洲.基于压差原理的泄漏检测方法研究及系统开发[D].杭州:浙江大学,2012.
[2]季增连,王道顺.直压式气体泄漏检测技术的研究[J].中国仪器仪表,2007(11):30-32.
[3]肖祥正.泄漏检测方法与应用 [M].北京:机械工业出版社,2009:1-13.
[4]季增连.气体泄漏检测系统的研究与设计[D].大连:大连交通大学,2008.
[5]Tinoco A V.Improving the performance of micro-machined metal oxide gas sensors:Optimization of the temperature modulation mode via pseudorandom sequences[D]. Catalan:University Rovirai Virgili,2006.
[6]Joanne H S,Mcmanus J B,Charles E K.Collection of leakage statistics in the natural gas system by tracer methods[J].Environmental Science and Technology,1997,31(7):2012-2019.
[7]熊四昌,黄林,金振峰.基于容积补偿的压差式高准确度气体检漏装置的研究[J].机床与液压,2008,36(11):20-22.
[8]秦国军,胡茑庆,袁杰红.氢泄漏检测技术[M].北京:国防工业出版社,2011:92-101.
[9]廖栩诚,华晓青.直压式微小泄漏检测技术研究[J].液压与气动,2009(6):62-65.
[10]ISO 10297—2006 Transportable gas cylinders-cylinder valves-specification and type testing[S].2006.
Study on the contents of three main conjugated estrogens in the pregnant mare’s urine using a new method of QAMS
YAO Jun1,2,LI Dongyu1,ZHANG Huangtao2,LU Yi2,GAO Xiaoli1
(1.College of Pharmacy,Xinjiang Medical University,Urumqi 830054,China;2.Xinjiang Uygur Autonomous Region Product Quality Supervision and Inspection Institute,Urumqi 830004,China)
The purpose of this paper is to establish the Quantitative Analysis of Multi-Components by Single Marker(QAMS)to determine the contents of three main conjugated estrogens in pregnantmares'urine based on mass spectrometry analysis.Samples were purified by a macroporous adsorption resin solid-phase extraction column and then detected by HPLC-MS.The relative correction factors in sodium equilin sulfate and sodium 17α-dihydroequilin sulfate were determined using sodium estrone sulfate as the internalstandard to assay the three main conjugated estrogens.The results show that the three main components are good in linear and precision,stability and recovery.The relative correction factors of sodium equilin sulfate and sodium 17α-dihydroequilin sulfate were 0.8663 and 0.9884 respectively.The chromatographic column and fragmentation voltage have little effect on the relative correction factors.There are no significant differencesin determining the three main conjugated estrogens in ten batchesof pregnant mares'urine samples.Therefore,this method has greater advantages in determining pregnant conjugated estrogens described in above.
conjugated estrogens;QAMS;LC-MS;relative correction factor
A
:1674-5124(2015)10-0058-05
10.11857/j.issn.1674-5124.2015.10.013
2015-05-14;
:2015-06-30
新疆维吾尔自治区自然科学基金(2013211A054)
姚 军(1973-),男,新疆乌鲁木齐市人,副教授,研究方向为药物分析。

