鞍带石斑鱼早期幼鱼对饲料中不同可消化糖源的利用
李伟峰,吴小易,姜顺天,罗 源
(海南大学 海洋学院水产养殖系,海南 海口 570228)
鞍带石斑鱼早期幼鱼对饲料中不同可消化糖源的利用
李伟峰,吴小易,姜顺天,罗 源
(海南大学 海洋学院水产养殖系,海南 海口 570228)
实验研究了鞍带石斑鱼(Epinephelus lanceolatus)早期幼鱼对饲料中不同可消化糖源的利用,结果显示:各实验组的增重率及成活率无显著差异(p>0.05).对照组饲料鱼的特定增长率(SGR)显著(p<0.05)低于其他各组;各组蛋白质保留率(PPV)和蛋白质利用效率(PER)无显著差异;对于喂食4种可消化糖的饲料鱼,其全鱼蛋白显著高于对照组,而对于喂食麦芽糖的饲料组鱼,其全鱼脂肪显著低于对照组;对于喂食4种可消化糖的饲料鱼,其肌肉脂肪含量显著低于对照组;血液谷丙转氨酶(ALT)、血清白蛋白(ALB)、葡萄糖、高密度脂蛋白(HDL-C)和低密度脂蛋白(LDL-C)的浓度显著受饲料中不同糖源的影响;各试验组鱼肠道的淀粉酶和麦芽糖酶活性均无显著差异.
鞍带石斑鱼幼鱼; 糖利用; 生长
糖是水产动物饵料中三大营养素之一[1],其代谢不仅是提供动物生命活动所需能量的主要途径之一,而且代谢过程中还可以产生许多重要的功能性中间产物.早期有学者对鱼类糖利用进行了综述并表明,海水鱼幼鱼可利用近20%可消化糖[2-3].近年来,关于海水鱼幼鱼营养素代谢的研究越来越受到关注,在蛋白质及脂肪代谢、利用方面,开展了较广泛的研究[4-6],一定程度上提高了海水鱼幼鱼的成活率.但是,作为主要营养素之一的糖,关于其在幼鱼体内的消化、转运等的研究很少.饲料中添加适当比例的糖类可以作为鱼类生命活动所需要的能源物质,同时又可以起到节约蛋白质降低饲料成本的作用[7],但是饲料中过多的糖类添加会导致鱼体内肝脏脂肪、肠系膜脂肪等的堆积,并引起鱼体内生理代谢活动的混乱[8-10].
作为最廉价的能源物质,糖类在自然界中分布极其广泛.鱼类和陆生动物相比,鱼类对饲料中糖的利用能力较低,当饲料中的糖添加水平过量时,就会引起鱼体生长迟缓、机体抗病能力下降、死亡率升高等一系列状况.影响鱼类对饲料中糖利用的因素有很多,包括鱼的食性、生长、胰岛素水平、代谢酶含量等内部因素和糖的种类、添加水平、摄食情况、环境、温度等外部因素.
随着石斑鱼养殖规模不断扩大,养殖过程中各个环节仍需进一步完善.目前国内石斑鱼养殖仍以生物饵料(新鲜小杂鱼、甲壳类、软体动物、虾和沙蚕等)为主,这种养殖模式增加了养殖成本,造成饵料营养不均衡、饲料利用率低下,引起水体污染,生物饵料中携带的病原菌会导致鱼体疾病的大规模暴发[11].海洋生物资源日渐匮乏,使得这种养殖方式已经不能满足石斑鱼养殖业健康可持续发展.开发新型、经济、高效和环保人工配合饲料成为当务之急.自上世纪90年代中期以来,关于不同种类石斑鱼营养需求国内外学者已经开展了研究,如蛋白质需求、脂肪需求、糖类需求等.但这些研究依旧不够全面,使得石斑鱼配合饲料的开发仍受到一定限制[12].
本实验选择鞍带石斑鱼(Epinephelus lanceolatus)为研究对象,研究其早期幼鱼对饲料中不同可消化糖源的利用.
1 材料与方法
1.1 实验饲料制作
实验设计了五种等蛋白(粗蛋白45%,干重)等脂(粗脂肪22%,干重)的不同饲料,包括一个不含可消化糖的对照组和4个糖添加水平均为8%的葡萄糖组、麦芽糖组、糊精组和淀粉组.按照配方制作出此5种饲料(表1).粉碎制作饲料所需的各种干原料,过40目筛,按配方比例称重、混合,手动混匀后放入搅拌机(A-200TMixerBenchModelunit,ResellFoodEquipmentLtd.,Ottawa,Canada)搅拌30min,搅拌过程中逐步加入鱼油和大豆卵磷脂.然后,按照每100g干物质30-50mL水的添加比例缓慢加水至原料搅拌成团.搅拌成团后,使用双螺杆挤压式挤条机、造粒机(中国,广州,华南理工大学,化学工程学院)制作成直接1.0mm的实验所需颗粒饲料.所有饲料均自然风干24h至水分含量10%以下.过筛然后使用密封袋封装保存在-20 ℃环境下备用.使用AOAC(1985)标准方法测定各饲料粗蛋白、粗脂肪及水分含量.
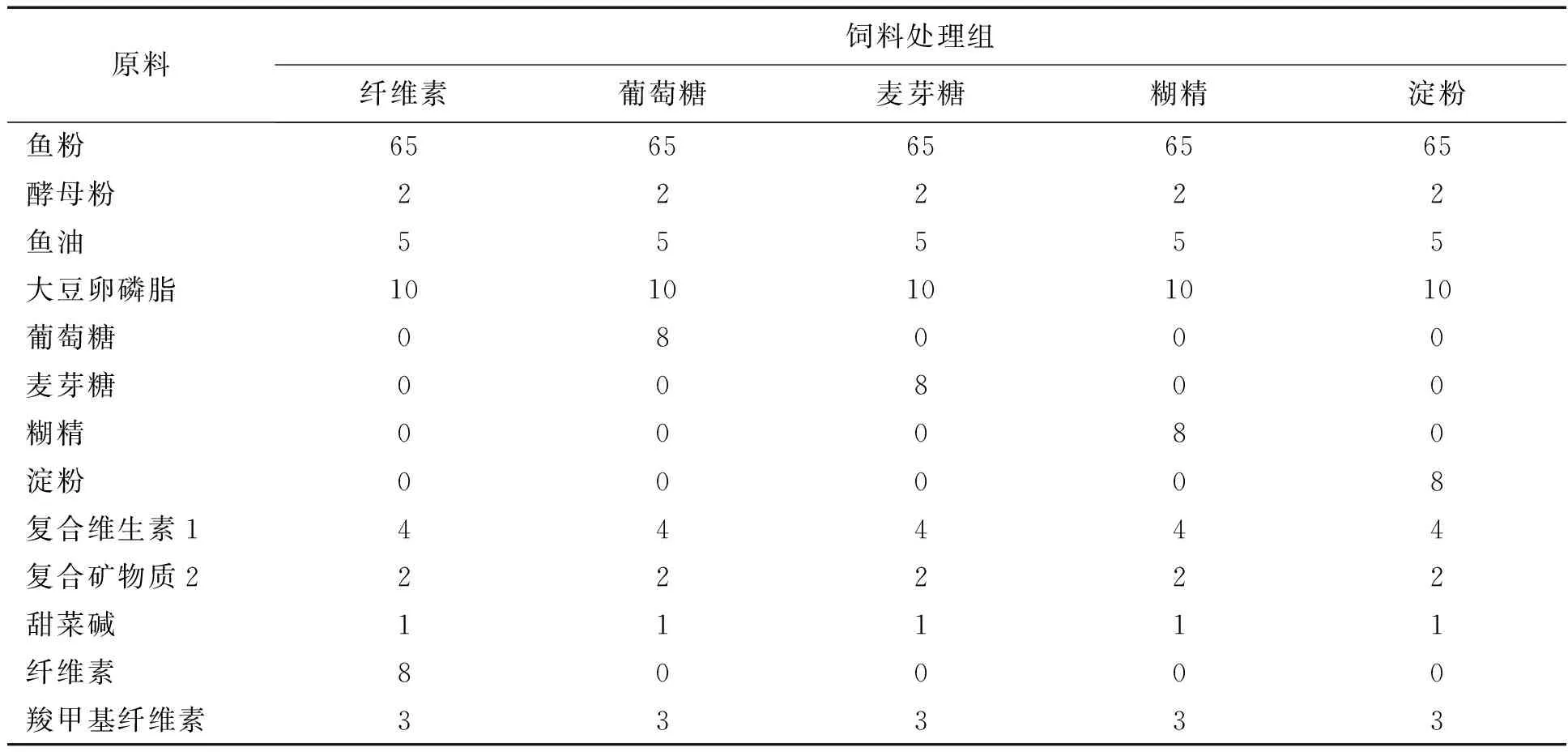
表1 试验饲料组成(%干物质)
1复合维生素 (干饲料kg-1): 浓缩胆碱 50%, 200g; 维生素E(500IU/g) 10g; 维生素D3 (500,000IU/g) 0.50g;维生素B3 1g; 维生素B5 2g; 维生素B1 100mg; 维生素B2 0.4g; 维生素B6 300mg; 维生素C20g;维生素B9 100mg;浓缩维生素B12 (1g/kg),1g;维生素K3 1g;肌醇30g;纤维素, 732.1g[13].
2复合矿物质(干物质gkg-1):90gKCl、 40mgKIO3、500gCaHPO4·2H2O、40gNaCl、3gCuSO4·5H2O、4gZnSO4·7H2O、20mgCoSO4·7H2O、20gFeSO4·7H2O、3gMnSO4·H2O、215gCaCO3、 124gMgSO4·7H2O、和 1gNaF[13].
1.2 实验鱼苗及实验设计 实验所用鞍带石斑鱼幼鱼来自海南省昌江县基益豊水产养殖有限公司.实验开始前,将实验用鱼饲养在室内水泥池网箱中驯化一周,至鱼苗适应养殖环境.将初始均重为(0.44±0.06)g实验幼鱼随机分配到15个6m3水泥池中,每个水泥池60尾鱼.实验分为5组,每3个水泥池为一个平行,各组分别投喂不含可消化糖饲料、含葡萄糖饲料、含麦芽糖饲料、含糊精饲料和含淀粉饲料.每天投喂3次,早上8:00,中午12:00和下午17:00,采用人工饱食投喂.实验采用流水养殖模式,自然光照,采用Allan[14]等人方法,每周测定海水盐度(30.16~35.23g/L)、水温(27~28 ℃)、氨氮(0~0.20mg/L)和溶解氧(5.9~6.3mg/L),养殖周期为40天.
1.3 样品采集 养殖试验进行到第40天后准备取样,取样前一天,对实验鱼进行饥饿处理16h,然后将每个水泥池实验鱼计数并称重.每个水泥池随机取11条鱼进行麻醉(10mg/LMS-222),其中3条用于鱼体组成分析,另外8条称重后使用内有肝素钠的注射器抽取血液并测定全长、体长,然后解剖,称量内脏、肝脏和肠系膜脂肪重.取鱼体背部两侧白肌,去皮后装袋标记备用.每个水泥池再各取一份完整的肝脏和肠道,分别放置在5mLEP管中,编号后迅速放入液氮中保存.血液样品用离心机3 500g离心10分钟,取上清注入5mLEP管中,编号后迅速放入液氮中保存待用.
1.4 分析方法 使用AOAC(1985)标准方法测定各组粗蛋白、粗脂肪及水分含量.将编号后的样品置于烘箱中105 ℃烘24h至恒重得到水分含量;粗蛋白(N×6.25)含量则使用凯斯定氮仪(1030-Auto-analyzer,Tecator,Sweden)测定;脂肪含量利用索氏抽提法即利用石油醚在脂肪抽提机中抽提(SoxtecSystemHT6,Tecator,Sweden)测定;灰分含量则是将标记好的样品置于马弗炉中600 ℃24h后测定获得.
血液谷丙转氨酶(ALT),白蛋白(ALB), 葡萄糖, 高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇 (LDL-C) 等指标采用全自动血液分析仪(Hitachi7170A,Hitachi,Tokyo,Japan)分析测定.
肝脏和肠道样品相关酶酶活力分析:将实验样品放入装有10倍生理盐水的玻璃匀浆器中冰冷却匀浆,然后用离心机在4 ℃,3 000g离心15分钟,去上清液-20 ℃保存待分析.淀粉酶、麦芽糖酶和葡萄糖六磷酸脱氢酶酶活性使用Elisa试剂盒(美国R&D)(试剂号:201311)在Bio-TekELX800酶标仪上测定.
1.5 计算公式 形态学指标公式:
肥满度 (CF) = (体重(g)) / (体长 (cm))3×100
脏体比(VSI) =内脏重 (g)/体重(g) ×100
肝体比(HSI) =肝脏重 (g)/体重(g) ×100
肠系膜脂肪体比 =肠系膜脂肪重(g) /体重(g) ×100
生长性能指标公式:
增重率 (WG) = (末均重(g)-初均重(g)) /初均重(g) ×100
特定生长率 (SGR) = (ln(末均重(g))-ln(初均重(g))) / 天数×100
饲料效率(FE) =(末均重(g)-初均重(g)) / 饲料摄取量(g)
饲料转化效率(FCR) =饲料干重(g) /增重(g)
蛋白质效率 (PER) =增重(g) /蛋白质投喂量(g)
摄入量(FI) =饲料消耗量(g) / ((初均重(g) +末均重(g))/2)/养殖天数×100%
蛋白保留率(PPV) =鱼体蛋白(g) / 蛋白投喂量(g)
1.6 数据统计 使用统计软件SPSS12.0进行单因素方差分析(ANOVA)(n =3),所有数据均采用平均值±标准差的方式表示.采用Duncan’s多重比较来分析各组数据间的差异性,显著性差异为p < 0.05.
2 结 果
2.1 生长性能和饲料利用 鞍带石斑鱼幼鱼的生长性能和饲料利用见表2.各组实验鱼末均重无显著性差异.增重率无明显差异,但是投喂纤维素饲料组鱼的特定生长率显著(p<0.05)低于其他各实验组鱼.摄食率、饲料效率、蛋白质效率和蛋白质保留率在各组鱼间均无显著性差异.

表2 喂食各组饲料40天鞍带石斑鱼幼鱼生长性能和饲料利用
注:同一行数值的不同字母上标表示彼此之间有显著差异 (p<0.05).
2.2 形态学指标 各组实验鱼的形态学指标(表3)显示,肥满度、脏体比和肠系膜脂肪体比(IPFratio)在各饲料组鱼间无显著性差异,但是喂食葡萄糖组饲料鱼肝体比显著低于其他各实验组鱼.
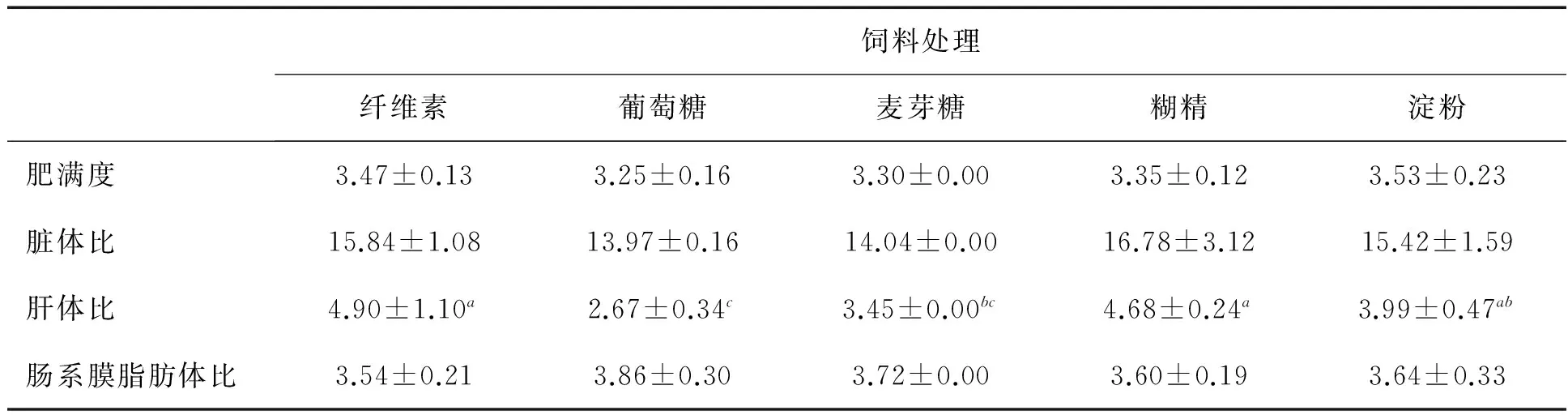
表3 喂食各组饲料40天鞍带石斑鱼幼鱼体组成指标
注:同一行数值的不同字母上标表示彼此之间有显著差异 (p<0.05).
2.3 全鱼及肌肉成分分析 全鱼及肌肉成分见表4.全鱼蛋白含量结果显示,喂食四种含可消化糖饲料鱼的全鱼蛋白显著高于对照组(p<0.05),喂食麦芽糖饲料组鱼全鱼脂肪显著低于对照组.喂食四种含可消化糖饲料鱼的肌肉脂肪含量显著低于对照组.
2.4 血液及酶活力指标 鱼体血液谷丙转氨酶(ALT)、血清白蛋白(ALB)、葡萄糖、高密度脂蛋白胆固醇(HDL-C)和低密度脂蛋白胆固醇(LDL-C)的含量受饲料中不同糖源影响显著(p<0.05)(表5).各试验组鱼葡萄糖六磷酸脱氢酶、肠道淀粉酶和麦芽糖酶酶活性均无显著差异(表6).

表4 喂食各组饲料40天鞍带石斑鱼幼鱼全鱼、肌肉和肝脏成分分析
注:同一行数值的不同字母上标表示彼此之间有显著差异 (p<0.05).

表5 喂食各组饲料40天鞍带石斑鱼幼鱼血液成分相关指标
注:同一行数值的不同字母上标表示彼此之间有显著差异 (p<0.05).

表6 喂食各组饲料40天鞍带石斑鱼幼鱼糖代谢相关酶酶活力
3 讨 论
相比于哺乳类动物,鱼类消化吸收糖类的能力更低[1].Wilson[2]、Hemre[3]和Krogdahl[15]等对鱼类糖利用进行了综述并得出结论:鱼类糖利用能力和鱼种类、食性及水温有关.例如,草鱼(Ctenopharyngodon idella)[16]比冷水、肉食性海水鱼类如大西洋鲑鱼(Salmo salar)[17]能更好利用糖类.在其他研究中也有报道,肉食性鱼类对饵料中糖的利用能力非常有限[18,19].除鱼类本身特性差异外,糖的来源、类型及饲料中糖添加水平均会影响鱼类糖利用效率.有研究[20]发现,糖类分子越小,幼白鲟对糖的利用能力越强,该研究表明:在幼白鲟饲料中添加 27.2%含量的不同类型糖源时,幼白鲟对这些不同类型糖源利用能力依次为葡萄糖>麦芽糖>糊精>半乳糖>纤维素.Silas等[21]在对虹鳟糖利用能力的研究中也得到了相同结果.在条纹鲈及杂交鲈的研究中,研究者发现这两种鱼对葡萄糖和麦芽糖的消化率也较对糊精的消化率高[22],但饲料中添加不同类型糖对条纹鲈及杂交鲈蛋白质及脂肪消化率无显著影响.
本实验中,喂食葡萄糖组和麦芽糖组鱼血液葡萄糖含量高于其他各组,这也和Hung等的实验结果相吻合.血液其它指标如谷丙转氨酶、白蛋白、高密度脂蛋白及低密度脂蛋白也受到各实验处理组的影响,但未表现出一定规律.增重率(WG)和蛋白质保留率(PPV)在各组间均无显著性差异.Peres等[23]和Stone[24]发现蛋白质利用效率受葡萄糖利用的影响.可消化糖添加组鱼特定生长率和全鱼蛋白含量显著高于无可消化糖添加组,但肌肉脂肪含量显著低于无可消化糖添加组 (p<0.05).由此可推测饲料中添加适宜含量糖可提高鞍带石斑鱼早期幼鱼肌肉蛋白含量,同时也能减少鱼体脂肪沉积.这可能是由于可消化糖摄入影响了实验鱼体内蛋白质及脂肪代谢效率,未来需在这方面开展进一步研究.肝脏组织葡萄糖-6-磷酸脱氢酶及肠道组织淀粉酶和麦芽糖酶活性在各实验组间无显著性差异,这可能与实验糖源添加水平较低有关.
总之,在本实验条件下,基于幼鱼特点生长率为指标,鞍带石斑鱼幼鱼能利用饲料中8%葡萄糖、或麦芽糖、或糊精、或是淀粉.下一步实验应研究饲料中可消化糖对饲料蛋白及饲料脂肪的替代作用.
[1]NRC(NationalResearchCouncil).NutrientRequirementsoffish[M].NewYork,USA:NationalAcad.Press, 1993.
[2]WilsonRP.Utilizationofdietarycarbohydratebyfish[J].Aquaculture, 1994, 124: 67-80.
[3]HemreGI,MommsenTP,KrordahlÅ.Carbohydratesinfishnutrition:effectsongrowth,glucosemetabolismandhepaticenzymes[J].Aquact.Nutr,2002, 8: 175-194.
[4]JohnsonEG,WatanabeWO,EllisSC.Effectsofdietarylipidlevelsandenergy:ProteinratiosongrowthandfeedutilizationofjuvenileNassau grouperfedisonitrogenousdietsattwotemperatures[J].NorthAmericanAquaculture, 2002, 64(1): 47-54.
[5]CahuCL,ZamboninonfanteJL,BarbosaV.Effectofdietaryphospholipidlevelandphospholipid:neutrallipidvalueonthedevelopmentofseabass(Dicentrarchus labrax)larvaefedacompounddiet[J].BritishJournalofNutrition, 2003, 90: 21 - 28.
[6]WuXY,LiuYJ,TianLX,etal.UtilizationofdifferentrawandpregelatinizedstarchsourcesbyjuvenileyellowfinseabreamSparuslatus[J].AquacultureNutrition, 2007, 13:389-396.
[7]MohantaKN,MohantySN,JenaJ,etal.Carbohydratelevelinthedietofsilverbarb, Puntius gonionotus(Bleeker)fingerlings:effectongrowth,nutrientutilizationandwholebodycomposition[J].AquacultureResearch, 2009, 40: 927-937.
[8]BraugeC,MedaleF,CorrazeG.Effectofdietarycarbohydratelevelsongrowth,bodycompositionandglycemiainrainbowtrout, Oncorhynchus mykiss,rearedinseawater[J].Aquaculture, 1994, 123: 109-120.
[9] 李爱杰.水产动物营养与饲料科学[M].北京:北京农业出版社,1996.
[10] 田丽霞,刘永坚,冯健,等.不同种类淀粉对草鱼生长、肠系膜脂肪沉积和鱼体组成的影响[J].水产学报,2002,26(3):247-251.
[11]LuoZ,LiuYJ,MaiKS,etal.OptimaldietaryproteinrequirementofgrouperEpinephelus coioidesjuvenilesfedisoenergeticdietsinfloatingnetcages[J].Aquac.Nutr, 2004, 10: 247-252.
[12]LuoZ,LiuYJ,MaiKS,etal.Effectofdietarylipidlevelongrowthperformance,feedutilizationandbodycompositionofgrouperEpinepheluscoioidesjuvenilesfedisonitrogenousdietsinfloatingnetcages[J].Aquac.Int, 2005, 13: 257-269.[13]MazuraisD,GlynatsiN,DariasMJ,etal.OptimallevelsofdietaryvitaminAforreduceddeformityincidenceduringdevelopmentofEuropeanseabasslarvae(Dicentrarchus labrax)dependonmalformationtype[J].Aquaculture, 2009, 294: 262-270.
[14]AllanGL,MaguireGB,HopkinsSJ.AcuteandchronictoxicityofammoniatojuvenileMetapenaeusmacleayiandPenaeusmonodonandtheinfluenceoflowdissolved-oxygenlevels[J].Aquaculture, 1990, 91: 265-280.
[15]Krogdahl,HemreGI,MommsenTP.Carbohydratesinfishnutrition:digestionandabsorptioninpostlarvalstages[J].Aquact.Nutr, 2005,11: 103-122.
[16]WilsonRPHandbookofNutrientRequirementofFinfish[M].BocaRaton,FL:CRCPress, 1991:89-96.
[17]WilsonRP.HandbookofNutrientRequirementofFinfish[M].BocaRaton,FL:CRCPress, 1991,pp. 13-22.
[18]BergotF.Carbohydrateinrainbowtroutdiets:effectsofthelevelandsourceofcarbohydrateandthenumberofmealsongrowthandbodycomposition[J].Aquaculture, 1979, 178: 157-547.
[19]HiltonJW,AtkinsonJL.Responseofrainbowtrout(Salmo gairdneri)toincreasedlevelsofavailablecarbohy-drateinpracticaltroutdiets[J].Br.J.Nutr, 1982, 47: 597-607.
[20]HungSSO,Fynn-aikinsK.Carbohydrateutilizationanditsimpactonsomemetabolicandhistologicalandhistologicalparamentersinwhitesturgeon[J].FishNutritioninPractice, 1993:127-136.
[21]HungSSO,StorebakkenT.Carbohydrateutilizationbyrainbowtroutisaffectedbyfeedingstrategy[J].AmericanInstituteofNutrition, 1994, 94: 223-230.
[22]RawlesSD,GatlinDM.Carbohydrateutilizationinstripedbass(Morone saxatilis)andsunshinebass(Morone chrysops♀×M.saxatilis ♂)[J].Aquaculture, 1998, 161:201-212.
[23]PeresH,Oliva-telesA.UtilizationofrawandgelatinizedstarchbyEuropeanseabass(Decentrarchus labrax)juveniles[J].Aquaculture, 2002, 205: 287-299.
[24]StoneSAJ,AllanGL,AndersonAJ.Carbohydrateutilizationbyjuvenilesilverperch, Bidyanus bidyanus (Mitchell).III.Theprotein-sparingeffectofwheatstarch-basedcarbohydrates[J].Aquact.Res, 2003, 34: 123-134.
Utilization of Different Dietary Carbohydrate Sources by Early Grouper Epinephelus lanceolatus Juveniles
LiWeifeng,WuXiaoyi,JiangShuntian,LuoYuan
(DepartmentofAquaculture,OceanCollege,HainanUniversity,Haikou570228,China)
Inthereport,theutilizationofdifferentdietarydigestiblecarbohydratesourcesbythegrouperEpinephelus lanceolatusjuvenilewasanalyzed.Theinclusionlevelofdietarycarbohydrateinallexperimentalgroupswas8%.Eachdietwasfedtotriplicategroupsoffish(initialbodyweight: 0.44g)stockedin6m3-volumepoolsatadensityof60fishpercementpool.Theresultsshowedthattherewerenosignificantdifferences(p>0.05)inweightgainrateandsurvivalrateamongallexperimentalgroups;thespecificgrowthrate(SGR)offishfedthecellulosecontroldietwassignificantly(p<0.05)lowerthanthatofothergroups;therewerenosignificantdifferences(p>0.05)inproteinefficiencyratio(PER)andproteinproductivevalue(PPV)amongallexperimentalgroups;thetotalfishproteinoftheexperimentalgroupswerehigherthanthatofcontrolgroup(p<0.05);themuscleandfatamountoftheexperimentalgroupswerelowerthanthatofcontrolgroup(p<0.05);theconcentrationsoftheplasmacerealthirdtransaminase(ALT),albumin(ALB),glucose,high-densitylipoproteincholesterol(HDL-C),andlow-densitylipoproteincholesterol(LDL-C)weresignificantly(p<0.05)affectedbydifferentdietarycarbohydratesources;therewerenosignificantdifferences(p>0.05)infishintestinalamylaseandmaltaseenzymeactivityamongallexperimentalgroups.
Epinephelus lanceolatusjuvenile;carbohydrateutilization;growth
2015-4-22
国家自然科学基金项目“鞍带石斑鱼仔稚鱼对糖的利用能力及代谢调控机制研究”(项目编号:31260641)
李伟峰(1988-),男,安徽临泉县人,海南大学海洋学院2012级硕士研究生, E-mail:545457677@qq.com
吴小易(1980-),男,江西进贤人,副教授,研究方向:水生经济动物营养,E-mail:wjurk@163.com
1004-1729(2015)03-0246-06
S
ADOl:10.15886/j.cnki.hdxbzkb.2015.0045

