Caspase-7(rs7907519, rs3127075)和IL1A(rs1800587)基因多态性与类风湿关节炎遗传易感性研究
裴建中, 张 辉, 汪明杰, 张正宇, 刘瑞平, 周鑫叠
(南京医科大学附属常州市第二人民医院, 1. 针灸科; 2. 骨科; 3. 风湿科, 江苏 常州, 213000)
Caspase-7(rs7907519, rs3127075)和IL1A(rs1800587)基因多态性与类风湿关节炎遗传易感性研究
裴建中1, 张辉2, 汪明杰2, 张正宇3, 刘瑞平2, 周鑫叠2
(南京医科大学附属常州市第二人民医院, 1. 针灸科; 2. 骨科; 3. 风湿科, 江苏 常州, 213000)
摘要:目的研究中国汉族人群中Caspase-7 rs7907519 C/A, rs3127075 G/C以及IL1A rs1800587 G/A 3个基因位点多态性与类风湿关节炎(RA)发病危险因素的关系。方法采用以医院为基础的病例-对照研究,自定义48-SNP体系, SNPscanTM高通量SNP分型技术,分析615例RA患者与839例对照组Caspase-7 rs7907519 C/A, rs3127075 G/C以及IL1A rs1800587 G/A基因多态性,计算各基因型RA的发生风险及其95%可信区间。结果依据Logistic回归分析以及亚组分析的结果,发现RA患者和对照组中Caspase-7 rs7907519, rs312707和IL1A rs1800587 3个基因多态性位点频率间均无显著性差异。结论Caspase-7 rs7907519 C/A, rs3127075 G/C和IL1A rs1800587 G/A基因多态性可能不是RA发病的危险因素。
关键词:Caspase-7; IL1A; 类风湿关节炎; 单核苷酸多态性
Correlation between Caspase-7 (rs7907519,
类风湿关节炎(RA)是一种主要影响关节滑膜的慢性炎症性疾病,全世界发病率约为1%[1]。其具体发病机制还没有完全明确,可能与环境、感染、激素表达、炎症因子以及基因遗传等多方面因素有关。目前研究[2]表明,非凋亡化程序性细胞死亡,在许多人类自身免疫性疾病发病过程中占据了重要的位置,包括RA。凋亡化程序性细胞死亡过程在胞内由半胱氨酸-天冬氨酸酸性酶调节,其又称之为半胱氨酸天冬氨酸蛋白酶(Caspase)。Caspase-7基因位于染色体区域10q25.1~10q25.2, 其与RA的联动区域尚未有文献报道[3]。白细胞介素-1(IL-1)是一种重要的炎症因子,其广泛参与了细胞内、细胞间及信号通路的作用过程中。Caspase裂解其氨基末端区域后,可促使激活的细胞释放IL-1[4]。IL-1活性作用通常由2个分子来表现,即IL-1α和IL-1β。其中,IL-1A编码IL-1α。目前的研究[5-6]表明, IL-1是多种自身免疫性疾病发病的关键因素,相应临床证据也表明,对体内IL-1浓度及相关受体进行调节,可有效抑制相应自身免疫性疾病进展。本研究探究Caspase-7中rs7907519 C/A, rs3127075 G/C两个位点和IL1A rs1800587 G/A位点多态性与RA遗传易感性间相互关系。
1材料与方法
1.1 材料
本研究总共纳入病例1 454例,其中病例组615例,对照组839例。病例组患者为2010年9月—2013年10月在常州市第一人民医院、常州市第二人民医院及常州市中医院收集完成,RA患者诊断纳入标准参照1987年美国风湿病学会(ACR)修订的RA分类标准[7]。对照组为同期于上述医院住院的非遗传性疾病患者,主要为外伤性疾病患者。所有纳入病例及对照组人群均为定居于常州及周边的汉族人群,且2组间性别构成比、年龄均无显著差异。
1.2 实验方法
在充分告知参与人群研究情况,获得书面的知情同意书后,对纳入病例组及对照组均进行特定问卷调查来获取相关纳入人群基本资料。在空腹情况下,采集纳入人群2 mL全血(EDTA抗凝), 1 h内采用4 000 r/min转速离心10 min, 分离白细胞层,其后采用Qiagen DNA提取试剂盒提取DNA,进行分装后于-80 ℃冰箱低温冻存。SNP分型方法采用48-SNP体系的SNPscanTM高通量SNP分型技术完成(Genesky生物技术公司,中国上海)。
1.3 统计学方法
应用SPSS软件进行统计学分析,对纳入病例组及对照组人群基本特征采用卡方检验或者t检验,同时采用SAS 9.1软件进行单因素Logistic回归分析,并计算优势比(OR)及其95%可信区间(CI),对Caspase-7 rs7907519 C/A, rs3127075 G/C以及IL1A rs1800587 G/A两个基因的三个位点多态性变异型与野生纯合型比较,探究其与RA发病的相对风险度,从而探究基因多态性与RA发病风险间相关联系。本研究功效分析采用Power and Sample Size Program软件进行。
2结果
2.1 人群基本特征及遗传平衡检验
本研究总共纳入RA患者615例(其中女472例,男143例),平均年龄54.51岁,对照组人群839例(女633例,男206例),平均年龄55.44岁。2组在年龄和性别无显著差异,见表1。在所有纳入人群中,成功进行了Caspase-7 rs7907519 C/A基因分型检测的在病例组有587例,对照组有824例; 598例病例组患者及829例对照成功进行了Caspase-7 rs3127075 G/C基因分型检测;而成功进行了IL1A rs1800587 G/A基因分型检测的在病例组有597例患者,对照组有826例患者。通过Hardy-Weinberg遗传平衡检验,作者发现对照人群的Caspase-7 rs7907519, rs3127075以及IL1A rs1800587 3个位点基因型P值符合遗传平衡定律,说明该人群Caspase-7 rs7907519, rs3127075以及IL1A rs1800587 3个位点基因型频率处于平衡状态,具有群体代表性。
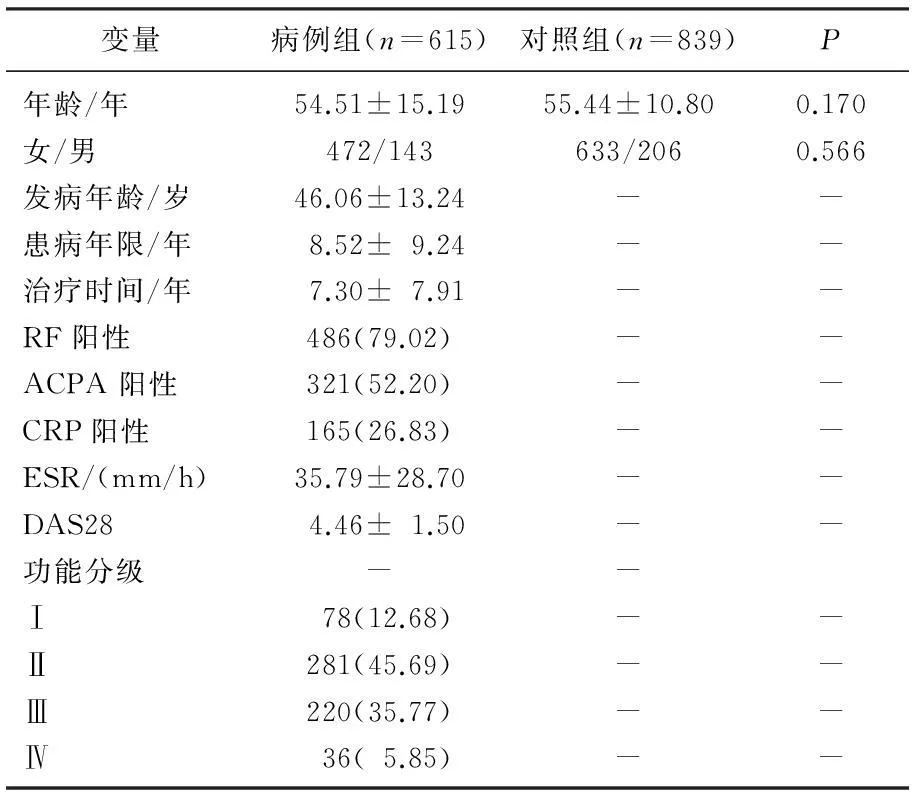
表1 纳入人群基本特征及类风湿关节炎相关临床指标
2.2 RA遗传易感性与Caspase-7 rs7907519C/A, rs3127075 G/C和IL1A rs1800587G/A基因型分布的关系
在单位点分析中,作者探究了RA患者和对照组中Caspase-7 rs7907519, rs312707和IL1A rs18005873个多态性位点频率间差异性。在Caspase-7 rs7907519位点中, Logistic回归发现与携带Caspase-7 rs7907519 CC基因型的个体相比较,携带CA等位基因型与RA的发病风险无明显相关(OR=1.10, 95%CI=0.88~1.38,P=0.388); 携带AA等位基因型与RA的发病风险无明显相关(OR=0.88, 95%CI=0.58~1.33,P=0.543)。Logistic回归发现隐性模型中相对于CC+CA基因型,携带AA基因型与RA的发病风险无显著差异(OR=0.84, 95%CI=0.57~1.26,P=0.402)。见表2。相类似的结果在Caspase-7 rs312707和IL1A rs1800587位点中也被观察。与Caspase-7 rs312707 GG基因型相比较, GC(OR=1.02, 95%CI=0.81~1.28,P=0.872)与CC(OR=0.86, 95%CI=0.49~1.50,P=0.586)等位基因型在病例组与对照组间均无显著差异;与IL1A rs1800587 GG基因型相比, GA(OR=0.78, 95%CI=0.58~1.05,P=0.095)与AA(OR=1.92, 95%CI=0.73~5.07,P=0.190)等位基因型在病例组与对照组间也均无显著差异。总结来看,作者发现RA患者和对照组中Caspase-7 rs7907519, rs312707和IL1A rs1800587 3个多态性位点频率间均无显著性差异。
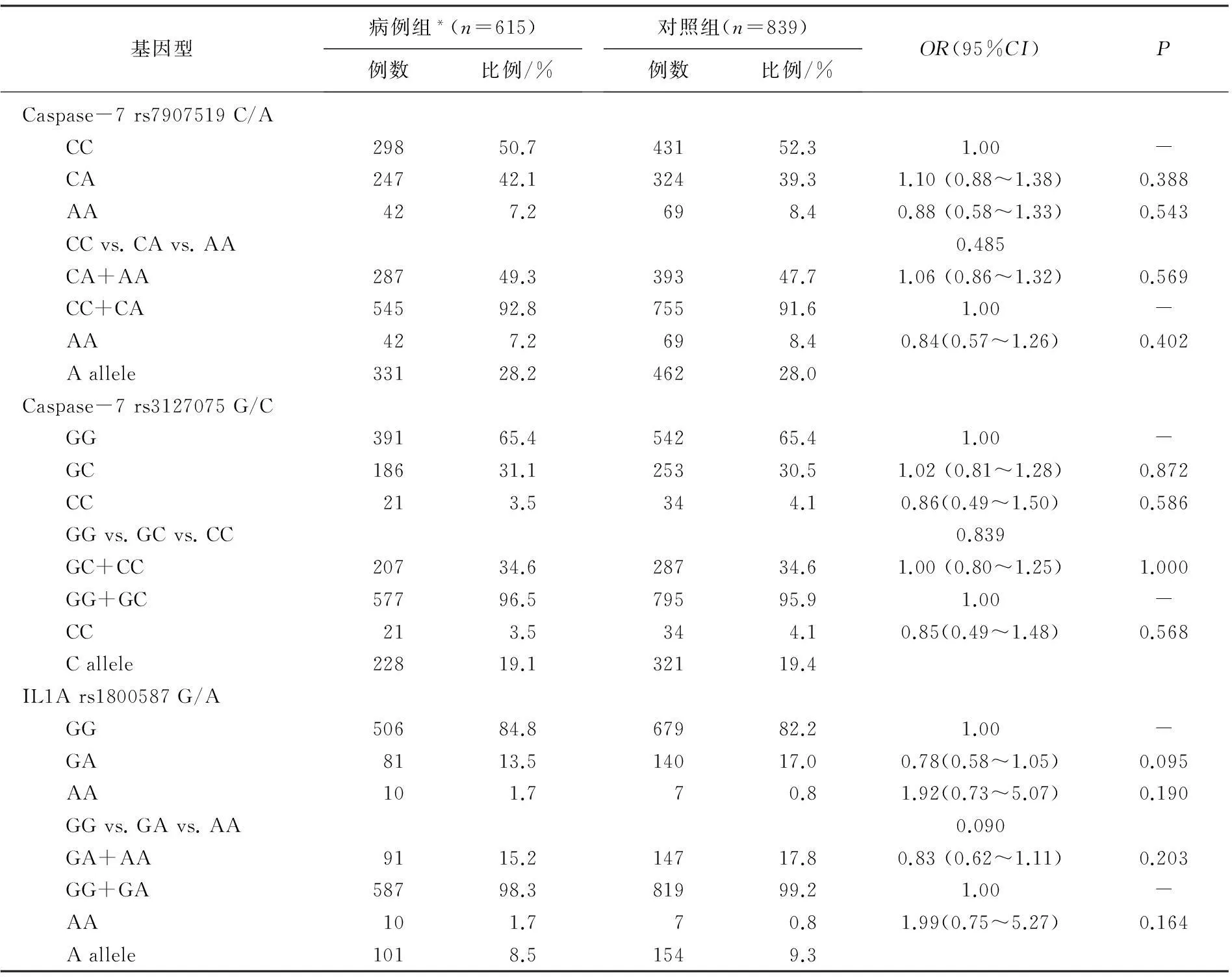
表2 Caspase-7 rs7907519 C/A, rs3127075 G/C, IL1A rs1800587 G/A多态性与类风湿关节炎发病风险间关系的Logistic回归分析
*587例病例组患者及824例对照成功进行了Caspase-7 rs7907519 C/A基因分型检测; 598例病例组患者及829例对照成功进行了Caspase-7 rs3127075 G/C基因分型检测; 597例病例组患者及826例对照成功进行了IL1A rs1800587 G/A基因分型检测。
3讨论
在本研究中,作者主要探究了Caspase-7 rs7907519, rs3127075和IL1A rs1800587基因多态性与RA发病风险之间的联系。在这项纳入635例患者及839例对照组的实验中,病例组与对照组等位基因频率符合Hardy-Weinberg遗传平衡,作者发现Caspase-7 rs7907519, rs3127075和IL1A rs1800587基因多态性与RA的遗传致病风险间可能无显著差异性,其相对应研究功效分别为0.292、0.211和0.988(隐性模型, α=0.05)。
RA是一种慢性全身性自身免疫性疾病,具有较高的致残率,目前对于RA的病因及发病机制至今尚未完全清楚。Caspases是一类半胱氨酸蛋白酶,在胞内以无活性酶原形式存在。成熟Caspases酶蛋白分别由两个p20及两个p10亚基进行组装,进而活化,活化的caspases可通过级联放大效应诱导凋亡[8]。Caspase-7基因位于染色体区域10q25.1~10q25.2。其是以非活性酶原形式存在的,其在天冬氨酸残基水解加工下可形成2个单元,一个大型,一个小型,两个形成二聚体,进而产生酶的活性。基于caspase-7在凋亡中的相关作用,其很可能是肿瘤或者自身免疫性疾病易感性的影响因素之一。Teixeira等[9]于2008年报道在白种人群中, Caspase-7 rs2227309位点基因多态性与RA无显著相关性,但其同时报道Caspase-7 α和β亚型可能参与了RA的致病过程。Laura等[10]报道了Caspase-12 rs497116位点基因多态性对RA可能的保护作用。García-Lozano等[11]报道Caspase-7 rs2227309多态性与RA遗传致病性相关,而rs11593766与rs2227310多态性与RA无显著关联性。江雨霏等[12]报道了Caspase-7β亚型基因rs2227309可能与中国台州地区人群RA易感性有关,并分析产生这种联系原因可能是由于Caspase-7非功能亚型转录水平相对升高致使滑膜细胞凋亡活性减弱所致。IL-1作为体内的炎症介质之一,其生物学作用非常广泛,参与介导了体内多种炎症反应。越来越多的研究[13-14]已经表明IL-1在RA致病过程中具有非常重要的作用,其广泛参与了骨与软骨破坏,以及滑膜炎等病理过程。许多IL-1阻滞剂,也在RA的治疗作用中,显示了其独特的疗效[15-17]。近年来,随着多态性研究的深入,已有相关文献报道了IL-1多态性与RA遗传致病性间相互关系,包括IL-1B+3953 C/T多态性[18], IL-1 F7基因rs3811047位点多态性[19], IL-1 F10以及IL-1RN基因多态性等[20]。本次研究中,作者选择了IL-1A基因上rs1800587位点,以探究其与RA遗传致病性的相关关系。rs1800587位点位于IL-1A 2号染色体,目前的报道表明其与椎间盘突出疼痛[21-22], 骨关节炎[23], 强直性脊柱炎[24], 认知功能障碍[25], HIV传播[26], 牙周炎[27]等疾病遗传致病性相关。强直性脊柱炎与RA同属于自身免疫性疾病,同时也基于骨关节炎与RA致病性间的相互交叉性,作者猜测IL-1 rs1800587位点多态性与RA遗传致病性间是否也存在相互联系。在作者的研究中,作者未发现Caspase-7(rs7907519, rs3127075)和IL1A(rs1800587)基因多态性与RA遗传易感性间存在显著性联系。分析产生这种情况的原因,可能是在汉族人群中, Caspase-7 rs7907519和rs3127075位点,以及IL1A rs1800587位点的突变,并未导致相关目标分子结构及量产生实质性变化,由于上述基因位点多态性与RA间相关性在国内外尚未有相关文献报道,因此作者无法就其可能结果进行进一步比较分析。
本研究结果提示Caspase-7 rs7907519, rs3127075和IL1A rs1800587基因多态性与RA遗传致病风险无显著关联性,但由于本研究样本量、人种、地域性的限制,无法完全排除选择性偏倚发生可能。Caspase-7 rs7907519, rs3127075和IL1A rs1800587基因多态性与RA遗传致病性的关系还需要进一步的大样本和多地区的进行调查。
参考文献
[1]Korczowska I. Rheumatoid arthritis susceptibility genes: An overview[J]. World journal of orthopedics, 2014, 5(4): 544.
[2]Mahoney J A, Rosen A. Apoptosis and autoimmunity[J]. Current opinion in immunology, 2005, 17(6): 583.
[3]Tiso N, Pallavicini A, Muraro T, et al. Chromosomal localization of the human genes, cpp32, mch2, mch3, and ich-1, involved in cellular apoptosis[J]. Biochemical and biophysical research communications, 1996, 225(3): 983.
[4]Jacques C, Gosset M, Berenbaum F, et al. The role of il-1 and il-1ra in joint inflammation and cartilage degradation [J]. Vitamins and hormones, 2006, 74(371): 403.
[5]Fitzgerald A A, Leclercq S A, Yan A, et al. Rapid responses to anakinra in patients with refractory adult-onset still′s disease[J]. Arthritis and rheumatism, 2005, 52(6): 1794.
[6]Dinarello C A. Blocking il-1 in systemic inflammation [J]. The Journal of experimental medicine, 2005, 201(9): 1355.
[7]Arnett F C, Edworthy S M, Bloch D A, et al. The american rheumatism association 1987 revised criteria for the classification of rheumatoid arthritis[J]. Arthritis and rheumatism, 1988, 31(3): 315.
[8]Fuentes-Prior P, Salvesen G S. The protein structures that shape caspase activity, specificity, activation and inhibition[J]. The Biochemical journal, 2004, 384(Pt 2): 201.
[9]Teixeira V H, Jacq L, Lasbleiz S, et al. Genetic and expression analysis of casp7 gene in a european caucasian population with rheumatoid arthritis[J]. The Journal of rheumatology, 2008, 35(10): 1912.
[10]Marshall L, Obaidullah M, Fuchs T, et al. Caspase-12 and rheumatoid arthritis in african-americans[J]. Immunogenetics, 2014, 66(4): 281.
[11]Garcia-Lozano JR, Torres B, Fernandez O, et al. Caspase 7 influences susceptibility to rheumatoid arthritis[J]. Rheumatology, 2007, 46(8): 1243.
[12]朱敏, 江沈金陈. 类风湿性关节炎患者caspase-7β亚型基因的多态性分析 [J]. 中国病理生理杂志, 2011, 12: 2368.
[13]Dayer J M. The saga of the discovery of il-1 and tnf and their specific inhibitors in the pathogenesis and treatment of rheumatoid arthritis[J]. Joint, bone, spine : revue du rhumatisme, 2002, 69(2): 123.
[14]Feldmann M, Brennan F M, Foxwell B M, et al. The role of tnf alpha and il-1 in rheumatoid arthritis[J]. Current directions in autoimmunity, 2001, 3: 188.
[15]Fleischmann R, Stern R, Iqbal I. Anakinra: An inhibitor of il-1 for the treatment of rheumatoid arthritis[J]. Expert opinion on biological therapy, 2004, 4(8): 1333.
[16]Pasi S, Kant R, Gupta S, et al. Novel multimeric il-1 receptor antagonist for the treatment of rheumatoid arthritis[J]. Biomaterials, 2015, 42: 121.
[17]Niu X, He D, Deng S, et al. Regulatory immune responses induced by il-1 receptor antagonist in rheumatoid arthritis[J]. Molecular immunology, 2011, 49(1/2): 290.
[18]Shafia S, Dilafroze, Sofi F A, et al. Rheumatoid arthritis and genetic variations in cytokine genes: A population-based study in kashmir valley [J]. Immunological investigations, 2014, 43(4): 349.
[19]Shi L P, He Y, Liu Z D. Correlation between single nucleotide polymorphism of rs3811047 in il-1 f7 gene and rheumatoid arthritis susceptibility among han population in central plains of china[J]. Asian Pacific journal of tropical medicine, 2013, 6(1): 73.
[20]Jung M Y, Kang S W, Kim S K, et al. The interleukin-1 family gene polymorphisms in korean patients with rheumatoid arthritis[J]. Scandinavian journal of rheumatology, 2010, 39(3): 190.
[21]Schistad E I, Jacobsen L M, Roe C, et al. The interleukin-1alpha gene c>t polymorphism rs1800587 is associated with increased pain intensity and decreased pressure pain thresholds in patients with lumbar radicular pain [J]. The Clinical journal of pain, 2014, 30(10): 869.
[22]Moen A, Schistad E I, Rygh L J, et al. Role of il1a rs1800587, il1b rs1143627 and il1rn rs2234677 genotype regarding development of chronic lumbar radicular pain; a prospective one-year study[J]. PloS one, 2014, 9(9): e107301.
[23]Kaarvatn M H, Jotanovic Z, Mihelic R, et al. Associations of the interleukin-1 gene locus polymorphisms with risk to hip and knee osteoarthritis: Gender and subpopulation differences[J]. Scandinavian journal of immunology, 2013, 77(2): 151.
[24]Lea W I, Lee Y H. The associations between interleukin-1 polymorphisms and susceptibility to ankylosing spondylitis: A meta-analysis[J]. Joint, bone, spine: revue du rhumatisme, 2012, 79(4): 370.
[25]Wang E H, Hong C J, Yeh H L, et al. Interleukin-1 alpha (rs1800587) genetic polymorphism is associated with specific cognitive functions but not depression or loneliness in elderly males without dementia[J]. Neuroscience letters, 2013, 556: 69.
[26]Ahir S, Chaudhari D, Chavan V, et al. Polymorphisms in il-1 gene cluster and its association with the risk of perinatal hiv transmission, in an indian cohort[J]. Immunology letters, 2013, 153(1/2): 1.
[27]Zuccarello D, Bazzato M F, Ferlin A, et al. Role of familiarity versus interleukin-1 genes cluster polymorphisms in chronic periodontitis[J]. Gene, 2014, 535(2): 286.
rs3127075) and IL1A (rs1800587) polymorphisms
and risks of rheumatoid arthritis
PEI Jianzhong1, ZHANG Hui2, WANG Mingjie2, ZHANG Zhengyu3,
LIU Ruiping2, ZHOU Xindie2
(1.DepartmentofAcupuncture; 2.DepartmentofOrthopedics; 3.DepartmentofRheumatology,
ChangzhouSecondPeople′sHospital,Changzhou,Jiangsu, 213003)
ABSTRACT:ObjectiveTo investigate the correlation between Caspase-7 rs7907519 C/A, rs3127075 G/C and IL1A rs1800587 G/A polymorphisms and the susceptibility to rheumatoid arthritis (RA) in the Chinese Han population. MethodsGenotypes were determined by a custom-by-design 48-Plex SNPscanTMKit in 615 RA cases and 839 controls. ResultsAccording to logistic regression analysis, there was no significant correlation between Caspase-7 rs7907519 C/A, rs3127075 G/C and IL1A rs1800587 G/A polymorphisms and RA risks in RA patients and controls. ConclusionCaspase-7 rs7907519 C/A, rs3127075 G/C and IL1A rs1800587 G/A polymorphisms may not serve as risk factors for RA susceptibility.
KEYWORDS:Caspase-7; IL1A; rheumatoid arthritis; single nucleotide polymorphism
通信作者:刘瑞平, Email: lrp216@sina.com
基金项目:国家自然科学基金资助项目(81371927)
收稿日期:2015-03-10
中图分类号:R 593.22
文献标志码:A
文章编号:1672-2353(2015)19-001-04
DOI:10.7619/jcmp.201519001

