秋水仙素对‘根茎型清水紫花苜蓿’幼苗变异率和成活率的影响
李悦,师尚礼
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续
发展研究中心,甘肃 兰州 730070)
秋水仙素对‘根茎型清水紫花苜蓿’幼苗变异率和成活率的影响
李悦,师尚礼
(甘肃农业大学草业学院,草业生态系统教育部重点实验室,中-美草地畜牧业可持续
发展研究中心,甘肃 兰州730070)
摘要:通过秋水仙素诱变对‘清水紫花苜蓿’萌动种子诱变后幼苗变异率的测定,并观察其幼苗成活率及部分生长指标的变化情况,结果表明:采用秋水仙素不同质量浓度(0.05%、0.10%、0.20%)溶液对清水紫花苜蓿萌动种子分别处理4、8、12 h,0.10%的秋水仙素溶液处理幼苗变异率较高,8 h处理时间产生较大变异.总体上幼苗变异率随着秋水仙素质量浓度的提高和时间的延长呈现增加趋势,质量浓度与时间互作处理0.1%+8 h苜蓿幼苗变异率最大为35.73%;其次0.2%+4 h处理,为30.6%;再次0.1%+12 h处理,为28.80%.而苜蓿幼苗成活率与处理质量浓度及处理时间呈负相关关系.秋水仙素处理后苜蓿幼苗的生长速度、叶宽、叶厚、茎粗与真叶数出现不同程度增加;苗长、根长、叶长、叶型指数、节间距与节间数则出现不同程度减小;处理苗第30 d的株高在0.05%、0.1%质量浓度处理4 h时较对照苗增加.苜蓿幼苗变异的秋水仙素最适剂量为0.1%+8 h.
关键词:秋水仙素;变异率;成活率
第一作者:李悦(1989-),女,硕士研究生,研究方向为草种质资源与育种.E-mial:807653824@qq.com
‘紫花苜蓿’(MedicagosativaL)是具有世界栽培意义,产量高,营养丰富[2],干旱半干旱地区固氮改土不可缺少[1]的多年生优质豆科牧草[2-3],是蛋白质含量很高的牧草饲料,在全球范围内种植利用非常广泛[4].不仅是畜牧业生产的主要饲草资源,而且也是生态环境治理的先锋草种[5],在西部生态环境建设、农业结构调整中日趋重要[6].‘根茎型紫花苜蓿’是‘紫花苜蓿’的一个变型,其根颈部较长,形成根茎混杂区,根颈距地表相对较深,并从其根颈区发育出类似根状的茎,萌发新芽与幼根,出土形成新的植株,是培育放牧型苜蓿的良好材料,耐牧、耐寒、耐旱,具有较强固土护坡和水土保持能力[7],及分枝能力强及具有根茎等特点[8-9],有许多栽培苜蓿所不具有的植物学和生物学特征特[10-11],因此,具有潜在的饲用栽培和良好的种质资源价值[8-9].
秋水仙素是诱导生物体遗传物质变异中使用最广泛的化学诱变剂,其作用机制是能够与分裂期细胞中的微管蛋白异二聚体相结合,从而抑制微管的组装,阻碍纺锤丝的形成,进而影响细胞分裂中期后的进程[12],使细胞染色体数增加.其剂量(浓度和时间)根据不同物种、不同部位而有所不同.一般来说,浓度越高,时间越长,对植物组织的抑制程度越大,而抑制程度过大,植株生长缓慢甚至死亡;浓度过低,时间过短,诱变效果不明显.因此,秋水仙素剂量的选择也成为诱变成功与否的关键.秋水仙素的诱变特点为:在一定范围内,变异率随着秋水仙素质量分数的升高和处理持续时间的延长而升高,超过一定范围,变异率与时间及质量浓度呈负相关,这是由秋水仙素毒害作用加重导致的.高效的试验方法是用临界范围内的高质量浓度和短时间处理法,以使诱变实现高的多倍体诱变率及高的成活率的结果.研究表明与大多数物种变异类似,‘紫花苜蓿’发生变异产生多倍体外部形态各个器官出现“巨大性”,并且倍数性水平越高,其植株生长速度越快[13],此外,植株变异后在其他农艺性状,生理生化特性,产量品质等方面也产生不同变化.因此,在世界范围内苜蓿资源利用及育种过程中诱变其产生多倍体将成为今后苜蓿育种工作的一个重要而广泛的研究方向.
本试验在以往学者研究的基础上,以‘清水紫花苜蓿’品种为材料,采用秋水仙素不同质量浓度溶液对苜蓿萌动种子进行不同时间长短的处理,并测定其苗期的变异率、及在诱变基础上成活率及生长指标的变化,旨在研究并获得苜蓿幼苗最大变异率和较高成活率的秋水仙素最适剂量,进而克服‘清水紫花苜蓿’叶小、茎细等缺点,进而开发适宜的育种方法,为进一步选育多倍体新品种奠定基础.
1材料与方法
1.1试验材料
供试品种由甘肃农业大学草业学院育成的国审品种‘根茎型清水紫花苜蓿,(MedicagosativaL cv.Qingshui),种子由草业生态系统教育部重点实验室提供.
1.2种子发芽处理
挑选大小均匀饱满的种子用蒸馏水浸泡一段时间,选择吸胀的种子整齐地摆放在铺有滤纸的9 cm直径培养皿中(80粒/皿),加入适量蒸馏水至不能流动为宜,之后放到25 ℃左右恒温培养箱中进行培养并及时补给水分,待种子露白时,用质量浓度为0.05%、0.1%、0.2%的秋水仙素溶液分别浸泡4、8、12 h后放入25 ℃左右恒温培养箱中继续培养,以蒸馏水处理作为对照,待80%的种子发芽后进行盆栽.秋水仙素处理质量浓度与时间组合如表1.
1.3盆栽试验
将等量沙子分装到塑料杯中(高7.8 cm,口径8.0 cm),然后将处理后的幼苗根尖用滤纸吸干移至花盆,于室温下培养,并定期浇灌霍格兰氏(Hoagland’s)营养液,以防幼苗缺素而影响其正常生长,在此期间观察各处理幼苗的生长状况.
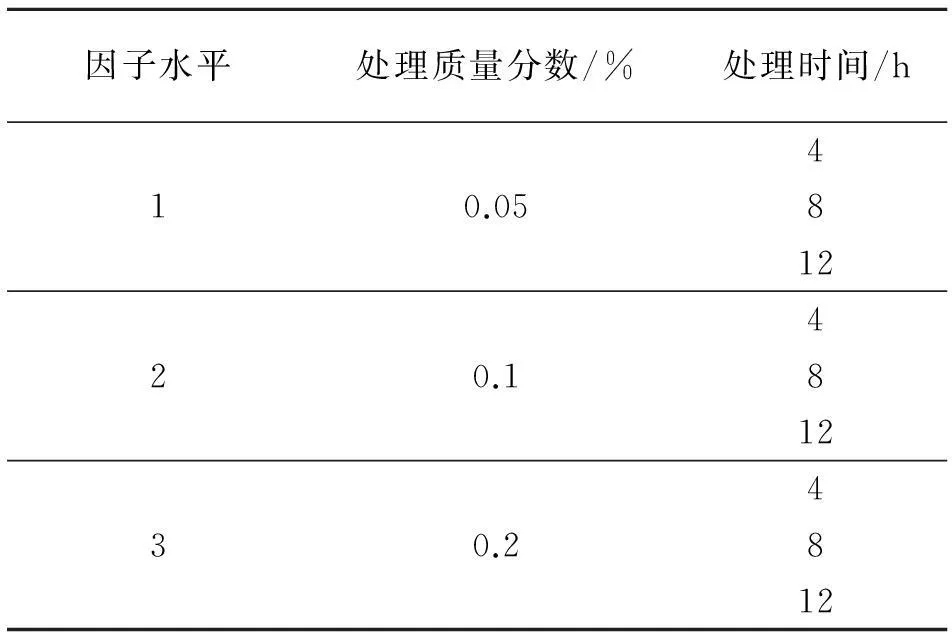
表1 秋水仙素处理质量浓度与时间组合
共9个处理,每个处理3次重复.
1.4测量指标和方法
1.4.1变异率和成活率的测定生长30 d后,根据外部形态变异特点(与对照苗相比较):植株矮小,茎干短缩且粗壮,叶片变厚,变皱,叶色加深等判定为变异苗,并计录变异苗数,同时记录成苗数,从而计算出变异率及成苗率,分别求其平均值.
1.4.2株高和生长速度的测定幼苗生长至10、15、20、25、30 d时用直尺(cm)每个重复随机量取记录8株幼苗株高,并且计算出各处理幼苗这30 d内的生长速度,取平均值.
1.4.3幼苗苗长和根长的测量生长至30 d时,每个重复随机选取15株幼苗,将栽培基质和苜蓿苗从杯中整体取出用清水冲洗,直至全株幼苗完全冲洗干净,用滤纸吸干表面水分,然后用直尺测量根长和苗长,取平均值.
1.4.4叶长、叶宽、叶厚的测量生长至60 d时,每个重复随机选取10株并共选取同部位叶片10片,用0.02 mm的游标卡尺测量叶长与叶宽,并计算出叶型指数(叶长/叶宽),选取10组叶片,每组均为10片(同部位),同样用游标卡尺测量叶厚,取各平均值.
1.4.5茎粗、节间数、节间距及真叶数的测量及观察每个重复随机选取10株苜蓿苗用游标卡尺测量距枝条基部2 cm处直径,并计算幼苗的真叶数及节间数,并从该10株中根据其叶片增大,增厚的特征挑选出3株用直尺测量各节间距,取平均值.
1.5数据分析
采用Excel 2003对数据进行初步整理,用SPSS 17.0进行数据分析及差异显著性检验.
2结果与分析
2.1秋水仙素不同处理质量浓度对苜蓿幼苗变异率的影响
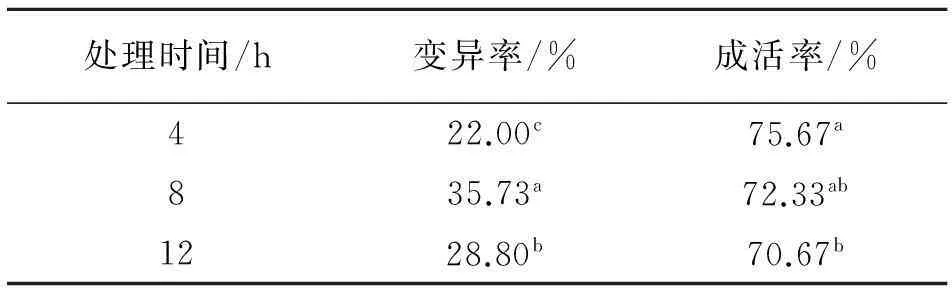
在不同处理质量浓度处理下幼苗变异率、成活率的差异性如表2所示.从表2可以看出,当处理时间同为8 h时,幼苗变异率随着处理质量浓度的增加发生相应变化,且各处理间差异极显著(P<0.01),在处理质量浓度从0.05%增加到0.10%时,幼苗变异率增加98.83%,但在质量浓度从0.10%增加到0.20%时,幼苗变异率降低20.35%,因此在0.10%处理质量浓度时幼苗变异率最大为35.73%.幼苗成活率在0.05%处理质量浓度下与其他处理间差异极显著(P≤0.01),而0.10%和0.20%处理质量浓度间差异不显著(P>0.05),因此可得出,0.1%质量浓度下幼苗成活率开始趋于稳定趋势,而此质量浓度下秋水仙素溶液对幼苗变异效果最好.
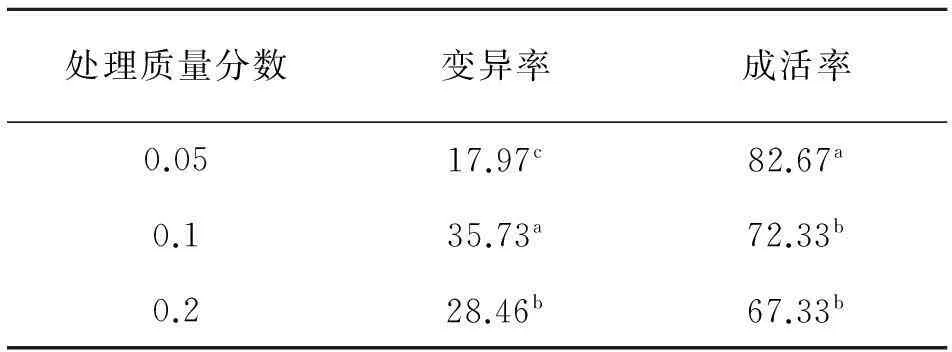
表2 秋水仙素不同处理下的 幼苗变异率和成活率
同列数据肩标不同小写字母表示差异显著(P<0.05).
2.2秋水仙素不同处理时间对苜蓿幼苗变异率的影响
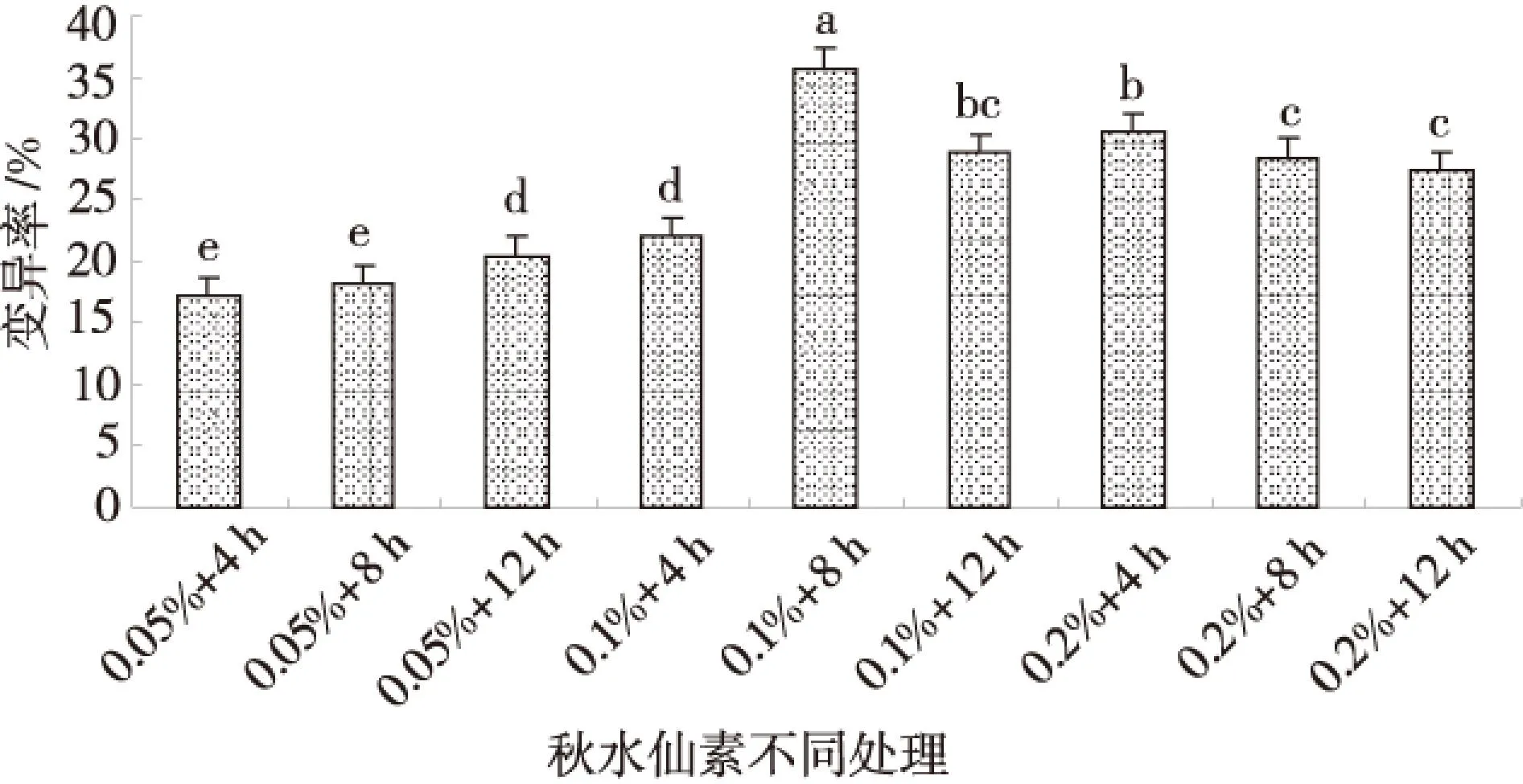
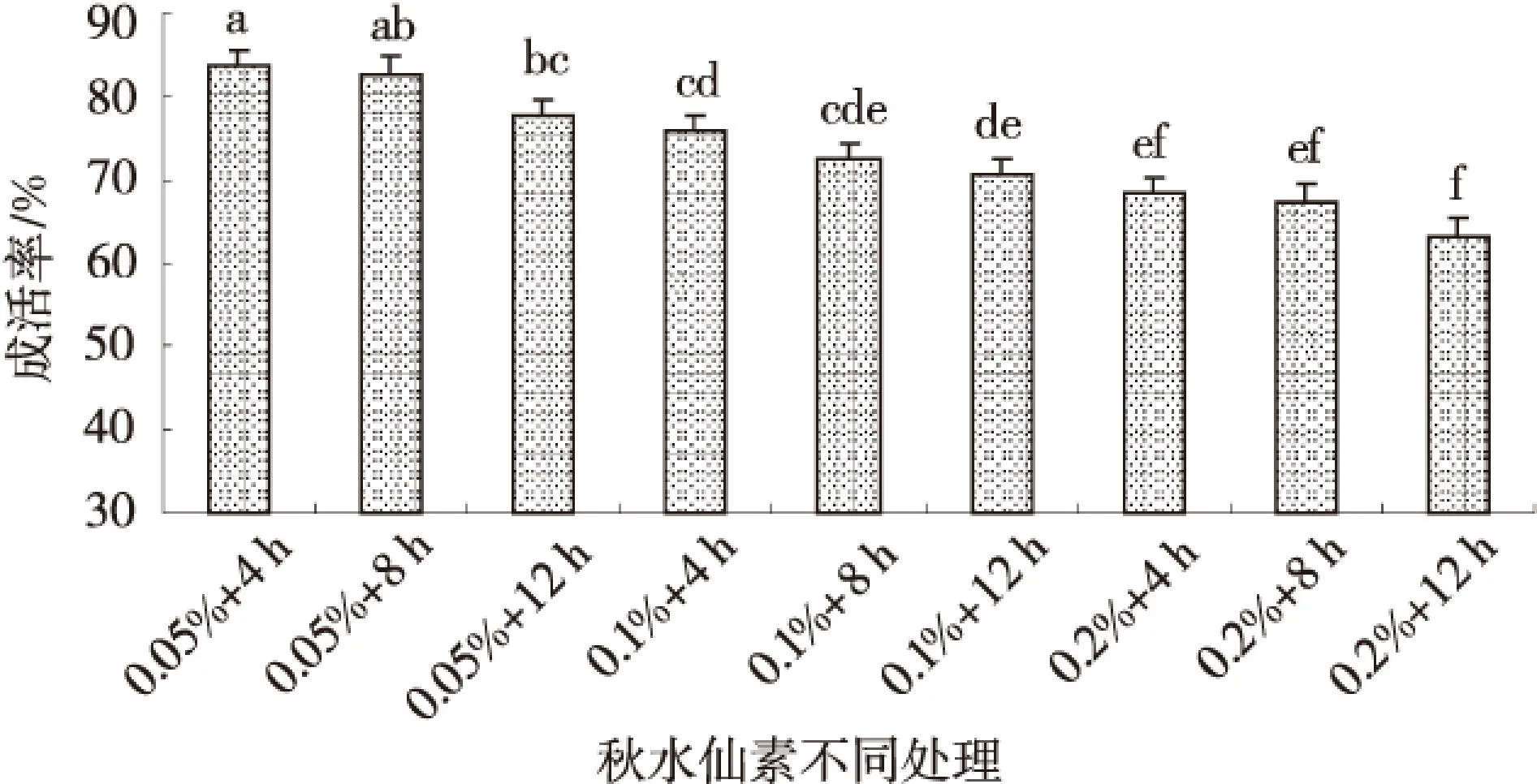
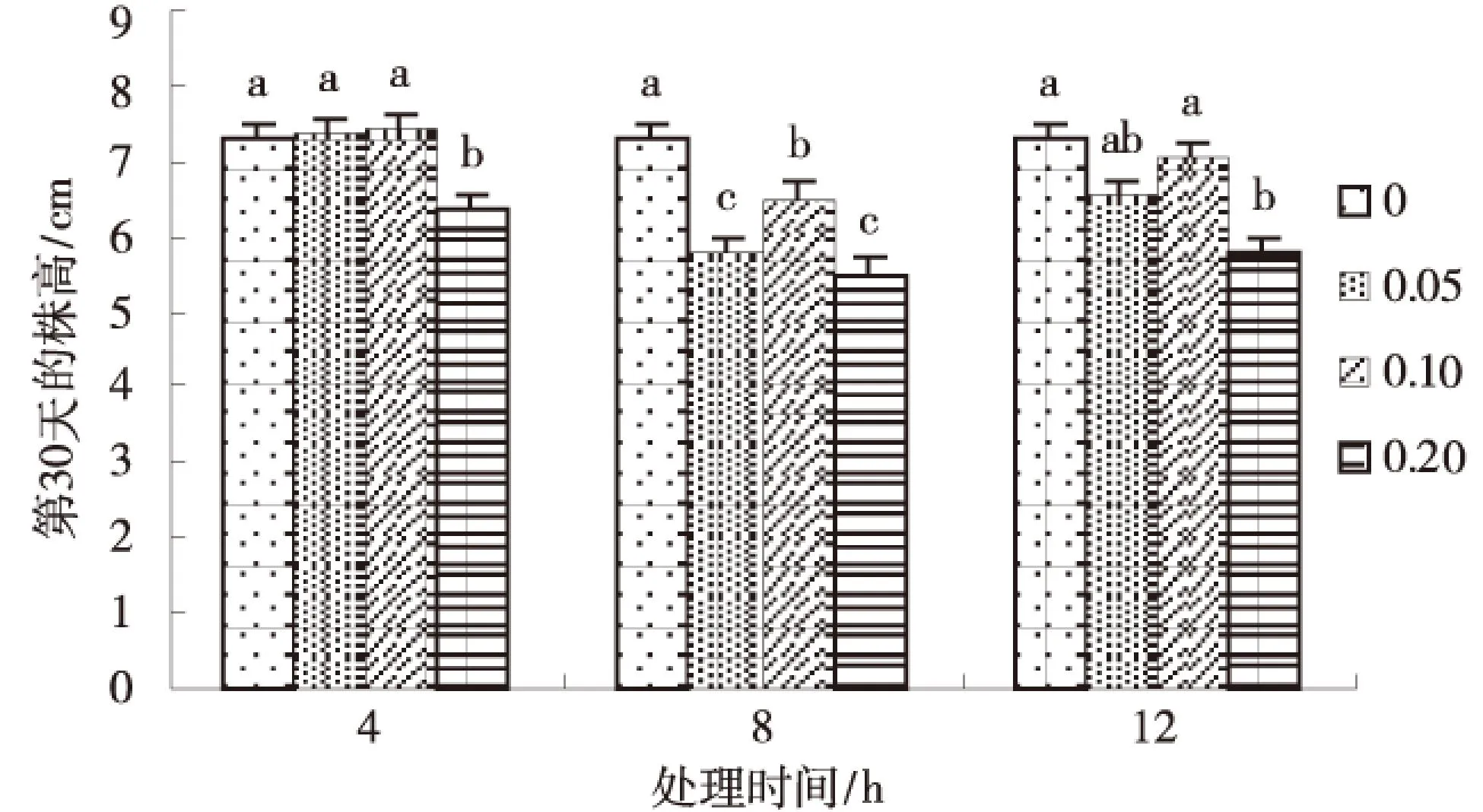
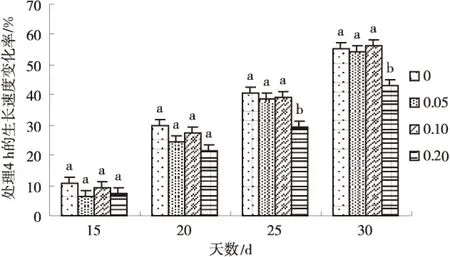
在不同处理时间下幼苗变异率、成活率的差异性如表3所示.从表3可以看出,当秋水仙素质量分数为0.10%时,3个处理时间对幼苗变异率产生一定影响,在处理4、8、12 h时变异率分别为22.00%、35.73%、28.80%,三者之间差异极显著(P<0.01),且在处理8 h时变异率最大.由此说明处理8 h时对幼苗变异产生较大的影响.而幼苗成活率在处理8 h时分别与处理4 h和12 h时差异不显著,而后两者之间差异显著(0.01 表3 秋水仙素不同处理时间下幼苗的变异率和成活率 同列数据肩标不同小写字母表示差异显著(P<0.05). 2.2秋水仙素处理质量浓度与时间的组合对苜蓿幼苗变异率与成活率的影响 从图1可以看出苜蓿幼苗的变异率随着秋水仙素处理时间与处理质量浓度的增加整体呈现增加趋势.并且在0.10%+8 h剂量下幼苗变异率达到最大值35.73%,且与其他处理间差异均极显著(P<0.01);其次0.20%+4h剂量下变异率为30.6%,除与0.10%+12 h、0.20%+8 h剂量差异不显著外,与其他处理间差异均极显著(P<0.01);再次0.10%+12 h剂量下变异率为28.8%,与0.20%+4 h、0.20%+8 h、0.20%+12 h三剂量差异不显著,而与其他处理间差异均极显著(P<0.01). 图1 秋水仙素不同质量浓度与时间组合处理对幼苗变异率的影响Fig.1 The effect of differents with colchicinesconcentration and time on the strain ofseedling in the mutation rate 从图2可以看出苜蓿幼苗的成活率随着秋水仙素处理时间和处理质量浓度的增加出现降低趋势.其中,0.10%+8 h时的成活率与0.05%+4 h、 0.05%+8 h、0.05%+12 h、0.20%+12 h剂量间的差异均较显著;与其他4个剂量差异不显著.因此幼苗的成活率也不同程度的响应了各秋水仙素剂量. 2.2秋水仙素质量浓度与时间互作效应下幼苗株高及生长速度的变化 如图3所示,幼苗第30 d的株高在0.05%、0.1%、0.2%质量浓度秋水仙素处理4 h时均与对照苗相比有一定变化,其中0.2%质量浓度下株高显著低于对照苗(0.01 图2 秋水仙素不同质量浓度与时间组合处理对幼苗成活率的影响Fig.2 The effect of differents with colchicinesconcentration and time on the strain ofseedling in the survival rate 图3 第30天幼苗株高的变化Fig.3 The change of seedling height in The 30th day 如图4所示,幼苗处理4 h时在其生长的30 d内,处理苗在第15天、20天、25天及30天的生长速度均整体呈增长趋势,并且在第30天时生长速度与前期相比有明显提高,并且0.1%质量浓度下较对照有所增加,第15天、20天、25天时各质量浓度处理下生长速度均较对照小,其中第15天与20天时各处理苗的生长速度均与对照苗之间无差异(P>0.05),而第25天与30天时0.2%质量浓度处理下的生长速度均与对照苗有差异,且前者差异不显著(P>0.05),后者差异极显著(0.01 图4 30 d内幼苗生长速度的变化Fig.4 The change of seedling growth speedwithin 30 days 2.3秋水仙素质量浓度与时间互作效应下幼苗苗长和根长的变化 如图5~6所示,苜蓿幼苗生长至30 d时,各处理幼苗苗长和根长均明显比对照苗短,而且整体都随着处理质量浓度及处理时间的增加呈缓慢缩短趋势.在处理4 h及8 h时各处理苗苗长与根长均与对照苗无差异(P>0.05),而其中幼苗苗长在0.1%处理12 h下与对照苗有差异但不显著,幼苗苗根长则在0.05%、0.1%分别处理12 h与对照间有极显著差异(0.01 图5 幼苗苗长的变化Fig.5 The change of seedlings length 图6 幼苗根长的变化Fig.6 The change of root length 2.4秋水仙素质量浓度与时间互作效应下幼苗叶长、叶宽、叶型指数及叶厚的变化 如表4所示,经过外观初选的变异幼苗与对照幼苗相比,随着秋水仙素溶液处理质量浓度及处理时间的增加,苜蓿苗生长至60 d 时叶形发生变化,其中叶长、叶厚呈缓慢增长趋势,而叶长及叶型指数则出现缓慢下降的趋势.叶长、叶宽、叶型指数在3个不同处理质量浓度分别处理4、8、12 h时各处理间、与对照之间均有极显著差异(P<0.01),并且在0.1%+8 h下叶长与叶型指数出现最小值10.458 mm与1.034,叶宽出现最大值10.118 mm.幼苗叶厚在处理4、8、12 h时3个不同质量浓度处理间、与对照苗间均有极显著差异,并且在0.1%+8 h下出现其最大值1.240 mm. 2.5秋水仙素质量浓度与时间互作效应下幼苗茎粗、节间数、节间距及真叶数的变化 如表5所示,不同剂量秋水仙素处理下,苜蓿幼苗的茎粗、节间距、节间数、真叶数均发生了相应的变化.其中,幼苗茎粗与真叶数随处理质量浓度与时间的增加整体缓慢增加,而节间数与节间距均整体出现降低趋势.如表可知,在0.1%+8 h出来剂量下茎粗、真叶数达最大值,分别为1.161 mm与56,且与对照苗之间的差异极显著(P<0.01).在0.2%+12 h处理下幼苗节间距出现其最小值2.506 cm,但与对照苗之间无较显著差异;在0.1%+4 h处理下幼苗节间数出现最小值8.4,与对照苗之间也有显著差异(0.01 3讨论 3.1秋水仙素剂量对幼苗变异的影响 近年来,随着生物技术的迅速发展,秋水仙素诱使植物发生变异产生多倍体的方法已广泛得到人们的关注,这种方法既经济又简单.目前已有许多利用秋水仙素成功诱变出多倍体植物的报道[14-20].人们对于诱变植物多倍体的秋水仙素最适剂量问题有着不同的看法[21-23],多数学者认为在某个剂量范围内变异率随秋水仙素质量浓度的升高而升高,但当超过某一临界剂量时,有效变异率反而下降.而对于植物经诱变后是否产生多倍体首先要从外部形态特征鉴定,经诱变的处理苗是否发生变异,并通过试验得出使其发生较明显变异的秋水仙素的适宜剂量.探究质量浓度与时间的组合是偏向高质量浓度短时间还是低质量浓度长时间[24],应根据材料的不同选择适宜剂量以获得更多理想的多倍体材料.秋水仙素通常对正在分裂的细胞产生影响,因而常选用萌动或萌发的种子、幼苗、正在生长的嫩梢及芽为处理材料.其中处理萌动种子、幼嫩组织、器官时质量浓度不宜过高[25].一般而言,质量浓度高时处理时间短一些,质量浓度低时处理时间可长些.刘丽萍等诱导菘蓝种子的研究结果认为较高质量浓度的秋水仙素在短时间内的诱变效果较好[26].武晓阳等通过对乌拉尔甘草的诱变研究也认为高质量浓度短时间的处理有较好的诱变效果,通过继代培养发现变异后的植株还会发生畸变,表明秋水仙素在植物组织细胞内是有残留的,会继续产生加倍作用[27].因此,随着秋水仙素加倍法操作技术的日益成熟,利用秋水仙素诱导植物变异并获得多倍体群体,可为多倍体育种提供基础材料.本试验结果表明秋水仙素质量浓度越高,处理时间越长,对材料产生的伤害也较大,变异率整体呈增加趋势,但质量浓度越低时间越短,变异率较低,诱变效果不明显.在不同处理质量浓度下幼苗变异率在0.10%秋水仙素溶液下较高,在不同处理质量浓度处理下幼苗变异率在处理8h时产生较大的影响.幼苗秋水仙素处理时间与质量浓度互作下,变异率尤以0.1%+8 h最高,为35.37%,是秋水仙素最适剂量,其次是0.2%+4 h,为30.60%,再次是0.1%+12 h,为28.80%.而苜蓿幼苗成活率与处理质量浓度及处理时间呈负相关关系.在以前的多倍体研究中,很多报道认为多倍体诱导具有秋水仙素质量浓度越高处理时间越短,质量浓度越低处理时间越长的显著特征.本试验中秋水仙素处理材料的诱导效果也表现出类似的特征.因此,掌握合适的处理质量浓度和时间对获得较好的诱变效果至关重要.综上所述,从外部形态特征鉴定经秋水仙素诱变的苜蓿苗是否发生变异对之后的细胞学鉴定阶段起到非常重要的前提作用. 表4 经初选的变异幼苗部分外部形态指标 同列数据肩标不同小写字母为差异显著(P<0.05) 表5 经初选的变异幼苗部分外部形态指标 同列数据肩标不同字母为差异显著(P<0.05). 3.2秋水仙素处理后幼苗外部形态特征的变化 秋水仙素诱导后幼苗外部形态特征的变化主要以形态学鉴定法来观察,这是一种粗放、直观的方法,在植株的整个生育期都可以用此方法进行判断.植物细胞和各器官体积在植物经秋水仙素诱变后一般都表现为增大的趋势,所以通过观察叶片的叶色、厚度、长宽、及根长、根粗等的变化进行初步判断.如果用肉眼能够观察到有明显的不同,说明植株很有可能是多倍体植株,然后对可疑植株进行染色体分析,以提供最直接的证据.石荫坪等通过观察苹果多倍体植株发现,多倍体植株的外观与对照比较,其茎短缩、粗壮,节间变短,叶片变宽变厚,而且叶色浓绿、叶脉突起等[28].张蜀敏等对新疆雪莲的茎段进行诱变,发现变异株外观与对照株相比变化显著,变异株的植株矮小,茎干短缩,叶片肥厚、叶形也有很大变化[29].还有研究表明,形态学的观察和细胞学鉴定的结果有较好的一致性.李立志等通过观察处理后的黄皮西瓜植株,发现器官的形态与对照比较发生了明显的变异,凭借经验对其进行外部形态判断出四倍体植株,并有较高的准确率[30].本研究结果表明,不同剂量的秋水仙素对苜蓿幼苗形态特征产生了一定的作用,其中苜蓿幼苗的生长速度、叶宽、叶厚、茎粗与真叶数均随处理质量浓度的增加,处理时间的延长整体呈增加趋势;而苗长、根长、叶长、叶型指数、节间距与节间数则整体呈降低趋势.利用形态学特征鉴定植物是否发生诱变的优点是简便、快速,不需要任何仪器测定,便可以在苗期做出鉴定,大大减轻了育种工作者的工作量,但是其缺点是存在着很大的经验因素,所以鉴定结果一般仅作为初步判断的结果,要得到比较准确的结论还需进一步更深刻地进行后续阶段的细胞学鉴定. 4结论 0.10%秋水仙素处理下幼苗变异率较高;8 h处理时间下幼苗产生较大变异.秋水仙素质量浓度与时间互作效应在0.1%+8 h处理下幼苗变异率最大,为35.73%;其次0.2%+4 h处理,为30.6%;再次0.1%+12 h处理,为28.80%.使苜蓿幼苗变异的秋水仙素最适剂量为0.1%+8 h. 随处理质量浓度与处理时间的增加,苜蓿幼苗的生长速度、叶宽、叶厚、茎粗与真叶数整体增加;苗长、根长、叶长、叶型指数、节间距与节间数整体减小;处理苗第30 d的株高在0.05%、0.1%质量浓度处理4 h时较对照苗增加. 参考文献 [1]崔乃然.新疆主要饲用植物志·2册[M].乌鲁木齐:新疆科技卫生出版社,1994:193-194 [2]Peterson P R,Sheaffer C C,Hall M H.Drought effects on perennial forage legume yield and quality[J].Agronomy Journal,1992,84:774-449 [3]John Frame.Advance in forage legume technology[J].草业学报,2001,10(4):1-17 [4]张勃,秦彧,王黎明,等.紫花苜蓿品种‘德宝’不同外植体愈伤组织诱导研究[J].甘肃农业大学学报,2012,47(4):100-104 [5]马晖玲,卢欣石,曹致中,等.紫花苜蓿不同栽培品种植株再生的研究[J].草业学报,2004,13(6):99-105 [6]孙建华,王彦荣,余玲.紫花苜蓿生长特性及产量形状相关性研究[J].草业学报,2004,13(4):80-86 [7]师尚礼,南丽丽,郭全恩.中国苜蓿育种取得的成就及展望[J].植物遗传与资源学报,2010,11(1):46-51 [8]王金,马永祥,李娟.紫花苜蓿营养成分及主要生物学特性[J].草业科学,2003,20(10):39-40 [9]王亚玲,师尚礼,焦亮.陇东野生紫花苜蓿的生态特征[J].草业科学,2008,25:55-58 [10]张雪婷,师尚礼.陇东野生紫花苜蓿的遗传特异性分析[J].草地学报,2009,17(3):333-348 [11]程鹏舞,黎明,魏武,等.一年生苜蓿种质资源形态变异及其形态特征[J].草原与草坪,2008(2):35-40 [12]彭尽晖,张良波,彭晓英,等.秋水仙素在植物倍性育种中的应用进展[J].湖南林业科技,2004(5):22-25 [13]Bingham E T .Isolation of hexaploid of tetraploid alfalfa [J].Crop Science,1971,11:433-435 [14]齐志广,秘彩莉,柏峰,等.不同预处理对有丝分裂的影响[J].河北师范大学学报:自然科学版,2003,27(1):88-91 [15]李光明,刘文海,何波.四种不同处理对蚕豆根尖细胞有丝分裂的影响[J].湘潭师范学院学报:自然科学版,2005,27(1):82-83 [16]黄永莲,胡木林.秋水仙素对洋葱根尖细胞的诱变效应[J].亚热带植物学报,2005,34(1):42-45 [17]孔舒颖,王照兰,杜建材,等.扁蓿豆新品系的多倍体诱导研究[J].中国草地学报,2010(4):31-34 [18]马育华.田间试验与统计分析[M].北京:中国农业出版社,1978 [19]秦素平,陈于和,林小虎.秋水仙素处理对黑麦根尖细胞有丝分裂的影响[J].麦类作物学报,2006,26(4):142-144 [20]连雪斌.兰州白百合多倍体诱导试验报告[J].甘肃农业科技,1995(6):14-15 [21]Chen C H,Coeden kallemeyn Y C.Invitroinduction of tetraploid plants fromcolehieines treated diploiddaylily callus[J].Euphytics,1979(28):705-709 [22]刘选明,周朴华.应用细胞工程技术选育四倍体龙牙百合的研究[J].生物工程学报,2002,12(增刊):197-203 [23]连雪斌.兰州百合多倍体诱导试验报告[J].甘肃农业科技,1995(6):14-15 [24]潘家驹.作物育种学总论[M].北京:中国农业出版社,1994:141-142 [25]胡冬南,徐荣华,李萍球.美丽胡枝子多倍体诱导的初步研究[J].江西农业大学学报,2007,29(1):81-84 [26]刘丽萍,王丽艳,殷奎德.菘蓝的多倍体诱导研究[J].黑龙江八一农垦大学学报,2008,20(3):23-26 [27]武晓阳,孟义江,袁静雅,等.乌拉尔甘草四倍体的离体诱导及倍性鉴定[J].河北农业大学学报,2008,31(4):18-21 [28]石荫坪,王强生,周广芳.苹果试管苗染色体工程育种[J].落叶果树,1993,(4):1-5 [29]张蜀敏,王晓军,徐琴,等.新疆雪莲多倍体的诱导初探[J].西北农业学报,2008,17(1):216-220 [30]李立志,何毅.黄皮西瓜化学诱导及四倍体利用研究初报[J].中国蔬菜,2002(3):8-11 (责任编辑李辛) Effects of colchicine treatment on mutation rate and survival rate of seedling ofMedicagosativa LI Yue,SHI Shang-li (College of Pratuculture,Gansu Agricultural University,Key Laboratory of Grassland Ecosystem of Ministry of Education,Sino-U.S.Centers for Grazingland Ecosystem Sustainability,Lanzhou 730070,China) Abstract:The study was conducted by determining the seeding survival rate and the growth index ofM.sativa(cv.Qingshui) treated with different colchicine concentration at 0.05%,0.10% and 0.20%,and different duration for 4 h,8 h and 12 h.The results showed that the maximum mutation rate of seedling was observed the treatment at 0.10% of colchicine for 8 h.The mutation rate of seedlings increased along with the increase of colchicine treatment concentration and duration.The maximum mutation rate of seedling was 35.73%,treated with 0.1% for 8 h;then the mutation rate 30.6%,treated with 0.2% for 4 h;and the mutation rate 28.80%,treated with 0.1% for 12 h.The survival rate of seedlings was negatively correlated with treatment concentration and duration.After treatment,the growth speed,blade width,thickness,stem diameter and leaf number of seedling increased at different levels;and seedling length,root length,leaf length,leaf index,the spacing and number of section reduced at different degree.The height of seedlings increased treated at 0.05% and 0.1% for 4 h after 30 days of treatment.The optimum dose for mutation of seedling was colchicine at 0.1% for 8 h. Key words:colchicine;mutation rate;survival rate 收稿日期:2014-12-18;修回日期:2015-03-03 基金项目:农业部牧草种质资源保护项目(NB2130135). 通信作者:师尚礼,男,博士,教授,研究方向为草种质资源与育种.E-mail:shisl@gsau.edu.cn 中图分类号:S 541+.1 文献标志码:A 文章编号:1003-4315(2015)06-0104-08