模拟镉胁迫生长土壤环境中龙葵的抗逆生理1)
丛建民 陈凤清
(白城师范学院,吉林白城,137000)
模拟镉胁迫生长土壤环境中龙葵的抗逆生理1)
丛建民 陈凤清
(白城师范学院,吉林白城,137000)
实验室内模拟土壤中镉(Cd)不同质量分数(0、5、10、25、50、100、200 mg·kg-1) 胁迫龙葵生长,测量超富集Cd龙葵生物量及叶片中的部分抗逆指标的变化情况。结果表明:在容器模拟180 d后,土壤中Cd质量分数低于50 mg·kg-1时,龙葵的生物量与对照无差异;土壤中Cd质量分数为200 mg·kg-1时,龙葵生物量与对照比,差异极显著。长期Cd胁迫,土壤中Cd质量分数为200 mg·kg-1时,丙二醛质量分数最高;脯氨酸质量分数,随着Cd质量分数增高,呈现先上升后下降趋势,峰值出现在Cd质量分数为50、100 mg·kg-1间。超氧化物歧化酶活性,随着土壤中Cd质量分数增加,呈现不规则状态。在土壤中Cd质量分数为50、100、200 mg·kg-1的胁迫下,过氧化物酶活性显著增高。过氧化氢酶的活力,随土壤中Cd质量分数增加,大致呈现先升高后下降趋势,峰值出现在土壤中Cd质量分数为25 mg·kg-1时。龙葵在土壤中Cd质量分数一定范围内,抗逆性强,潜在的增加植物组织吸附Cd的能力。
龙葵;土壤环境;镉胁迫;抗逆生理
A pot experiment in laboratory was conducted to investigate the effect of Cd on the biomass and tolerance (based on responses to oxidative stress) in hyperaccumulatorsSolanumnigrum. The Cd concentrations was 0-200 mg·kg-1over a period of 180 days. Oxidative stress inS.nigrumwas evaluated by lipid peroxidation and activities of malondialdehyde (MDA), proline, superoxide dismutase (SOD), peroxidase (POD), and catalase (CAT). The biomass of solanum nigrum was no difference under Cd 50 mg·kg-1compared with control grope, but there were significant differences at 200 mg·kg-1. It was the highest level of MDA under 200 mg·kg-1group. Proline content increased with the increasing of Cd firstly, then decreased, and the peaks appeared on 50 and 100 mg·kg-1. The activity of SOD increased irregularly with Cd. The activity of POD increased significantly on 50, 100, and 200 mg·kg-1. The activity of CAT increased firstly and then decreased substantially with the increasing of Cd, and the peak value appeared on 25 mg·kg-1concentration group. Thus, the manipulation of antioxidant enzyme activities increases tolerance, thereby potentially increasing the uptake capacity of an organism.
土壤中重金属污染,是影响生态环境建设的一个普遍问题。土壤中重金属的存在,会严重影响人类、动物、植物生产[1]。重金属污染的主要来源,是岩石侵蚀及人为使用农药、工业、采矿、冶炼和人类其他活动而造成的影响。工业化不健康地快速发展,加速了环境污染物污染农业生态的进程,继而严重影响人类健康[2]。通过去除有害污染物治理环境,是生态建设的重要挑战。20世纪80年代早期,植物修复作为一种重要的技术,处理受污染的土壤。植物提取技术,是一种最有前途和发展的植物修复技术,主要使用超富集植物蓄积过量重金属,收集植株,进而去除污染土壤中重金属。镉(Cd)是一种常见的广泛分布的重金属,由于其污染具有隐蔽性、不可恢复性、滞后性等特点,一直是环境科学研究中的一个热点。
龙葵(SolanumnigrumL.)是新近发现的一种典型的Cd超积累植物,对Cd具有很强富集能力[3]。在龙葵植株体内,根据迁移情况分布,Cd的富集能力从大到小,大致呈现叶片、茎、根、籽实的富集量逐渐减少的基本特征[4]。本文在不同Cd质量分数处理的土壤中,室内盆栽龙葵,检测长期Cd胁迫的龙葵叶片中丙二醛质量分数、脯氨酸质量分数以及几种抗氧化酶活性的变化,旨在探讨Cd胁迫的龙葵生理响应机制。
1 材料与方法
1.1 材料处理
实验方法参照Gao Y. et al[5]。
2011年9月,试验土取自白城师范学院校园(东经122°85′,北纬45°62′)没有污染的表层(土层深度≤20 cm)土壤。土壤风干后,过4 mm细筛后与基本肥料混合,与不同剂量CdCl2溶液混合。混合土壤放进高20 cm、直径20 cm塑料桶中。土壤pH=8.18;有机物16.17 mg·kg-1;总N、P,分别是1.14、1.36 mg·kg-1;Cd2+、Cu2+、Zn2+、Pb2+等离子,分别是0.18、22.90、38.10、15.10、7.40 mg·kg-1。栽培容器置放在白城师范学院实验室,室温22~25 ℃。Cd2+在干土壤中质量分数0、5、10、25、50、100、200 mg·kg-1,对应处理编号分别为CK、Cd-5、Cd-10、Cd-25、Cd-50、Cd-100、Cd-200,每个处理3次重复;Cd盐用CdCl2·5H2O。野生龙葵种子,采自白城师范学院实验田,经初敬华鉴定为SolanumnigrumL.。10月份,龙葵种子在营养钵育苗;当5叶龄时移栽到实验容器中,每容器定植3株;视盆栽土壤缺水情况,不定期浇自来水(水中未检出Cd);在室温下栽培180 d后,取其嫩叶片,检测长期Cd胁迫下龙葵反馈的生理指标。本研究中,界定土壤中Cd质量分数为5、10、25 mg·kg-1试验组为低剂量组,50 mg·kg-1试验组为中剂量组,100、200 mg·kg-1试验组为高剂量组。
1.2 生物量及生理指标测定
在室温下栽培180 d,取龙葵全株,用自来水冲洗掉根系土壤后,用蒸馏水冲洗洁净,置实验室阴干,测其生物量。生物量采用恒质量法测量。
取不同处理的龙葵鲜嫩叶片,清洁叶面后称取一定质量,冰浴研磨、离心、过滤、定容,即为提取液。丙二醛质量分数,用硫代巴比妥酸法测定;脯氨酸质量分数,用酸性茚三酮法测定;超氧化物歧化酶的活性,用NBT法测定;过氧化物酶的活性、过氧化氢酶的活性,均参照Shi Gangrong et al[6]方法测定。
1.3 数据处理
利用SPSS12.0软件进行单因素方差分析,在p<0.05和p<0.01水平上多重比较采用邓肯比较,应用Sig-maplot 9.0和Excel 2003软件进行数据处理。
2 结果与分析
2.1 Cd胁迫的龙葵生长状态
室温下,龙葵生长在不同时期不同Cd处理下,表现不同的生长态势(见图1)。图1是龙葵在从营养钵移栽到容器中1个月时的生长状态。图1从左到右,分别为对照及逐级提高Cd质量分数处理的龙葵生长态势。在移栽初期,龙葵生长差异不大,处理组中龙葵叶片出现紫褐色,颜色随Cd质量分数升高而加深。这是Cd胁迫下,影响龙葵光合作用某种色素合成代谢的结果,该发现有待于进一步研究。生长态势当达到结果期时,开始出现明显差距。龙葵植株对照组,与Cd质量分数低于50 mg·kg-1的试验组长势在后期相似;高剂量试验组,生长势明显落后于中、低剂量试验组,并Cd质量分数越高越明显。高剂量试验组,植株表现为纤细、羸弱;叶片色泽嫩黄;明显营养不良,是长期高质量分数Cd胁迫下,影响土壤或植物机体某代谢相关,进而影响植株生长。

图1 Cd胁迫下龙葵生长状态
2.2 Cd胁迫的龙葵生物量变化
在不同Cd质量分数胁迫下,龙葵生物量积累情况不同(见表1)。由表1可见:在低Cd质量分数胁迫下,即土壤中Cd质量分数为5、10、25 mg·kg-1时,龙葵植株的生物量变化无显著性差异(p<0.05);在中、高Cd质量分数胁迫下,即土壤中Cd质量分数为50、100、200 mg·kg-1时,生物量整体上明显下降,且存在明显的差异极显著(p<0.01),并随土壤中Cd质量分数增加差异越明显。说明龙葵植株耐Cd胁迫,在土壤中Cd质量分数有一定限度;在土壤中Cd质量分数为25 mg·kg-1及以下时候,表现为有较强的耐受性,与Gao Y. et al[5]、Wesam Al Khateeb et al[7]、魏树和等[3]研究基本一致。
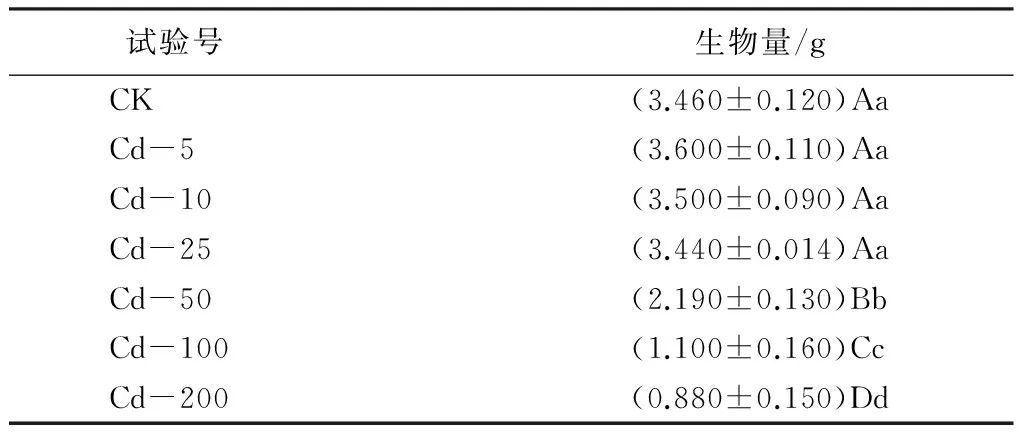
表1 不同Cd质量分数处理对龙葵生物量的影响
注:表中数据为“平均值±标准差”;同列不同小写字母表示差异显著(p<0.05),同列不同大写字母表示差异极显著(p<0.01)。
2.3 龙葵抗逆生理指标
长期Cd胁迫下,叶片中丙二醛质量分数变化情况(见表2):对照组、土壤中Cd质量分数为5~100 mg·kg-1的试验组,丙二醛质量分数较低;Cd质量分数为200 mg·kg-1的试验组,丙二醛质量分数最高。经多重比较,对照组与土壤中Cd质量分数为5、10、25、50、100 mg·kg-1试验组相比,丙二醛质量分数不存在差异显著性(p<0.05);对照组、土壤中Cd质量分数100 mg·kg-1及以下试验组中,丙二醛质量分数与200 mg·kg-1试验组相比,在p<0.01水平存在差异极显著。
龙葵植株叶片脯氨酸质量分数,随着土壤中Cd质量分数增高,呈现先上升后下降趋势,峰值出现在土壤中Cd质量分数为50、100 mg·kg-1之间。多重比较结果显示:对照组与土壤中Cd质量分数为5、10 mg·kg-1处理组,组间脯氨酸质量分数存在差异显著性(p<0.05);对照组与土壤中Cd质量分数为25、50、100、200 mg·kg-1试验组,组间脯氨酸质量分数存在差异极显著(p<0.01);处理组50、100 mg·kg-1,与处理组200 mg·kg-1,脯氨酸质量分数存在差异极显著(p<0.01)。

表2 不同Cd质量分数处理对龙葵生化指标变化的影响
注:表中数据为“平均值±标准差”;同列不同小写字母表示差异显著(p<0.05),同列不同大写字母表示差异极显著(p<0.01)。
超氧化物歧化酶活性,随着土壤中Cd质量分数增加呈现不规则状态。对照组超氧化物歧化酶活性最低,与各处理组间存在差异显著性(p<0.05)。各处理组间超氧化物歧化酶活性,存在不同的差异。土壤中Cd质量分数为25 mg·kg-1的处理组,超氧化物歧化酶活性最高,且与其他处理组存在差异极显著(p<0.01);土壤中Cd质量分数为5 mg·kg-1的处理组,超氧化物歧化酶活性次之,与其他处理组间存在差异极显著(p<0.01);其他处理组间,超氧化物歧化酶活性差异性不规律。
Cd胁迫使龙葵植株过氧化物酶活性增高。对照组与低剂量试验组相比,过氧化物酶活性无差异显著性(p<0.05),对照组与中、高剂量试验组相比,存在差异显著性(p<0.05)。在土壤中质量分数Cd为50、100、200 mg·kg-1的胁迫下,过氧化物酶的活性显著增高。
随着土壤中Cd质量分数的增加,过氧化氢酶的活力,大致呈现先升高后下降趋势,峰值出现在土壤中Cd质量分数为25 mg·kg-1的试验组。土壤中Cd质量分数为25 mg·kg-1的试验组,过氧化氢酶活力与其他组相比,存在差异极显著(p<0.01);对照组与土壤中Cd质量分数为200 mg·kg-1试验组相比,过氧化氢酶活力存在差异显著(p<0.05),对照组过氧化氢酶活力高于200 mg·kg-1的试验组。土壤中Cd质量分数为5、10 mg·kg-1的试验组过氧化氢酶活力,与土壤中Cd质量分数为50、100 mg·kg-1的试验组酶活力,存在差异显著性(p<0.05);土壤中Cd质量分数为50 mg·kg-1的试验组,与土壤中Cd质量分数为100 mg·kg-1的试验组间,过氧化氢酶活力存在差异显著性(p<0.05)。
3 结论与讨论
3.1 Cd胁迫与龙葵生长
Cd为高毒性元素,人们对其在植物生长上的毒副作用有广泛研究。高质量分数Cd抑制植物生长,低质量分数Cd对植物生长有积极作用,如:水稻[8]、大豆[9]、芒草[10]、高粱[11]等的生长实验。这种影响,取决于植物种类和实验条件,如:Cd的浓度和胁迫时间的选择。低质量分数Cd,刺激植物生长的现象,主要来自增强细胞的分裂,这已在动物和植物细胞培养中观察到。低质量分数Cd,刺激细胞增殖,调节Cd2+容量替代Zn2+,与复制和翻译的关键酶的调节等作用相关[12]。
本研究结果表明,Cd质量分数低于中剂量试验组,与对照比,龙葵的生物量差异不显著(p<0.05);Cd质量分数高于50 mg·kg-1,龙葵生物量随Cd质量分数上升而下降。Cd质量分数在200 mg·kg-1时,与对照比,龙葵生物量差异极显著(p<0.01)。Cd质量分数为200 mg·kg-1时,龙葵生物量较小,说明Cd质量分数为200 mg·kg-1时,龙葵有一定耐受力。不同的学者研究中,反馈龙葵耐Cd强度不同,缘由与其研究中实验介质相关;介质中pH、离子强度、离子种类、有机质含量及种类等多因素,与龙葵生长量相关[8]。本实验结果,基于北方冬天日光短、温度相对低的生长环境的龙葵叶片,检测各生理指标数值上与其他文献报道数据有出入,但趋势吻合。
3.2 龙葵抗逆生化指标
植物吸收Cd后,Cd代谢影响植物各种细胞结构,影响细胞膜的完整性[13-14]。Hendny G A F et al[15]提出,Cd胁迫对植物的作用是诱发高活性自由基,自由基是导致膜脂过氧化主要原因。丙二醛是细胞膜损伤的重要标志[16]。本研究中,Cd质量分数为100 mg·kg-1及以下时,丙二醛质量分数在处理组与对照组间无差异。当Cd质量分数为200 mg·kg-1时,与低、中剂量试验组间丙二醛质量分数存在差异极显著。说明长期过高质量分数Cd的胁迫,使龙葵体内氧自由基明显积累,诱发并加剧膜脂过氧化作用,从而使丙二醛大量积累。


超氧化物歧化酶活性,随着Cd质量分数增加而呈现不规则状态。对照组超氧化物歧化酶活性最低;Cd质量分数为25 mg·kg-1的试验组,超氧化物歧化酶活性最高,且与其他试验组存在差异显著性(p<0.01)。各组间,超氧化物歧化酶活性存在差异不同,这不能否定龙葵作为超富集Cd植物的可靠性,由于Cd处理导致龙葵植株体内的营养元素吸收紊乱,而恰好影响了超氧化物歧化酶的活力。
在土壤中Cd质量分数50、100、200 mg·kg-1胁迫下,龙葵植株过氧化物酶活性显著增高。说明龙葵体内的过氧化物酶活性,在高质量分数Cd的长期胁迫下,对Cd胁迫起到了较强的抗逆作用;也进一步验证了龙葵的超富集Cd的能力。
随着Cd质量分数的增加,过氧化氢酶的活力,大致呈现先升高后下降趋势,峰值出现在Cd质量分数为25 mg·kg-1的试验组。Cd质量分数为25 mg·kg-1的试验组,过氧化氢酶活力与其他试验组相比,存在差异极显著(p<0.01)。可见,叶片中过氧化氢酶,在Cd质量分数高时活性降低;说明在龙葵中,过氧化氢酶对高质量分数Cd具有较弱的抗逆性。机理是,龙葵植株本身的富集Cd能力存在一定的“局限性”,在高质量分数Cd的胁迫下,呈现过氧化氢酶活力下降的现象。
总体看,龙葵在一定的Cd质量分数范围内,具有较强的抗逆性,因而提升龙葵植株组织器官中吸附Cd的能力。但龙葵对Cd的富集能力存在一定的限度,一旦超过富集限度,龙葵的生理反应会受到一定的伤害。因此,超氧化物歧化酶、过氧化物酶、过氧化氢酶活性以及丙二醛、脯氨酸的质量分数,可作为龙葵抗逆性筛选的依据。龙葵富集重金属Cd的迁移系数及其他生理生化指标,有待于进一步研究。
[1] Lepp N W. Effect of heavy metal pollution on plants/pollution monitoring series[M]. London Englewood: Applied Science Publishers,1981.
[2] Sherameti I, Varma A. Definition of “Heavy Metals” and their role in biological systems. Soil Heavy Metals (Soil Biology)[M]. Berlin: Springer-Verlag Berlin and Heidelberg GmbH & Co K,2010.
[3] 魏树和,周启星,王新,等.一种新发现的镉超积累植物龙葵(SolanumnigrumL.)[J].科学通报,2004,49(24):2568-2573.
[4] Wei Shuhe, Wang Shanshan, Li Yunmeng, et al. Root system responses of hyperaccumulatorSolanumnigrumL. to Cd[J]. J Soils Sediments,2013,13(6):1069-1074.
[5] Gao Y, Zhou P, Mao L, et al. Phytoextraction of cadmium and physiological changes in Solanum nigrum as a novel cadmium hyperaccumulator[J]. Russian Journal of Plant Physiology,2010,57(4):501-508.[6] Shi Gangrong, Liu Caifeng, Cai Qingsheng, et al. Cadmium accumulation and tolerance of two safflower cultivars in relation to photosynthesis and antioxidantive enzymes[J]. Bull Environ Contam Toxicol,2010,85(3):256-263.
[7] Wesam Al Khateeb, Hajer Al-Qwasemeh. Cadmium, copper and zinc toxicity effects on growth, praline content and genetic stability ofSolanumnigrumL., a cropwild relative for tomato; comparative study[J]. Physiol and Mol Biol of Plants,2014,20(1):31-39.
[8] Aina R, Labra M, Fumagalli P, et al. Thiol-peptide level and proteomic changes in response to cadmium toxicity inOryzasativaL. roots[J]. Environmental and Experimental Botany,2007,59(3):381-392.
[9] Sobkowiak R, Deckert J. Cadmium-induced changes in growth and cell cycle gene expression in suspension-culture cells of soybean[J]. Plant Physiol Biochem,2003,41(8):767-772.
[10] Arduini I, Masoni A, Mariotti M, et al. Low cadmium application increase miscanthus growth and cadmium translocation[J]. Environmental and Experimental Botany,2004,52(2):89-100.
[11] Pinto A P, Vilar M T, Pinto F C, et al. Organic matter influence in cadmium uptake by Sorghum[J]. Journal of Plant Nutrition,2005,27(12):2175-2188.
[12] Ana P Pinto, Ana S Alves, Antonio J Candeias, et al. Cadmium accumulation and antioxidative defences inBrassicajunceaL. CzernNicotianatabacumL. andSolanumnigrumL.[J]. International Journal of Environmental Analytical Chemistry,2009,89(8/12):661-676.
[13] Van Assche F, Clijsters H. Effects of metals on enzyme activity in plants[J]. Plant Cell & Environment,1990,13(3):195-206.
[14] Smeets K, Cuypers A, Lambrechts A, et al. Induction of oxidative stress and antioxidative mechanisms inPhaseolusvulgarisafter Cd application[J]. Plant Physiol Biochem,2005,43(5):437-444.
[15] Hendny G A F, Beker A J M, Wart C F E. Cadmium tolerance and toxicity: Oxygen radical processes and molecular damage in cadmium-tolerant and cadmium-sensitive ofHolcuslanatusL[J]. Acta Bol Necrl,1992,41(3):271-281.
[16] Liu Jinguang, Zhang Hongmei, Zhang Yuxiu, et al. Silicon attenuates cadmium toxicity inSolanumnigrumL. by reducing cadmium uptake and oxidative stress[J]. Plant Physiology and Biochemistry,2013,68(1):1-7.
[17] Martínez Domínguez D, Córdoba García F, Canalejo Raya A, et al. Cadmium-induced oxidative stress and the response of the antioxidative defense system inSpartinadensiflora[J]. Physiol Plant,2010,139(3):289-302.
[18] Sharma S S, Schat H, Vooijs R. In vitro alleviation of heavy metalinduced enzyme inhibition by proline[J]. Phytochemistry,1998,49(6):1531-1535.
[19] Schutzendubel A, Polle A. Plant responses to abiotic stresses: heavy metalinduced oxidative stress and protection by mycorrhization[J]. Journal of Experimental Botany,2002,53:1351-1365.
[20] Olmos E, Martinez-Solano J R, Piqueras A, et al. Early steps in the oxidative burst induced by cadmium in cultured tobacco cells (BY-2 line)[J]. Journal of Experimental Botany,2003,54:291-301.
[21] Zhang F Q, Zhang H X, Wang G P, et al. Cadmium-induced accumulation of hydrogen peroxide in the leaf apoplast ofPhaseolusaureusandViciasativaand the roles of different antioxidant enzymes[J]. Journal of Hazardous Materials,2009,168(1):76-84.
[22] Wang M E, Zhou Q X. Joint stress of chlorimuron-ethyl and cadmium on wheatTriticumaestivumat biochemical levels[J]. Environmental Pollution,2006,144(2):572-580.
[23] Boominathan R, Doran P M. Cadmium tolerance and antioxidative defenses in hairy roots of the cadmium hyperaccumulatorThlaspicaerulescens[J]. Biotechnology and Bioengineering,2003,83(2):158-167.
Ecological Stress and Physiological Changes Cadmium Hyperaccumulator inSolanumnigrumL.
Cong Jianmin, Chen Fengqing(Baicheng Normal University, Baicheng 137000, P. R. China)/Journal of Northeast Forestry University,2015,43(4):42-45,56.
Solanumnigrum; Soil environment; Cadmium stress; Stress-tolerance physiology
1)吉林省自然科学基金项目(20140101222JC);吉林省教育厅“十二五”科学技术研究项目(吉教科合字[2012]第363号)。
丛建民,男,1974年1月生,白城师范学院生命科学学院,副教授。E-mail:congjianmin@126.com。
2014年8月2日。
Q945.78
责任编辑:张 玉。

