梅花鹿鹿茸组织Anxa-1基因cDNA克隆及表达1)
曲昊淼 丁玲 赵姬臣 夏彦玲
(东北林业大学,哈尔滨,150040)
梅花鹿鹿茸组织Anxa-1基因cDNA克隆及表达1)
曲昊淼 丁玲 赵姬臣 夏彦玲
(东北林业大学,哈尔滨,150040)
从梅花鹿(Cervusnippon)鹿茸间充质中成功克隆出包括膜联蛋白A1(Anxa-1)基因全部编码区的cDNA序列,并结合生物学信息方法及实时荧光定量技术对该基因的氨基酸序列及不同生长时期的表达情况进行了分析。结果表明:Anxa-1基因编码346个氨基酸。经生物学信息分析,该基因编码蛋白为稳定蛋白,不具备信号肽,相对分子质量为38 830.4,理论等电点为6.17,一级结构中亮氨酸占最大比例(10.4%)。同源序列比对及系统进化树分析表明,梅花鹿Anxa-1氨基酸序列与藏羚羊(Pantholopshodgsonii)、绵羊(Ovisaries)、山羊(Caprahircus)和水牛(Bubalusbubalis)相似性较高。实时荧光定量RT-PCR分析表明,Anxa-1基因在不同生长时期鹿茸顶端间充质表达存在差异,生长前期的表达量高于中期与后期。
膜联蛋白A1;鹿茸;cDNA;克隆;实时荧光定量RT-PCR
We cloned the cDNA sequence including all the coding region of theAnxa-1 gene from sika deer antler mesenchymal for the first time, and used bioinformatics method and real-time RT-PCR to analyze the amino acid sequence and the expression at different phases. TheAnxa-1 gene encoded a peptide of 346 amino acid residues of which the relative molecular weight was 38 830.4. By analyzing biological information, the gene had an isoelectric point of 6.17, and did not contain a signal peptide; Leucine accounted for the largest proportion in the primary structure was 10.4%. Homologous sequence alignment and phylogenetic tree analysis indicated that theAnxa-1 mature protein of sika deer was highly similarity withPantholopshodgsonii,Ovisaries,CaprahircusandBubalusbubalis. By real-time RT-PCR, the gene expression at different phases had specificity, and the expression of theAnxa-1 gene was higher at its earlier stage than that at its intermediate and advanced stage.
鹿茸为雄鹿(驯鹿除外)未骨化而带有茸毛的幼角,是我国一种传统贵重的滋补药材,在中医临床中占有重要地位,已有两千多年的入药历史。鹿茸的独特之处在于其是所有动物组织中唯一可以循环再生的组织;在生长旺期,其尖端组织细胞的分裂生长速度是肿瘤细胞生长速度的30多倍,但没有任何癌变迹象,这吸引了众多科学家的高度关注[1-3],是研究哺乳动物细胞增殖、生长与分化的理想材料。鹿茸的快速增长离不开各种基因的调控,而这些基因由于其自身因素及其在不同生长阶段表达量的不同,导致其在组织中存在不同的调控作用,因此了解基因在鹿茸组织中的调控作用有助于更深层次的了解鹿茸的生长发育机理。
膜联蛋白A1(Anxa-1)是一种以Ca2+介导能与带有负电荷的细胞膜磷脂相结合的蛋白,是Annexin超家族在脊椎动物中第一个被发现且研究最为深入的成员。Anxa-1广泛分布于动植物的各种组织器官中,不同动植物中其氨基酸残基组成的长度也有很大不同[4],最早是作为糖皮质激素诱导的磷脂酶A2抑制蛋白被发现的。Anxa-1在细胞分化、增殖及凋亡过程中起着重要作用[5],研究表明,其在不同类型的肿瘤细胞中表达量存在显著差异。目前GenBank中尚无鹿源Anxa-1基因序列的任何记录。本研究根据牛、猪等物种Anxa-1基因序列设计同源引物,首次成功克隆了具有完整编码区的Anxa-1基因的cDNA序列,并对其序列进行了生物信息学分析,通过实时荧光定量技术研究了鹿茸间充质在不同生长时期——生长前期(小鞍子)、生长中期(二杠茸)、生长后期(三杈茸)中Anxa-1基因的表达差异,推测其在鹿茸生长发育过程中的作用,这一研究的开展可能为鹿茸的生长发育机理的研究提供很好的理论依据和技术支持。
1 材料与方法
1.1 试验材料
选取人工驯养的一头健康成年东北梅花鹿(Cervusnippon)作为试验动物。在其小鞍子茸型时采集左茸顶端组织作为前期试验样品,在其二杠茸型时采集右茸顶端组织作为中期试验样品,在其被锯的左茸再长至三杈茸型时采集其顶端组织作为后期试验样品,分别截取3个时期的鹿茸顶端5 cm左右,迅速将其表面消毒,纵向剖开,按照Li等[6]所述的方法采取鹿茸顶端的间充质组织,按每管大约100 mg分装于冻存管中,迅速放入液氮罐中保存备用。
1.2 鹿茸顶端间充质组织的总RNA的提取及cDNA模板的获取
按照TRIzol试剂的操作步骤分别提取鹿茸3个不同生长时期的总RNA,1%琼脂糖凝胶电泳和紫外分光法检测总RNA质量(图1)。以提取的总RNA为模板,以Oligo-dT为引物,以M-MLVⅢ逆转录酶反转录合成cDNA。
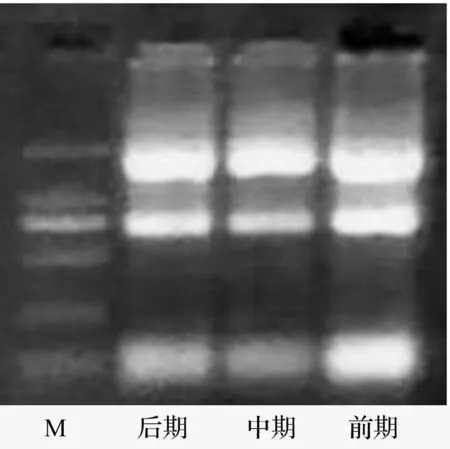
图1 鹿茸顶端间充质组织总RNA纯度检测
1.3 Anxa-1基因cDNA克隆
参照GenBank中牛、猪、绵羊等物种的Anxa-1基因序列,设计同源引物(Forward primer:CAAAAATGGCAATGGTAT和Reverse primer:ATCAAAGGAATGTTTAGTCTC),以中期组织cDNA为模板进行PCR扩增,利用DNA凝胶回收试剂盒回收PCR产物,将回收产物连接到pMD18-T载体上,转化到大肠杆菌DH5α中,涂板并于37 ℃过夜培养。挑取转化菌落,接种于LB液体培养基中,37 ℃振荡培养6~8 h,经阳性克隆检测送往华大公司进行双向测序。
1.4 Anxa-1的生物信息学分析
采用ORF程序查找序列的开放阅读框,用ExPASy服务器上ProtParam程序分析蛋白的理化性质,ProScal程序分析蛋白的疏水性,使用NCBI上的BlastP程序进行蛋白保守区预测,应用软件SignalP3.0预测蛋白的信号肽,使用PSORT Ⅱ和TMHMM Server v.2.0对蛋白质的亚细胞定位及跨膜蛋白分析,使用SOPMA软件进行蛋白质的二级结构预测。利用软件DNAStar和MEGA5.0进行氨基酸的多重序列比对和系统进化树的绘制。
1.5 Anxa-1的实时荧光定量RT-PCR分析
分别提取鹿茸尖端不同生长时期的总RNA,反转录成cDNA。合成Anxa-1基因的特异性引物(Forward primer:GCTATCCCCATCTCCGCAG和Reverse primer:GGCTGGCTTGTAGCACACTTC),以β-actin作为内参基因(Forward primer:GCGTGACATCAAGGAGAAGC和Reverse primer:GGAAGGACGGCTGGAAGA),对鹿茸不同生长时期的Anxa-1基因表达量进行定量分析。在ABI公司的7500 Real-Time PCR system上进行Real-time RT-PCR,PCR反应体系(25.0 μL)包括:SYBR Premix EXTaqTM Ⅱ(2×)12.5 μL,正向及反向引物(10 mmol·L-1)各1.0 μL,cDNA模板1.0 μL,加高压灭菌水补足体积至25.0 μL。反应程序分为两部分:第一部分为扩增反应,95 ℃ 10 min,在95 ℃ 15 s,60 ℃ 1 min,72 ℃ 30 s下循环40次,设定在每个循环中60 ℃ 1 min时读取荧光值;第二部分为建立荧光PCR产物熔解曲线,扩增反应结束后继续从72 ℃升温至95 ℃,持续15 s,然后降至60 ℃,持续1 min,之后缓慢升温至95 ℃,整体反应结束。使用软件ABI 7500 Software Version 2.3分析Anxa-1基因相对β-actin基因的的差异表达Ct值,通过普遍使用的2-ΔΔCt法[7]来计算分析基因在不同时期的相对表达量,其中,ΔCt=Ct(目的基因)-Ct(内标基因);ΔΔCt=ΔCt(试验组)-ΔCt(对照组);2-ΔΔCt表示试验组目的基因的表达相对于对照组变化的倍数。
2 结果与分析
2.1 Anxa-1基因cDNA的获得
Anxa-1基因的阳性克隆检测获得一条1 000 bp左右的插入片段(图2),后经测序公司反馈回的双向测序结果经DNAStar拼接得到1 059 bp片段,与预期片段大小一致。经进一步与GenBank数据库进行Blast比对分析,证实为Anxa-1基因的cDNA序列(图3)。
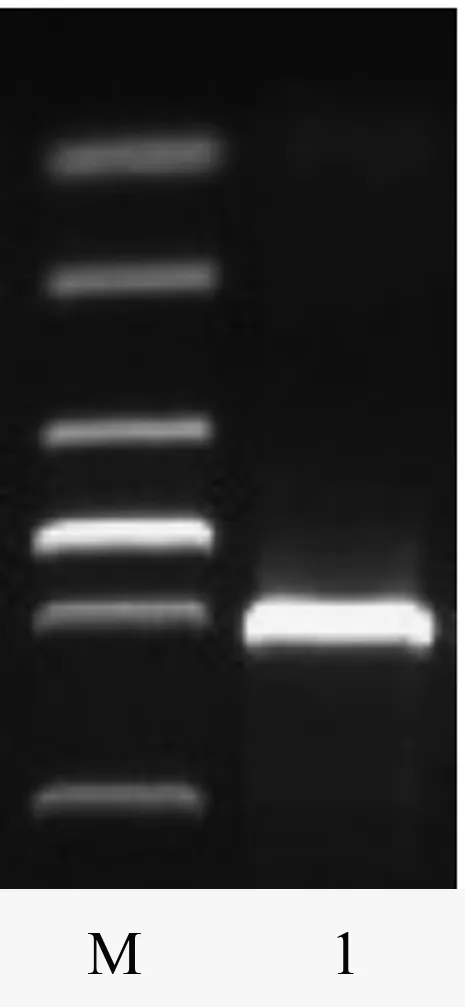
M.DL2000 Marker;1.阳性菌落PCR产物。

图3 Anxa-1基因的cDNA序列和推定的氨基酸序列
2.2 Anxa-1基因的序列
ORF程序显示:Anxa-1基因的开放阅读框为1 041 bp,编码346个氨基酸;通过NCBI的BlastP在蛋白保守区数据库对Anxa-1基因进行蛋白保守区预测表明,与此基因匹配的蛋白保守区共有4个Annexin结构域,其匹配区段分别为从第47~111个氨基酸、第118~183个氨基酸、第202~267个氨基酸和第277~342个氨基酸(图4);ProtParam软件预测Anxa-1基因编码蛋白的相对分子质量为38 830.4,理论等电点为6.17,整个氨基酸组成中亮氨酸占最大比例(10.4%),其次为赖氨酸(9.8%),不稳定系数为39.26,属于稳定蛋白;使用SignalP3.0软件显示该基因编码的蛋白质不具备信号肽;利用TMHMM Server v.2.0软件预测到其跨膜蛋白的数目为0,结果预期数值为0.00019,分值小于18,它不可能是一个跨膜蛋白;使用PSORT Ⅱ软件进行亚细胞定位分析表明,56.5%的可能性在细胞质中。
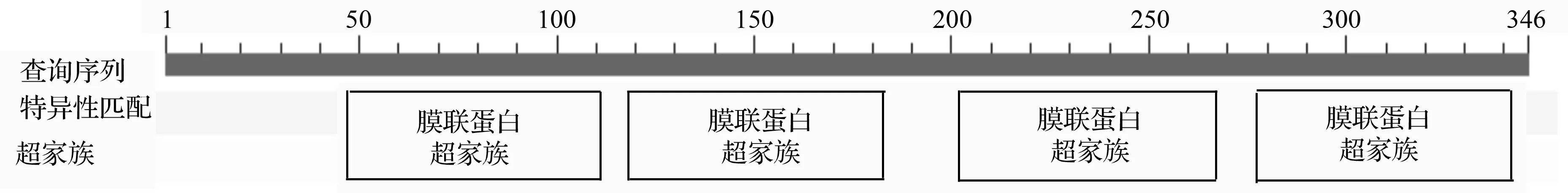
图4 推导的Anxa-1氨基酸保守区查找结果
2.3 不同物种间Anxa-1的同源性
将梅花鹿与GenBank选出的8种动物的Anxa-1氨基酸全序列进行BlastP对比,发现其与藏羚羊(Pantholopshodgsonii)、绵羊(Ovisaries)、山羊(Caprahircus)、水牛(Bubalusbubalis)具有很高的相似性,与小鼠(Musmusculus)和猪(Susscrofa)次之,而与原鸡(Gallusgallus)和人(Homosapiens)的Anxa-1序列相似性最低。
应用软件DNAStar和MEGA5.0对9个物种的Anxa-1氨基酸序列进行多重序列比对和系统进化树的绘制(图5、图6),结果表明,不同物种的Anxa-1氨基酸表现出较高的同源性,说明Anxa-1基因作为功能基因在进化中具有较高的保守性。从进化树可以看出,在该基因座位上梅花鹿与藏羚羊、绵羊、山羊和水牛在进化关系上较近,与原鸡和人亲缘关系较远,分析结果与各种物种在传统分类学上的地位一致。

1.梅花鹿(Cervusnippon);2.绵羊(Ovisaries);3.藏羚羊(Pantholopshodgsonii);4.山羊(Caprahircus);5.人类(Homosapiens);6.猪(Susscrofa);7.小鼠(Musmusculus);8.水牛(Bubalusbubalis);9.原鸡(Gallusgallus)。
图5 梅花鹿与其他动物Anxa-1氨基酸的多重序列对比
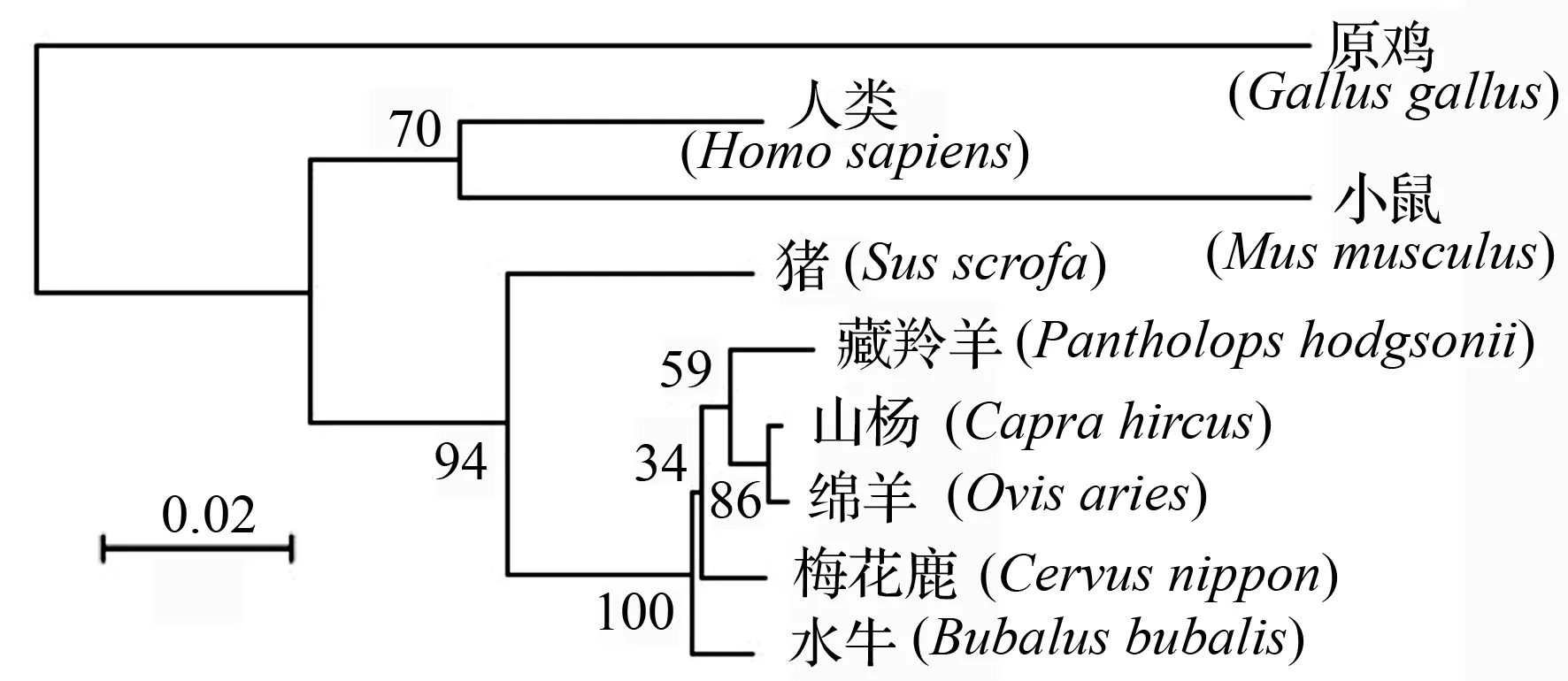
图6 动物Anxa-1系统进化树
2.4 Anxa-1基因的实时荧光定量RT-PCR
实时荧光定量RT-PCR的结果显示,Anxa-1基因在鹿茸生长前期表达量是中期的(1.84±0.34)倍,后期的表达量是中期的(1.12±0.26)倍,可见Anxa-1基因在鹿茸尖端表达的规律是前期>后期>中期(表1)。
表1 鹿茸顶端间充质组织前期、后期与中期Anxa-1基因表达的差异

生长期Anxa-1平均Ct值β-actin平均Ct值ΔCtΔΔCt2-ΔΔCt前期22.34±0.0323.04±0.19-(0.70±0.11)-(0.88±0.21)1.84±0.34中期(对照组)23.41±0.0323.23±0.110.18±0.0601.00后期22.68±0.2222.67±0.100.02±0.14-(0.16±0.24)1.12±0.26
注:表中数据为平均值±标准差。
3 结论与讨论
Anxa-1基因cDNA中开放阅读框1 041 bp编码346个氨基酸残基,组成分子量为38 830.4的Anxa-1蛋白,其中心结构域由4个重复序列组成,每个重复序列含有5个α螺旋。4个重复序列紧密压缩在一起,形成一个轻度弯曲的盘状结构,具有与钙离子及磷脂结合的位点。从其生物学信息分析中可以看出,其编码蛋白质没有具备信号肽的可能,且不是跨膜蛋白,是高度保守的稳定蛋白。利用MEGA软件进行物种间遗传距离计算得出与原鸡的遗传距离最远,与藏羚羊遗传距离最近,其分析结果与物种的传统分类学地位十分一致,且符合进化关系。
近年来的研究表明,Anxa-1基因可能是作为一种肿瘤抑制基因或某些肿瘤细胞/组织特定类型的肿瘤启动子。Srisomsap等[8]研究证明Anxa-1主要具有抑癌功能,其在肿瘤形成前呈高表达,其后随不同程度而减弱。也有研究表明其可抑制由表皮生长因子(EGF)引起的肝细胞增殖[9]。但有研究发现Anxa-1也可促进细胞增殖,在肝细胞中磷酸化的Anxa-1可作为一种诱导信号刺激细胞信使前列腺素E2的释放,从而引发一系列的细胞增殖反应[10]。目前就Anxa-1基因在细胞增殖中的作用还存在疑议,有可能是其在不同的组织细胞中发挥不一样的作用导致。本研究发现,Anxa-1基因在鹿茸生长前期表达量高于生长中期、后期的表达量,由此可以推测其在生长前期抑制了鹿茸细胞的增殖,而到了中期和后期表达下调,鹿茸得以进入快速增长期。
[1] Brockes J P, Kumar A. Appendage regeneration in adult vertebrates and implications for regenerative medicine[J]. Science,2005,23:1919-1923.
[2] Odelberg S J. Cellular plasticity in vertebrate regeneration[J]. Anat Rec B New Anat,2005,287(1):25-35.
[3] Price J, Allen S. Exploring the mechanisms regulating regeneration of deer antlers[J]. Philos Trans R Soc Lond B Biol Sci,2004,29:809-822.
[4] Gerke V, Moss S E. Annexins: from structure to function[J]. Physiol Rev,2002,82(2):331-371.
[5] Lim L H, Pervaiz S. Annexin 1: the new face of an old molecule[J]. FASEB J,2007,21(4):968-975.
[6] Li Chunyi, Clark D E, Lord E A, et al. Sampling technique to discriminate the different tissue layers of growing antler tips for gene discovery[J]. Anat Rec,2002,268(2):125-130.
[7] Livak K J, Schmittgen T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCtmethod[J]. Methods,2001,25(4):402-408.
[8] Srisomsap C, Sawangareetrakul P, Subhasitanont P, et al. Proteomic studies of cholangiocarcinoma and hepatocellular carcinoma cell secretomes[J]. J Biomed Biotechnol,2010:437143.doi:10.1155120101437143.
[9] Croxtall J D, Waheed S, Choudhury Q, et al. N-terminal peptide fragments of lipocortin-1 inhibit A549 cell growth and block EGF-induced stimulation of proliferation[J]. Int J Cancer,1993,54(1):153-158.
[10] Hirata F, Thibodeau L M, Hirata A. Ubiquitination and SUM Oylation of annexin A1 and helicase activity[J]. Biochem Biophys Acta,2010,1800(9):899-905.
Cloning and Expression Analysis ofAnxa-1 Gene cDNA from Sika Deer Antler Tissue
Qu Haomiao, Ding Ling, Zhao Jichen, Xia Yanling(Northeast Forestry University, Harbin 150040, P. R. China)/Journal of Northeast Forestry University,2015,43(3):99-103.
Annexin A1; Antler; cDNA; Clone; Real-time RT-PCR
曲昊淼,男,1988年10月生,东北林业大学野生动物资源学院,硕士研究生。E-mail:510008084@qq.com。
夏彦玲,东北林业大学野生动物资源学院,副教授。E-mail:xiayanling1974@163.com。
2014年8月4日。
S825.2
1)中国博士后基金(20110491124)。
责任编辑:程 红。

