超早期高压氧对大鼠局灶性脑缺血后梗死体积及脑组织水含量的影响
何庆权,张志强,张立新
急性缺血性脑血管病是导致人类死亡的主要疾病之一。在缺血中心不可逆坏死区与正常脑组织之间存在处于低灌注状态的缺血半暗带[1],如能及时恢复血流或采用药物干预,则可能被挽救,否则转为不可逆损伤。高压氧(hyperbaric oxygen,HBO)治疗具有改善组织缺氧,维持细胞能量代谢,保护血脑屏障,减轻脑水肿,保护梗死周围缺血半暗带组织,改善脑梗死预后的作用[2]。目前关于HBO治疗脑缺血的研究较多,但多数以脑缺血再灌注的实验模型为主,而临床上人类脑缺血发病更接近于持续脑缺血模型。目前国内外对HBO治疗的时间窗的研究已有不少报道:有研究表明对于持续性脑缺血HBO治疗时间窗一般在缺血2h之内[3-7],而缺血3h或6h后进行治疗对梗死灶大小和神经功能无影响[8]。因此,如果条件允许,应尽早给予HBO治疗。本研究选择在脑缺血后超早期给予HBO治疗,通过检测缺血后12h脑组织含水量及梗死体积的测定,探讨超早期HBO治疗对脑缺血的治疗作用。
1 材料与方法
1.1 材料 ①实验动物及分组:选取健康雄性SD大鼠60只,体质量250~300g,购自中国医科大学附属盛京医院动物部。适应性饲养1周,自由进食水,室温22℃,12h明暗交替。将60只大鼠随机分为假手术组、对照组和HBO组各20例。②动物模型的制备:参照Longa等[9]报道的方法建立大鼠局灶性脑缺血模型。用10%水合氯醛(0.3~0.5ml/100g体质量)将大鼠麻醉成功后,仰卧位固定,取颈正中切口,钝性分离暴露左侧颈总动脉(common carotid artery,CCA)、颈内动脉(internal carotid artery,ICA)及颈外动脉(extenal carotid artery,ECA),在ICA和 ECA分叉处结扎ECA,并结扎CCA近心端。在距ICA和 ECA分叉约0.5cm处的CCA用4.5号针头扎一直径0.35mm的小口,将直径0.309mm、长5cm的尼龙线经颈总动脉插入ICA,入颅至大脑前动脉起始部,闭塞大脑中动脉起始部,进线长度为距ICA和 ECA分叉18~20mm,至稍有阻力感,动脉出血停止。然后将尼龙线结扎固定于CCA上,逐层缝合至皮肤。大鼠于术后约2~4h后清醒,清醒后右侧肢体功能障碍,行动迟缓,进食水情况较差。清醒后行神经功能评分,1~3分提示造模成功,0分及4分者剔除。
1.2 方法 HBO组:给予HBO治疗,应用烟台宏远GY3200型氧舱进行治疗,于氧舱常压空气环境下完成栓塞大鼠左侧大脑中动脉,栓线成功后立即加压吸氧,升压时间10min,维持压力2.0ATA,稳压后吸纯氧60min,减压时间10min。对照组:常压空气条件下栓塞大鼠左侧大脑中动脉,不行HBO治疗。假手术组:栓线仅插入1cm,不阻断大脑中动脉,不行HBO治疗。
1.3 评定标准 所有大鼠均在模型制作成功后12h取材。①神经功能评分:动物清醒后及取材前评价,采用zea longa 5分制评分标准进行评分:0分,无神经损伤症状;1分,不能完全伸展对侧前爪;2分,向外转圈;3分,向对侧倾倒;4分,不能自发行走,意识丧失。②脑梗死体积测定:用2,3,5-氯化三苯基四氮唑(triphenyltetrazolium chloride,TTC)染色的方法测定梗死体积。各组大鼠于相应时间点麻醉后断头取脑,于-20℃冰箱冰冻20min,取出后从大脑与小脑之间从后向前切取2mm厚的切片6片,浸于2%的TTC溶液中放入37℃温箱中染色20min,不时翻动脑片使两面染色均匀,第一刀在脑前极与视交叉连线中点处;第二刀在视交叉部位;第三刀在漏斗柄部位;第四刀在漏斗柄与后叶尾极之间。正常脑组织被染成红色,梗死区脑组织呈白色。取出后于4%的多聚甲醛中固定24h,数码相机双面脑片拍照,应用Nis-Elements Br3.0分析软件计算梗死体积百分比。③脑组织含水量:采用干湿法检测。各组大鼠于相应时间点麻醉后断头取脑,切开左右半脑,用电子天平准确称其湿重,放置于100℃烤箱24h,烘干至衡重后用电子天平称其干重。脑组织含水量=(湿重-干重)/湿重×100%。
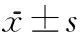
2 结果
神经功能缺损评分比较,假手术组为0分,HBO组大鼠评分明显低于对照组(P<0.05)。脑梗死体积结果显示,大鼠脑切片TTC染色可见正常脑组织被染成红色,梗死区脑组织不能被染色,呈白色;HBO组大鼠脑梗死体积较对照组明显降低(P<0.05)。脑组织含水量比较,对照组较假手术组和HBO组明显升高(P<0.05)。见表1。
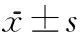

组别n神经缺损评分(分)脑梗死体积(%)脑组织含水量(%)HBO组201.68±0.73a13.46±0.84a80.01±0.85a对照组202.26±0.5021.18±1.7984.43±0.78b假手术组200077.89±0.45a
与对照组比较,aP<0.05;与假手术组比较,bP<0.05
3 讨论
由于HBO治疗能明显增加机体对氧的摄取和利用,使血氧含量增加,血氧分压增高,氧弥散能力增强,是治疗各种缺氧性疾病的有效措施。局灶脑缺血后组织缺氧是细胞损伤的主要原因之一,HBO可以改善组织供氧,维持细胞能量代谢,保护血脑屏障,减轻脑水肿,因此HBO治疗被认为是治疗脑缺血较具潜力的方法之一。目前较公认的理论是脑缺血核心区周围是缺血半暗带,缺血半暗带可随着供血及供氧的恢复转化为正常灌注区,否则将转化为梗死区。因此尽早改善半暗带区供氧是HBO治疗脑缺血的理论基础[10]。
本实验中选择造模成功后立即进行HBO治疗,在脑缺血形成过程中维持缺血区脑组织供氧及供血,减小缺血半暗带区,造模后12h取脑经TTC染色,发现HBO组大鼠较对照组大鼠脑梗死体积明显减小,神经缺损评分明显降低。相似研究表明,HBO治疗应在脑缺血早期进行,才能改善神经功能。在全脑缺血模型中,Yang等[11]发现HBO治疗促进全脑缺血大鼠神经功能的恢复,改善存活率,病理研究也证实HBO治疗能减少全脑缺血后海马CAI神经元的迟发型死亡[12]。应用局灶性脑缺血模型,Veltkamp等[13]显示缺血后早期HBO治疗显著改善短暂性脑缺血(75min)后行为功能恢复,并减少梗死体积,尤其是皮层梗死。而Sunami等发现永久性局灶脑缺血后 10min用HBO治疗能减少18%的梗死体积[14]。有研究运用MRI成像研究证实,永久性脑缺血后2h应用HBO治疗有效,且并无氧化损伤[15]。Badr等[16]在脑缺血后不同时间点应用HBO治疗,发现仅在短暂性脑缺血后6h内HBO治疗才能改善神经功能。因此,HBO治疗脑缺血有时间窗,在病情允许的情况下,应尽早进行HBO治疗以减轻脑梗塞体积,减轻症状。
HBO治疗能降低脑水肿可能的机制:①HBO可使脑血管收缩,从而减轻水肿[17];②HBO能改善缺氧,有利于脑细胞代谢,切断脑缺氧和水肿之间的恶性循环,从而减轻水肿[18-19];③HBO能改善和恢复大脑微血管内皮细胞,从而能减轻水肿[20]。此外,HBO治疗能减少梗死体积,其原因可能是HBO能增加缺血区的细胞供氧,从而减少梗死体积和神经损伤程度[21],从而改善脑组织缺氧状态。HBO能提高血氧张力,促进血管收缩,降低颅内压,有利于受损组织的恢复。HBO还使缺血部位的脑血流量增加,纠正缺血部位的酸中毒,改善微循环,促进侧支循环保护脑细胞免受氧自由基损伤。在HBO暴露下,微动脉收缩、微静脉无明显变化,因此我们推测, HBO条件下毛细血管内血压下降,这将有利于组织液吸收,从而起到减轻组织间隙水肿的作用。同时HBO使毛细血管内血氧含量增加,脑血流虽有所减少,但组织供氧反而增加,这是其它血管收缩因素所不能替代的[22]。脑缺血半暗带区氧供的迅速而有效地改善,可为因缺血而处于濒危的组织提供能量供应,降低脑组织对扩散阻抑现象(spreading depressions, SD)的敏感性, 防止濒危组织能量的进一步耗竭。对缺血核心区谷氨酸盐和乳酸盐的微量分析研究表明,HBO 可降低神经组织缺血损伤后的兴奋性毒性水平。此外,还有报道表明,HBO还具有促进自由基清除剂基因表达、抑制白细胞黏附和再灌注损伤的作用[23]。为防止氧中毒等HBO可能的毒性作用和不良反应,我们采取了每吸氧1 h后改吸1h高压空气的间断方法,以提高动物对HBO的耐受性[24]。
近期的研究结果表明[25-26],HBO的脑保护作用可能与能保护血脑屏障、抑制炎症反应和细胞凋亡、增强促进细胞存活基因Bcl-2表达、减少环氧化酶-2mRNA和蛋白质水平、减少多种凋亡基因表达,如诱导因子-1α、P54、caspase-9及caspase-3 等相关。
本实验中选择线栓造模成功后即刻进行HBO治疗,证实超早期HBO治疗可以减低脑水肿,减小脑梗死体积,改善神经功能。这与之前的研究结果相一致。今后的研究中应对其产生上述作用的具体机制进行研究。综上所述,大鼠局灶性脑缺血后,给予超早期HBO治疗可以减轻脑水肿,减小脑梗死体积,进而改善神经功能。
[1] Astrup J, Siesjo BK, Symon L. Thresholds in cerebral-the ischemic penumbra[J].Stroke,1981,12(6):723-725.
[2] Badr AE, Yin W, Mychaskiw G, et al. Effect of hyperbaric oxygen on striatal metabolites: a microdialysis study in awake freely mov-ing rats after MCA occlusion[J]. Brain Res, 2001,916(1-2):85-90.
[3] Wang XL, Yang YJ, Wang QH, et al. Effect of hyperbaric oxygen therapy administered at different time on white matter damage following hypoxic-ischemic brain damage in neonatal rats[J].Zhongguo Dang Dai Er Ke Za Zhi,2007,9(4):308-312.
[4] Harman F,Hasturk AE, Duz B, et al. An evaluation of the effectiveness of pre-ischemic hyperbaric oxygen and post-ischemic aminoguanidine in experimental cerebral ischemia[J]. Neurosciences (Riyadh),2012,17(2):121-126.
[5] Chen S, Xiao N, Zhang X. Effect of combined therapy with ephedrine and hyperbaric oxygen on neonatal hypoxic-ischemic brain injury[J]. Neurosci Lett,2009,465(2):171-176.
[6] Acka G, Sen A, Canakci Z, et al. Effect of combined therapy with hyperbaric oxygen and antioxidant on infarct volume after permanent focalcerebral ischemia[J]. Physiol Res,2007,56(3):369-373.
[7] Wang XL, Zhao YS, Yang YJ, et al. Therapeutic window of hyperbaric oxygen therapy for hypoxic-ischemic brain damage in newborn rats[J]. Brain Res, 2009,916(7):85-90.
[8] Li Z, Liu W, Kang Z,et al. Mechanism of hyperbaric oxygen preconditioning in neonatal hypoxia-ischemia rat model[J].Brain Research,2008,27(1196):151-156.
[9] Longa EZ, Weinstein PR, Carlson S, et al. Reversible middle cerebral artery occlusion without craniectomy in rats[J].Stroke,1989,20(10):84-91.
[10]Yin X, Meng F, Wang Y, Wei W, et al. Effect of hyperbaric oxygen on neurological recovery of neonatal rats following hypoxic-ischemic brain damage and its underlying mechanism[J]. Int J Clin Exp Pathol, 2013,6(1):66-75.
[11]Yang J,Chang C,Lee T, et al. Hyperbaric oxygen treatment decreases post-ischemic neurotrophin-3 mRNA down-regulation in the Rathippocampus[J]. Neuroreport, 2001,12(16):3589-3592.
[12]Takahashi M,Iwatsuki N,Ono K, et al. Hyperbaric oxygen therapy accelerates neurologic recovery after 15-minute complete global cerebral ischemia in dogs[J].Crit Care Med,1992,20(11):1588-1594.
[13]Veltkamp R, Siebing D,Sun L, et al Hyperbaric oxygen reduces blood-brain barrier damage and edema after transient focal cerebral ischemia[J].Stroke,2005,36(8):1679-1683.
[14]Sunami K, Takeda Y,Hashimoto M, et al. Hyperbaric oxygen reduces infarct volume in rats by increasing oxygen supply to the ischemic periphery[J]. Crit Care Med,2000,28(8):2831-2836.
[15]Henninger N, Küppers-Tiedt L, Sicard KM, et al. Neuroprotective effect of hyperbaric oxygen therapy monitored by MR-imaging after embolic stroke in rats[J]. Exp Neurol, 2006,201(2):316-323.
[16]Badr AE, Yin W, Mychaskiw G, et al. Dual effect of HBO on cerebral infarction in MCAO rats[J]. Am J Physiol Regul Integr Comp Physiol, 2001,280(3):R766-R770.
[17]Li Z, Liu W, Kang Z, Lv S, et al. Mechanism of hyperbaric oxygen preconditioning in neonatal hypoxia-ischemia rat model[J]. Brain Res, 2008,28(8):2831-2836.
[18]Holbach KH, Caroli A, Wassmann H. Cerebral energy metabolism in patients with brain lesions at normo and hyperbaric oxygen pressure[J]. J Neurol,1997,217(8):17-30.
[19]Shiokawa O, Yanai T, Sadishisa, et al. Survival and brain tissue metabolism in acute cerebral ischemia treated with hyperbaric oxygen in spontaneously hypertensive rats[J]. Medicine, 1984,35(8):73-76.
[20]Duan S, Shao G, Yu L, et al. Angiogenesis contributes to the neuroprotection induced by hyperbaric oxygen preconditioning against focalcerebral ischemia in rats[J]. Int J Neurosci,2014,35(7):1381-1389.
[21]Demchenko IT, Boso SE, O Neill TJ, et al. Nitric oxide and cerebral blood flow responses to hyperbaric oxygen[J].Journal of Applied Physiology,2000,88(4):1381-1389.
[22]Cideciyan A V , Pugh E N Jr , Lamb T D. Rod Plateaux during dark adap2 tation in sorsby' s fundus dystrophy and vitamin A deficiency[J]. InvestOphthalmol Vis Sci,1997,38(9):1789-1794.
[23]Yin W, Badr AE, Mychaskiw G, et al. Down regulation of COX-2 isinvolved in hyperbaric oxygen treatment in a rat transient focalcerebral ischemia model[J].Brain Res,2002, 926(6):165-171.
[24]Chavko M, McCarron RM. Extension of brain tolerance to hyper-baric O2 by intermittent air breaks is related to the time of CBF increase[J]. Brain Res, 2006, 1084(1):196-201.
[25]Zhang JH, Lo T, Mychaskiw G, et al. Mechanisms of hyperbaric oxygen and neuroprotection in stroke in adult rats[J]. Pathophysiology, 2005,12(1):63-77.
[26]Cheng O, Ostrowski RP, Wu B, et al. Cyclooxygenase-2 mediates hyperbaric oxygen preconditioning in the rat model of transient global cerebral ischemia[J].Stroke,2011,42(2):484-490.
沉痛悼念王培生教授
《中国康复》杂志第1届、第2届、第3届编辑委员会副主编王培生教授因病医治无效,于2014年12月30日22时逝世,享年84岁。
王培生教授于1930年10月出生于湖北黄冈,1949年7月参加革命工作,1953年1月加入中国共产党。50年代起,在湖北医学院第一医院工作,为医院乃至湖北省的医学学科建设,发挥了重要、积极作用。1981年进入华中科技大学同济医学院附属梨园医院工作,1996年1月离休。曾任湖北医学院附属第一医院医政科科长、华中科技大学同济医学院附属梨园医院副院长、梨园医院老年康复中心主任、湖北省医学会物理医学与康复专业委员会主任委员、湖北省康复医学会副会长。在担任《中国康复》杂志副主编期间,为杂志的发展尽心尽力,做出了卓越贡献。
王培生教授热爱中国共产党,热爱祖国,热爱医疗事业。在担任梨园医院副院长期间,积极开展各项工作,注重调查研究。他于1981年创建了湖北省梨园医院理疗科,于1988年牵头成立了湖北省梨园医院老年康复中心,并以身作则,带领大家奋力拼搏,精益求精,在短时间内使得理疗科和老年康复中心当时的规模和技术水平达到省内领先地位。他一生致力于康复医学研究,即便是在离休后,仍不顾高龄,继续参加与康复有关的各项学术活动,倾心培养学科晚辈。特别是在为《中国康复》杂志审稿中,表现出了老一辈康复专家的高风亮节和一丝不苟、不懈追求的严谨学风,认真对待每一篇稿件,既实事求是、坚持科学、严把学术质量关,又不辞辛劳、认真细致、不遗余力地帮助作者和提携学科新人,深受编辑部编辑和作者们的欢迎与尊敬。
王培生教授一生兢兢业业、勤勤恳恳,他的离去,使我们失去了一位深受爱戴的好师长。虽然他离开了我们,但他所树立的榜样作用将永存于我们的心中,并将激励我们化悲痛为力量,勤勉工作,无私奉献,为发展我国康复医学事业,造福于广大患者做出应有的贡献。
王培生教授永垂不朽!
《中国康复》编辑部

