急性一氧化碳中毒对大鼠少突胶质前体细胞的影响
孙瑞佼,郭大志,李航,李铭鑫,胡慧军,潘晓雯
急性一氧化碳中毒(acute arbon monoxide poisoning,ACOP)是国内外最常见的意外中毒之一[1],研究证实,脑白质的脱髓鞘改变是最常见、最主要的病理改变[2],但髓鞘脱失机制不详。在中枢神经系统中,少突胶质前体细胞(oligodendrocyte precursor cells,OPCs)向少突胶质细胞(oligodendrocytes,OLs)的分化是髓鞘形成的关键步骤,也是髓鞘损伤后再生修复的主要来源[3]。本研究应用免疫组织化学染色和Western Blot观察ACOP大鼠中枢神经系统髓鞘损伤后髓鞘标志物髓鞘碱性蛋白(myelin basic protein,MBP)和OPCs特异性细胞标志物硫酸软骨素蛋白多糖NG2表达的变化,为探讨ACOP后中枢神经系统髓鞘脱失机制提供一定的实验参考。
1 材料与方法
1.1 材料 ①实验动物:健康成年雄性Sprague-Dawley大鼠36只(军事医学科学院实验动物中心提供),清洁级,9~10周龄,体质量200~250g,于12h明-暗交替、室温18~20℃的动物房适应性饲养1周。自由进食标准大鼠饲料及普通自来水。②主要仪器和设备:轮转切片机(德国Leica公司),组织匀浆器(BIOSPEC公司),低温水平离心机(美国),垂直电泳槽(BIO-RAD公司),半干转移电泳仪(BIO-RAD公司),凝胶成像分析系统(美国),全自动显微照相机(日本Olympus)。
1.2 方法 参照Fechter[4]及王耀宏等[5]的研究,利用分次腹腔注射CO法制作ACOP大鼠模型。参考前期预实验结果,预计染毒死亡率约50%,故36只SD大鼠中按电脑随机数选取24只进行染毒,分次腹腔内注射纯品CO气体(99.9%,燕山石化),首次剂量120ml/kg,后以半量追加注射3次,每次间隔4h。其余12只作为对照组按同样方案注射空气。染毒后每隔15~20min观察1次大鼠变化。造模结束后从存活大鼠中随机选取12只作为染毒组纳入实验;正常对照组注射空气后无死亡,全部纳入。
1.3 检测指标 ①免疫组织化学染色:在染毒后第1d、3d,2组各随机取3只大鼠,腹腔注射20%乌拉坦(0.7 ml/100g体质量)麻醉,灌注,取脑,4%中性甲醛液固定2h,30%蔗糖溶液脱水7d,浸蜡,包埋,切片(厚度15um),石蜡切片脱蜡后,3%双氧水灭活内源性过氧化酶,经微波对抗原进行热修复后加入一抗MBP、NG2,0.01mol/L PBS清洗后,添加生物素标记的山羊抗兔二抗,37℃孵箱孵育30min,PBS清洗后加入ABC复合物,37℃孵箱孵育30min。DAB显色,苏木精复染,常规脱水,透明,封片。②组织蛋白样本制备及Western Blot分析:在相同实验节点2组各随机取3只大鼠,处死后取脑,加入5ml细胞裂解液及蛋白酶抑制剂充分匀浆,再加蛋白上样液,95℃加热5min,离心后取上清,每孔加样5ul,用10%SDS聚丙烯酰胺凝胶电泳分离蛋白质,经转膜及封闭后,将膜移入含抗MBP、NG2多克隆抗体的一抗反应液中,4℃过夜,洗膜后加入二抗,室温避光缓摇60min,洗膜后扫描,摄片。③图像分析: MBP、NG2免疫组织化学染色结果:在光镜下采集图像,每个标本取5个视野,应用Imagic-Pro 5.1图像分析软件测定髓鞘、MBP、NG2的积分光密度值(integral optical density,IOD)。Western Blot以β-actin为内参,计算目的蛋白的表达水平。
2 结果
2.1 染毒后表现 大鼠腹腔注射CO后中毒症状与王耀宏等[5]文献报道类似,5~10min出现烦躁、撞笼,15min陆续出现少动、四肢瘫软、抽搐、昏迷,黏膜及肢端皮肤呈樱桃红色,部分发生角弓反张。上述症状体征持续至末次染毒后6h逐渐消失。造模后CO染毒组存活14只,死亡10只,尸检发现大鼠皮肤黏膜及肝脏呈典型“樱桃红”样改变,心脏、肝脏及脾脏等脏器重度充血伴散在出血点,脑组织充血水肿严重。对照组大鼠无异常表现,无死亡。
2.2 免疫组织化学染色结果 大鼠ACOP后1d,MBP表达轻度下降,与对照组比较IOD值差异无统计学意义;3d后MBP表达进一步下降,与对照组比较IOD值差异有统计学意义(P<0.05),见图1;大鼠ACOP后1d,NG2表达减少,与对照组比较IOD值差异无统计学意义,3d时进一步减少,与对照组比较IOD值显著下降(P<0.05),见图2。局部放大后观察,对照组可见数目较多的NG2阳性细胞,胞体小,呈圆形或椭圆形,从胞体向四周放射状伸出多数突起。染毒3d后OPCs数量减少,细胞形态异常,胞体缩小,突起减少,见图3。具体数据见表1。
2.3 Wester Blot检测结果 2组大鼠脑组织中均有MBP、NG2表达,相对分子质量MBP为18500、NG2为300000。MBP、NG2在对照组中正常表达,染毒组染毒1d后MBP及NG2表达均减少,3d时进一步减少,与对照组比较差异有统计学意义(P<0.05)。见图4,5。

a.染毒组1d b.染毒组3d

c.对照组1d d.对照组3d
图1a~d 大鼠脑组织MBP免疫组织化学染色结果(×40)

a.染毒组1d b.染毒组3d

c.对照组1d d.对照组3d
图2a~d 大鼠脑组织NG2免疫组织化学染色结果(×40)

a.染毒后3d b.正常对照
图3a~b 3d大鼠脑组织NG2免疫组织化学染色局部放大(×60)
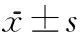

组别nMBP1d3dNG21d3d对照组317.74±0.8318.24±1.0314.95±0.7514.56±0.83染毒组316.24±0.8915.15±0.75a13.22±0.6610.85±0.93a
与对照组比较,aP<0.05

对照组 中毒1d 中毒3d
图4 大鼠脑组织MBP表达的Western Blot电泳图

对照组 中毒1d 中毒3d
图5 大鼠脑组织NG2表达的Western Blot电泳图
3 讨论
建立合适的动物染毒模型是进行相关中毒研究的基础,目前常用ACOP模型的造模方法有吸入染毒法和腹腔注射染毒法。温韬等[6]在Fechter基础上改良的分次腹腔注射染毒法,具有操作简单、染毒程度容易控制等优点,注射后血碳氧血红蛋白可迅速升高至所需水平,并引起明显中毒症状,神经系统损伤及生化指标改变均与临床所及CO中毒表现一致。因此本研究选用此方法进行造模。但此方法在染毒过程中有一定的死亡率,死亡率随注射剂量增加而增大,且死亡大都发生于首次注射后。王耀宏等[5]研究发现,对体质量240~280g的大鼠,腹腔注射CO半数致死剂量为146ml/kg,95%可信范围129~165ml/kg。在保证大鼠出现明显中毒效应,且死亡率可接受的前提下,我们选用首次注射剂量为120ml/kg。王耀宏等[5]报道此剂量大鼠死亡率约30%,而我们在前期预实验中发现死亡率约50%,此差异推测与本研究所选用大鼠体质量较小(200~250g),耐受性相对较差有关。实验中对24只大鼠进行染毒,死亡10只,实际死亡率41.67%。
ACOP后脑白质脱髓鞘的机制尚不明确,在其它脑白质脱髓鞘疾病,如缺血缺氧性脑病、多发性硬化症的研究中发现,缺血缺氧后星形细胞、小胶质细胞、巨噬细胞和中性白细胞被激活后释放大量的炎性细胞因子、蛋白酶、NO 和氧自由基,这些物质均可直接或间接地造成OLs损伤,最终导致脑白质缺血性脱髓鞘病理改变[7-10];多发性硬化症尽管机制不明,但其主要病理进程基本取得共识[11],包括原发性脱髓鞘,此时很少有OLs的损伤;脱髓鞘过程中OLs的广泛丢失;原发性OLs损伤并导致继发性脱髓鞘;大量的巨噬细胞被激活,引起非选择性的组织损伤,不仅累及髓鞘还涉及轴突和星形胶质细胞。ACOP对人体的损伤机制非常复杂,既往研究已证明存在与上述脑缺血缺氧、多发性硬化等疾病类似的缺氧损害、免疫损伤、氧化应激、炎症损伤等损伤机制[12-13]。除此以外,CO还特有细胞毒性作用,能直接作用于线粒体造成细胞损伤[14]。ACOP后中枢神经系统脱髓鞘是否与OLs受损有关,目前尚无研究报道。从本实验结果看,中毒后1d即可看到MBP表达较正常对照组减少,3d时进一步减少,证明ACOP后大鼠中枢神经系统发生脱髓鞘改变。
在中枢神经系统中,OPCs向OLs的分化是髓鞘形成的关键步骤,也是髓鞘损伤后再生修复的主要来源[15]。大量研究表明在各种损伤因素导致脱髓鞘病变后,OPCs开始增殖并迁移至脱髓鞘区域,分化为OLs包裹脱髓鞘轴突形成新的髓鞘。另外有研究发现在缺血损伤区域存活下来的OLs不能进行分化和髓鞘再生,有高度迁移和分化潜能的OPCs形成的新生少突胶质细胞是髓鞘再生的来源[16]。作为髓鞘脱失后修复的主要来源,OPCs受损会对髓鞘修复造成影响,导致修复不良或不能修复。近年来研究发现,OPCs对缺血缺氧等刺激同样敏感,脑缺血引起的能量耗竭、氧化应激同样会损伤OPCs[17-18]。另外,OPCs膜上分布有丰富的非N-甲基-D-天冬氨酸(non-N-methyl-D-aspartic acid,non-NMDA)受体,脑缺血后细胞间隙积聚的大量兴奋性氨基酸将激活non-NMDA受体,损伤OPCs[19]。在慢性多发性硬化患者中,OPCs很少分化,这与患者后期髓鞘修复失败相吻合[20]。从本实验结果来看,ACOP后1d 即可看到NG2表达减少,3d时进一步减少;与正常对照组比较,中毒后3d时OPCs数量明显减少,残存细胞形态异常,胞体缩小,突起减少,表明ACOP对OPCs造成损伤。此外有研究显示,老年大鼠脑内的OPCs移动能力较弱,细胞形态与成年大鼠不同[21],而临床上观察到在ACOP患者中高龄患者髓鞘脱失持续时间长,恢复慢,迟发脑病的发生率明显高于年轻患者[22]。
综上,ACOP在造成中枢神经系统脱髓鞘的同时,也对OPCs细胞造成损伤。推测OPCs受损后不能及时分化成OLs修复脱失的髓鞘,是后续发生迟发脑病的可能机制之一,有待进一步研究证实。
[1] Hampson NB,Weaver LK. Carbon monoxide poisoning: a new incidence for an old disease[J]. Undersea Hyperb Med,2007,34(3):163-168.
[2] Satoru W,Hirotaka M,Yasushi K,et al. Transient degradation of myelin basic protein in the rat hippocampus following acute carbon monoxide poisoning[J]. Neuroscience Research,2010,68(2):232-240.
[3] Frö hlich N, Nagy B, Hovhannisyan A, et al. Fate of neuron-glia synapses during proliferation and differentiation of NG2 cells[J]. Anat, 2011, 219(1):18-32.
[4] Fechter LD, Liu Y. MK-801 protect against carbon monoxide-induced hearing loss[J]. Toxicol Appl Pharmacol, 1995, 132(3): 196-202.
[5] 王耀宏,赵金垣,崔书杰,等. 急性一氧化碳中毒迟发性脑病的动物模型制备研究[J].中国职业医学,2004,31(1):5-10.
[6] 温韬,赵金垣. 一种制备急性CO中毒迟发性脑病动物模型的新方法[J].中国工业医学杂志,2003,16(3):129-132.
[7] Masumura M, Hata R, Nagai Y, et al. Oligodendroglial cell death with DNA fragmentation in the white matter under chronic cerebral hypoperfusion: comparison between normotensive and spontaneously hypertensive rats[J]. Neurosci Res, 2001, 39(4):401-412.
[8] Mabuchi T, Kitagawa K, Ohtsaki T, et al. Contribution of microglia/ macrophages to expansion of infarction and response of oligodendrocytes after focal cerebral ischemia in rats[J]. Stroke,2000, 31(7):1735-1743.
[9] Stoll G, Jander S, Schroeter M. Inflammation and glial responses in ischemic brain lesions[J]. Prog Neurobiol, 1998, 56(2):149-171.
[10]Toulmond S, Parnet P, Linthorst AC. When cytokines get on your nerves: cytokine networks and CNS pathologies[J]. Trend Neurosci,1996, 19(10):409-410.
[11]Brown WR, Moody DM, Thore CR, et al. Cerebrovascular pathology in Alzheimer's disease and leukoaraiosis[J]. Ann N Y acad Sci, 2000, 903(1): 39-45.
[12]Thom SR, Bhopale VM, Han ST, et al. Intravascular neutrophil ctivation due to carbon monoxide poisoning[J]. Am J Respir Crit Care Med,2006,74(16):1239-1248.
[13]Piantadosi CA, Zhang J, Levin ED, et al. Apoptosis and delayed neuronal damage after carbon monoxide poisoning in the rat[J]. Exp Neurol,1997,147(2):103-114.
[14]Zhang J, Piantadosi CA. Mitochondrial oxidative stress after carbon monoxide hypoxia in the rat brain[J]. J Clin Invest, 1992, 90(12): 1193-1199.
[15]Nishiyama A. Polydendrocytes: NG2 cells with many roles in development and repair of the CNS[J]. Neuroscientist,2007,13(1): 62-76.
[16]Wang A,He BP. Characteristics and functions of NG2 cells in normal brain and neuropathology[J].Neurol Res,2009,31(2): 144-150.
[17]Dewar D, Underhill SM, Goldberg MP. Oligodendrocytes and ischemic brain injury[J]. J Cereb Blood Flow Metab,2003,23(3): 263-274.
[18]Li L, Harms KM, Ventura PB, et al. Focal cerebral ischemia induces a multilineage cytogenic response from adult subventricular zone that is predominantly gliogenic[J]. Glia,2010,58(13):1610-1619.
[19]Matute C, Domercq M, Sánchez-Gómez MV. Glutamate-mediated glial injury: mechanisms and clinical importance[J]. Glia,2006,53(2):212-224.
[20]Kurosinski P, Gotz J. Glial cells under physiologic and pathologic conditions[J]. A rch N eurol, 2002, 59(10): 1524-1528.
[21]Ohta K, Iwai M, Sato K, et al. Dissociative increase of oligodendrocyte progenitor cells between young and aged rats after transient cerebral ischemia[J]. Neurosci Lett,2003,335(3):159-162.
[22]Huijun H, Xiaowen P, Yi W, et al. Factors affecting the rognosis of patients with delayed encephalopathy after acute carbon monoxide poisoning[J]. The American Journal of Emergency Medicine,2011,29(3):261-264.

