γδ T 细胞体外抑制未成熟树突状细胞向破骨细胞转分化①
陈清娇 曾志勇 邱东飚 陈君敏 (福建医科大学附属第一医院,福州350005)
多发性骨髓瘤(Multiple myeloma,MM)为血液系统浆细胞恶性肿瘤,多见于老年人。MM 仍是一种无法治愈的疾病,虽然20 年来由于干细胞移植的应用和诸如硼替佐米、雷那度胺和沙利度胺等新药的出现,MM 的生存有很大的改观。骨髓瘤骨病(Myeloma bone disease,MBD)是MM 患者常见并发症,表现为严重的骨质破坏、病理性骨折、高钙血症和神经压迫症状,严重影响患者生存质量[1]。
由于单核细胞在RANKL 和巨噬细胞集落刺激因子(Macrophage colony-stimulating factor,M-CSF)诱导下可分化为参与MBD 发生发展的OC,目前普遍将其作为OC 的前体[2]。然而,近年有研究发现,M-CSF 与RANKL 可诱导参与免疫调节的未成熟树突状细胞(Immature dendritic cells,imDC)转分化为具有骨吸收作用的OC,并且imDC 较单核细胞更易融合为多核的OC,认为imDC 是比单核细胞更接近OC 的前体细胞。此外,有研究学者发现在MM 骨髓微环境下,imDC 可转分化为OC,因此这一转分化过程可能在MBD 的发生发展过程中起重要作用[3]。
γδ T 细胞为表达γδ TCR 的特殊T 细胞亚群,具有抗原特异性识别而无MHC 限制性,在感染、肿瘤及自身免疫性疾病中起着重要作用[4]。先前的研究证实健康人及多种肿瘤患者外周血单个核细胞(Peripheral blood mononuclear cells,PBMNC)经唑来膦酸(Zoledronate,Zol)刺激及重组人白细胞介素2(Interleukin-2,IL-2)扩增可获得高纯度的γδ T 细胞,后者可促进imDC 的成熟[5],因此γδ T 细胞可能在imDC 转分化为OC 过程中发挥作用。
因此,本研究旨在体外条件下探讨MM 患者与健康志愿者体外激活扩增γδ T 细胞的差异,并进一步研究体外扩增的γδ T 细胞对imDC 转分化为OC过程的影响,为γδ T 细胞用于免疫治疗MBD 提供实验依据。
1 材料与方法
1.1 材料 Zol 购自恒瑞公司,重组人M-CSF、重组人RANKL、GM-CSF、IL-4、IL-2 为Peprotech 公司产品,人淋巴细胞分离液购自天津市灏洋生物制品有限责任公司,抗酒石酸酸性磷酸酶TRAP 染色试剂盒、甲苯胺蓝染液购自Sigma 公司,牙本质片购自Immunodiagnostic Systems 公司,抗CD51/61 抗体、抗CD1a、CD3 和γδTCR 抗体购自eBioscience 公司,CD14+、γδ TCR 阳性分选免疫磁珠购自Miltenyi 公司,人TNF-α ELISA 试剂盒购自RayBio 公司。流式细胞仪为美国Beckman Coulter FC-500。
1.2 方法
1.2.1 γδ T 细胞的体外培养和鉴定 采集MM 患者或健康志愿者外周血10 ml,用淋巴细胞分离液分离获取PBMNC,接种于24 孔培养板,细胞密度为(1~2)×106个/ml,在培养当日加入Zol(终浓度为1 μm)和IL-2(终浓度为100 U/ml)或仅加入IL-2(终浓度为100 U/ml),在37℃,5%CO2饱和湿度培养箱中培养,以后每3 d 一次半量换液,并加入含IL-2 100 U/ml 的10 % FBS RPMI1640 新鲜培养液重悬继续培养。收集培养前后细胞,PBS 洗涤2 次,分别加入5 μl 抗CD3-FITC 与γδ TCR-PE 抗体混匀,用抗鼠IgG 单克隆抗体做同型对照;室温避光孵育20 min,加入2 ml PBS 洗涤1 次,重悬于500 μl的PBS,流式细胞仪检测CD3/γδ TCR 表达情况。
1.2.2 imDC 转分化为OC 的体外诱导培养 淋巴细胞分离液分离健康志愿者外周血以获取PBMNC,免疫磁珠分选出CD14 阳性细胞后,接种于24 孔培养板(细胞数为5 ×105个/孔),加入GM-CSF(终浓度为150 ng/ml)和IL-4(终浓度为50 ng/ml),在37℃,5%CO2饱和湿度培养箱培养,以后每2~3 d换液,并加入含上述浓度的细胞因子的新鲜培养液继续培养。于培养第5~6 天收集细胞,用含M-CSF(25 ng/ml)和RANKL(100 ng/ml)的10% FBS α-MEM 培养液培养,以后每2 d 换液,并加入含上述浓度的细胞因子的新鲜培养液继续培养。流式细胞术检测培养前后CD14、CD1a 和CD51/61 的表达情况。
1.2.3 γδ T 细胞体外对imDC 转分化为OC 的影响 收集imDC 细胞,含M-CSF(25 ng/ml)和RANKL(100 ng/ml)的10%FBS α-MEM 培养液调整细胞密度为1 ×105ml-1,置于24 孔培养板内培养,免疫磁珠分选方法分选培养至第7 天的γδ T 细胞,含M-CSF(25 ng/ml)和RANKL(100 ng/ml)的10%FBS α-MEM 培养液调整细胞密度为1 × 106ml-1,置于millicell 小室内,即上室为γδ T 细胞,下室为imDC,二者细胞比为10∶1,于37℃,5%CO2饱和湿度培养箱共培养。设立imDC 单独培养组、γδ T 细胞单独培养组为对照组。于共培养第7 天、14天分别进行TRAP 染色及甲苯胺蓝染色以了解不同培养组OC 生成情况。
1.2.4 细胞因子检测 收集γδ T 细胞-imDC 间接接触共培养组、γδ T 细胞单独培养组及imDC 单独培养组第7 天的培养上清,采用ELISA 检测培养上清中TNF-α 实验按照ELISA 试剂盒操作步骤进行。
1.3 统计学处理 采用SPSS16.0 软件,数据采用±s 表示。采用两独立样本均数t 检验比较健康志愿者与MM 患者外周血γδ T 细胞扩增纯度差异及Zol 联合IL-2 扩增的γδ T 细胞与单用IL-2 扩增的γδ T 细胞纯度差异;其余均采用单向方差分析(One-way ANOVA)。P<0.05 表示差异有统计学意义。
2 结果
2.1 健康志愿者外周血γδ T 细胞体外扩增 3 名健康志愿者来源PBMNC 分别经Zol 联合IL-2、单用IL-2 刺激诱导γδ T 细胞生成,流式细胞仪检测培养第7 天细胞CD3 和γδ TCR 表达,CD3+γδ TCR+的细胞百分比分别为69.33% ±16.84%和29.50% ±5.8%(P<0.05)(图1)。
2.2 MM 患者与健康志愿者外周血γδ T 细胞体外扩增
2.2.1 倒置相差显微镜观察细胞培养过程形态变化 PBMNC 加入Zol 和IL-2 培养第1 天,细胞为非贴壁生长,可见细胞分散分布,少部分细胞聚集成团状;随着培养时间的延长,细胞团状生长数目增多,团块增大,单个散在生长的细胞观察可见较为明显的细胞突起,MM 患者与健康志愿者来源的PBMNC体外诱导细胞形态相仿(图2)。
2.2.2 MM 患者与健康志愿者γδ T 细胞体外扩增纯度鉴定 3 例MM 患者和3 名健康志愿者来源的PBMNC 经Zol 和IL-2 刺激诱导γδ T 细胞生成,流式细胞仪检测培养第7 天细胞CD3 和γδ TCR 表达,CD3+γδ TCR+的细胞百分比分别为68.87% ±20.94%和69.33% ±16.84%,两组无统计学差异(P >0.05)(图3)。
2.3 imDC 转分化为OC 的体外诱导培养
2.3.1 倒置相差显微镜观察imDC 转分化为OC 体外诱导培养过程细胞形态变化 接种24 h 后贴壁的PBMNC 大小均匀一致,呈圆形,部分呈单个分散分布,部分聚集成团;培养3 d 时以单核细胞数量居多,胞体增大,形态多为圆形或椭圆形,可见梭状突起;于第6 天诱导imDC 转分化为OC 过程中,细胞可随着诱导培养时间的延长,呈类圆形、梭形、漏斗形或不规则形的细胞增多,胞体逐渐增大,部分细胞含多个细胞核,胞质可见大小不等的空泡,部分细胞可见伪足样结构(图4)。
2.3.2 流式细胞仪检测诱导PBMNC 分化为OC 过程CD14、CD1a 及CD51/61 表达情况 流式结果显示新分离的PBMNC可表达CD14,经免疫磁珠分选可获得较高纯度的CD14+细胞,PBMNC 低表达或不表达CD1a;经GM-CSF 及IL-4 细胞因子作用培养6 d 后,相比于诱导前,CD14 表达量降低,而CD1a表达量增高;imDC 诱导为OC 前可低表达CD51/61,经诱导转化为OC 细胞后表达CD51/61 量增多(图5)。
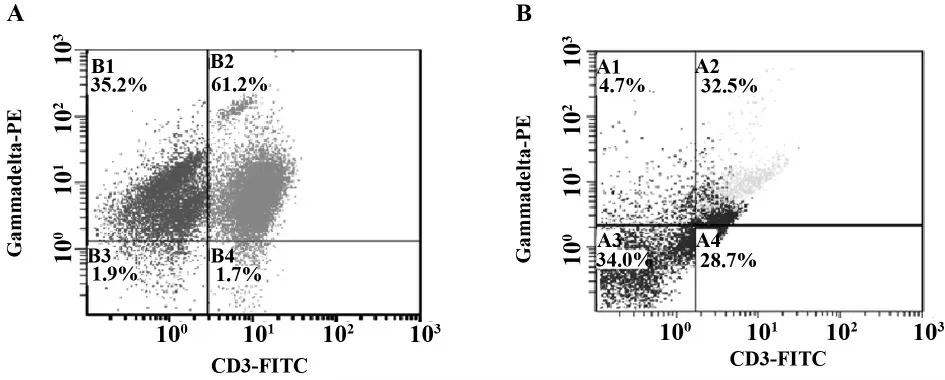
图1 不同方法γδ T 细胞培养后γδ T 细胞的阳性率比较Fig.1 γδ T positive cells with different stimulator

图2 倒置相差显微镜观察MM 患者与健康志愿者γδ T细胞体外培养过程形态变化Fig.2 Photomicrographs of γδ T cells from MM and healthy volunteers during culture period
2.4 γδ T 细胞-imDC 间接共培养条件下γδ T 细胞对imDC 转分化为OC 过程的影响
2.4.1 倒置显微镜下不同培养组细胞形态变化 γδ T 细胞-imDC 间接接触共培养第1 天,共培养组较imDC 单独培养组细胞突起较少,未见γδ T 细胞单独培养组中的细胞集落,且随着培养时间的延长,差距越明显;至培养第7 天,镜下可见共培养组部分细胞体积较大,少部分可见细胞突起,相较于imDC单独培养组少,而γδ T 细胞培养组可见细胞成集落状生长(图6)。
2.4.2 TRAP 染色结果和不同培养组TRAP +多核细胞数目差异 取培养至第14 天的细胞爬片进行TRAP 染色,细胞核≥3 个为OC,低倍镜下计数10个视野OC 数目,取每一视野平均细胞数,每组实验重复3 次,比较Zol 和IL-2 联合刺激培养的γδ T 细胞-imDC 间接接触共培养组与IL-2 单独刺激培养的γδ T 细胞-imDC 间接接触共培养组和imDC 单独培养组OC 数目差异,分别为5.67 ±0.58 个、17.00 ±2.00 个和28.33 ±2.08 个,各组间差异均具有统计学意义(P<0.001)(图7)。IL-2 组体外扩增的γδ T 细胞对imDC 转分化过程的抑制作用较Zol 和IL-2 联合刺激组弱。
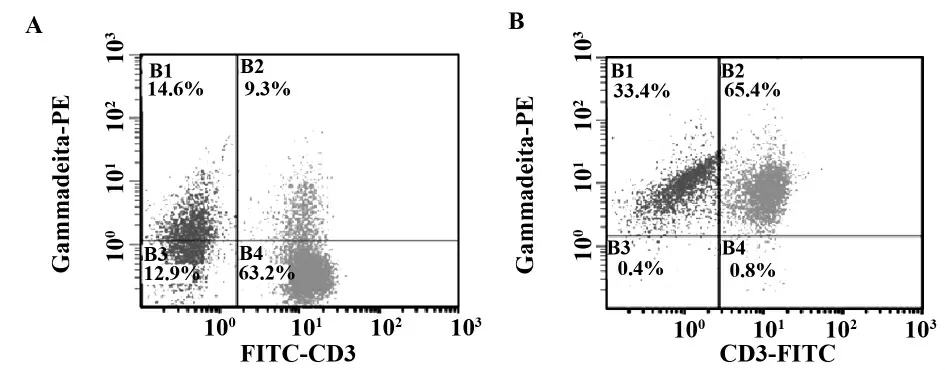
图3 γδ T 细胞培养前后γδ T 细胞的阳性率Fig.3 γδ T positive cells before(A)and after culture(B)

图4 倒置显微镜下imDC 转分化为OC 过程的细胞形态变化(×400)Fig.4 Photomicrographs of imDC during differentiating into OC(×400)
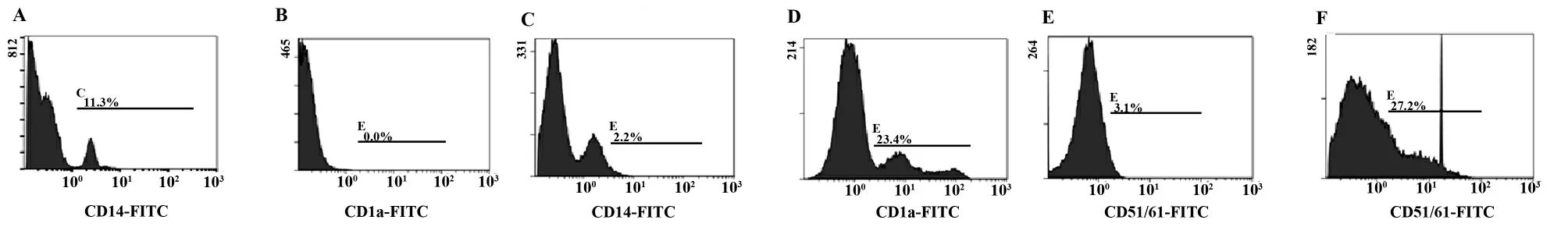
图5 流式细胞术检测培养过程CD14、CD1a 及CD51/61 的表达Fig.5 CD14,CD1a and CD51/61 expression of cultured cells measured in flow cytometry
2.4.3 不同培养组OC 骨吸收作用 取培养至第21 天的牙本质片,甲苯胺蓝染色结果显示γδ T 细胞-imDC 间接接触共培养体系未见着色或仅少量着色部位,imDC 单独培养组可见多处形状不规则着色部位。采用Image J 图像分析软件计算γδ T 细胞-imDC 间接接触共培养和imDC 单独培养组牙本质片骨吸收面积百分比,每组实验重复3 次,分别为4.97% ±4.3%和28.47% ±12.8%,差异具有统计学意义(P<0.05)(见图8)。

图6 倒置显微镜下各培养组细胞形态变化Fig.6 Photomicrographs of cells of different groups

图7 不同培养组TRAP 染色结果Fig.7 Tartrate resistant acid phosphatase staining of different groups

图8 培养至第21 天牙本质片甲苯胺蓝染色Fig.8 Dentin toluidine blue staining on d21
2.5 ELISA 方法检测不同培养组培养上清中TNFα 的差异 结果显示在γδ T 细胞存在的培养条件下,TNF-α 水平较高,γδ T 细胞-imDC 间接接触共培养TNF-α 浓度较γδ T 细胞单独培养组高,P<0.001[分别为(68.61 ±3.11)pg/ml 和(36.61 ±2.03)pg/ml],较imDC 单独培养组高,P<0.001[分别为(68.61 ± 3.11)pg/ml 和(50.30 ± 4.04)pg/ml],γδ T 细胞单独培养组TNF-α 浓度较imDC 单独培养组低,P<0.001[分别为(36.61 ±2.03)pg/ml 和(50.30 ±4.04)pg/ml],差异具有统计学意义。
3 讨论
MM 为血液系统常见恶性肿瘤,溶骨性骨破坏为其标志性特征之一,区别于血液系统其他肿瘤类别,临床上多表现为溶骨性改变,严重影响MM 患者的预后及生存质量[6]。MBD 的相关发病机制复杂,研究认为OC 与MM 细胞相互作用形成骨破坏和肿瘤的进展、恶化的恶性循环对MM 患者发生溶骨性改变起关键作用[7]。不仅MM 细胞及其周边细胞包括骨髓基质细胞可分泌OC 活化因子促进OC 的形成与活化,而且OC 与MM 瘤细胞相互作用可抑制肿瘤细胞自身凋亡并促进瘤细胞增长。本实验组成员前期研究证实OC 活性增强和成骨细胞发育障碍共同参与MBD 的发生[8,9]。可见,OC 在MBD 的发生发展过程中发挥重要作用,研究抑制OC 的生成与活化成为目前治疗MBD 的焦点。
传统认为,OC 来源于单核/巨噬细胞系统,最近研究发现imDC 在RANKL 及M-CSF 的诱导下可转分化为具有骨吸收功能的OC,且该途径较单核-巨噬细胞来源途径更有效[2]。本实验室前期研究采用外周血单个核细胞在GM-CSF 及IL-4 作用下诱导生成imDC,继而在M-CSF 与RANKL 作用下转分化为OC。本实验过程中,以TRAP 染色及骨吸收作用鉴定生成的OC 活性,结果证实imDC 在M-CSF与RANKL 作用下可转分化为TRAP 染色阳性的多核OC,并具有骨吸收作用,流式细胞术结果亦显示诱导生成的细胞表达OC 特异性表面抗原物质CD51/61。本实验证实在体外条件下,imDC 可转分化为具有骨吸收作用的多核OC。因此推测,imDC可能是MM 患者OC 重要来源,参与促进MM 患者MBD 的发生,如何阻断这一途径在防治MBD 方面有重要意义。
二膦酸盐可抑制OC 相关性溶骨性改变,临床研究证实Zol 及帕米膦酸盐等二膦酸盐的应用可明显减少骨骼相关性事件的发生,是目前MBD 标准治疗的主要药物[10,11]。新近的研究发现二膦酸盐有更广泛的作用,如Zol 和帕米膦酸盐可诱导MM 瘤细胞凋亡,在骨髓微环境下抑制MM 瘤细胞生长并通过免疫调节功能发挥抗肿瘤作用[12]。同时,在体外条件下,Zol 可促进成骨细胞增殖,可能在MM 患者骨破坏成骨细胞活性恢复方面发挥作用[13]。此外,Zol 还能在体内外激活γδ T 细胞,后者是否参与MBD 的发生是本文作者关注的方向。
γδ T 细胞为一类表达γδ TCR 的特殊免疫T 淋巴细胞,具有抗原特异性识别而无MHC 限制性,不仅具有固有免疫作用、发挥抗原提呈细胞的功能并可执行适应性免疫功能,已被证实可在体内外抑制多种肿瘤的生长,是目前肿瘤细胞免疫治疗的新热点[14]。Vγ9Vδ2 T 细胞为细胞表面表达γδ TCR 的一类特殊T 细胞亚群,是γδ T 细胞的主要亚群。Vγ9Vδ2 T 细胞识别非多肽抗原、天然磷酸抗原或者甲羟戊酸(MVA)代谢途径中间产物异戊烯焦磷酸抗原(IPP)可大量激活扩增Vγ9Vδ2 T 细胞,在体内外发挥抗肿瘤作用。
国内外研究证实,外周血来源、骨髓来源或脐血来源的单个核细胞在体外条件下可扩增获得较高纯度的Vγ9Vδ2 T 细胞[15]。由于外周血来源较为简便,更易获得,据报道,体外条件下,γδ T 细胞经刺激后可扩增100 倍,足以应用于MM 患者临床免疫治疗。本实验采用Zol 与重组人IL-2 体外激活扩增PBMNC 中的γδ T 细胞。实验结果显示,Zol 和IL-2联合作用可选择性扩增外周血来源PBMNC 中的γδ T 细胞。实验中,所选择的3 例MM 患者治疗上均未达缓解,在入院化疗前尚未使用Zol,在体外培养条件下,外周血中的γδ T 细胞可经Zol 和IL-2 激活扩增,并获得较高纯度,且与健康志愿者相比较二者扩增后获得的纯度无统计学差异,本文的结果与Burjanadzé 等[16]报告大致相仿。
新近研究发现,Vγ9Vδ2 T 细胞不仅可抑制OC活性,还可抑制其产生,破坏MM-OC 恶性循环过程,从而阻止MM 进展,在一定程度上降低MBD 事件。Cui 等[17]报道,经Zol 及IL-2 体外激活扩增的Vγ9Vδ2 T 细胞对MM 骨髓微环境下的OC 有杀伤作用。实验过程中,扩增后的Vγ9Vδ2 T 细胞与同一志愿者PBMNC 诱导生成的贴壁生长OC 按照不同的效靶比共培养12 h 后,贴壁生长的OC 可发生溶解,细胞数量明显减少。
本研究中采用millicell 共培养技术,建立γδ T细胞-imDC 间接接触共培养体系,研究在体外条件下γδ T 细胞对其下室中imDC 转分化为OC 过程的影响。实验结果显示Zol 和IL-2 联合刺激扩增的γδ T 细胞及IL-2 单独刺激扩增的γδ T 细胞均可抑制imDC 转分化为OC,前者更甚。
我们认为在γδ T 细胞存在的条件下,imDC 转分化为OC 过程受到限制。至于γδ T 细胞如何影响imDC 转分化为OC,目前还不清楚。有报道激活的γδ T 细胞可分泌TNF-α 和IFN-γ,促进imDC 成熟[18],我们推测可能在共培养过程γδ T 细胞促进imDC 成熟而减少其向OC 转分化。
TNF-α 主要有巨噬细胞产生,参与类风湿性关节炎、强直性脊柱炎及骨关节炎等多种风湿性疾病活动[19-21],相关研究认为其可促进破骨细胞分化成熟,参与骨破坏过程[22]。本实验过程中γδ T 细胞-imDC 间接接触共培养组较γδ T 细胞单独培养组分泌的TNF-α 水平高,且差异具有统计学意义,表明在共培养过程中imDC 可能增加γδ T 细胞TNF-α的分泌;共培养组较imDC 单独培养组高,差异具有统计学意义,因此,在imDC 转分化过程中是否可能增加细胞TNF-α 的分泌需进一步求证。综上所述,体外激活的γδ T 细胞可抑制imDC 转分化为OC,但其作用机制仍需进一步探讨。
4 结论
本实验观察了激活的γδ T 细胞在体外培养条件下对imDC 转分化为OC 的影响。研究发现:(1)MM 患者和健康志愿者来源的PBMNC 在Zol 和IL-2 作用下,选择性扩增γδ T 细胞;(2)imDC 在RANKL 和M-CSF 存在条件下可转分化为具有骨吸收作用的OC;(3)在γδ T 细胞存在的条件下,imDC转分化为OC 过程受限。综上所述,γδ T 细胞具有抑制imDC 转分化为OC 的作用,有望成为MBD 治疗的新手段,但其机制仍需进一步研究。
[1]Raab MS,Podar K,Breitkreutz I,et al.Multiple myeloma[J].Lancet,2009,374(9686):324-339.
[2]Zeng Z,Zhang C,Chen J.Lentivirus-mediated RNA interference of DC-STAMP expression inhibits the fusion and resorptive activity of human osteoclasts[J].J Bone Miner Metab,2013,31 (4):409-416.
[3]Tucci M,Stucci S,Savonarola A,et al.Immature dendritic cells in multiple myeloma are prone to osteoclast-like differentiation through interleukin-17A stimulation[J].Br J Haematol,2013,161(6):821-831.
[4]Champagne E.gammadelta T cell receptor ligands and modes of antigen recognition[J].Arch Immunol Ther Exp(Warsz),2011,59(2):117-137.
[5]Meraviglia S,Caccamo N,Salerno A,et al.Partial and ineffective activation of Vgamma9Vdelta2 T cells by Mycobacterium tuberculosis-infected dendritic cells[J].J Immunol,2010,185 (3):1770-1776.
[6]Terpos E,Dimopoulos MA,Berenson J.Established role of bisphosphonate therapy for prevention of skeletal complications from myeloma bone disease[J].Crit Rev Oncol Hematol,2011,77 Suppl 1:S13-S23.
[7]Roodman GD.Pathogenesis of myeloma bone disease[J].J Cell Biochem,2010,109(2):283-291.
[8]郑晓强,陈君敏.骨髓瘤细胞抑制成骨细胞活性和Runx2 表达[J].中国老年学杂志,2011,31(18):3524-3526.
[9]郑晓强,陈君敏.多发性骨髓瘤成骨细胞活性和Runx2 的表达[J].中国老年学杂志,2011,31(22):4366-4368.
[10]Ciolli S.Effects on bone metabolism of new therapeutic strategies with standard chemotherapy and biologic drugs[J].Clin Cases Miner Bone Metab,2013,10(3):183-186.
[11]Kyle RA,Yee GC,Somerfield MR,et al.American Society of Clinical Oncology 2007 clinical practice guideline update on the role of bisphosphonates in multiple myeloma[J].J Clin Oncol,2007,25(17):2464-2472.
[12]Terpos E.Bisphosphonate anticancer activity in multiple myeloma[J].Anticancer Agents Med Chem,2012,12(2):123-128.
[13]肖萍萍,陈君敏,叶德富,等.唑来膦酸对多发性骨髓瘤成骨细胞增殖及其RANKL/OPG 表达的影响[J].中国药理学通报,2011,27(10):1392-1396.
[14]Kabelitz D,He W.The multifunctionality of human Vgamma9 Vdelta2 gammadelta T cells:clonal plasticity or distinct subsets?[J].Scand J Immunol,2012,76(3):213-222.
[15]Noguchi A,Kaneko T,Kamigaki T,et al.Zoledronate-activated Vγ9γδ T cell-based immunotherapy is feasible and restores the impairment of γδ T cells in patients with solid tumors[J].Cytotherapy,2011,13(1):92-97.
[16]Burjanadzé M,Condomines M,Reme T,et al.In vitro expansion of gamma delta T cells with anti-myeloma cell activity by Phosphostim and IL-2 in patients with multiple myeloma[J].Br J Haematol,2007,139(2):206-216.
[17]Cui Q,Shibata,Oda A,et al.Targeting myeloma-osteoclast interaction with Vgamma9Vdelta2 T cells[J].Int J Hematol,2011,94:63-70.
[18]Saito A,Narita M,et al.Enhancement of anti-tumor cytotoxicity of expanded gammadelta T Cells by stimulation with monocyte-derived dendritic cells[J].J Clin Exp Hematop,2007,47(2):61-72.
[19]Parameswaran N,Patial S.Tumor necrosis factor-alpha signaling in macrophages[J].Crit Rev Eukaryot Gene Expr,2010,20(2):87-103.
[20]Braun J,Baraliakos X,Heldmann F,et al.Tumor necrosis factor alpha antagonists in the treatment of axial spondyloarthritis[J].Expert Opin Investig Drugs,2014,23(5):647-659.
[21]Sun R,Zhang B,Chen L,et al.Role of nuclear factor of activated T cells 1 in the pathogenesis of osteoarthritis[J].Exp Ther Med,2014,7(1):195-198.
[22]Kitaura H,Kimura K,Ishida M,et al.Immunological reaction in TNF-α-mediated osteoclast formation and bone resorption in vitro and in vivo[J].Clin Dev Immunol,2013,2013:181849.

