小肠细菌过度生长与肠易激综合征的关系
崔立红,王晓辉,闫志辉,李 超,贺 星,弓三东
海军总医院 消化内科,北京,100048
小肠细菌过度生长与肠易激综合征的关系
崔立红,王晓辉,闫志辉,李 超,贺 星,弓三东
海军总医院 消化内科,北京,100048
目的探讨小肠细菌过度生长与肠易激综合征的关系,为肠易激综合征的发病和治疗寻找新思路。方法选择2013年1月- 2015年1月在我院就诊的120例肠易激综合征(irritable bowel syndrome,IBS)患者作为观察组,选取同期我院体检中心60例健康查体者作为对照组。两组均行乳糖甲烷-氢呼吸试验检查、炎性细胞因子检测及完善IBS症状积分调查问卷。小肠细菌过度生长(small intestinal bacterial overgrowth,SIBO)阳性的IBS患者接受利福昔明治疗2周后复查甲烷-氢呼吸试验,根据氢呼吸试验结果将SIBO阳性的IBS患者分为转阴组和未转阴组,观察IBS的治疗有效率。结果观察组与对照组SIBO阳性率(68.33% vs 18.33%)存在统计学差异(P<0.05);利福昔明治疗SIBO的转阴率为70.73%;转阴组(症状积分:3.96±1.42 vs 12.45±3.78,IL-6:97.32±13.83 vs 158.84±15.51,TNF-α:29.67±6.19 vs 42.67±7.65)及未转阴组(症状积分:7.89±2.37 vs 12.39±3.69,IL-6:126.79±14.29 vs 156.43±15.49,TNF-α:35.12±6.67 vs 43.27±7.64)治疗后IBS症状积分及炎性细胞因子均明显低于治疗前(P<0.05);转阴组治疗后IBS治疗有效率(82.75% vs 62.50%)、IBS症状积分(3.96±1.42 vs 7.89±2.37)及炎性细胞因子(IL-6:97.32±13.83 vs 126.79±14.29,TNF-α:29.67±6.19 vs 35.12±6.67)均优于未转阴组(P<0.05)。结论SIBO在IBS患者中有较高的发病率,治疗SIBO可以改善IBS患者的临床症状。
肠易激综合征;小肠细菌过度生长;利福昔明;甲烷-氢呼吸试验
肠易激综合征(irritable bowel syndrome,IBS)是临床上常见的慢性肠道疾病,主要表现为腹痛、腹胀伴粪便性状和(或)排便习惯改变,但缺乏肠道形态学改变[1]。在西方发达国家该疾病的患病率高于我国,总患病率为5% ~ 11%[2]。该疾病发病机制尚不明确,治疗尚无有效方法[3]。小肠细菌过度生长(small intestinal bacterial overgrowth,SIBO)主要指小肠内菌群种类发生变化和(或)数量出现增多,而出现腹胀、腹泻、营养不良、吸收不良等症状[4]。其病因及治疗相对明确,且症状与IBS相似,已有研究报道两者之间的关联性[5]。故本研究拟通过甲烷-氢呼吸试验观察IBS与SIBO之间的关系,并治疗SIBO,观察IBS症状的改善,旨在为IBS的发病和治疗寻找新的思路。
对象和方法
1 研究对象 2013年1月- 2015年1月海军总医院消化内科门诊及住院就诊的符合罗马Ⅲ诊断标准[6]的IBS患者120例作为观察组,其中男性56例,女性64例,年龄(44.5±13.2)岁;选取同期我院体检中心行健康查体60例健康志愿者作为对照组,其中男性29例,女性31例,年龄(43.9±12.9)岁。两组年龄、性别差异无统计学意义(P>0.05)。所有病人均已接受血、尿、粪常规、血生化、肝病毒指标、心电图、胸部X线片、腹部彩超、胃肠镜或消化道造影检查,排除器质性改变。所有受试者均知情同意并签署同意书,本研究经医院伦理委员会审查通过。
2 排除标准 1)近2周曾使用通便或影响胃肠动力药物者;2)近2周曾使用抗生素或者抗精神病类药物者;3)近2周内有行结肠气钡造影、结肠镜检查或接受灌肠术者;4)利福昔明或利福霉素类药物过敏者;5)儿童、妊娠或哺乳期妇女;6)依从性差、无法配合检查者。
3 呼吸试验检测方法 采用美国QUINTRON公司生产的甲烷-氢气呼出气体分析仪(BreathTracker)。正确记录被检者基础呼气氢浓度后,嘱被检查者口服10 g乳糖。每隔15 min记录1次氢气浓度,直至180 min,共得出13组数据,根据上述数据绘制出折线图。SIBO阳性判定标准:1)基础H2浓度>20 ppm,或者出现典型的小肠峰、盲肠峰或二者融合成“高平台”现象;2)口服乳果糖后出现小肠峰且呼气中H2浓度升高≥12 ppm;3)空腹时呼气中氢气(H2)浓度>20 ppm,且服用乳果糖后继续升高>12 ppm;4)进食乳果糖后出现双峰图形,第1峰出现在餐后90 min内,升高幅度≥20 ppm。
4 治疗及分组 根据甲烷-氢呼吸试验结果,给予SIBO阳性的IBS患者利福昔明片(0.2 g意大利阿尔法韦士曼制药公司)治疗(400 mg,3/d,14 d)。疗程结束后,复查甲烷-氢呼吸试验,根据氢呼吸试验结果将SIBO阳性的IBS患者分为转阴组和未转阴组,再次检测两组患者的炎性细胞因子、收集IBS症状积分。
5 观察指标 1)IBS相关症状积分[1,6]。治疗以前及治疗期间,要求患者每天记录腹痛时间、腹胀时间、排便时有无腹胀腹痛、排便次数异常比例、粪便性状异常比例、黏液便比例及里急后重比例。按照表1的评分准则,计算各症状的积分总和,每周统计1次。2)采用ELISA法进行检测血清TNF-α、IL-6。3)IBS疗效标准[8]:显效:腹痛、腹胀等临床症状完全消失,排便0 ~ 2次/d,成形软便且无黏液;有效:部分上述症状消失或半数以上症状好转;无效:治疗之后各项症状均无好转;总有效率=显效率+有效率。
6 统计学处理 采用SPSS19.0软件进行统计分析,计量资料采用表示,组间及治疗前后数据比较采用t检验;计数资料采用例数(n)和率(%)表示,组间及治疗前后的比较使用χ2检验,P<0.05为差异有统计学意义。

表1 IBS相关症状积分表(分)Tab. 1 Scoring for the symptoms of patients with IBS (score)
结 果
1 观察组和对照组SIBO阳性率比较 观察组120例中,SIBO阳性82例,阳性率68.33%;对照组60例受试者中,SIBO阳性11例,阳性率18.33%。两组SIBO阳性率差异有统计学意义(χ2=40.044,P<0.001)。见表2。
2 观察组SIBO阳性转阴率 治疗后,82例SIBO阳性患者再次行呼气试验后,转阴58例,未转阴24例,转阴率70.73%。
3 转阴组和未转阴组治疗有效率比较 转阴组显效22例,有效26例,无效10例,治疗总有效率为82.75%;未转阴组显效9例,有效6例,无效9例,治疗总有效率为62.50%,两组差异有统计学意义(χ2=23.914,P<0.05)。
4 转阴组和未转阴组外周血炎症因子水平比较
转阴组与未转阴组治疗前IL-6、TNF-α水平明显高于对照组(P<0.05),但两组间差异无统计学意义(P>0.05);转阴组与未转阴组治疗后IL-6、TNF-α水平较本组治疗前均明显降低,差异存在统计学意义(P<0.05),但仍高于对照组(P<0.05),转阴组较未转阴组下降更加显著(P<0.05)。见表2。
5 转阴组与未转阴组治疗后症状积分比较 治疗前转阴组症状积分与未转阴组差异无统计学意义(t=0.07,P>0.05),但均高于对照组(t=17.98,16.97,P<0.05);治疗后转阴组与未转阴组症状积分明显低于本组治疗前(t=16.01,5.03,P<0.05),且转阴组症状治疗后积分明显低于未转阴组(t=9.27,P<0.05)。见表2。
表2 转阴组和未转阴组IBS患者干预前后外周血炎性因子及症状积分比较Tab. 2 Comparison of serum inflammatory cytokines and symptom score between turning-negative IBS and not turning-negative IBS ()
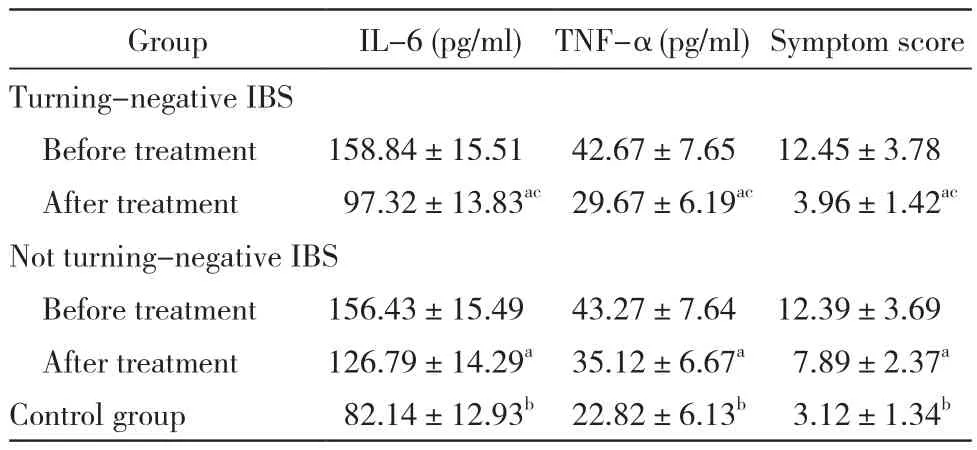
表2 转阴组和未转阴组IBS患者干预前后外周血炎性因子及症状积分比较Tab. 2 Comparison of serum inflammatory cytokines and symptom score between turning-negative IBS and not turning-negative IBS ()
aP<0.05, vs before treatment;bP<0.05, vs turning-negative IBS after treatment, not turning-negative IBS after treatment;cP<0.05, vs not turningnegative IBS after treatment
GroupIL-6 (pg/ml)TNF-α (pg/ml)Symptom score Turning-negative IBS Before treatment158.84±15.5142.67±7.6512.45±3.78 After treatment97.32±13.83ac29.67±6.19ac3.96±1.42acNot turning-negative IBS Before treatment156.43±15.4943.27±7.6412.39±3.69 After treatment126.79±14.29a35.12±6.67a7.89±2.37aControl group82.14±12.93b22.82±6.13b3.12±1.34b
讨 论
肠易激综合征是一种发病率逐年增高的功能性胃肠疾病,社会环境、遗传、饮食、肠道低度炎症、肠道菌群以及脑-肠轴等多因素均参与其发病[9]。但具体发病机制及相互关系尚不清楚,因此目前对于IBS的研究主要集中在病因及机制方面。由于相关报道及本课题组前期研究均支持肠道菌群在IBS发病中的重要作用,故本研究从肠道菌群的角度着手,使用相对简单、安全、无创的甲烷-氢呼吸方法,对IBS与SIBO之间的关系进行研究,结果发现SIBO与IBS之间存在关联,治疗SIBO可以改善IBS患者的症状及炎性因子,提示SIBO可能在IBS的发病中发挥重要作用。
SIBO是指上消化道内的细菌数量>105CFU/ ml。以往通常认为SIBO与肠道解剖结构异常有关,如空肠横向吻合术、肠道狭窄、肠瘘、肠道动力减退及防御功能减弱等[10]。但近期研究发现,SIBO也可出现在无明显肠道解剖异常的患者中。SIBO与IBS的症状相似,对两者关系的研究引起了学术界的重视。与IBS不同的是,SIBO的诊断方法较多,如细菌培养、呼吸试验、尿蓝母测定等,目前使用较多的是氢呼吸试验。但是,不同方法报道IBS患者中SIBO的阳性率差异较大。有报道采用小肠液细菌培养法获得IBS患者中SIBO阳性率为4%,与正常人相近[11]。Park等[12]使用乳糖氢呼吸的方法得出IBS患者中SIBO的阳性率为44.7%,但同样方法也有测得IBS患者中SIBO阳性率高达84%[13]。差异较大的原因考虑与种族、地域、氢呼吸试验的灵敏度和特异性较低有关,因此需要多中心的临床研究对该数据进行补充和完善。本研究使用的甲烷-氢呼吸仪器在普通氢呼吸的基础上,通过甲烷(CH4)及二氧化碳(CO2)对结果进行校正,排除相关干扰因素,能够提高诊断的准确性。研究结果显示,IBS患者中SIBO的阳性率为68.33%,健康对照组中SIBO的阳性率仅为18.33%,支持SIBO在IBS中有较高发病率的结论。
肠道菌群在多种肠道功能的调节方面发挥重要作用。小肠内的细菌数量和种类发生变化(SIBO)会影响小肠的各种功能和作用,产生IBS样症状:1)SIBO患者肠道内细菌会发酵产生过量的CO2,部分患者还会产生CH4,上述气体过度蓄积会导致腹胀,严重者会出现腹痛、腹部不适及便秘[14-16]。2)SIBO会对肠道黏膜的免疫激活产生影响,异常肠道菌群产生的有毒物质(包括氨、D-乳酸、内源性细菌肽聚糖),作用于黏膜内的免疫细胞,通过炎性细胞因子放大免疫反应信号、干扰肠道的分泌和运动功能[17-18]。3)SIBO能破坏IBS患者的肠黏膜屏障,使肠道的通透性增加,导致腹泻。有研究通过小肠黏膜活检发现,SIBO患者的肠道黏膜及隐窝变薄,淋巴细胞增多[10]。4)SIBO还可以产生化学物质,如甲酰甲硫氨酰-亮氨酰-苯丙氨酸,其作用于肠神经系统,通过脑-肠轴影响IBS患者的情绪,进一步加重IBS症状[19]。
为了进一步明确IBS与SIBO之间的关系,本研究使用利福昔明[20]对IBS患者中SIBO阳性者进行治疗。作为利福霉素类衍生物,利福昔明具有抗菌谱广、不良反应小、口服不吸收等特点,是目前治疗SIBO的主要药物。结果发现,经利福昔明治疗后SIBO转阴率为70.73%,与相关报道结果相符。SIBO转阴患者的IBS症状积分明显低于未转阴组,提示SIBO异常产生的大量气体可能是导致IBS症状的原因之一,并进一步明确了SIBO在IBS中的作用。研究同时发现,SIBO转阴组在炎性因子改善方面效果明显,提示SIBO可能通过干扰肠道的免疫反应影响炎性因子,产生IBS症状。另外,本研究在对转阴组与未转阴组的症状积分及炎性细胞因子进行比较时发现,经利福昔明治疗后,无论SIBO是否转阴,IBS患者的症状积分及炎性因子较治疗前均有改善,也提示能够使SIBO转阴的药物在IBS的治疗中起到重要作用。本研究存在的不足在于并没有对IBS患者的肠道标本进行取样,因此无法对于SIBO影响肠道黏膜屏障方面的作用进行观察,同时没有对5-羟色胺进行研究,无法对SIBO在脑-肠轴方面的影响进行研究。
综上,本研究发现SIBO在IBS的发病中起到重要作用,治疗SIBO可以改善IBS患者的症状。本研究的结论为IBS的发病和治疗提供了新思路。
1 Abbas Z, Yakoob J, Jafri W, et al. Cytokine and clinical response to Saccharomyces boulardii therapy in diarrhea-dominant irritable bowel syndrome: a randomized trial[J]. Eur J Gastroenterol Hepatol,2014, 26(6): 630-639.
2 Didari T, Mozaffari S, Nikfar S, et al. Effectiveness of probiotics in irritable bowel syndrome: Updated systematic review with metaanalysis[J]. World J Gastroenterol, 2015, 21(10): 3072-3084.
3 Pineton De Chambrun G, Neut C, Chau A, et al. A randomized clinical trial of Saccharomyces cerevisiae versus placebo in the irritable bowel syndrome[J]. Dig Liver Dis, 2015, 47(2): 119-124.
4 Bures J, Cyrany J, Kohoutova D, et al. Small intestinal bacterial overgrowth syndrome[J]. Gastroenterology, 1981, 80(4): 834-845.
5 陈雅菲,范钟麟,王学红.小肠细菌过度生长在肠易激综合征中的研究进展[J].胃肠病学,2010,15(5):309-311.
6 贺星.肠易激综合征与小肠细菌过度生长关系的临床研究[D].合肥:安徽医科大学,2014.
7 姚欣,杨云生,赵卡冰,等.罗马Ⅲ标准研究肠易激综合征临床特点及亚型[J].世界华人消化杂志,2008,16(5):563-566.
8 郑秀丽,聂淑英,马圆圆,等.易激胶囊对腹泻型肠易激综合征患者白细胞介素-1β、白细胞介素-13的影响[J].河北中医,2013,35(3):342-344.
9 El-Salhy M. Irritable bowel syndrome: Diagnosis and pathogenesis[J]. World J Gastroenterol, 2012, 18(37): 5151-5163.
10 Ghoshal UC, Srivastava D. Irritable bowel syndrome and small intestinal bacterial overgrowth: meaningful association or unnecessary hype[J]. World J Gastroenterol, 2014, 20(10): 2482-2491.
11 Rana SV, Malik A. Breath tests and irritable bowel syndrome[J]. World J Gastroenterol, 2014, 20(24): 7587-7601.
12 Park JS, Yu JH, Lim HC, et al. Usefulness of lactulose breath test for the prediction of small intestinal bacterial overgrowth in irritable bowel syndrome[J]. Korean J Gastroenterol, 2010, 56(4): 242-248.
13 Boltin D, Perets TT, Shporn E, et al. Rifaximin for small intestinal bacterial overgrowth in patients without irritable bowel syndrome[J]. Ann Clin Microbiol Antimicrob, 2014, 13(1): 49.
14 Simrén M, Stotzer PO. Use and abuse of Hydrogen breath tests[J]. Gut, 2006, 55(3): 297-303.
15 Gasbarrini A, Lauritano EC, Gabrielli M, et al. Small intestinal bacterial overgrowth: diagnosis and treatment[J]. Dig Dis, 2007,25(3): 237-240.
16 Ghoshal UC, Srivastava D, Verma A, et al. Slow Transit constipation associated with excess methane production and its improvement following rifaximin therapy: a case report[J]. J Neurogastroenterol Motil, 2011, 17(2): 185-188.
17 曹艳菊.益生菌对实验性结肠炎大鼠肠黏膜TLR2、TLR4表达及NF-κB活性的影响[J].胃肠病学和肝病学杂志,2012,21(8):760-763.
18 Loh G, Blaut M. Role of commensal gut bacteria in inflammatory bowel diseases[J]. Gut Microbes, 2012, 3(6): 544-555.
19 Barbara G, Stanghellini V, Brandi G, et al. Interactions between commensal bacteria and gut sensorimotor function in health and disease[J]. Am J Gastroenterol, 2005, 100(11): 2560-2568.
20 Chedid V, Dhalla S, Clarke JO, et al. Herbal therapy is equivalent to rifaximin for the treatment of small intestinal bacterial overgrowth[J]. Glob Adv Health Med, 2014, 3(3): 16-24.
Relationship between irritable bowel syndrome and small intestinal bacterial overgrowth
CUI Lihong, WANG Xiaohui, YAN Zhihui, LI Chao, HE Xing, GONG Sandong
Department of Gastroenterology, Navy General Hospital, Beijing 100048, China
ObjectiveTo investigate the relationship between small intestinal bacterial overgrowth (SIBO) and irritable bowel syndrome (IBS) and look for new ideas for the pathogenesis and treatment of irritable bowel syndrome.MethodsFrom January 2013 to January 2015, 120 IBS patients in our hospital were chosen as observation group, 60 healthy volunteers in physical examination center in our hospital at the same period were selected as control group. Patients in two groups underwent lactose methane-hydrogen breath test, inflammatory cytokines detection and IBS symptoms integral questionnaire. IBS patients with SIBO positive were treated for 2 weeks by rifaximin capsule, then they received methane-hydrogen breath test. IBS patients with SIBO positive were divided into SIBO turning-negative group and not turning- negative group according to theResultsof hydrogen breath test and the treatment efficacy were observed.ResultsThe SIBO positive rate between observation group and control group (68.33% vs 18.33 %) had statistical differences (P<0.005); The turning-negative rate of rifaximin capsule was 70.73%; After treatment, IBS symptoms score and inflammatory cytokines in both SIBO turning-negative group (symptoms score: 3.96±1.42 vs 12.45±3.78; IL-6: 97.32± 13.83 vs 158.84±15.51; TNF-α: 29.67±6.19 vs 42.67±7.65) and not turning- negative group (symptoms score: 7.89±2.37 vs 12.39±3.69; IL-6: 126.79±14.29 vs 156.43±15.49; TNF-α: 35.12±6.67 vs 43.27±7.64) were significantly lower than before (P<0.05); IBS symptoms score (3.96±1.42 vs 7.89±2.37), inflammatory cytokines (IL-6: 97.32±13. 83 vs 126.79±14.29; TNF-α: 29.67±6.19 vs 35.12±6.67) and treatment efficacy (82.75% vs 62.50%) in SIBO turning-negative group were superior to not turning- negative group (P<0.05).ConclusionThere is a high incidence of SIBO in patients with IBS. Treating SIBO can improve the clinical symptoms of patients with IBS.
irritable bowel syndrome; small intestinal bacterial overgrowth; rifaximin; methane-hydrogen breath test
R 574
A
2095-5227(2015)10-0979-04 DOI:10.3969/j.issn.2095-5227.2015.10.005
时间:2015-08-21 17:55
http://www.cnki.net/kcms/detail/11.3275.R.20150821.1755.002.html
2015-06-15
吴阶平临床科研专项资助基金(320.6750.13175)
Supported by the Foundation of WU Jie-Ping(320.6750.13175)
崔立红,女,博士,主任医师,教授,主任,博士生导师。研究方向:功能性胃肠疾病;肠内营养、微生态与消化系疾病;消化道早癌诊治。Email: luckycui861@sina.com
The first author: CUI Lihong. Email: luckycui861@sina.com

