匙羹藤愈伤组织培养研究
苏 钛,黄宁珍
(1.云南省药物研究所,云南 昆明 650111;2.云南白药集团创新研发中心,云南 昆明 650111;3.云南省中药和民族药新药创制企业重点实验室,云南 昆明 650111;4.广西植物研究所,广西 桂林 541006)
匙羹藤愈伤组织培养研究
苏 钛1,2,3,黄宁珍4
(1.云南省药物研究所,云南 昆明 650111;2.云南白药集团创新研发中心,云南 昆明 650111;3.云南省中药和民族药新药创制企业重点实验室,云南 昆明 650111;4.广西植物研究所,广西 桂林 541006)
以匙羹藤组培苗为外植体,研究茎段、茎尖和叶片以及不同植物生长调节剂组合对愈伤组织形成的影响;采用4因素4水平正交设计,用SPSS软件其结果进行分析。结果显示:各种外植体诱导愈伤的能力不同,依次是茎段、叶片。叶片诱导出非胚性愈伤组织,茎段、茎尖利于诱导胚性愈伤组织和胚状体;愈伤诱导的最佳培养基为MS+2,4-D 2.0 mg/L+6-BA 0.5 mg/L,诱导率为84.5%,愈伤生长旺盛,分裂快,颜色为淡黄色。愈伤组织分化成苗效果最好的条件是MS+NAA 1.0 mg/L+IBA 0.1 mg/L,分化率达到90.6%,最佳的生根条件是1/2 MS+NAA 1.6 mg/L,生根率为100%。这为研究匙羹藤的组织的脱分化、分化以及胚状体的形成机制提供了参考。
匙羹藤;组织培养;愈伤组织;正交设计
匙羹藤[Gymnemasylvestre(Retz.)Schult],属于萝摩科(Asclepiadaceae)匙羹藤属(Gymnema),别名武靴藤、金刚藤、心服黄,在全球主要分布较于印度、非洲、印度尼西亚等地区,我国主要分布在云南、广西、海南、浙江、福建、台湾等地,主要攀爬生于沟边、林缘、灌木中[1]。收载于《广西中药材标准》(第二册),具祛风止痛、生肌、消肿之功效,用于风湿关节痛、糖尿病、毒蛇咬伤[2]。还被收载于《印度药典》(IP2010)[3],近年来研究发现匙羹藤叶具有独特的降血糖、降血脂、抗龋齿和抑制甜味等作用[3]。可见,匙羹藤无论是作为药品还是保健品,均有较好的开发前景。关于匙羹藤的研究目前主要集中在匙羹藤的化学成分分析和药理活性等方面,结合我们前期对匙羹藤组培快繁的研究,本文以匙羹藤无菌苗为材料,采用正交试验设计法,旨在明确不同外植体类型、不同植物生长物质及其不同浓度组合对匙羹藤愈伤组织诱导的影响,期望能为匙羹藤的进一步研究与利用提供一定的技术依据。
1 材料和方法
1.1 材料和试剂
实验所用材料均来自广西植物研究所组培室匙羹藤继代苗,植物生长调节NAA (Naphthalene acetic acid)、2-ip[6-(△-isopenylamino)purine]、TDZ (Thidiazuron)、6-BA(6-benzylaminopurine)和KT (Kinetin)均为分析纯,为上海Sigma公司生产。
1.2 方法
1.2.1 外植体及基本培养基对匙羹藤愈伤组织诱导形成的影响
取0.5~1.0 cm左右的茎段、茎尖和0.5 cm2的叶片方块,接种在N68 附加NAA(0,0.5 mg/L)、2,4-D(0.1,0.5,1.0,2.0 mg/L)的培养基上和MS附加2,4-D(2.0,3.0 mg/L)、NAA(0,0.5 mg/L)、BA(0.5 mg/L)的培养基上,置于培养架上培养,20 d后观察记录不同外植体及不同基本培养基对愈伤诱导情况。
1.2.2 不同植物生长调节剂组合对愈伤组织诱导的影响
根据前期实验初步结论,以茎段为外植体,MS为基本培养基,考察不同植物生长调节剂浓度及组合(2,4-D、NAA、BA、2-ip),对匙羹藤愈伤组织诱导的影响,每个植物生长调节剂取4个水平(见表1),根据L16(44)[4]正交表安排16个实验,20 d后观察记录。
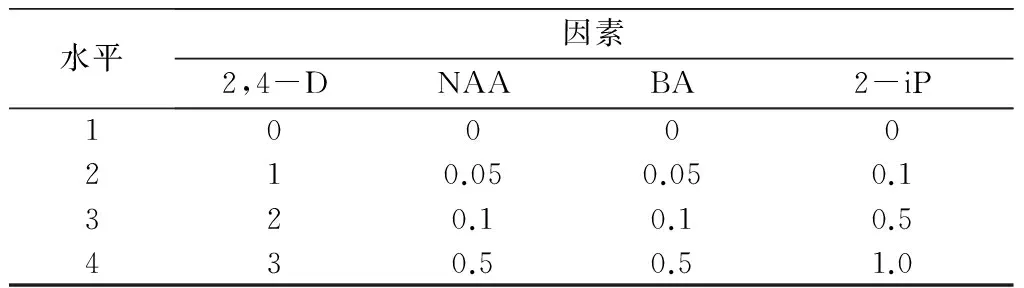
表1 植物生长调节剂种类和水平表
1.2.3 愈伤组织分化研究
将淡黄色的分化能力强的愈伤组织接种于含不同植物植物生长调节剂的分化培养基(表2),40 d后统计分化率,(分化率=分化的愈伤组织数/接种的愈伤组织数)×100%。
1.2.4 生根培养
将分化的3 cm左右的嫩芽切下,转接至生根培养基中,诱导生根。40 d后统计生根率(生根率=生根苗数/接种嫩芽数×100%)。
1.2.5 炼苗及移栽
将长至7 cm以上,有3条根以上的的匙羹藤小苗打开瓶盖,在大棚中放置5~7 d后,取出洗净培养基,移栽至基质中(基质组成:菜园土与蛭石,体积比为1 ∶1),15 d后统计成活率。
2 结果与分析
2.1 叶片、茎段等外植体及基本培养基对愈伤组织诱导的影响
将匙羹藤叶片、茎段外植体接种于表2所列不同诱导培养基上,培养2周后观察,结果表明:各种外植体诱导愈伤的能力不同,依次是茎段、叶片,形成的愈伤组织在形态上比较一致。叶片从切口处连续产生愈伤组织,最后整个外植体周围都形成愈伤组织。茎段首先在切口处形成愈伤,在腋芽处也可形成。两种外植体的愈伤组织初形成时都呈透明、无色或淡黄绿色,随着愈伤组织不断地增殖,逐渐形成白色、粘稠、不透明的愈伤组织。其中茎段形成的愈伤组织增殖最快,愈伤组织的这种形态特性也最明显;而叶片产生的愈伤组织淡黄色,表面粗糙, 增殖快,大多为非胚性愈伤组织。综合比较各个因素,后期的实验中主要采用叶片为外植体诱导非胚性愈伤组织,茎段作为外植体,诱导胚性愈伤组织和胚状体。

表2 不同外植体形成愈伤的能力差异
注: “+”表示长势一般,“++”表示生长较好,“+++”表示长势最好。
两种材料在只含2,4-D而不含BA的N68培养基上均能诱导出愈伤组织,诱导率随2,4-D浓度的增加而增大,当2,4-D为2.0 mg/L时诱导率最高,茎为56%,叶为45%。往培养基中添加一定浓度的BA(0.5 mg/L),愈伤的诱导率明显提高,茎和叶的愈伤诱导率分别提高到67%和60%。可见,2,4-D和BA对匙羹藤愈伤的形成都非常重要,最佳植物生长调节剂组合为2,4-D 2.0 mg/L和BA 0.5 mg/L。
在上述最佳的植物生长调节剂浓度和组合下,将基本培养基由N68换为MS后发现,茎和叶愈伤的诱导率均升高到100%。可见,不同的基本培养基对匙羹藤愈伤形成的频率影响很大,表现为MS基本培养基诱导愈伤组织效果最好,可见匙羹藤在诱导愈伤组织时对大量元素的需求较高。这与当归的愈伤组织诱导不同[5-6],可能是不同物种对营养的要求不同所致。
2.2 不同植物生长调节剂种类及浓度组合对愈伤组织诱导的影响
诱导愈伤组织的成功与否与于培养条件,尤其是植物生长调节剂的种类和浓度最为重要,而外植体的选择来源和种类对愈伤组织的诱导形成显得不是那么重要[7]。在匙羹藤愈伤诱导的实验中发现,在一定条件下,叶片和茎段在添加了2,4-D的条件下都能诱导出愈伤组织,但是加入其它植物生长调节剂配合能获得更好的诱导效果,在上述实验基础上,以MS为基本培养基,通过正交试验,系统考察了2,4-D、NAA、BA、2-iP四种植物生长调节剂对匙羹藤愈伤率和愈伤质量的影响(表3)。

表3 不同植物生长调节剂组合对愈伤诱导的影响
注:“++++”表示长势最好,其次为“+++”表示生长较好,“++”表示长势一般,“+”表示长势不好。
方差分析表明 (表4), 实验的4种植物生长调节剂中在设定范围内,只有2,4-D对愈伤的诱导具有显著性影响(Sig=0.01),其它的都无显著性影响。
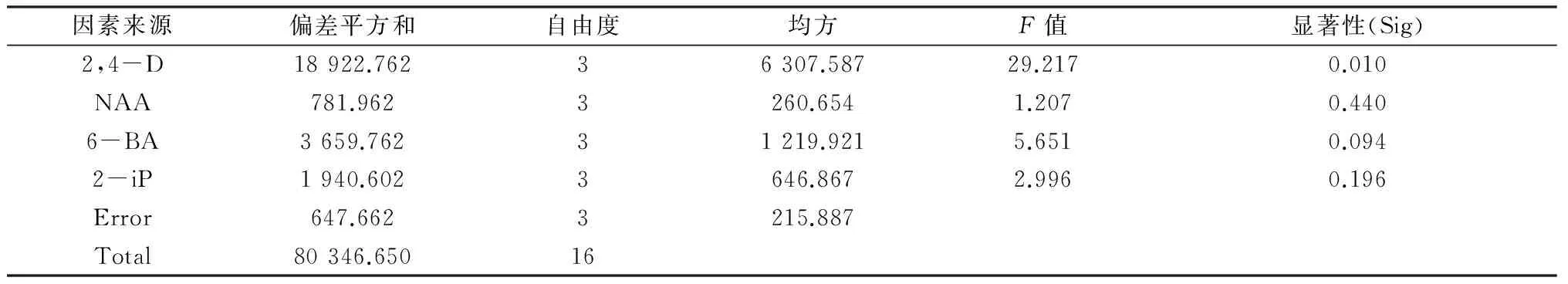
表4 愈伤诱导的方差分析
对2,4-D 进行LSD多重比较表明,当2,4-D为 3.0 mg/L时愈伤诱导率的均值差比其它处理高得多,但是诱导出的愈伤生长迅速,大多为白色,粘稠状、丝状、絮状、表面光滑,水渍状愈伤,继代困难。当2,4-D 2.0 mg/L时,均值差虽没2,4-D 3.0 mg/L的大,诱导率没那么高,但是,诱导出的愈伤生长旺盛,分裂快,颜色为淡黄色,表现出亢进分裂型愈伤组织的特征,因此在诱导愈伤过程中,应该采用2,4-D 2.0 mg/L。
对6-BA 进行LSD多重比较分析表明,6-BA浓度0 mg/L和0.5 mg/L组间均值差较大,存在显著性差异,而且在浓度为0.5 mg/L时,愈伤诱导最大,诱导愈伤大多为类型Ⅱ。因此在诱导培养时应用6-BA 0.5 mg/L作为优选浓度。
经Duncan a,b 多重比较分析表明,NAA、2-iP的各个处理均处于同一个子集(Subset)中,说明在所选各个浓度处理条件下,愈伤诱导率并不表现出明显差异,为非重要因素,在诱导愈伤时,按照重要因素取最佳值,非重要因素经济的原则,选用最低值。
综合以上分析,愈伤诱导的最佳培养基为MS+2,4-D 2.0 mg/L+6-BA 0.5 mg/L,诱导率为84.5%,愈伤生长旺盛,分裂快,颜色为淡黄色。
2.3 不同植物生长调节剂对愈伤组织分化的影响
考察不同激素浓度及组合(IBA和BA)对匙羹藤愈伤组织分化的影响(见表5)发现,当BA的浓度一定时,IBA的浓度为0.05~0.1 mg/L时,能诱导分化,分化率随着浓度的增加而增大;BA浓度为1.0 mg/L时,诱导的愈伤组织诱导率高,长势最好。因此最佳的分化培养基为MS+IBA 0.1 mg/L+BA 1.0 mg/L,诱导率为90.6%。
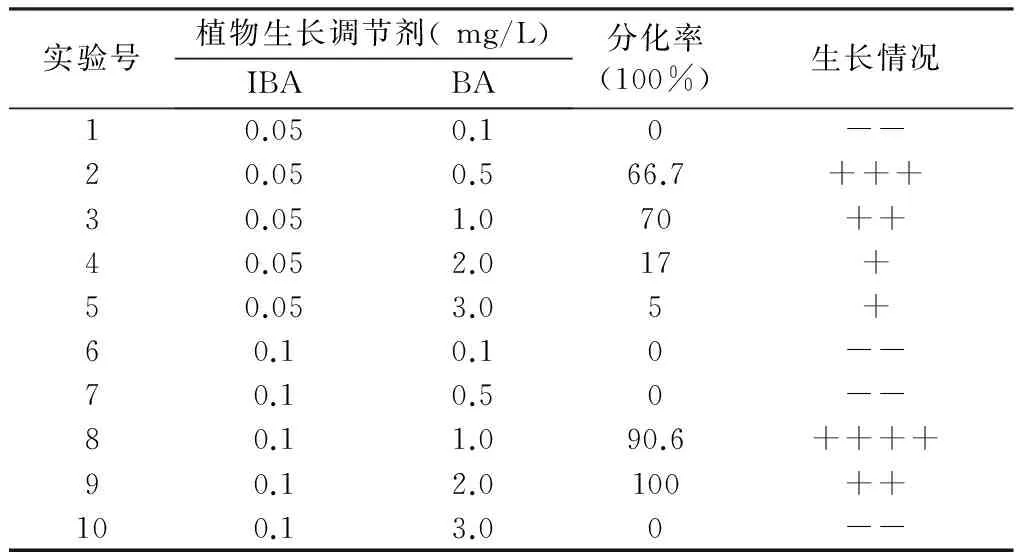
表5 不同激素组合对根分化的影响
注:“++++”表示长势最好,其次为“+++”表示生长较好,“++”表示长势一般,“+”表示长势不好。

图1 匙羹藤不同阶段生长情况
2.4 NAA对匙羹藤生根的影响
影响生根的因素很多,如外植体、光照、温度等,但是最重要的还是植物生长调节剂,由前期的预实验已知,NAA对匙羹藤的生根具有重要影响,因此,本实验添加不同浓度的NAA,其中1/2 MS+NAA1.6 mg/L的培养基生根最好,培养40 d后生根率达到100%,苗健壮(表6)。

表6 NAA对匙羹藤生根的影响
注:“++++”表示长势最好,其次为“+++”表示生长较好,“++”表示长势一般,“+”表示长势不好。
2.5 炼苗和移栽
匙羹藤在生根养基上生根后,在大棚炼苗5~7 d,移栽到基质上,约15 d后长出新叶。在实验过程中发现,不同季节炼苗对成活率有很大关系。4月份炼苗成活率最高,可达100%,苗长得比较快。
3 讨 论
在匙羹藤诱导愈伤组织时,所有外植体在不含有植物植物生长调节剂的N68、Whiter和MS基本培养基上均不能形成愈伤组织,只有在附加2,4-D等植物生长调节剂时,才产生愈伤组织。可见,器官脱分化对植物生长调节剂的需要是必不可少的,所以对植物生长调节剂的研究也是人们进行愈伤组织培养时关注的焦点之一。
愈伤组织是非组织化和非分化的组织,由薄壁细胞组成,通常在分化组织和器官的伤口产生,愈伤组织的诱导受培养基中生长调节剂的影响[7]。诱导和培养实际上与内源激素和外源生长调节剂有关,通过加入不同种类和浓度的外源生长调节剂结合内源激素,实现外植体到组培苗的整个过程。细胞分裂素促进细胞分裂,生长素可以促进细胞伸长,愈伤组织的形成,是分化细胞脱分化以及分生组织细胞直接分裂形成[8]。根据本研究的实验结果可知,愈伤组织的诱导过程中,只要有适当浓度的2,4-D存在,即可启动外植体的脱分化的过程、以及分生细胞的直接分裂,导致匙羹藤愈伤组织的产生和增殖,说明2,4-D是诱导匙羹藤愈伤组织形成的有效物质,且相对较高浓度的2,4-D对愈伤组织的增殖更为有利。其根本原因可能是2,4-D具有生长素的活性,一方面活化匙羹藤质膜上的ATP酶,促使细胞壁环境酸化,增加细胞壁的可塑性,另一方面,生长素促进核的有丝分裂,有利于RNA和蛋白质的合成,为原生质体和细胞壁的合成提供原料,最终表现为加快细胞的生长,形成愈伤组织[5],2,4-D是具有苯环的区别于吲哚乙酸等具有吲哚环和具有萘环的萘乙酸等具有生长素活性的生长素,这可能是2,4-D优于其余生长素类在诱导愈伤组织方面表现较好的因素。这是其他种类生长素所不具备的特异性;6-BA对匙羹藤愈伤组织的诱导、增殖有独特的作用,这可能因为细胞分裂素6-BA调控细胞质分裂,它与受体蛋白结合后,调节基因活性,促进RNA合成,加强了转录和翻译。因为6-BA存在于核糖体上,促进核糖体与mRNA的结合,形成多核糖体,加速翻译进度,形成新的蛋白质,最终表现为细胞的扩大,组织增大,产生愈伤组织[6]。因此,相对低浓度的6-BA与2,4-D协同作用,能明显地促进细胞分裂,使愈伤组织快速增殖。因此,可以得出如下结论:在一定的浓度范围内,高浓度的2,4- D与低浓度的6-BA协同作用,能有效的促进匙羹体愈伤组织的诱导及增殖。而其余的生长素和细胞分裂素组合则不能有效的诱导匙羹藤愈伤组织的形成与增殖。这可能与2,4-D和6-BA的结构特异性有关。
[1] 中国科学院植物研究所.中国高等植物图鉴:第3册[M].北京:科学出版社,2002:861,1040.
[2] 广西壮族自治区卫生厅.广西中药材标准:第2册[S].南宁:广西科学技术出版社, 1992:219-222..
[3] 韦宝伟,施骞.匙羹藤的研究概况[J].国外医药·植物药分册,1996,11(3):107.
[4] 张军舰,杨善朝.SPSS 统计软件应用基础[M].桂林:广西师范大学出版社,2001:58.
[5] 潘瑞炽.植物生理学[M].4版. 北京:高等教育出版社,2000:175-180.
[6] 查帅兵.安徽羽叶报春愈伤组织的诱导和培养[J].生物学杂志,2006,23(5):43-45.
[7] [印]H.S查夫拉. 植物生物技术导论(原著第2版[M]).许亦农,麻密,主译.北京:化学工业出版社.2005:30.
[8] 李浚明.植物组织培养教程[M].北京:北京农业大学出版社,1992:180.
Study on Callus Culture fromGymnemasylvestre
Su Tai1,2,3,Huang Ningzhen4
(1.Yunnan Institute of Materia Medica, Kunming 650111,China;2.Yunnan Baiyao Group Innovation and R&D Center, Yunnan Institute of Materia Medica, Kunming 650111,China; 3.Yunnan Province Company Key Laboratory for TCM and Ethnic Drug of New Drug Creation, Yunnan Institute of Materia Medica, Kunming 650111,China;4.Guangxi Institute of Botany,Guilin 541006, China)
UsingGymnemasylvestreas explants to study how stems, stem tips, leaves and hormone affect callus. Using 4 factors and 4 levels orthogonal to design, using SPSS to analyze results. Results displayed that all kinds of explants have different callus induction abilities, followed by stems and leaves. Leaves inducedi non-embryogenic callus. Stems and stem tips induced embryogenic callus and embryoid. The best tissue culture of callus induction is MS+2,4-D 2.0 mg/L+6-BA 0.5 mg/L, the induction rate is 84.5%, callus grown more vigorous, splinter grown faster, the color is faint yellow. The optimal medium for differentiation was MS+IBA 0.1 mg/L+NAA 1.0 mg/L. The inducing rate was 90.6%, The optimal rooted medium was 1/2 MS+NAA 1.6 mg/L. The rooting rate was 100%. This provides reference for dedifferentiation, differentiation, embryoid formation mechanism ofGymnemasylvestreorganization.
GymnemaSylvestre; tissue culture; callus ; orthogonal designing
2014-12-28
广西科技攻关项目(桂科攻0330003-1,0424008-1H)。
苏钛(1981—),男(白族),硕士,工程师,主要从事药用植物资源与生物技术研究。E-mail:kusutai2000@aliyun.com
10.3969/j.issn.1006-9690.2015.05.004
Q943.1
A
1006-9690(2015)05-0014-06

