乌头碱抗血清制备与鉴定
郭方超 肖文华 崔平福 王永娟
摘要:通过活性酯法将小分子的乌头碱(ACO偶联到牛血清白蛋白(BSA、鸡卵清白蛋白(OVA上,形成偶联物ACO-BSA、ACO-OVA。以ACO-BSA为免疫原,ACO-OVA为检测原,通过ELISA法检测ACO-BSA免疫鼠血清效价,间接竞争ELISA法检测抗体特异性、最低检测限。结果表明,免疫原和检测原均偶联成功,血清效价均大于 12 800。间接竞争ELISA法检测结果表明,所获抗体对ACO特异性强,最低检出限为1 ng/mL,IC50值为30 ng/mL,检测范围为1~6 μg/mL。
关键词:乌头碱;活性酯法;完全抗原;抗血清;牛血清白蛋白;鸡卵清白蛋白
中图分类号: S8544+3文献标志码: A
文章编号:1002-1302(201412-0336-03[HS][HT9SS]
收稿日期:2014-04-28
基金项目:江苏农牧科技职业学院重点支持项目(编号:NSFD1305、D1204。
作者简介:郭方超(1982—,男,江苏徐州人,实验员,从事临床兽医学研究。E-mail:445785442@qqcom。
通信作者:王永娟,博士,副教授,从事动物疫病防控研究。E-mail:43088591@qqcom。
乌头碱(aconitine,ACO是存在于川乌、草乌、附子等植物中的主要有毒成分,也是发挥部分药效的主要有效成分。现代药理研究表明,乌头类有毒中药如乌头、附子具有多种药理作用,主要表现为强心抗休克、抗心律失常、抑制呼吸中枢等[1-2]。ACO在强心、镇痛、抗肿瘤、调节免疫等方面已显示了良好的疗效。乌头碱的毒性经过炮制后会大大降低,然而临床上经常出现因炮制不当或服用过量导致患者中毒死亡的报道,一般认为口服乌头碱02 mg 即可引起中毒,2以上则有致死性。 为了保障ACO制剂的质量及用药安全,必须对ACO限量进行测定。精准把控乌头属中药材应用时的疗效与安全性,精确快速检测药物或生物材料中ACO的含量,一直是乌头属中药材研究的难点。本试验对ACO完全抗原的合成条件进行了研究,旨在为ACO快速定量检测试剂盒开发提供依据。
1材料与方法
11材料
牛血清白蛋白(BSA、卵清白蛋白(OVA、1-(3-二甲氨基丙基-3-乙基碳二亚胺盐酸盐(EDC、二甲基甲酰胺(DMF、N-羟基琥珀酰亚胺 (NHS、辣根过氧化物酶标记羊抗鼠IgG、弗氏完全佐剂、弗氏不完全佐剂均购于Sigma公司;其他试剂均为国产分析纯;乌头碱(ACO样品购自成都瑞芬斯生物科技有限公司;96孔可拆酶标板、低温高速离心机、U-2901型紫外、可见及近红外分光光度计均购自日本HITACHI公司;ELX800型酶标仪、ELX50型自动洗板机均购自美国BioTek公司;超纯水制备仪购自美国Millipore公司;Balb/C雌性小鼠购自扬州大学比较医学中心。
12完全抗原制备与鉴定
121完全抗原的合成
采用改进后的N-羟基琥珀酰亚胺活性酯法[4-5],分别合成免疫原ACO-BSA、包被抗原 ACO-OVA。精确称取 10 mg ACO标准品、5 mg NHS、5 mg EDC充分溶解于1 mL DMF及200 μL双蒸水中,室温下避光搅拌,过夜反应得恩诺沙星的反应液A,按此法再制得第2份反应液A;精确称取 25 mg BSA溶于3 mL PBS(pH值为 74中,另称取18 mg OVA溶于3 mL PBS(pH值为 74中,此溶液为B液。将上述反应液A逐滴加入B中,要求每5 min~10 加入200 μL,15 h内操作完毕。用透析袋、离心机初步纯化完全抗原。
122 偶联抗原浓度测定与鉴定 配制不同浓度的BSA标准品,BCA法测定吸光度并制作标准曲线;进而测定合成的偶联抗原浓度。同时,以PBS为空白,采用紫外光谱扫描,波长范围为230~300 nm,检测偶联情况。
13 动物免疫
对6~8周龄小鼠随机多点注射ACO-BSA,每只 05 mL,每2周免疫1次,共免疫5次。首次免疫使用等量弗氏完全佐剂乳化抗原,之后3次加强免疫时免疫原与弗氏不完全佐剂乳化;第3次加强免疫4 d后,眼眶静脉采血,ELISA方法检测小鼠免疫血清效价。选择血清效价高且敏感性好的小鼠进行冲击免疫,免疫途径为腹腔注射,剂量为初免剂量(不加弗氏佐剂)。同时设阴性对照小鼠。
14血清效价检测
每孔包被005 mg/mL ACO-OVA 100 μL,试验组血清抗体从1 ∶[G-3]100开始倍比稀释,采用间接ELISA方法检测血清效价最高的小鼠。
15ACO-OVA最佳工作浓度确定
包被抗原ACO-OVA从20 μg/mL开始倍比稀释,免疫血清从1 ∶[G-3]100开始倍比稀释,按间接ELISA操作步骤进行试验。以抗体稀释倍数为横坐标,D450 nm值为纵坐标作曲线,考察不同包被抗原浓度曲线的平滑度。以D450 nm值为10左右对应的抗原浓度作为最佳包被浓度。
16抗体敏感性测定(Ci-ELISA法
配制一系列浓度的ACO标准品溶液作为竞争品,血清抗体浓度按上面步骤确定的抗体最佳工作浓度。按间接竞争ELISA法步骤进行试验,计算抑制率。
2结果与分析
21人工抗原紫外光谱鉴定
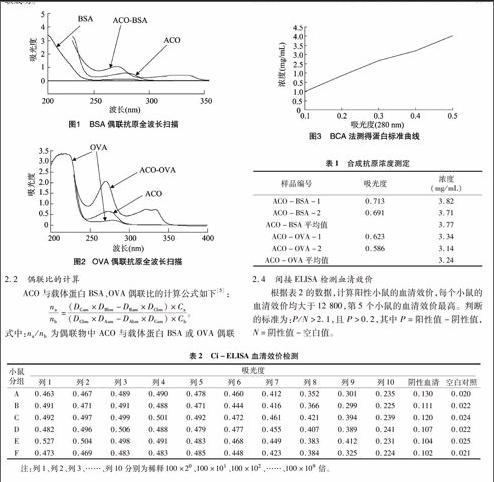
由图1、图2可知,偶联抗原的最大吸收波长发生紫移,且ACO-OVA的全波长扫描曲线与ACO、OVA曲线不同,说明人工抗原合成成功,同理可以判定人工抗原ACO-BSA偶联成功。
[F(W10][TPGFC1tif][F]
[F(W10][TPGFC2tif][F]
22偶联比的计算
ACO与载体蛋白BSA、OVA偶联比的计算公式如下[5]:
[HS2][J][SX(]nanb[SX]=[SX(](DCam×DBbm-DBam×DCbm×Ca(DCbm×DAam-DAbm×DCam×Cb [SX]。
式中:na/nb为偶联物中ACO与载体蛋白BSA或OVA偶联的物质的量比;DCam为偶联物在ACO最大吸收波长处的吸光度;DBbm为BSA或OVA在其最大吸收波长处的吸光度;DBam为BSA或OVA在ACO最大吸收波长处的吸光度;DCbm为偶联物在BSA或OVA最大吸收波长处的吸光度;DAam为ACO在其最大吸收波长处的吸光度;DAbm为ACO在BSA或OVA最大吸收波长处的吸光度;Ca为ACO标准物的浓度;Cb为BSA或OVA标准物的浓度。经计算ACO与BSA的偶联比为22 ∶[G-3]1,ACO与OVA的偶联比为16 ∶[G-3]1。
23BCA法测定蛋白浓度
利用BCA法测定不同浓度标准品的吸光度,并制作标准曲线(图3)。根据标准曲线,测得ACO-BSA的浓度为 377 mg/mL,ACO-OVA的浓度为324 mg/mL(表1。
[F(W10][TPGFC3tif][F]
[F(W9][HT6H][J]表1合成抗原浓度测定[HTSS][STB]
[HJ5][BG(!][BHDFG3,W11,W9。2W]样品编号 吸光度 浓度(mg/mL
[BHDG12]ACO-BSA-10713382
[BHDW]ACO-BSA-20691371
ACO-BSA平均值377
ACO-OVA-10623334
ACO-OVA-20586314
ACO-OVA平均值324[HJ][BG)F][F)]
24间接ELISA检测血清效价
根据表2的数据,计算阳性小鼠的血清效价,每个小鼠的血清效价均大于12 800,第5个小鼠的血清效价最高。判断的标准为:P/N>21,且P>02,其中P=阳性值-阴性值,N=阴性值-空白值。[FL]
[F(W+49mm][HT6H][J][WTH]表2Ci-ELISA血清效价检测[WTB][HTSS][STB]
[HJ5][BG(!][BHDFG3,W22/5,W573/5W]小鼠分组[B(][BHDWG12,W573/5W]吸光度[BHDWG12,W44/5。12W]列1列2列3列4列5列6列7列8列9列10阴性血清空白对照[BW]
[BHDG12,W22/5,W44/5。12W]A046304670489049004780460041203520301023501300020
[BHDW]B049104710491048804710444041603660299022501110022
C049204970499050104920472046104210394023901200024
D048204960506048804790477045504070389024101070022
E052705040498049104830468044903830412023101040025
F047304690483048304850448042303840325022401020021[HJ][BG)F]
注:列1、列2、列3、……、列10分别为稀释100×20、100×101、100×102、……、100×109倍。[F]
[FL(22]25方阵滴定法选择ACO-OVA包被吸光度浓度和抗血清的最佳工作浓度
由表3可知,最佳抗原包被浓度为25 μg/mL,对应的抗体稀释倍数为12 800。
26血清抗体敏感性测定
通过添加不同浓度ACO竞争品,所得线性回归方程y=-9016lnx+109223(r2=0992 7,IC50值为30 ng/mL,根[CM(25]据回归公式计算,抗体对ACO的检测范围(IC20~IC80为[CM][FL]
[F(W12][HT6H][J][WTH]表3抗血清最佳工作浓度和ACO-OVA包被浓度测定[WTB][HTSS][STB]
[HJ5][BG(!][BHDFG3,W5,W55W][JP3]ACO质量浓度(μg/mL[B(][BHDWG12,W55W]吸光度[XXSX2-SX542]列1列2列3列4列5列6列7列8列9列10[BW]
[BHDG12,W5,W52。10DWW]203125302630982947295528252791279928130288
[BHDW]103056300829862871269525712431243324560144
53018295829722648233119551781169217210186
253047286728342214163812261063101809700234
1252975280124031491090507150641056107900180
06252857253718920977060904950375036604960229
03122452189010260598033902250186016201840214
01562129156309350451025902830241021002870252[HJ][BG)F]
注:列1、列2、列3、……、列10分别为稀释100×20、100×101、100×102、……、100×109倍。[F]
[FL(22]1~6 μg/mL,最低检测限为1 ng/mL。
3结论与讨论
ACO是小分子化合物,只具有反应原性,没有免疫原性,只有在与大分子的载体蛋白偶联后才成为完全抗原而具有免疫原性、反应原性。据报道,BSA、OVA中分别有60、20个游离氨基[6],有利于ACO与载体蛋白的偶联作用。本试验采用改进后的N-羟基琥珀酰亚胺活性酯法,首先将ACO分子与EDC反应活化羧基,过夜后,短时间内缓慢加入蛋白反应物,这样可以减少蛋白质间的交联。偶联抗原鉴定时,虽然SDS-PAGE技术是偶联抗原常用的技术,但ACO分子量相对于BSA、OVA分子量而言较小,所以,不适宜用SDS-PAGE电泳分析,以通过迁移距离的变化来判断偶联是否成功。本试验选择了人工抗原紫外光谱鉴定法,取得了很好的鉴定效果。基于抗体与抗原或半抗原之间的高度特异性及敏感性而建立起来的免疫分析法简单、快捷、经济,被广泛应用于生化检测方面,在中药质量控制领域鲜有报导。对于天然产物中含量低的物质,定量分析比较困难,目前采用的HPLC法或LC-MS法对仪器要求很高,前期处理工作复杂,检测灵敏度无法满足痕量检测的要求[7]。免疫分析法已逐步应用到微量痕量中药成分的定性定量分析、中药成分的体内药物代谢动力学研究中。拥有特异性ACO抗体是免疫分析法检测ACO的基础,因此,制备具有免疫原性的ACO抗原对于ACO检测具有重要意义。
[HS2][HT85H]参考文献:[HT8SS]
[1][(#]陶长戈,李文军,彭成 乌头碱在大鼠体内的毒代动力学研究[J] 湖北中医药大学学报,2011,13(3:21-23
[2]杨姝,金振辉,羊晓东,等 乌头属植物的化学成分及药理作用研究进展[J] 云南农业大学学报:自然科学版,2007,22(2:293-295,298
[3]王东青,张亚丽应高度重视乌头类中药的毒副作用[J] 国医论坛,2009,24(2:37-38
[4]Watanabe H,Satake A,ido Y,et al Monoclonal-based enzyme-linked immunosorbent assay and immunochromatographic assay for enrofloxacin in biological matrices[J] The Analyst,2002,127(1:98-103
[5]于洪侠,杨曙明 莱克多巴胺人工抗原的合成与鉴定[J] 中国兽医科技,2005,35(12:1000-1003
[6]Hourwitz F The chemistry and function of protein[M] New York:Academic Press Inc,1963:190
[7]秦利芬,杨玉琴 不同采收期的附子中3种乌头碱的含量比较[J] 微量元素与健康研究,2012,29(6:31-32[HJ][FL]
[F(H0267。54Q]更正:《江苏农业科学》2014年第42卷第8期169-171页所刊论文《紫斑牡丹杂交授粉后胚珠的形态学观察》,漏登了通信作者。该文通信作者为:鞠志新,博士,教授,硕士生导师,从事观赏植物教学与研究工作。E-mial:jilinju@126com。特此更正,并向作者和读者致歉。

