低温胁迫对甜瓜幼苗叶片保护酶活性的影响

摘要:本研究选择新疆吐鲁番地区栽植面积比较大的西州密25号为试材,通过-5℃、0℃和常温三个处理,分别于处理后24小时、48小时、72小时、96小时、120小时测定其叶片SOD和POD酶的活性,研究低温胁迫对甜瓜幼苗叶片保护酶活性的影响。结果表明:-5℃以下的甜瓜叶片随着低温胁迫时间的延长,依然保持较高的酶活性,这可能是SOD和POD保护酶活性的耐寒机制已形成,当处理96小时,酶活性达到最高,这是低温的一种适应性反应,使其能比在0℃和常温下更有效地清除体内的有毒物质,保护植物免受伤害或减少伤害。但到96小时后,酶活性开始呈下降趋势,随着低温时间的延长甜瓜有受冻害的可能,因此在甜瓜栽植,遇到冷害时温度和时间都是要必须考虑的因素。
关键词:低温胁迫;甜瓜;幼苗;酶活性
项目名称:鄯善县哈密瓜主要病虫害综合防控技术
中图分类号: S652 文献标识码: A DOI编号: 10.14025/j.cnki.jlny.2015.04.034
甜瓜原产于印度、非洲热带沙漠地区,为葫芦科甜瓜属一年生蔓生作物。甜瓜属于冷敏感作物,近年来,随着甜瓜反季节以及早熟设施栽培技术发展迅速,甜瓜冷害问题也日益突出,成为甜瓜栽培生产的主要障碍之一[1-4]。特别是在我国甜瓜栽植面积比较大的新疆吐鲁番地区常常会在春季出现倒春寒或者夏季温度突降的现象,在很大程度上影响了甜瓜的栽植。在早春时节突遇倒春寒将对3月份的甜瓜定植苗造成严重伤害,后期会严重影响甜瓜品质、产量和经济效益,可见研究甜瓜的抗寒性对甜瓜反季节以及设施栽培的稳定发展,提高甜瓜的生产效益具有重要的现实意义。
1材料与方法
1.1材料
于2014年6~7月选择新疆吐鲁番地区主栽的甜瓜品种西州密25号为试材,采集叶片带回实验室,混匀后随机分组进行三个处理:常温,0℃,-5℃。
1.2方法
将叶片采摘下来0小时的时候先测定SOD酶和POD酶的活性,然后每隔24小时分别测定叶片SOD酶的活性,连续测定5天,时间分别是24小时,48小时,72小时,96小时,120小时。
1.2.1 SOD酶活性的测定
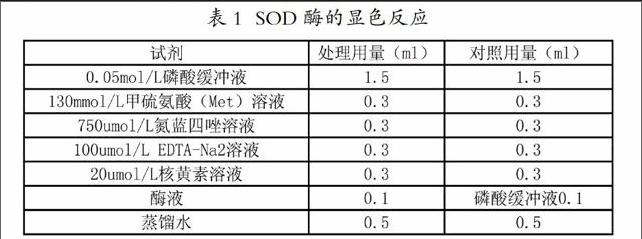
酶液提取。在处理时间到后,每次分别准时从每个处理中随机取出数个叶片,用软纸将叶片表面的灰尘拭擦干净,除去主脉后用剪刀将叶片剪碎。随机称取0.5克放置于预冷的研钵中,加入适量的石英沙和2毫升已预冷的磷酸缓冲液(其中含1%的PVP)在冰浴上研磨成匀浆并转移至离心管中,接着再分别加入磷酸缓冲液2次,每次2毫升冲洗残留在研钵中的浆液后也转移到离心管中。每两只离心管平衡后,对称放入离心机中在4℃的条件下,转速10000转/分钟离心20分钟,其上清液即为SOD粗提取液(显色反应见表1)。
表1 SOD酶的显色反应
各种试剂依次加入以后立即震荡摇匀,快速地用黑色塑料袋将其中一支对照管多层缠绕包严,和另外三支试管同时置于4000lx日光灯下反应10分钟(要求各试管照光条件一致,反应温度控制在25℃~35℃)。
SOD活性的测定。反应时间到,立即将试管从光源处取出,用黑布罩盖试管,以终止反应。以遮光的对照管为空白,用721分光光度计在560纳米处测定各反应液的吸光度(OD值),利用测得的数据计算SOD活性的大小。
1.2.2 POD酶活性的测定
酶液提取。采用愈创木酚法,依次取三种温度下处理的叶片,擦干净,大叶片去叶脉,剪碎。用万分之一天平分别称取不同温度处理下的叶片0.5克,分别放入冰冻的研钵中,研磨前加入2毫升的磷酸缓冲液及少许石英沙,进行冰浴研磨,研磨成匀浆状,再加入2毫升的磷酸缓冲液转移到离心管中,最后加入2毫升磷酸缓冲液冲洗研钵,通过加石英沙进行调平,放入低温下准备离心。提前将离心机制冷打开,将调平后的离心管放入离心机中,以10000转/分钟离心20分钟,提取酶液低温储藏。
酶活性测定。用三个试管分别取2.9毫升0.05摩尔/升pH 7.8的磷酸缓冲液,1.0毫升0.05摩尔/升的愈创木酚溶液,0.2毫升酶液,1.0毫升2%双氧水,以煮过失活的酶液为对照,反应体系加入酶液后放入34℃的水浴锅水浴3分钟,水浴后迅速加入2毫升 20%三氯乙酸(终止反应液),用721分光光度计470纳米波长下测吸光度,利用测得的数据计算POD活性的大小[5]。
2结果与分析
2.1 不同低温处理甜瓜叶片SOD酶活性的变化
由图1可以看出:在-5℃的条件下,SOD酶的活性在处理24小时后,开始上升,48小时时依然处于上升的状态,在处理72小时后,SOD酶活性达到最大。而后在96小时时开始剧烈的下降,在120小时后其活性已经非常低。在常温的处理条件下:SOD酶的活性变化比较平缓。说明在经受-5℃的低温胁迫以后,SOD酶的活性随处理时间上升,酶的保护机制形成并发挥作用,在72小时时达到最大。说明酶的应激机制在外界的低温刺激下形成,对不良外界条件发挥抵抗作用。但是随着低温胁迫时间的延长,SOD酶的活性降低甚至失活,这种酶的保护机制被破坏,其抵抗低温的能力也随着减弱和消失。
2.2 不同低温处理甜瓜叶片POD酶活性的变化
由图2可知,POD过氧化物酶的活性在-5℃处理下的栾树叶片的酶活性变化幅度较大,0℃下的次之,常温下的相对稳定。同一处理下不同时间的整体表现为先上升后下降的动态趋势。3个不同温度处理下的甜瓜叶片POD酶活性在96小时均达到最高值,然后开始下降,同样说明随着低温胁迫时间的延长,POD酶的活性降低甚至失活。
3小结与讨论
当植物处于低温逆境胁迫时,植物体内活性氧产生和清除的动态平衡遭到破坏,大量的活性氧不能及时清除而在细胞内积累对细胞造成氧化损伤,从而导致蛋白质,膜脂,DNA及其他细胞组分的严重损伤,并直接攻击叶绿体、线粒体等细胞器,使植物生长发育受到影响。高浓度氧对植物细胞伤害的另一个重要原因是引起膜的过氧化作用。超氧物歧化酶即SOD是需氧生物体内普遍存在的一种含金属酶。是植物酶促防御系统的重要保护酶,它能够防御或减轻活性氧或其他过氧化物自由基对细胞膜系统的伤害,保护正常的代谢,因此其活性的大小与植物的抗寒性密切相关[6-7]。另外不少研究已经证明,过氧化物酶POD作为植物低温胁迫中的膜保护酶,在植物遭受低温逆境时,迅速清除植物体内产生的有毒物质,如活性氧自由基及过氧化物,消除或减轻低温对植物的伤害,从而提高植物的抗寒力。POD能催化H2O2与酚类的反应,从而有效地阻止自由基在植物体内积累,使细胞内自由基维持在一个低水平,防止细胞受自由基的毒害。逆境下植物产生更多的氧自由基,加剧了膜脂过氧化从而导致膜系统受损,最终组织受到破坏。POD酶是植物对膜脂过氧化的酶促防御系统中重要的保护酶,POD酶在保护酶系统中主要是起到酶促降解H2O2的作用,从而使植物抵抗在逆境胁迫下代谢过程产生的有害物质对细胞的伤害,表现出一定的抗逆性。一般情况下,细胞内的活性氧与防御系统之间保持着平衡[8-10]。本试验中-5℃以下的甜瓜叶片随着低温胁迫时间的延长,依然保持较高的酶活性,这可能是SOD和POD保护酶活性的耐寒机制已形成,能够使活性氧代谢处于一定的平衡,避免了活性氧等各种自由基的大量积累,减轻了膜脂过氧化作用,降低了细胞膜的破坏程度。当处理96小时,酶活性达到最高,这是低温的一种适应性反应,使其能比在0℃和常温下更有效地清除体内的有毒物质,保护植物免受伤害或减少伤害。但到96小时后,酶活性开始呈下降趋势,随着低温时间的延长甜瓜有受冻害的可能,因此栽植甜瓜遇到冷害时,冷害的温度和时间都是必须要考虑的因素,及时采取防冻保温措施,防止低温对甜瓜幼苗危害的发生[11-12]。
参考文献
[1]和红云.低温胁迫对甜瓜幼苗生长及生理生化的影响[D].石河子大学,2008.
[2]王兴虎.低温对厚皮甜瓜幼苗生长及生理生化特性的影响[D].甘肃农业大学,2005.
[3]李琦.低温弱光对甜瓜幼苗生理特性的影响[D].华中农业大学,2012.
[4]孙玉宏. 甜瓜耐冷(湿)性鉴定指标及耐冷(湿)性材料的筛选[D].华中农业大学,2002.
[5]李建明,黄志,王忠红.低温锻炼对冷胁迫下甜瓜幼苗抗氧化酶活性与质膜透性的影响[J].西北农业学报,2007,(01):168-171.
[6]武雁军,刘建辉.低温胁迫对厚皮甜瓜幼苗抗寒性生理生化指标的影响[J].西北农林科技大学学报(自然科学版),2007,(03):139-143.
[7]刘景安.夜间亚低温对甜瓜幼苗生长和生理生化特性的影响[D].安徽农业大学,2009.
[8]李瑶.嫁接提高甜瓜耐低温生理机制的研究[D].吉林大学,2014.
[9]吕成群,黄宝灵.低温胁迫对巨尾桉幼苗膜脂过氧化及保护酶的影响[J].广西植物,2004,(01):64-68.
[10]史亮,李鸿波,金学柱,王建军,杜予州.低温胁迫对西花蓟马抗氧化酶活性的影响[J].应用昆虫学报,2013,(04):1062-1067.
[11]欧阳孔胜,邓卜凡,滕钊,袁林,于文凤,权辉,王晶莹.低温胁迫对甜瓜砧木幼苗生长及生理特性的影响[J].中国瓜菜,2011,(05):10-14.
[12]李静.低温弱光胁迫对甜瓜幼苗生长及生理指标的影响[J].河南农业科学,2012,(05):106-109.
作者简介:袁森,本科学历,新疆维吾尔自治区葡萄瓜果研究所,高级农艺师,研究方向:葡萄栽培和西甜瓜栽培,及病虫害防治等。endprint

