外源激素对碗莲开花及酶活性的影响1)
孔德政 申雪莹 孟伟芳 张云峰 刘艺平
(河南农业大学,郑州,450002)
荷花(Nelumbo nucifera Gaertn.)作为中国十大传统名花之一,其花朵硕大,花色净洁,清香淡远,深受人们的喜爱。其小型品种碗莲因其体型较小,易栽培易管理更是进入了千家万户。在观赏应用中荷花的花期较短、着花数量少是限制其发展的重要因素,因此,荷花开花调控的研究具有重要的现实意义,目前,荷花花期调控的研究主要在光照和温度调节等方面[1-3],但是利用外源内源激素调控荷花生长发育还鲜有报道。因此,本试验研究了外源生长素(IAA)、赤霉素(GA3)、细胞分裂素(6-BA)对碗莲品种‘红霞’生长发育及生长过程中酶活性的影响,为碗莲的栽培管理提供理论依据。
1 材料与方法
供试材料为碗莲品种‘红霞’(Nelumbo nucifera‘Hongxia’),购于河南省郑州市田园情水生花卉基地。2013 年4 月5 日,选择生长健壮、无病虫害、顶芽完好无损、具有三节粗壮藕鞭的种藕,种植于2 m×1 m 的水池中,土壤为泥层深厚肥沃、富含有机质的黄泥土。
2013 年5 月23 日选择材料的第3 片立叶进行试验处理。在距叶心2 cm 处进行1 cm2大小的划伤处理,然后在创伤处涂抹外源激素,每片叶子处理2处。3 种外源激素的质量浓度处理分别为50、100、150 mg·L-1,每个处理10 株,对照只进行同样的划伤处理。酶活性测定从处理当天开始取样,选取生长良好的完整立叶,放入液氮带回实验室。以后每隔20 d,即6 月12 日、7 月2 日、7 月22 日、8 月11日、8 月31 日进行取样。
生长发育指标测定:记录各处理碗莲的立叶数量、叶面积(叶片纵径代表)、叶柄高度、开花总量、花期。计算各指标的绝对生长率,绝对生长率=[(处理100 d 时生长量-未处理时生长量)/未处理时生长量]×100%。
生理生化指标的测定:SOD 活性测定采用氮蓝四唑法[4];POD 活性测定采用愈创木酚法[5];PPO活性测定采用朱广廉等[6]和王鹏[7]的方法;CAT 活性测定采用李合生等[8]的方法。
数据处理:数据采用SPSS 19.0 和Excel 2007 进行统计分析。
2 结果与分析
2.1 外源激素对碗莲叶片生长与开花的影响
从表1 可以看出,经不同质量浓度IAA 处理后,立叶数、叶面积和叶高绝对生长率比对照均有了不同程度的降低,开花总数有了一定的增加。其中,经150 mg·L-1IAA 处理的立叶数目绝对生长率比对照降低了200%,达到极显著水平;经100、150 mg·L-1IAA 处理的叶面积绝对生长率分别比对照减小了79%和81%,差异显著;叶高在100 mg·L-1IAA处理下的绝对生长率比对照降低了205%,差异显著。开花总数在50、100 mg·L-1IAA 的处理下增加2朵,开花时间提前了3 d;经150 mg·L-1IAA 处理的增加7 朵,开花时间比对照提前了10 d。各处理的落花日期没有变化。
经不同质量浓度GA3处理后,立叶数、叶面积和叶高绝对生长率均有不同程度的降低,开花总数增加。经50、100、150 mg·L-1GA3处理的立叶数目绝对生长率分别比对照降低了261%、243%、114%,差异均达到极显著水平;经50、100 mg·L-1GA3处理的叶面积绝对生长率分别比对照减小了76%和83%,叶高绝对生长率分别比对照减小了199%和204%,差异均达到显著水平。经50 mg·L-1GA3处理的开花总数比对照增加了5 朵,开花时间提前了7 d;经100 mg·L-1GA3处理的比对照增加了2朵,开花时间提前了3 d;而经150 mg·L-1GA3处理的开花时间与对照相同,但落花时间延迟了7 d。
经不同质量浓度6-BA 处理后,仅经100 mg·L-16-BA 处理的立叶数、叶面积和叶高绝对生长率有所增加,比对照分别增加了45%、26%、158%,差异极显著;经50、150 mg·L-16-BA 处理的立叶数目绝对生长率分别比对照降低了218%和164%,差异达到极显著水平,而叶面积、叶高绝对生长率与对照无显著差异。经150 mg·L-16-BA 处理的开花总数比对照增加了4 朵,开花日期提前了7 d。
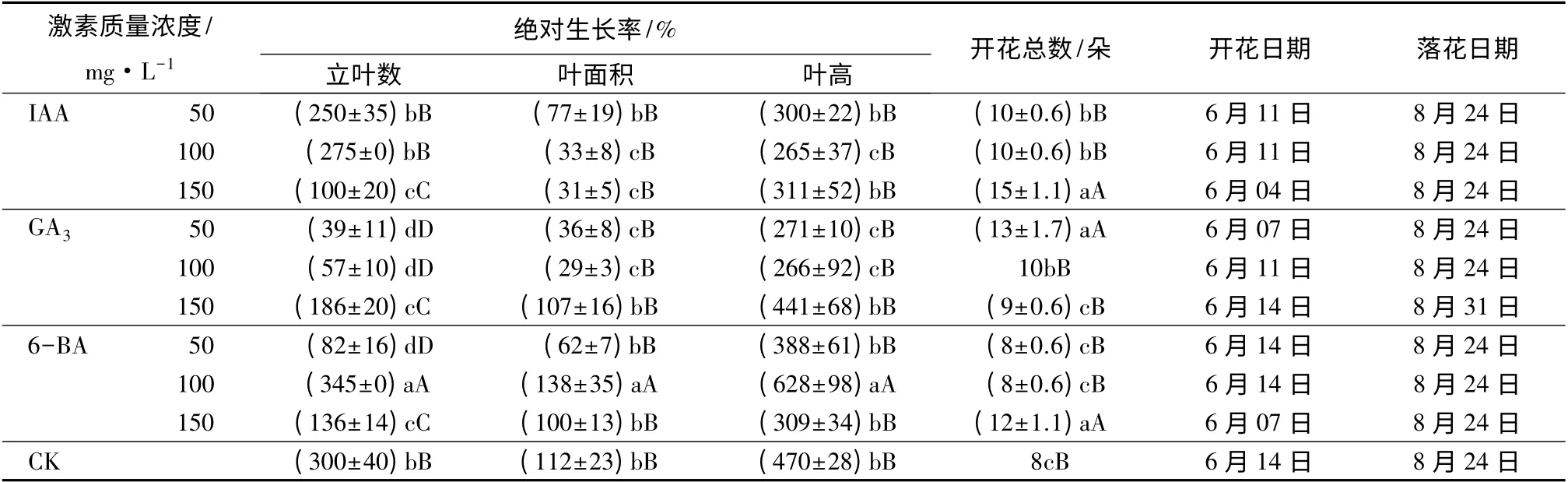
表1 不同激素处理对碗莲叶片生长与开花的影响
注:表中数据为平均值±标准差;CK 为对照;同列不同小写字母表示在0.05 水平上差异显著,不同大写字母表示在0.01 水平上差异显著。
2.2 外源激素对碗莲酶活性的影响
2.2.1 SOD 活性的变化规律
SOD 与细胞活性氧代谢密切相关,主要功能是清除超氧阴离子自由基,活性增加说明其清除自由基的能力增强,反之则弱。从表2 可以看出,试验过程中各处理与对照叶片的SOD 活性整体呈先上升后下降的趋势,对照的SOD 活性在处理60 d(7 月22 日)达到最高值221 U·g-1,显著高于其他时期。经50、100 mg·L-1IAA 和50 mg·L-1GA3处理的SOD 活性也在处理60 d 时达到最高值,而其他各处理SOD 活性均在处理40 d(7 月2 日)时达到最高值,各处理的SOD 活性最高值均大于对照,且与其他时期的SOD 活性值差异显著。说明外源IAA、GA3和6-BA 均在不同程度上提高碗莲叶片的SOD 活性,从而促进碗莲的生长发育。
2.2.2 POD 活性的变化规律
POD 可以促进植物体内的代谢、反映植物的生长发育特性,其活性的高低反映了植物代谢能力的大小。从表2 看出,对照的POD 活性在处理20 d(6月12 日)迅速达到最高值372 U·g-1·min-1,而后急剧下降,然后又略有上升。经150 mg·L-1IAA 处理的POD 活性于处理60 d(7 月22 日)达到最高值,比对照最高值高出37 U·g-1·min-1,其他处理的最高值均小于对照。经50 mg·L-1GA3、6-BA 处理的POD 活性分别在处理40 d(7 月2 日)和80 d(8 月11 日)达到最高值,其他处理的POD 活性和对照相同均在处理20 d 达到最高值。从POD 活性结果来看,150 mg·L-1IAA 能够明显刺激碗莲的新陈代谢活动,而对50 mg·L-1GA3、6-BA 处理不敏感。
2.2.3 PPO 活性的变化规律
PPO 是儿茶酚氧化酶和漆酶的统称,许多生物、非生物因素都可诱导PPO 活性增加。由表2 可以看出,对照的PPO 活性先是下降而后上升,在处理60 d 时(7 月22 日)急剧上升达到最高值,为170 U·g-1·min-1,而后迅速下降,后略有上升。经100 mg·L-1IAA、6-BA 处理的PPO 活性与对照同样于7 月22 日达到最高值,其他各处理的PPO 活性均早于对照达到最高值。各处理的PPO 活性最高值均低于对照最高值。
2.2.4 CAT 活性的变化规律
CAT 是生物防御系统的关键酶之一,能够有效清除植物细胞内过量的活性氧和自由基,酶活性越高,清除能力越强。从表2 可以看出,对照的CAT酶活性在处理20 d(6 月12 日)迅速达到最高值,为420 U·g-1·min-1,经IAA、GA3、6-BA 各处理的CAT 活性最高值均出现在花期,而后下降,初期的酶活性最低。除50 mg·L-1IAA 处理外,CAT 活性最高值均与其他时期差异显著。经100、150 mg·L-16-BA 处理的CAT 活性最高值大于对照,分别为423、450 U·g-1·min-1,其他处理的CAT 活性的最高值均低于对照。经100、150 mg·L-16-BA 处理的表现出较高的CAT 酶活性,有利于促进碗莲的开花生长。
3 结论与讨论
植物激素与植物成花间的关系一直是成花研究的中心内容,植物内源激素水平的平衡,被认为是比较重要的一个影响因素[9]。但内源激素系统调控植物体生长发育并不是一个简单的过程,而是多种激素在时空上联合后建立起来的某种平衡关系,而且这种关系随着时空的变化而改变[10-11]。这种平衡状态控制着SOD、POD、PPO、CAT 等酶活性,从而影响着植物生理功能和生长发育。赤霉素类、生长素类主要与营养积累和运输有关,对促进植物细胞的增长较显著,细胞分裂素类主要控制细胞分裂和器官发育[12]。
本试验中随着生长素质量浓度的增加,对碗莲开花数量和花期提前的促进作用也越来越明显。经150 mg·L-1IAA 处理能增加碗莲开花数量及促进提早开花,在该处理下SOD 和POD 的活性在花期显著提高,说明经150 mg·L-1IAA 处理可促进碗莲的花芽分化进程,这与靳丹丹[13]研究结果一致。外施赤霉素对碗莲的开花表现为双重作用,经50 mg·L-1GA3处理后碗莲的开花数量显著增加,开花日期明显提前,在仙客来[14]中也有同样的结果;而经150 mg·L-1GA3处理的则使落花期延缓,这一处理下SOD 和PPO 活性在开花前期均显著提高,并且之后仍保持在较高的水平,可能与落花期的延缓相关。章铁等[15]、胡惠蓉等[16]在研究梅花时,发现赤霉素可有效延缓花期和明显增加开花量。经100 mg·L-16-BA 处理能够显著促进叶片的伸长、叶面积和叶片数量的增加,该处理下CAT 活性在初花期保持在较高水平,而其他酶活性的变化与对照没有明显差异。经150 mg·L-16-BA 处理也能够提高碗莲的开花数量和提前花期,该处理下SOD 活性显著提高、PPO 活性最大值提前、CAT 活性提高,说明6-BA 主要是通过影响SOD、PPO、CAT 等活性来促进碗莲开花的。
[1] 姜红卫,李欣,江君,等.苏南观赏荷花设施栽培周年开花技术研究[J].江苏农业科学,2013(12):191-193.
[2] 晏淑贞,刘志方,朱黎明,等.荷花促成栽培试验[J].山东林业科技,2011,41(3):67-68.
[3] 杨镇明,程萍,罗丽霞.珠海冬季荷花反季节栽培技术[J].广东农业科学,2006(7):83-84.
[4] 郝再彬,苍晶,徐仲.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2005.
[5] 汤章城.现代植物生理实验指南[M].北京:科学出版社,1999.
[6] 朱广廉,钟诲文,张爱琴.植物生理学实验[M].北京:北京大学出版社,1990.
[7] 王鹏.马铃薯离体块茎休眠生理研究[D].北京:中国农业科学院,2001.
[8] 李合生,孙群,赵世杰.植物生理生化实验原理及技术[M].北京:高等教育出版社,2004.
[9] 桂仁意,曹福亮,沈惠娟,等.植物生长调节剂对石竹试管成花及内源激素与多胺的影响[J].南京林业大学学报:自然科学版,2003,27(1):6-10.
[10] Davies P J.植物激素:合成、信号转导和作用[M].3 版,段留生,主译.北京:中国农业大学出版社,2008.
[11] 孟云,马少锋,邵建柱,等.喷施6-BA 对‘天红2 号’苹果苗腋芽萌发及其内源激素的影响[J].园艺学报,2012,39(5):837-844.
[12] 王磊,汤庚国,刘彤,等.冷藏对石蒜鳞茎休眠生理及开花的影响[J].东北林业大学学报,2009,37(12):51-53.
[13] 靳丹丹.碗莲花芽分化形态发育以及相应时期生理生化的动态研究[D].郑州:河南农业大学,2008.
[14] 梁芳,郑成淑,曹后男,等.赤霉素对仙客来生长与开花的影响[J].北方园艺,2006(4):113-114.
[15] 章铁,彭潮,周群.赤霉素处理对梅树开花和座果的影响[J].安徽农业大学学报,1997,24(2):398-400.
[16] 胡惠蓉,包满珠,王彩云,等.赤霉素(GA3)对武汉市露地梅花部分品种花期的影响[J].华中农业大学学报,2003,22(2):167-171.

