基于角质颚长度的头足类种类判别*
刘必林 陈新军① 方 舟 金 岳
(1.上海海洋大学海洋科学学院 上海 201306;2.国家远洋渔业工程技术研究中心 上海 201306;3.大洋渔业资源可持续开发教育部重点实验室 上海 201306;4.远洋渔业协同创新中心 上海 201306)
剑尖枪乌贼 Uroteuthis edulis、杜氏枪乌贼Uroteuthis duvauceli、金乌贼Sepia esculenta、曼氏无针乌贼Sepiella maindroni、短蛸Octopus ocellatus是我国沿海主要经济头足类,常见于沿海渔市。角质颚是位于头足类口球内的几丁质硬组织,由上颚和下颚两部分组成,其稳定的形态结构和极强的耐腐性使其在头足类的分类鉴定中起着重要作用(刘必林等2009)。传统的分子生物学方法判别头足类的种类实验操作比较复杂,并且在分类地位比较相近的种类的判别上不明显,而利用角质颚形态来判别头足类的种类和种群要便捷许多(Kassahn et al,2003 Doubleday et al,2009)。自Clarke(1962)首先对头足类的角质颚形态进行了描述以来,全世界各大洋累计共有39科240多种头足类的角质颚形态特征得到了描述和测定(Xavier et al,2007)。随之而来的是,角质颚长度被广泛用于柔鱼类、枪乌贼类、乌贼类和蛸类的种类鉴定。
我国在大洋性柔鱼类的角质颚中开展了一些相关研究(刘必林等,2010;李思亮等,2010;Chen et al,2012),而对近海的头足类的相关报道还很缺乏(郑小东等,2002),其研究还需要加强。因此,本文通过分析我国近海几种常见经济头足类角质颚的长度特征,并根据其长度的差异对头足类的种类进行判别,目的旨在开启我国在相关领域的研究,同时为我国近海头足类的种类判别提供新方法。
1 材料与方法
1.1 材料来源
研究样本为2013年8月采集于舟山市沈家门东河菜场,共获剑尖枪乌贼样本49尾(雌性25尾,雄性24尾)、杜氏枪乌贼样本51尾(雌性5尾,雄性46尾)、金乌贼样本57尾(雌性35尾,雄性22尾)、曼氏无针乌贼样本 55尾(雌性 36尾,雄性 19尾)和短蛸样本39尾(雌性6尾,雄性33尾)。
1.2 角质颚长度测量
样本在实验室解冻,利用米尺测量胴长(精度1cm),电子天平称取体重(精度 1g),并用镊子取出各种头足类的角质颚,放入75%的酒精中保存,利用游标卡尺(精度 0.01mm)对角质颚形态进行测量。角质颚由上颚和下颚两部分组成,两者均包括喙部、头盖、脊突、翼部、侧壁等部分。测量的形态参数依据刘必林等(2009,2010): 头盖长(hood length,HL),即为喙顶端至头盖后缘末端长;脊突长(crest length,CL),即为喙顶端至脊突后缘末端长;喙长(rostrum length,RL),即为喙顶端至颚角末端长;侧壁长(lateral wall length,LWL),即喙顶端至侧壁后缘末端长;翼长(Wing length,WL),即为颚角至翼部前缘末端长(图1)。

图1 角质颚形态参数示意图Fig.1 Schematic diagram showing the measurement of the beak morphometric variables
1.3 数据分析
采用逐步判别分析法(stepwise discriminant analysis,SDA)和主成分分析法(principal component analysis,PCA)分析各种头足类之间以及枪乌贼类和乌贼类的种间角质颚长度差异,并据此判定各种头足类。为了消除个体大小对角质颚长度的影响,标准化后的角质颚长度数据也被应用于SDA和PCA分析中。标准化时,选择UHL作为自变量,其余9个角质颚长度指标作为因变量与之建立线性关系:
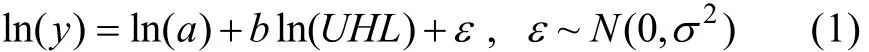
式中,y为除UHL之外其余9个角质颚长度指标;a和b为估算参数,ε~ N (0,σ2)表示残差相符合正态分布。标准化后的角质颚长度指标可由公式转化后获得:标准化后9个角质颚长度指标分别记为UCLs、URLs、ULWLs、UWLs、LHLs、LCLs、 LRLs、LLWLs和 LWLs。

1.4 统计检验
单因素方差分析(Univariate analyses of variance,ANOVA)和多因素方差分析(multivariate analysis of variance,MANOVA)用来检验不同种类之间的角质颚长度差异。利用判别分析的前两个判别函数系数及其均值计算 95%椭圆置信区间,95%椭圆置信区间由R2.13.1软件计算。运用弃一法交叉验证法(leave-oneout cross-validation,又称折叠再分类法 Jackknife reclassification procedure)检验种类划分的成功率。
2 结果
2.1 角质颚长度种间差异
方差分析显示,剑尖枪乌贼、杜氏枪乌贼、金乌贼、曼氏无针乌贼和短蛸等5种头足类角质颚各部的长度差异显著(ANOVA: P<0.001)。从角质颚各部的长度可看出金乌贼的角质颚尺寸最大,其次为杜氏枪乌贼和曼氏无针乌贼,再次为剑尖枪乌贼,短蛸的角质颚尺寸最小(表1)。
2.2 角质颚长度判别分析
SDA分析显示,10个角质颚原始长度指标中仅ULWL、UHL、LCL、LWL、LHL、LLWL、UCL 被用于最终的判别分析,由典型相关系数(表 2)和Wils’s λ(表 3)分析可得 ULWL、UHL、LCL 贡献了绝大部分种间差异。5种头足类总的判别成功率为96.2%,其中金乌贼和短蛸的判别成功率为100%,剑尖枪乌贼、杜氏枪乌贼和曼氏无针乌贼依次为98.0%、86.3%和 96.5% (表 4,图2a)。
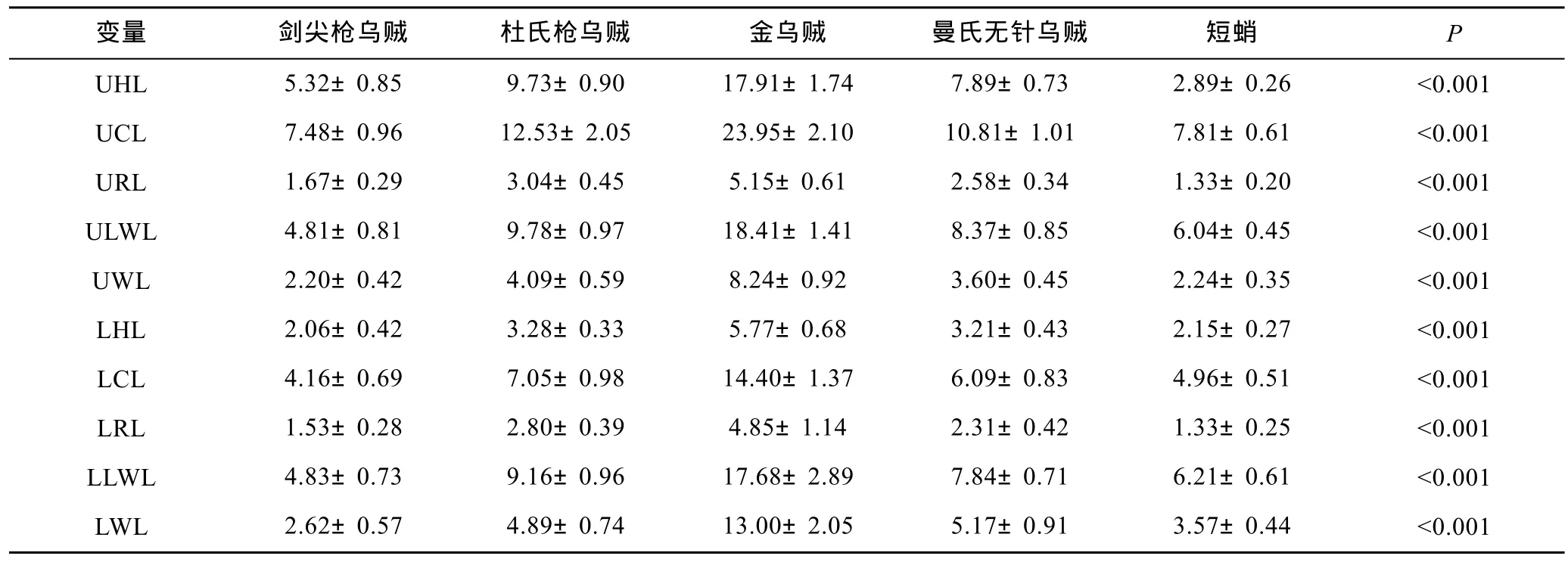
表1 五种头足类角质颚长度(均值±标准差)Tab 1 The beak morphometric variables of 5 cephalpods
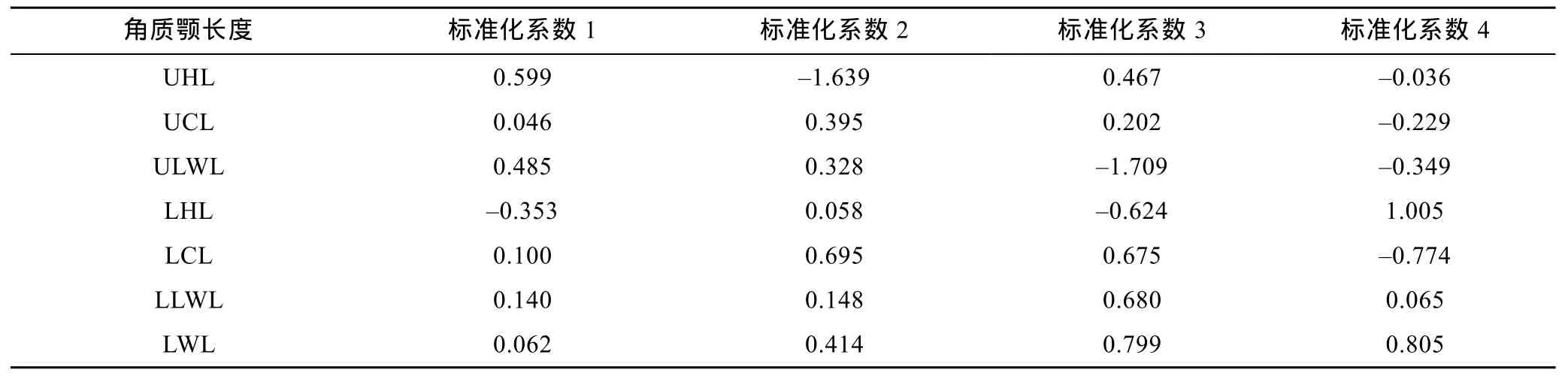
表2 五种头足类角质颚长度逐步判别分析标准化系数Tab.2 Canonical discriminant function (DF)coefficients for DF1,DF2,DF3 and DF4 for each morphometric variables used in the discriminant function analysis for 5 cephalopods
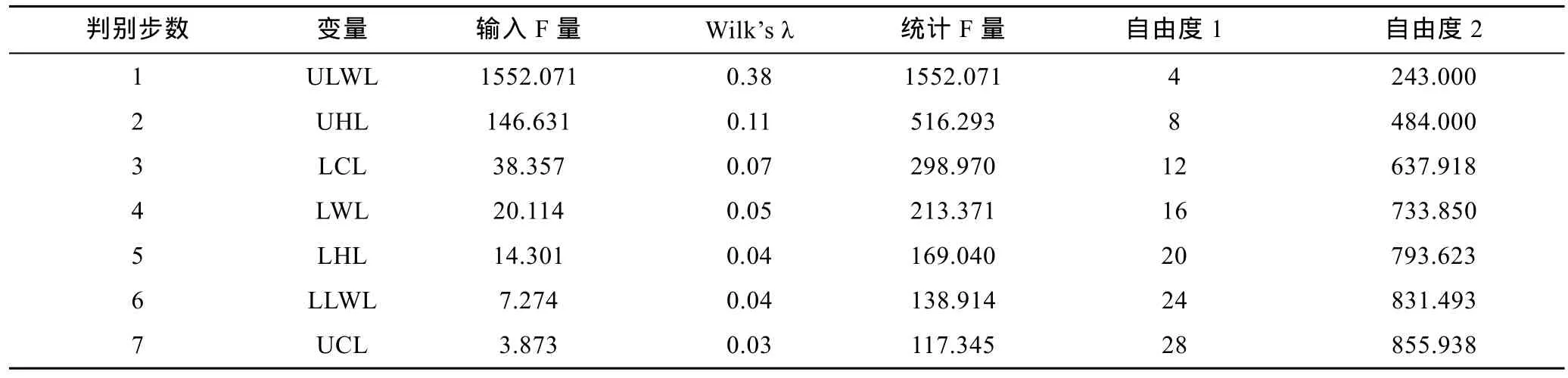
表3 基于角质颚长度的逐步判别分析结果Tab.3 Summary of stepwise discriminant analysis showing the order of variables to entry and the successful discrimination rate for the five species in beak morphometrics
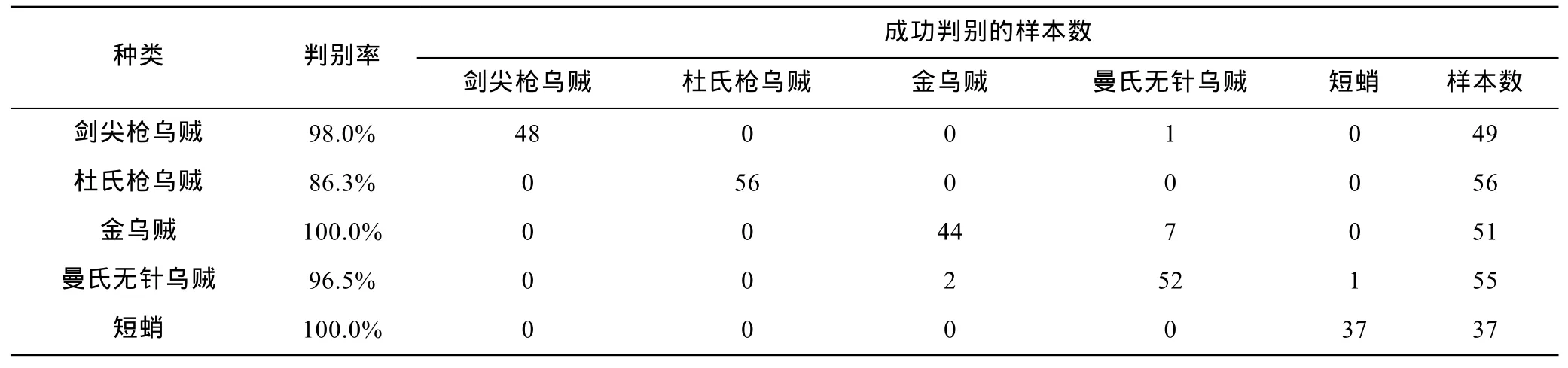
表4 基于角质颚长度的头足类种类判别成功率Tab.4 The successful discrimination rate for the five species in beak morphometrics

图2 五种头足类角质颚原始长度(a)及标准化长度(b)判别分析函数系数散点图Fig.2 Canonical discriminant plots of initial (a)and standardized (b)beak morphometric variables for 5 cephalopods
SDA分析显示,枪乌贼类(剑尖枪乌贼和杜氏枪乌贼)以及乌贼类(金乌贼和曼氏无针乌贼)种间的判别成功率为100%(表5);PCA分析显示,根据角质颚长度差异可以将剑尖枪乌贼与杜氏枪乌贼以及金乌贼与曼氏无针乌贼完全分开(图3)。
2.3 角质颚标准化长度判别分析
SDA分析显示,10个角质颚标准化长度指标中仅 LRLs、LWLs、ULWLs、URLs、UWLs、LCLs、UCLs、LHLs和 LLWLs被用于最终的判别分析,由典型相关系数(表 6)和 Wils’s λ(表 7)分析可得 LRLs和LWLs贡献了绝大部分种间差异。5种头足类总的判别成功率为100.0% (表8,图2b)。
SDA 分析显示,枪乌贼类(剑尖枪乌贼和杜氏枪乌贼)以及乌贼类(金乌贼和曼氏无针乌贼)种间的判别成功率为100%(表9);PCA分析显示,角质颚标准化长度差异可以将剑尖枪乌贼与杜氏枪乌贼以及金乌贼与曼氏无针乌贼完全分开(图4)。
3 讨论
角质颚作为头足类少数硬组织之一,形态结构稳定,它在头足类,尤其属以上单元的分类鉴定中起着重要作用(刘必林等,2009)。柔鱼类、枪乌贼类、乌贼类和蛸类等 4种主要头足类的角质形态差异明显(董正之,1991)。枪乌贼类(剑尖枪乌贼、杜氏枪乌贼)的上颚头盖弧度较圆,下颚颚角较大,头盖和侧壁均较狭窄;乌贼类(金乌贼、曼氏无针乌贼)的上颚颚角比较平直,下颚颚角更大,头盖和侧壁均较狭窄;蛸类(短蛸)的上颚喙和头盖均甚短,脊突尖狭,下颚喙也甚短,顶端钝,侧壁更为狭窄。然而,角质颚形态特征在种这一分类水平的鉴定作用显得有些复杂,它需要研究者们对角质颚各部的细微结构进行一一判别,甚至有些相近的种类之间的角质颚形态特征完全没有差异,因此,角质颚形态测量学的出现弥补了这些不足(Clarke,1962,1986)。例如,研究认为,枪乌贼类角质颚的种间差异极其微小,因此只能通过角质颚某些部位的长度差异才能将其相互区分(Pineda et al,1996)。根据角质颚的形态和长度特征,部分大洋及海域的头足类得到了鉴定,例如,西班牙临比戈湾(Clarke et al,1974)、南非海域(Smale et al,1993)、西北太平洋(Kubodera et al,1987)、澳大利亚南部(Lu et al,2002)以及南大洋(Xavier et al,2009)等。
近年来,业内的学者们不断尝试通过角质颚长度来鉴定那些分类地位相近、栖息环境相似的头足类(Martínez et al,2002;Vega et al,2002;许嘉锦,2003)。本文研究发现,角质颚长度同样适合用来判定我国近海的头足类,逐步判别分析结果显示,判别成功率高达 96.2%以上。然而,与之相比,标准化后的角质颚长度更适合用作种类的判定,其判别成功率达到了 100%。由于标准化后的角质长度,排除了头足类个体自身大小对其角质长度的影响,因此判定效果更准确、更有效,这在以往的研究中得到了充分证明(Vega et al,2002;Lefkaditou et al,2004;李思亮等,2010;Chen et al,2012;Liu et al,2015)。角质颚长度用于区分分类地位上相近的种类来说同样效果较好,PCA分析显示,枪乌贼类(剑尖枪乌贼和杜氏枪乌贼)以及乌贼类(金乌贼和曼氏无针乌贼)种间的判别成功率达到 100%。尽管如此,角质颚长度来常被用作头足类的种群鉴定(Vega et al,2002;Kassahn et al,2003;Doubleday et al,2009)。Vega 等(2002)根据角质颚长度分析显示,采自太平洋和大西洋的巴塔哥尼亚枪乌贼Loligo gahi分属3个不同种群。Kassahn等(2003)和 Doubleday等(2009)根据分子标记以及角质颚和内壳的形态分别分析了澳大利亚巨乌贼 S.apama和毛利蛸O.maorum复杂的种群结构。李思亮等(2010)认为角质颚长度差异可用来划分北太平洋柔鱼群体;在此基础上,Fang等(2014)通过角质颚和耳石长度的综合判别分析,将北太平洋柔鱼划分为东部和西部两个群体。Liu等(2015)根据角质颚长度对茎柔鱼潜在的地理种群进行了划分,判别成功率达到 89.5%。除此之外,研究还显示,角质颚长度用作头足类的性别鉴定也有一定的效果,例如,鉴定茎柔鱼性别的成功率超过 60% (Liu et al,2015)。
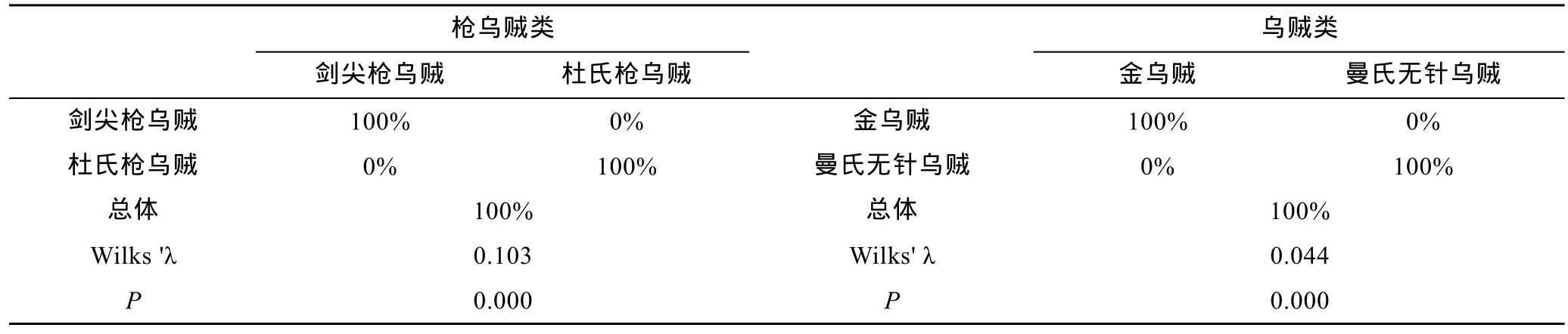
表5 基于角质颚长度的枪乌贼和乌贼类种间判别成功率、Wilks’ λ和P值Tab.5 Successful discrimination rate,Wilks' λ and P for loliginids and cuttlefishes with beak morphometric variables
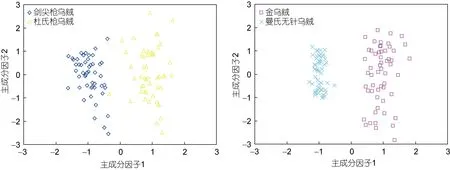
图3 基于角质颚长度的枪乌贼和乌贼类主成分分析因子散点图Fig.3 Plot of factorial scores of PCA made with beaks morphometric variables of loliginids and cuttlefishes with beak morphometric variables
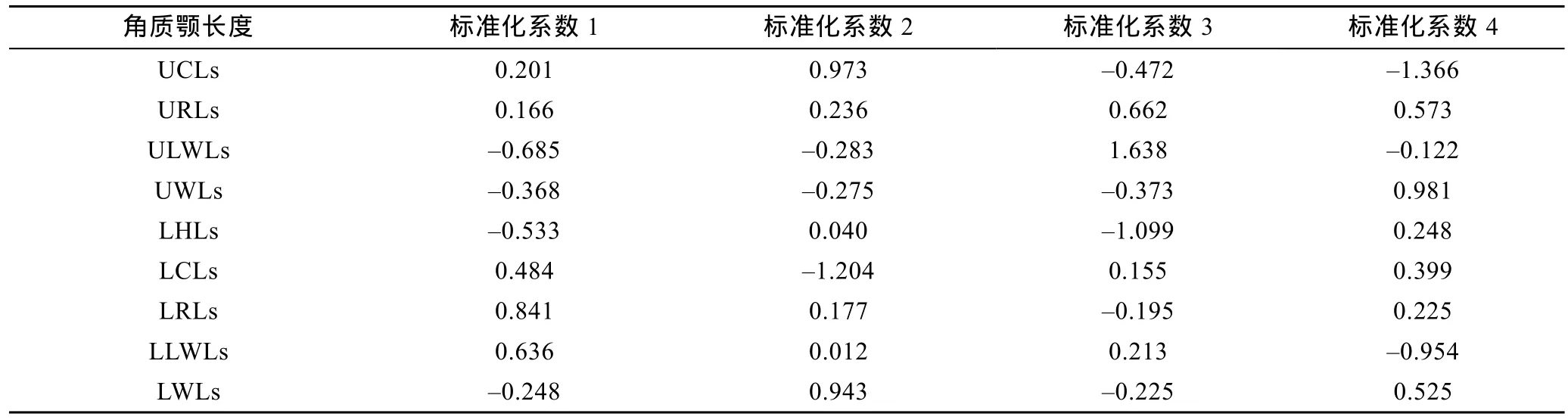
表6 五种头足类角质颚标准化长度典型判别分析标准化系数Tab.6 Canonical discriminant function (DF)coefficients for DF1,DF2,DF3 and DF4 for each standardized morphometric variables used in the discriminant function analysis for 5 cephalopods
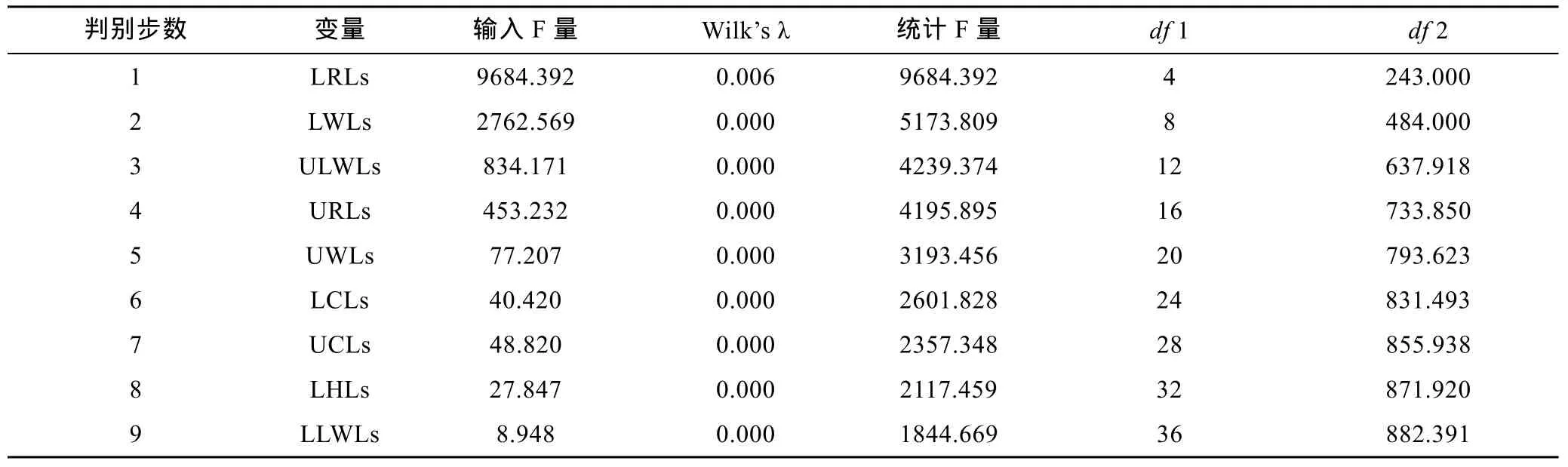
表7 基于角质颚标准化长度的逐步判别分析结果Tab.7 Summary of stepwise discriminant analysis showing the order of variables to entry

表8 基于角质颚长度的头足类种类判别成功率Tab.8 The successful discrimination rate for the five species based on standardized beak morphometric variables

表9 基于角质颚标准化长度的枪乌贼和乌贼类种间判别成功率、Wilks’ λ和P值Tab.9 Successful discrimination rate,Wilks' λ and P for loliginids and cuttlefishes with standardized beak morphometric variables

图4 基于角质颚标准化长度的枪乌贼和乌贼类主成分分析因子散点图Fig.4 Plot of factorial scores of PCA made with beaks morphometric variables of loliginids and cuttlefishes with standardized beak morphometric variables
由于头足类的软体组织形态不够稳定,因此用作种类或种群判定的效果不好(Martínez et al,2002)。此外,其另外一个重要缺陷就是化学结构不稳定、极易腐蚀,这对样品的保存、获取途径等要求极高。然而,角质颚不仅形态特征明显,而且其化学结构异常稳定(Miserez et al,2007)、极耐腐蚀,常残留于头足类捕食者的胃中,是大型捕食动物食性分析的理想材料(Xavier et al,2011)。因此,在缺少其它分类性状,尤其对捕食动物的胃含物分析时,角质颚的形态是头足类分类鉴定的重要依据。根据胃含物中残留的角质分析显示,鱼类(Cherel et al,2004)、鲸类(Clarke et al,1998)、海豚(Blanco et al,2006)、海鸟(Piatkowski et al,2001)等都是头足类的主要捕食者。
4 结论
我国近海的剑尖枪乌贼、杜氏枪乌贼、金乌贼、曼氏无针乌贼、短蛸等5种常见经济头足类的角质颚长度差异十分显著,根据角质颚长度的差异可对其进行种类判别,判别效果显著,然而标注化后的角质颚长度鉴定头足类种类的效果更好。过去的研究显示仅凭角质颚形态上的差别来判定分类地位相近或栖息环境相似的头足类的效果不佳,而本研究揭示角质长度的差异更适合解决此类问题。因此,本研究方法的提出将大大提高角质颚在头足类种类鉴定中的作用,为进一步分析不同头足类物种在海洋生态系统中所扮演的角色提供了前期基础。此外,以往的研究还显示,角质颚长度在头足类种群甚至性别鉴定上都起着重要作用,因此,希望今后重点在种群鉴定方面开展相关研究,丰富头足类种群研究方法,为我国近海头足类资源合理开发利用提供基础。
刘必林,陈新军,2009.头足类角质颚的研究进展.水产学报,33(1): 157—164
刘必林,陈新军,2010.印度洋西北海域鸢乌贼角质颚长度分析.渔业科学进展,31(1): 8—14
许嘉锦,2003.Octopus与Cistpous属章鱼口器地标点之几何形态学研究.台湾: 国立中山大学海洋生物研究所硕士学位论文,66
李思亮,陈新军,刘必林等,2010.利用角质额判别西北太平洋柔鱼种群结构.北京: 中国科技论文在线,http: //www.paper.edu.cn/releasepaper/content/201007-514
郑小东,王如才,刘维青,2002.华南沿海曼氏无针乌贼Sepiella maindroni表型变异研究.青岛海洋大学学报,32(5): 713—719
董正之,1991.世界大洋经济头足类生物学.济南: 山东科学技术出版社,3—4
Blanco C,Raduán M Á,Raga J A,2006.Diet of Risso’s dolphin(Grampus griseus)in the western Mediterranean Sea.Sci Mar,70(3): 407—441
Chen X J,Lu H J,Liu B L et al,2012.Species identification of Ommastrephes bartramii,Dosidicus gigas,Sthenoteuthis oualaniensis and Illex argentinus (Ommastrephidae)using beak morphological variables.Sci Mar,76(3): 473—481
Cherel Y,Duhamel G,2004.Antarctic jaws: cephalopod prey of sharks in Kerguelen waters.Deep Sea Res I,51(1): 17—31
Clarke M R,1962.The identification of cephalopod beaks and the relationship between beak size and total body weight.Bull Br Mus Nat Hist Zool,8: 4l9—480
Clarke M R,1986.A Handbook for the Identification of Cephalopod Beaks.Oxford,UK: Clarendon Press,273
Clarke M R,Macleod N,1974.Cephalopod remains from a sperm whale caught off Vigo,Spain.Journal of Marine Biology Association of the United Kingdom,54: 959—968
Clarke M R,Young R,1998.Description and analysis of cephalopod beaks from stomachs of six species of odontocete cetaceans stranded on Hawaiian shores.Journal of Marine Biological Association of the UK,78(2):623—641
Doubleday Z A,Semmens J M,Smolenski A J et al,2009.Microsatellite DNA markers and morphometrics reveal a complex population structure in a merobenthic octopus species (Octopus maorum)in south-east Australia and New Zealand.Mar Biol,156(6): 1183—1192
Fang Z,Liu B L,Li J H et al,2014.Stock identification of neon flying squid (Ommastrephes bartramii)in the North Pacific Ocean on the basis of beak and statolith morphology.Sci Mar,78(2): 239—248
Kassahn K S,Donnellan S C,Fowler A J et al,2003.Molecular and morphological analyses of the cuttlefish Sepia apama indicate a complex population structure.Mar Biol,143(5):947—962
Kubodera T,Furuhashi M,1987.A Manual for Identification of Myctophid Fishes and Squids in the Stomach Contents.Japanese: the fisheries agency of Japan,65
Lefkaditou E G,Bekas P,2004.Analysis of beak morphometry of the horned octopus Eledone cirrhosa (Cephalopoda:Octopoda)in the Thracian Sea (NE Mediterranean).Medit Mar Sci,5(1): 143—149
Liu B L,Fang Z,Chen X J et al,2015.Spatial variations in beak structure to identify potentially geographic populations of Dosidicus gigas in the Eastern Pacific Ocean.Fish Res,164:185—192
Lu C C,Ickeringill R,2002.Cephalopod Beak Identification and Biomass Estimation Techniques: Tools for Dietary Studies of Southern Australian Finfishes.Museum Victoria Science Reports,6: 1—65
Martínez P,Sanjuan A,Guerra A,2002.Identification of Illex coindetii,I.illecebrosus and I.argentinus (Cephalopoda:Ommastrephidae)throughout the Atlantic Ocean;by body and beak characters.Mar Biol,141(1): 131—143
Miserez A,Li Y L,Waite J H et al,2007.Jumbo squid beaks:inspiration for design of robust organic composites.Acta Biomater,3(1): 139—149
Piatkowski U,Pütz K,Heinemann H,2001.Cephalopod prey of king penguins (Aptenodytes patagonicus)breeding at Volunteer Beach,Falkland Islands,during austral winter 1996.Fish Res,52(1—2): 79—90
Pineda S E,Aubone A,Bruneth N E,1996.Identificaión Y morfometría comparada de las mandibulas de Loligo gahi Y Loligo sanpaulensis (Cephalopoda,Loliginidae)del Atlantico Sudoccidental.Rev Invest Des Pesq,10: 85—99
Smale M J,Clarke M R,Klages N T W et al,1993.Octopod beak identification-resolution at a regional level (Cephalopoda,Octopoda: Southern Africa).South Afr J Mar Sci,13(1):269—293
Vega M A,Rocha F J,Guerra A et al,2002.Morphological differences between the Patagonian squid Loligo gahi populations from the Pacific and Atlantic Oceans.Bulletin of Marine Science,71(2): 903—913
Xavier J C,Cherel Y,2009.Cephalopod Beak Guide for the Southern Ocean.Cambridge,UK: British Antarctic Survey,129
Xavier J C,Clarke M R,Magalhães M C et al,2007.Current status of using beaks to identify cephalopods: III International Workshop and training course on Cephalopod beaks,Faial island,Azores,April 2007.Life Mar Sci,24: 41—48
Xavier J C,Phillips R A,Cherel Y,2011.Cephalopods in marine predator diet assessments: why identifying upper and lower beaks is important.ICES J Mar Sci,68(9): 1857—1864

