新疆传统干酪中1株产广谱细菌素乳酸菌的筛选及其生物学特性
杨尚娇,倪亚雯,倪永清*
(石河子大学食品学院,新疆 石河子 832000)
细菌素是不同于抗生素的一种抑菌物质,其是一类在细菌代谢过程中通过核糖体合成机制产生的具有抑菌活性的蛋白质或多肽[1]。乳酸菌代谢产生的细菌素称为乳酸菌素[2]。细菌素一般可以广泛抑制革兰氏阳性(G+)腐败菌和致病菌,有些甚至可以抑制某些革兰氏阴性菌(G-)、真菌和病毒的生长,同时,细菌素对产生菌自身有免疫性[3]。细菌素被称为“生物食品保鲜剂”,其优势在于无毒、无抗药性、无副作用、无残留,能够取代化学防腐剂和抗生素在食品生产过程中的使用,在食品保鲜领域具有巨大的开发应用价值[4]。如今,在食品工业中应用多种乳酸菌素抑制食物腐败菌和病原微生物的生长。文献报道的乳酸菌素主要是乳球菌属的双球菌素(Diplococcin)、乳酸链球菌素(Nisin)、乳球菌素(Lactococcin)、片球菌素(Pediocin)、肉食杆菌素(Camobacteriocin)、乳杆菌素(Lactocin)、明串珠菌素(Leuconostocin)、植物乳杆菌素(Plantaricin)、肠球菌素(Enterocin)等[5]。本研究从新疆多地采取牧民自制干酪样品中分离乳酸菌,用牛津杯法筛选出1株对革兰氏阳性菌葡萄球菌、枯草芽孢杆菌、李斯特氏菌和革兰氏阴性菌大肠杆菌均具有明显抑制作用的乳酸菌,经排除酸、过氧化氢干扰,胃蛋白酶和胰蛋白酶处理后,仍然具有较好的抑菌活性。研究其生物学特性和抑菌谱,表明此菌株具有较为广泛的应用价值,为开发安全的食品生物保鲜乳酸菌及其生产应用奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 样品来源
从新疆伊宁、巩留、可可托海、昭苏、那拉提、新源等地随机采取牧民自制奶制品样品。
1.1.2 菌种及试剂
大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)、李斯特氏菌(Listeria monocytogenes):实验室保存。金黄色葡萄球菌(Staphylococcus aureus)CICC21600:中国工业微生物菌种保藏管理中心。
试验所用试剂均购自天津市巴斯夫化学试剂厂。胰蛋白酶(活性>250U/mg),胃蛋白酶(活性:3.0~3.5NFU/mg)。
1.1.3 培养基
①LB培养基:蛋白胨10 g,酵母提取物5 g,NaCl 10 g,蒸馏水1 000 mL,pH 7.0,121 ℃高压蒸汽灭菌15 min。②改良MRS培养基[6]:蛋白陈10 g,牛肉膏10 g,酵母提取物5 g,K2HPO42 g,柠檬酸二铵2 g,乙酸钠5 g,葡萄糖20 g,吐温-80 1 mL,MgSO4·7H2O 0.588 g,MnSO4·H2O 0.25 g,琼脂15 g,蒸馏水1 000 mL,pH 6.2~6.4,121 ℃高压蒸汽灭菌15 min。③分离培养基:Elliker琼脂培养基、M17培养基、胆汁七叶灵苷叠氮钠培养基和乳酸杆菌选择性培养基。
1.2 仪器与设备
5810R高速冷冻离心机:德国Eppendorf仪器公司;LAC-5040S全自动高压灭菌锅:韩国LabTech公司;PHS-3C标准pH计:上海精密科学仪器有限公司;TC-512PCR扩增仪:美国Techne公司;PowerPac Universal水平电泳仪、Gel DOC XR凝胶成像系统:美国BioRad公司;CX21光学显微镜:日本Olympus公司;UVmini-1240紫外分光光度计:日本岛津公司;SW-CJ超净工作台:苏州安泰空气技术有限公司;HH-42恒温水浴锅:常州国华仪器有限公司。
1.3 试验方法
1.3.1 乳酸菌分离
1 g干酪放入装有100 mL无菌水的三角瓶中→37 ℃摇床振荡40 min→菌悬液
吸取菌悬液,采用梯度稀释法涂布于分离培养基上。37 ℃厌氧培养2 d,根据菌落颜色、形态、大小、凸凹等表型差异进行初步分离筛选并纯化,所得纯培养物转接到MRS固体培养基上,4 ℃保藏备用。
1.3.2 乳酸菌发酵上清液的制备
将菌株接种到MRS液体培养基中,于30 ℃厌氧培养24 h,离心(10 000 r/min、10 min、4 ℃)获得上清液,并用0.22 μm微孔滤膜过滤得到无细胞发酵上清液,于4 ℃保存备用。
1.3.3 指示菌菌悬液的制备
分别挑取已活化的四种指示菌接种于5 mL LB培养基,37 ℃培养24 h,测其浓度,用无菌生理盐水稀释成107CFU/mL菌悬液,于4 ℃保存备用。
1.3.4 牛津杯法初筛具有抑菌活性的乳酸菌
将100 μL指示菌菌悬液均匀涂布在LB培养基上,在每个平皿中等距离放置4个牛津杯,其中3个牛津杯中加入200 μL乳酸菌上清液,其余加入等量的MRS培养基作为对照,标注菌株号,于37 ℃培养16 h,观察抑菌圈。
1.3.5 产细菌素乳酸菌复筛
按照参考文献进行排除有机酸、过氧化氢试验及蛋白酶敏感性试验[7-8]。
1.3.6 产细菌素乳酸菌的鉴定
菌株的细胞形态、菌落形态、革兰氏染色、生理生化试验参照文献[10-11]进行。尿素法提取菌株DNA,PCR扩增并测序,将所测得的16S rDNA序列提交到GenBank数据库中,用BLAST进行相关序列的比对。
1.3.7 菌株KKTHD13生物学性质的研究
(1)热稳定性
将KKTHD13发酵上清液在30 ℃、40 ℃、60 ℃、80 ℃、100 ℃、121 ℃水浴锅中分别放置培养20 min以及冰浴处理20 min,将未处理发酵上清液作阳性对照,分别测定抑菌活性。
(2)pH稳定性
将KKTHD13发酵上清液用1 mol/L HCl或者1 mol/L NaOH调节pH值2~12,室温培养2 h,再将pH值调至6.0,测试其抑菌性。
(3)表面活性剂处理
选择十二烷基硫酸钠(sodium do decyl sulfate,SDS)、Tween 80、乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、Triton X-100和尿素(urea)五种表面活性剂,以1 mg/100 mL添加到待测乳酸菌发酵上清液中,置于37 ℃处理5 h。以不添加表面活性剂空白培养基作为阳性对照,检测其残余抑菌活性,每个处理做三个平行试验,取其平均值。
(4)蛋白酶敏感性
为进一步检测KKTHD13发酵上清液对蛋白酶的敏感性,选取胰蛋白酶和胃蛋白酶对发酵上清液进行处理。先将发酵上清液的pH值调节至各种酶反应的最适pH值,再向发酵上清液中添加各种酶,置于37 ℃培养2 h,再置于沸水浴中灭酶处理5 min。以未经酶处理的发酵上清液中作为阳性对照,检测其抑菌活性,每个处理做三个平行试验,取其平均值。
1.3.8 抑菌谱
选定一些常见革兰氏阳性(G+)和革兰氏阴性(G-)的致病菌和腐败菌作为指示菌,测定细菌素的抑菌谱。
2 结果与分析
2.1 产细菌素乳酸菌的筛选结果
以大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、李斯特菌(Listeria monocytogenes)及枯草芽孢杆菌(Bacillus subtilis)作为指示菌,从分离纯化得到的34株乳酸菌中筛选出8株具有抑菌活性的菌株,采用牛津杯法初筛具有抑菌活性的乳酸菌,结果见表1。
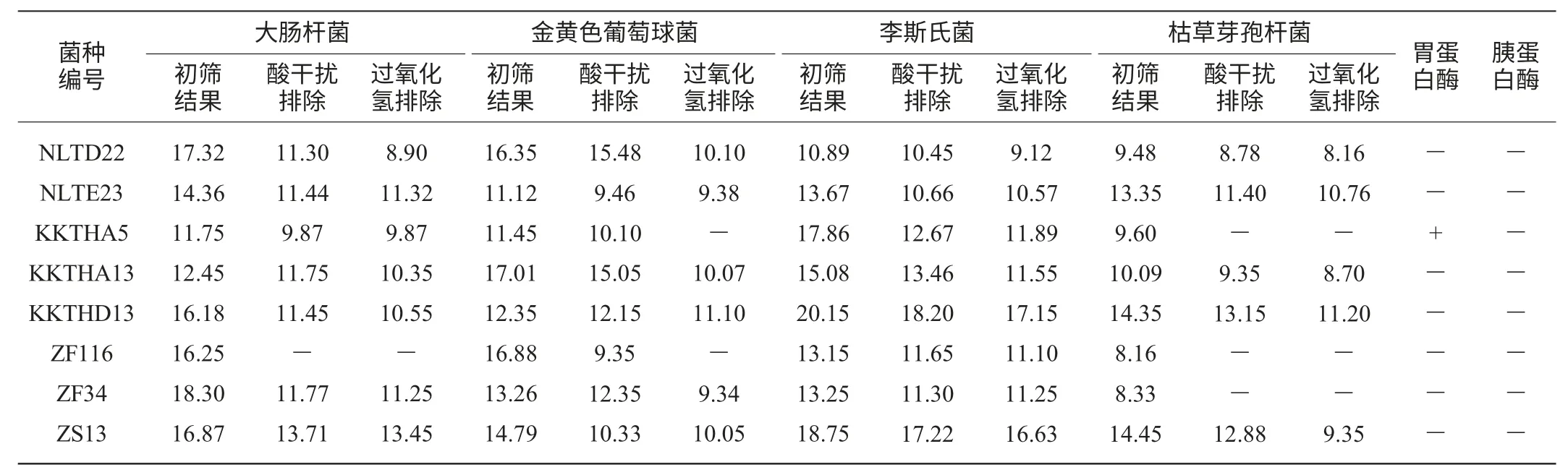
表1 抑菌试验结果Table 1 Results of bacteriostatic test mm
由表1可知,通过酸干扰排除和过氧化氢排除试验,8株菌产生的抑菌圈直径都有不同程度的缩小,表明这些乳酸菌所产生的酸和过氧化氢在一定条件下对指示菌具有抑制作用,但是排除酸和过氧化氢作用后抑菌活性仍然存在,证明其抑菌活性并非全部由酸和过氧化氢引起,很有可能是细菌素作用产生的。
鉴于细菌素的蛋白性质,通过酶解试验来确定乳酸菌对指示菌起抑制作用的物质是否为细菌素。表1中酶解试验结果表明,经胃蛋白酶和胰蛋白酶处理后,抑菌圈几乎消失,菌株所产抑菌物质的抑菌活性明显下降,可见抑菌物质对蛋白酶较敏感,说明抑菌物质为蛋白质类物质,可初步确定抑菌物质为细菌素。
在本研究中,经过牛津杯法初筛、酸干扰排除试验和过氧化氢排除试验,由表1数据可知,菌株KKTHD13抑菌效果最稳定,抑菌活性最好,以下试验均以菌株KKTHD13作为目标菌株。
2.2 产细菌素的乳酸菌的鉴定
KKTHD13菌株的形态学试验结果见图1。由图1可知,该菌株G+,细胞呈球状,成对或短链状排列,无鞭毛、无芽孢、无荚膜。菌落直径约1 mm、乳白色、圆形、凸起、边缘整齐、表面光滑。
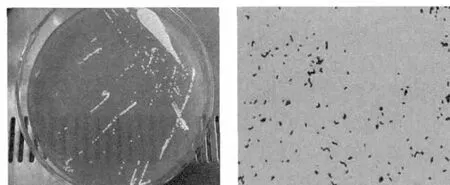
图1 KKTHD13菌株形态及革兰氏染色Fig.1 Colony characteristic and cell morphology of strain KKTHD13
根据东秀珠、蔡妙英《常见细菌系统鉴定手册》所进行的生理生化试验,结果见表2。由表2可知,菌株接触酶试验、甲基红试验、硝酸盐还原试验及精氨酸试验均呈阴性,且V-P试验阳性;耐盐性试验表明,菌株生长NaCl含量范围在0~6%左右,盐含量>6%时即停止生长;除了木糖不能利用,其他试验13种糖及醇都能利用。
综合以上菌株的特性,对照《伯杰细菌鉴定手册(第九版)》[9]、《乳酸菌分类鉴定及试验方法》[10]及《常见细菌系统鉴定手册》[11],初步将KKTHD13菌株鉴定为肠球菌属(Enterococcussp.)。

表2 菌株KKTHD13生理生化试验Table 2 Physiological and biochemical characteristics of strain KKTHD13
进一步对菌株KKTHD13的16S rRNA基因序列同源性分析并构建系统发育树,结果见图2。由图2可知,菌株KKTHD13隶属于肠球菌属(Enterococcussp.),与已知种屎肠球菌(Enterococcus faecium)系统发育关系最近,序列同源性达到99%,同时与肠球菌其他几个种的亲缘关系也较近,其中与蒙氏肠球菌(Enterococcus mundti)的16S rRNA基因序列同源性达到98%,与鸟肠球菌(Enterococcus avium)、苍黄肠球菌(Enterococcus gilvus)、耐久肠球菌(Ente rococcus durans)、铅黄肠球菌(Enterococcus casseliflavus)等的同源性也在95%以上,因此依据微生物种鉴定的通用标准[15],在种水平上不能明确该菌株的系统发育地位,初步确定该菌为肠球菌属(Enterococcussp.)。
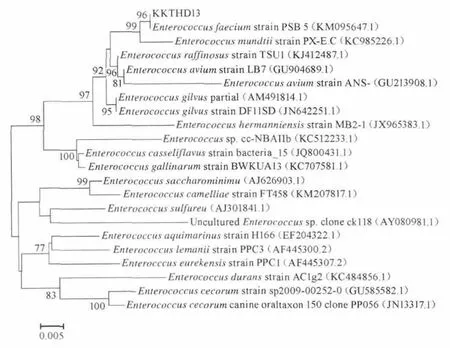
图2 基于16S rRNA 基因序列构建KKTHD13系统发育树Fig.2 Phylogenetic tree of strain KKTHD13 based on 16S rRNA gene partial sequences
2.3 菌株KKTHD13生物学性质的研究
菌株KKTHD13生物学性质研究结果见表3。
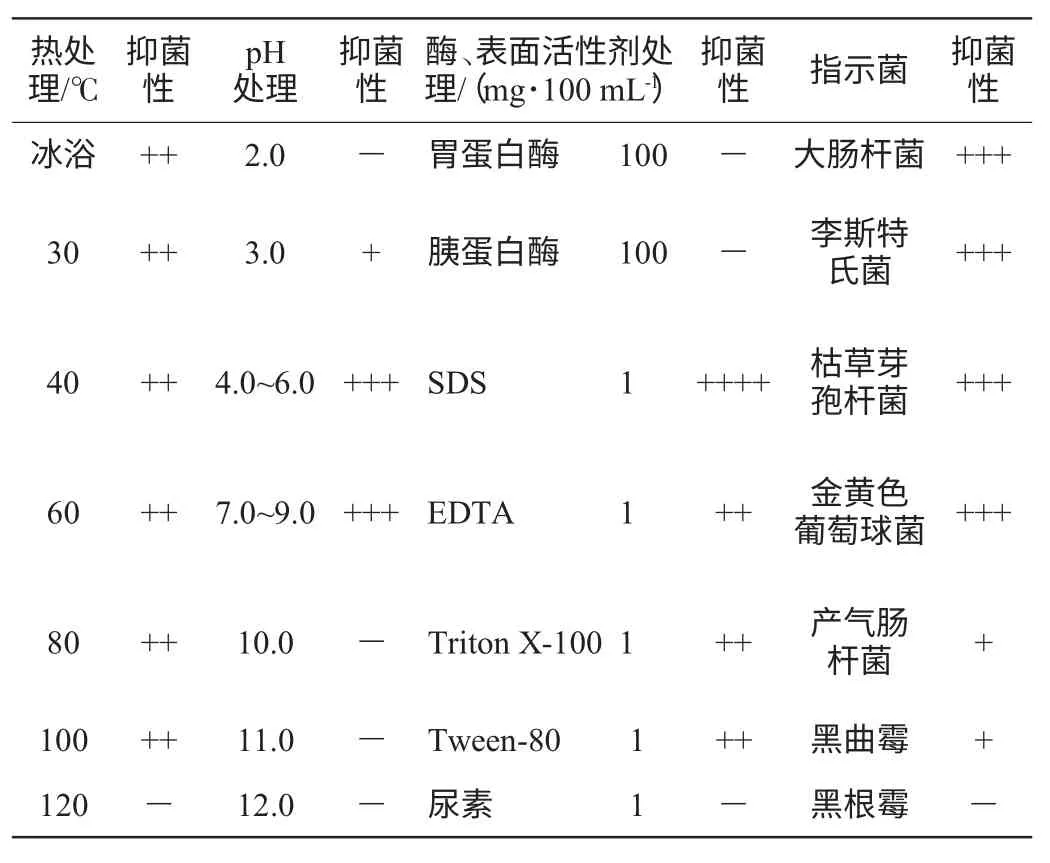
表3 热、p H、酶、表面活性剂对KKTHD13细菌素活性的影响及抑菌谱Table 3 Effect of temperature,p H,enzyme and surfactant on the antibacterial activity of bacteriocin KKTHD13 and its antimicrobial spectrum
由表3可知,随着处理温度的升高,细菌素的抑菌活性逐渐降低,但变化不明显,在121 ℃处理20 min后,基本失去抑菌活性,说明KKTHD13菌株所产生的细菌素具有一定的热稳定性。
由表3可知,在pH 4.0~6.0的微酸条件下,KKTHD13细菌素的抑菌圈直径最大,表明具有最强的抑菌活性,相反在pH 3.0时抑菌活性反而下降,pH 2.0时抑菌活性甚至消失,排除酸对细菌素的抑菌活性影响。KKTHD13细菌素的抑菌活性在相对较宽的pH范围(pH 3.0~9.0)内都很稳定。酶及表面活性剂试验结果表明,经胰蛋白酶和胃蛋白酶处理后的发酵上清液完全丧失抑菌活性,说明菌株的发酵上清液中的抑菌物质对蛋白酶比较敏感。菌株KKTHD13产生的细菌素在1 mg/100 mL的SDS、EDTA、Triton X-100、Tween-80存在条件下抑菌活性仍然保持稳定,在尿素(urea)处理后抑菌活性消失。本研究试验结果与植物乳杆菌素C19[12]、片球菌素ST18[13]的研究结果基本一致。
2.4 菌株KKTH13 细菌素的抑菌谱
利用菌株KKTHD13 产生的细菌素对枯草芽孢杆菌、李斯特氏菌、产气肠杆菌、大肠杆菌、金黄色葡萄球菌及部分真菌进行抑菌试验[14]。结果(表3)可知,菌株KKTHD13细菌素不仅对枯草芽孢杆菌、金黄色葡萄球菌等革兰氏阳性菌有较强的抑制作用,对大肠杆菌、产气肠杆菌等革兰氏阴性菌也有较强的抑制作用,而且对部分真菌也有抑制作用,说明该菌株所产细菌素具有较广泛的抑菌谱。
3 结论
本试验从新疆传统发酵干酪中利用牛津杯法筛选得到一株对革兰氏阳性菌枯草芽孢杆菌、金黄色葡萄球菌、李斯特菌及革兰氏阴性菌大肠杆菌有较好抑制作用的乳酸菌KKTHD13,鉴定为粪肠球菌属(Enterococcussp.)。菌株KKTHD13对指示菌没有抑制作用,其发酵上清液具有较好的抑菌性,说明具有抑菌作用的物质存在于乳酸菌KKTHD13的代谢产物中。排除了酸、过氧化氢的干扰后,KKTHD13的发酵上清液仍然具有较强的抑菌作用,说明其代谢产物中还有其他的抑菌物质。该抑菌物质在酸性条件下稳定,对胰蛋白酶和胃蛋白酶敏感,根据细菌素的定义可知,KKTHD13所产生的抑菌物质为细菌素类物质。KKTHD13的发酵上清液具有较好的热稳定性。经过1 mg/100 mL 的SDS、EDTA、Triton X-100、Tween-80处理下抑菌活性仍然保持稳定,预期在食品生物保鲜中,在酸性、中性以及弱碱性环境中均具有应用潜能。
[1]靳慧杰.细菌素及其在干酪中的应用[J].中国乳业,2007(1):35-36.
[2]邹 鹏.产细菌素乳酸茵分离鉴定及培养条件的研究[D].哈尔滨:黑龙江大学硕士论文,2006.
[3]MATSUMOTO-NAKANO M,KURAMITSU H K.Role of bacteriocin immunity proteins in the antimicrobial sensitivity of Streptococcus mutans[J].J Bacteriol,2006,188(23):8095-8102.
[4]吴荣荣,张 良,王 倩.产细菌素乳酸菌的选育及抑菌特性的研究[J].中国酿造,2009,28(6):25-27.
[5]杨洁彬,郭兴华,张 篪,等.乳酸菌:生物学基础及应用[M].北京:中国轻工业出版社,1996.
[6]凌代文.乳酸细菌分类鉴定及试验方法[M].北京:中国轻工业出版社,1999.
[7]董彩文,毛多斌,白燕红,等.产广谱细菌素口乳杆菌菌株的筛选和鉴定[J].食品工业科技,2009,30(5):129-133.
[8]李 悦,孙玉梅,杨 红,等.产细菌素乳酸菌的筛选及其发酵特性[J].大连工业大学学报,2008,27(1):19-21.
[9]R.E.布克南,N.E.吉姆斯.伯杰细菌鉴定手册[M].北京:科学出版社,2004.
[10]凌代文,东秀珠.乳酸细菌分类鉴定及试验方法[M].北京:中国轻工业出版社,1999.
[11]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001.
[12]ATRIH A,REKHIF N,MOIR A J G,et al.Mode of action,purification and amino acid sequence of plantaricin C19,an anti-listeria bacteriocin produced byLactobacillus plantarumC19[J].Int J Food Microbiol,2001,68(1-2):93-104.
[13]TODOROV S D,DICKS L M T.Pediocin ST18,an anti-listerial bacteriocin produced byPediococcus pentosaceusST18 isolated from boza,a traditional cereal beverage from Bulgaria[J].Process Biochem,2005,40(1):365-370.
[14]曹珂珂,王 娣,李 妍.1 株产广谱细菌素乳酸菌的筛选及其抑菌物质的特性[J].食品与发酵工业,2012,38(11):89-91.
[15]ROSSELL M R,AMANN R.The species concept for prokaryotes[J].FEMS Microbiol Rev,2001,25(1):39-67.

