运动干预通过纹状体MSNs结构可塑性改善PD模型大鼠行为功能
陈巍 时凯旋 刘晓莉
1 北京师范大学体育与运动学院(北京100875)
2 河北科技师范学院体育系
帕金森病(Parkinson’s disease, PD)是全球第二大神经退行性病变, 其病理学基础是中脑黑质致密部多巴胺(dopamine, DA)能神经元变性脱失及纹状体DA含量显著减少[1]。 源自黑质致密部的DA能神经元终末与纹状体中等多棘神经元(medium spiny neurons, MSNs)树突棘颈部形成突触,而源自皮层的谷氨酸(glutamate,Glu)能终末与MSNs树突棘头部构成突触,这种特殊的毗邻特征为DA对纹状体Glu能传入的调节以及MSNs对纹状体神经元信息整合和运动功能调节提供了重要的解剖学基础[2]。 有研究发现,PD患者与PD动物模型纹状体MSNs树突棘密度均出现下降,而且这种形态变化与行为功能障碍的出现具有一致性[3,4];Wonju等的研究甚至还发现, 在DA能神经元大量坏死的情况下,MSNs树突形态的重塑仍有助于改善PD模型动物的行为功能[5]。目前已经明确,DA缺失是纹状体MSNs树突棘脱落的“起始事件”,由此引发的皮层Glu释放增多激活突触后膜Glu受体是影响突触后神经元胞内信号转导的直接因素[2]。 纹状体内α-氨基-3-羟基-5-甲基-4-异恶唑丙酸 (a-amino-3-hydroxy-5-methy1-4-isoxa-zoleppropionate,AMPA)受体主要由GluR1和GluR2两种亚基构成, 其组分比例不仅决定受体功能特性而且直接影响突触后膜对Ca2+的通透性[6]。有证据表明,运动具有重塑啮齿类动物纹状体MSNs树突结构的作用[7]。 运动训练对改善PD患者与模型动物行为功能障碍也有显著效果[8,9]。 由此推测,运动干预可能通过调节纹状体MSNs形态结构的可塑性改善PD相关行为功能障碍, 但迄今为止仍未见到直接的实验证据。为此,本研究通过观察运动干预后PD模型大鼠纹状体MSNs树突棘形态变化与行为功能改善的关系, 揭示运动干预治疗PD的神经解剖学机制。
1 实验材料与研究方法
1.1 实验对象及分组
选用清洁级SD雄性大鼠(体重220~240 g)为实验对象, 实验动物由北京华阜康生物科技股份有限公司提供,生产许可证号:SCXK(京)2009-0007。 所有大鼠实行分笼饲养,自由饮食,自然光照,动物房室内温度控制在20~25℃,相对湿度为45%~50%。 大鼠进入实验室后适应性饲养7天,随机分为4组:假手术组(Control组,n = 14)、假手术运动组(Control+Ex组,n = 14)、PD模型组(PD组,n = 14)、PD模型运动组(PD+Ex组,n =14)。
1.2 主要实验仪器
数显动物脑立体定位仪(深圳,瑞沃德)、微量进样器(瑞士Hamilton)、颅骨钻(美国Foredom)、动物跑台(杭州,段氏DSPT-202型)、冷冻切片机(德国,Leica)、石蜡包埋机(德国,Leica)、石蜡切片机(德国,Leica)、5417R离心机(德国,艾本德)、显微镜(奥林巴斯BX61-DP72)。
1.3 主要试剂
水合氯醛、6-羟基多巴胺 (6-hydroxydopamine, 6-OHDA)和阿扑吗啡(apmorphine, APO)购自sigma公司;冰冻切片神经元高尔基法快速染色试剂盒 (美国,GENMED)由上海杰美基因医药科技有限公司提供;谷氨酸受体1抗体(Anti-GluR1/AMPA) 与2抗体 (Anti-GluR2/AMPA) 由北京博奥森生物科技有限公司提供,其它常规试剂为国产的分析纯。
1.4 研究方法
1.4.1 PD大鼠模型的建立与评价
实验前用含0.02% 抗坏血酸的生理盐水配制成浓度为2 μg/μL的6-OHDA溶液, 进行分装后立即置于-80 ℃超低温环境避光保存。 采用10%水合氯醛溶液(3.5 mL/kg)对PD和PD+Ex组大鼠进行腹腔注射, 大鼠进入深度麻醉后,以平颅位将其固定于脑立体定位仪上,皮肤消毒后实施手术,暴露包括前囟前0.5 cm至后囟后0.4 cm的手术野。 根据Paxinos等[10]大鼠脑立体定位图谱定位右侧前脑内侧束(MFB:AP:-4.3 mm,R:1.5 mm,V:7.6 mm),采用高速颅骨钻对颅骨钻孔,用微量进样器将4 μL的6-OHDA溶液注入到右侧MFB(1.0 mm/min的速度缓慢进针,1 μL/min的速度注射),注射完毕后留针5 min,再以1.0 mm/min速度缓慢退针[11]。 Control与Control+Ex组大鼠采用同样的方法注射同等剂量含0.02% 抗坏血酸的生理盐水。 对伤口进行消毒缝合后置所有大鼠回笼单只饲养。 造模后7、14、28天,对大鼠颈部皮下注射APO(0.5 mg/kg)诱导旋转行为,注射药物3 min后开始记录每只大鼠的旋转圈数。 30 min内大鼠向健侧旋转圈数与向损毁侧旋转圈数的差值>100转作为6-OHDA诱导PD大鼠模型成功的标准[12]。
1.4.2 运动干预方案
Control+Ex与PD+Ex组大鼠在手术后24 h开始进行跑台运动干预。 依Tajiri等[9]运动方案共进行为期4周的运动干预(11 m/min,30 min/day,5 day/week,周一至周五9:00~11:00训练,周六、周日休息)。
1.4.3 行为学评价
采用圆桶试验(Cylinder Test)结合APO诱导的旋转行为测试评价大鼠的行为功能。 圆桶试验主要用于评价前肢活动的不对称性。 测试时将大鼠置于一个两端开口的透明树脂玻璃圆筒(内径20 cm,高30 cm)内,用高清摄像机记录3 min内大鼠前肢接触桶壁的次数:大鼠采用一侧前肢接触桶壁为该前肢触壁1次;如果该前肢在保持触壁的同时,对侧前肢也触壁1次,或两侧前肢同时接触桶壁,则为两侧前肢同时触壁1次。 大鼠左侧前肢接触桶壁比例的计算公式如下[13]:

同时,在6-OHDA注射后的第14和28天对各组大鼠进行APO诱导的旋转行为测试, 结合圆桶试验综合评价运动干预对PD大鼠行为功能的改善效果。
1.4.4 纹状体MSNs树突棘密度的观察
采用高尔基染色技术观察大鼠纹状体MSNs树突棘密度的变化。 每组大鼠各取8只,用10 %水合氯醛溶液(3.5 ml/kg)进行腹腔注射麻醉,使用37 ℃的生理盐水由心脏处灌注3次,每次50 ml以去除血液,然后快速取出脑组织,用无菌预冷的手术刀将脑组织切成0.5 cm厚的组织块,用高尔基染色试剂盒处理后,再用二甲苯透明并封片,在奥林巴斯显微镜下观察,并采用Image-Pro Plus 6.0软件进行图像分析。 从每只大鼠纹状体切片中选择背侧区 (与运动行为执行密切相关区域)2张切片,每张切片观察2个形态较完整的MSNs神经元。 这些神经元呈现胞体中等大小(直径约为15 μm),可见4~8条主树突且含有分支, 在远离胞体约30 μm树突上分布有密集的树突棘。 选取主树突第一次分支30~50 μm长度内计数树突棘个数, 以树突棘个数/10 μm表示其密度。
1.4.5 纹状体AMPA受体亚基表达
最后一次运动干预24 h后, 每组大鼠各取6只,采用10%水合氯醛溶液(3.5 mL/kg)进行腹腔注射麻醉,用37℃生理盐水和4℃的4%多聚甲醛经左心室-升主动脉插管灌流,快速取出脑组织块后置于4%多聚甲醛中后固定24 h,用不同浓度的乙醇进行梯度脱水、透明、浸蜡、包埋制成石蜡块,进行连续冠状切片,厚度约5 μm,将脑片附贴于涂有多聚赖氨酸的载玻片上,62℃恒温烤箱中烘烤60 min,然后进行染色。 主要步骤:常规二甲苯脱蜡(15 min×3),水化,PBS洗(3min×3),抗原修复15 min,PBS洗(5 min×3), 滴加3%双氧水在载玻片上,封闭20 min,PBS洗(5 min×3),正常山羊血清封闭20 min, 加一抗4 ℃孵育过夜,37 ℃复温20 min,PBS洗(5 min×3),二抗孵育20 min,PBS洗(5min×3),滴加辣根酶标记链霉卵白素37℃孵育20 min,PBS洗 (5 min×3),DAB显色约5 min,苏木素复染5 min,梯度脱水,透明, 封片。 应用奥林巴斯显微镜对纹状体背侧区域拍照。 采用Image-Pro Plus 6.0软件对免疫阳性细胞光密度(optical density,OD)进行分析,每个样本取平均值进行统计。
1.4.6 数据处理
应用SPSS18.0统计软件对所得实验数据进行统计学处理,计量资料以均数±标准差(±s)表示。 各组间均数的比较采用方差分析 (Two-Way ANOVA), 选择LSD检验对组间均值差异进行比较, 显著性水平为P <0.05。
2 研究结果
2.1 运动干预后PD大鼠行为能力的变化
APO诱导旋转试验结果显示,与Control组比较,第14天与28天PD和PD+Ex组大鼠旋转圈数均显著增加(均P <0.01);与PD组比较,第14天PD+Ex组大鼠旋转次数无显著变化(P >0.05),而第28天呈显著降低(P <0.05)。 Control和Control+Ex组大鼠无明显旋转现象发生,如表1所示。
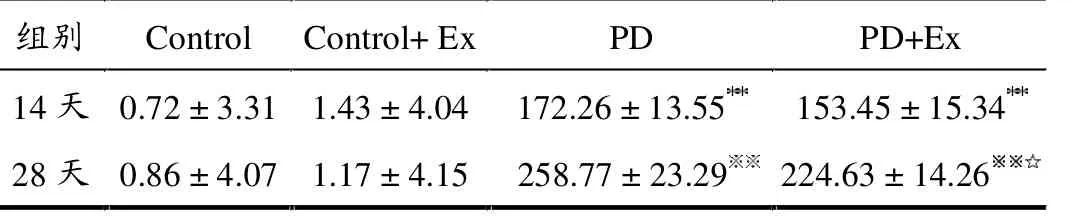
表1 各组大鼠APO诱导旋转次数变化
圆桶试验结果显示:与Control组比较,PD与PD+Ex组大鼠左侧前肢触壁的比例降低, 且差异均具有显著性(P <0.01),表明注射6-OHDA后大鼠左侧前肢的运动功能出现明显下降; 但PD+Ex组大鼠触壁次数较PD组显著增加(P <0.05),如图1所示。

图1 各组大鼠左侧前肢使用情况比较
2.2 运动干预后PD大鼠纹状体MSNs树突棘密度的变化
高尔基染色结果显示,与Control组(14.43 ± 2.03/10 μm)比较,Control+Ex组(15.14 ± 2.14/10 μm)大鼠纹状体MSNs树突棘密度未出现显著变化 (P >0.05),但PD组大鼠出现显著降低 (P <0.01); 与PD组比较,PD+Ex组大鼠纹状体MSNs树突棘密度显著增加(7.21 ±1.19/10 μm vs 12.57 ± 1.40/10 μm)(P <0.01), 如图2所示。
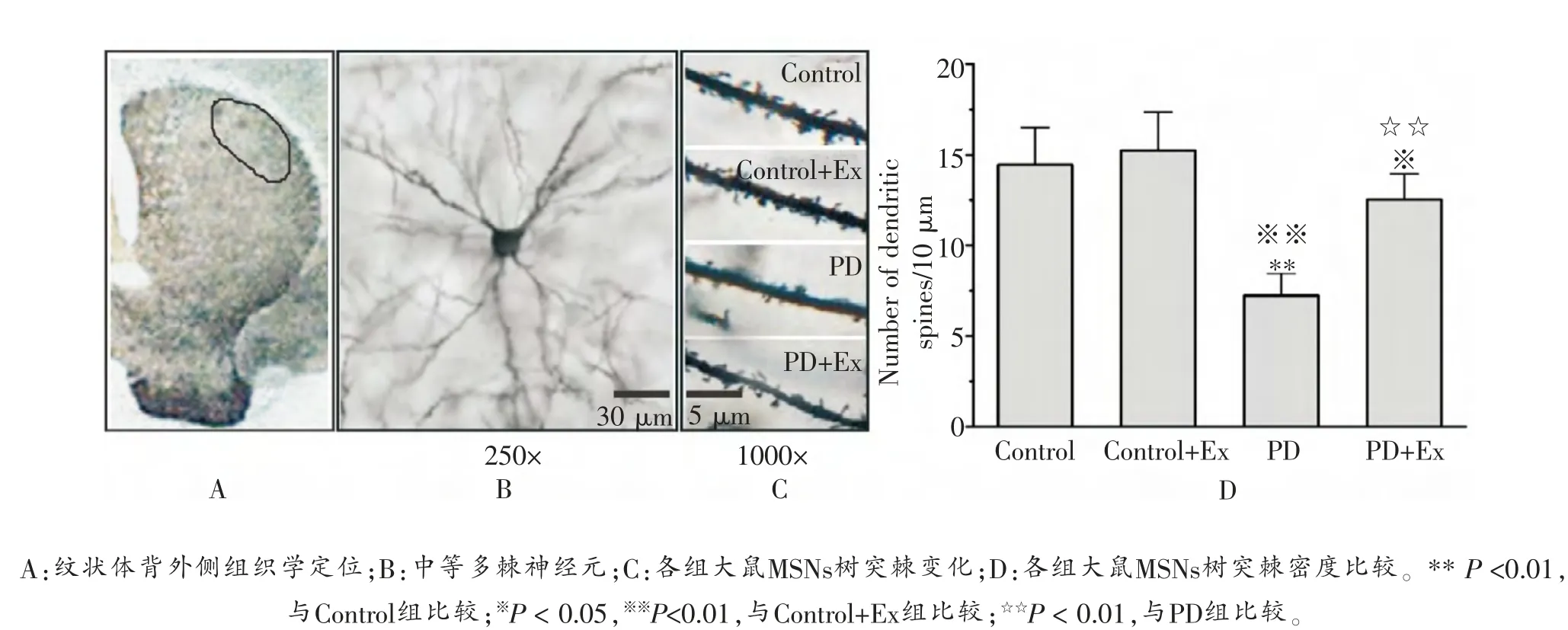
图2 各组大鼠纹状体MSNs树突棘密度比较
2.3 运动干预后PD大鼠纹状体AMPA受体亚基表达的变化
免疫组化染色结果显示,与Control组相比,PD组大鼠纹状体GluR2亚基表达下调,差异显著(P < 0.01);而GluR1亚基表达未见显著改变(P >0.05)。 此外,与PD组相比,PD+Ex组大鼠纹状体GluR2亚基表达上调,差异具有统计学意义(P < 0.01),而GluR1亚基表达没有显著性改变(P >0.05),如图3所示。
3 讨论

图3 各组大鼠纹状体GluR1和GluR2表达比较(200×)
基底神经节功能性紊乱与PD运动行为功能障碍存在密切关系。 纹状体是基底神经节中信息传导的主要核团之一,参与随意运动的程序编制与执行,在运动方向、顺序、速度、幅度以及运动可塑性调节等方面都具有重要作用[2,8]。 在纹状体神经元构筑中,MSNs约占其神经元总数的95%,MSNs树突及其分支上存在大量棘状突起,即树突棘,它是神经元之间形成突触的重要部位[2]。 MSNs同时接受皮层﹣纹状体通路的Glu能输入和黑质﹣纹状体通路的DA能输入, 分别通过MSN-GPi(直接通路易化运动)和MSN-GPe(间接通路抑制运动)调节基底神经节的功能[14,15],可见,MSNs形态结构可塑性对运动功能的调控具有重要意义。 PD发生后, 由于DA缺失其纹状体MSNs树突棘发生萎缩并脱落[3],PD模型大鼠黑质DA能神经元坏死后也可以造成其纹状体MSNs树突棘的密度显著下调[4]。另有研究发现,PD动物黑质﹣纹状体DA能传递减弱的同时伴随着皮层﹣纹状体Glu能活动的增强[16],而皮质剥离术可抑制去DA神经支配诱导的纹状体MSNs树突棘的丢失[17],这提示皮层﹣纹状体Glu能传入也参与了MSNs突触结构可塑性的调节过程。
胞内游离Ca2+水平可直接影响MSNs树突棘稳定性的改变[8,16]。 导致胞内游离Ca2+水平变化的因素有很多。在纹状体,Glu从突触前膜释放后,与突触后膜上的Glu受体(包括AMPA和NMDA两种受体亚型)作用,触发突触后神经元胞内一系列信号级联反应[6]。Glu首先与AMPA受体结合, 通过调节阳离子流入及对NMDA受体的修饰,使突触后神经元去极化进而产生脉冲发放[18]。 纹状体内的AMPA受体亚基主要为GluR1和GluR2,GluR2的激活可限制Ca2+内流,影响突触后膜对Ca2+的通透性[18,8]。而胞内Ca2+信号的频率、持续时间和幅度等信息的瞬时变化又会直接影响MSNs树突棘的稳定性[2]。 由此可见,GluR2对MSNs树突棘及突触结构的完整性具有重要的调节作用。 PD状态下,由于黑质﹣纹状体DA通路的抑制作用减弱, 导致皮层﹣纹状体通路Glu的输入增强,同时AMPA受体组分发生改变, 降低了GluR2对Ca2+内流的限制,使大量Ca2+流入胞内并导致Ca2+超载,引发突触后膜的持续性兴奋[8,18]。 同时,MSNs树突棘内Ca2+水平的升高可促进Ca2+/钙调蛋白依赖性蛋白激酶Ⅱ(CaMKⅡ)Thr286的磷酸化水平, 进而影响细胞骨架蛋白F-actin动力学调控并介导了树突棘萎缩与脱落[2,19]。由此可见,Glu兴奋性毒作用是诱导MSNs树突棘脱落的主要原因之一。
近年的研究显示,纹状体MSNs树突棘密度的增加可代偿PD动物纹状体DA水平的减少并促进其行为功能恢复[5]。但运动干预改善PD患者行为功能是否与纹状体MSNs可塑性有关以及相关机制目前尚未阐明。 6-OHDA是第一个被用于特异性诱导DA能神经元坏死的神经毒素类药物, 其主要通过氧化应激途径使黑质﹣纹状体DA系统传递障碍引起动物的PD症状[20]。 本研究将6-OHDA注射入大鼠右侧前脑内侧束成功诱导了偏侧PD模型大鼠, 前脑内侧束是黑质致密部连接纹状体的DA能神经纤维通路,该通路是纹状体DA神经递质的主要来源,6-OHDA可沿前脑内侧束逆向转运至黑质致密部引发DA能神经元坏死,纹状体DA含量丢失。 本研究结果显示,PD模型大鼠运动行为功能显著降低,同时纹状体MSNs树突棘密度出现明显减少,这与Oscar等的研究结果一致[21]。 本研究还发现,PD模型大鼠纹状体AMPA受体的GluR2亚基表达下降,这将会促进MSNs胞内Ca2+水平持续升高, 可能与MSNs树突棘脱落存在密切关系。此外,本研究结果证实,4周运动干预可有效增加PD模型大鼠纹状体MSNs树突棘密度, 上调AMPA受体的GluR2亚基表达, 同时运动行为功能得到明显的改善。Vanleeuwen等通过跑台运动训练也显著上调了PD模型小鼠纹状体AMPA受体GluR2亚基表达水平,同时抑制了PD模型小鼠纹状体MSNs的兴奋性[22]。 综合既往研究结果推测, 运动干预改善PD模型大鼠行为功能可能与AMPA受体介导的MSNs结构重塑有关,GluR2亚基可能参与了运动调节PD大鼠皮层-纹状体突触可塑性的过程。
大量研究表明,黑质DA能神经元坏死,纹状体DA水平减少是导致PD运动行为功能异常的原发性因素。因此,探讨运动干预改善PD患者或PD模型动物行为功能的机制更多关注了运动对黑质-纹状体DA能神经元的保护作用、DA传递效能改变等方面[5,9,8]。 但随着研究的逐步深入,发现PD模型动物行为功能改善与黑质DA能神经元存活或纹状体DA水平变化并非直接相关[23,24],认为运动可能对皮层-纹状体Glu能神经输入也有一定的调节作用[5,8]。 由于MSNs是直接通路和间接通路的起始神经元,同时接受黑质-纹状体DA能神经纤维和皮层-纹状体Glu能纤维的支配。 因此,运动干预对MSNs形态可塑性的调节对改善黑质-纹状体DA能传递与皮层-纹状体Glu能传递均具有重要作用[25]。 从本研究结果推测,运动干预可能通过增加PD模型大鼠纹状体MSNs树突棘密度和上调GluR2亚基表达, 修饰皮层-纹状体Glu能突触结构可塑性,代偿黑质-纹状体DA传递障碍, 调节并改善基底神经节功能紊乱导致的行为活动异常。 此外,Vigers等的研究还发现,脑源性神经营养因子(brain-derived neurotrophic factor, BDNF)的表达与中枢神经元树突棘的完整性及动物的行为功能调节有关[26]。 Real等的研究证实, 在纹状体注射BDNF受体拮抗剂后,运动干预对PD模型大鼠行为功能的改善作用消失[27]。 提示BDNF可能参与了PD模型大鼠纹状体MSNs突触结构可塑性的调节。
综上所述,运动干预调节PD模型大鼠纹状体MSNs树突棘形态结构可塑性是改善其运动行为功能障碍的关键性因素; 特别是在PD发病早期介入运动干预可能将最大限度地发挥神经保护作用和神经营养作用,避免MSNs树突棘的脱落,保护其形态结构的完整性。 此外,以左旋多巴(L-dopa)为代表的DA替代疗法是目前PD药物治疗的主要手段, 但随着药物使用时间的延长其疗效逐渐降低,大多数患者还会出现异动症或精神障碍等并发症[1]。 事实上,PD早期纹状体内DA受体(D2DR)表达上调可以代偿DA含量的降低,然而MSNs树突棘渐进性脱落现象一旦发生, 会很大程度上限制纹状体对DA缺失的代偿能力,这可能是长期服用L-dopa后PD患者出现严重副作用的机制之一[2]。 由此可见,纹状体MSNs树突棘密度的保持对延缓PD病情加重、延长DA替代药物的使用时间及治疗效果也具有重要意义。
4 结论
运动干预增加了PD模型大鼠纹状体MSNs树突棘密度,上调了GluR2亚基表达,有效改善了行为功能障碍,纹状体MSNs形态结构重塑可能是运动改善PD大鼠行为功能障碍的重要途径之一。运动上调纹状体AMPA受体GluR2亚基表达可能介导了这一过程。
[1] Galvan A, Wichman T. Pathophysiology of parkinsonism. Clin Neurophysiol, 2008, 119: 1459-1474.
[2] Deutch AY, Colbran RJ, Winder DJ. Striatal plasticity and medium spinyneuron dendritic remodeling in parkinsonism.Parkinsonism Relat Disord, 2007, 13(Supp3): 251-258.
[3] Rosa MV, Heyne L, Yoland S. Dopaminergic denervation and spine loss in the striatum of MPTP-treated monkeys. Exp Neurol, 2009, 215: 220-227.
[4] Stephens B, Mueller AJ, Shering AF,et al. Evidence of a breakdown of corticostriatal connections in Parkinson’s disease. Neuroscience, 2005, 132(3):741-754.
[5] Wouju K, Mi JI, Cheol HP, et al. Remodeling of the dendritic structure of the striatal medium spinyneurons accompanies behavioral recovery in a mouse model of Parkinson’s disease.Neurosci Lett, 2013, (557): 95-100.
[6] Santos SD, Carvalho AL, Caldeira MV, et al. Regulation of AMPA receptors and synaptic plasticity. Neuroscience, 2009,158(1):105-125.
[7] Takamatsu Y, Ishida A, Hahakawa M, et al. Treadmill running improves motor function and alters dendritic morphology in the striatum after collagenase-induced intracerebral hemorrhage in rats. Brain Res, 2010, 1355(8): 165-173.
[8] 刘晓莉, 时凯旋, 乔德才. 运动对帕金森病模型大鼠纹状体神经元电活动的影响. 北京体育大学学报, 2014, 37(5): 57-61.
[9] Tajiri N, Yasuhara T, Shingo T, et al. Exercise exerts neuroprotective effects on Parkinson's disease model of rats . Brain Res, 2010, 1310(15): 200-207.
[10] Paxinos G, Watson C. The Rat Brain in Stererotaxic Coordinates. 3th ed. San Diego: Academic Press, 1997:35, 38-40.
[11] Truong L, Allbutt H, Kassiou M, et al. Developing a preclinical model of Parkinson’s disease: a study of behaviour in rats with graded 6-OHDAlesions. Behav Brain Res, 2006, 169(1):1-9.
[12] Jia J, Sun Z, Li B, et al. Electro-acupuncture stimulation improves motor disorders in Parkinsonian rats. Behav Brain Res,2009, 205(1):214-218.
[13] Karhunen H, Virtanen T, Schaller T, et al. Forelimb use after focal cerebral ischemia in rats treed with an alpha 2-adrenoceptor antagonist. Pharmacol Biochem Behav, 2003, 74(3):663-669.
[14] Robert ST, Michel D. Basal ganglia contributions to motor control: a vigorous tutor. Curr Opi Neurobiol, 2010, 20(6):704-716.
[15] Tsumori T, Yokota S, Ono K, et al. Synaptic organization of GABAergic projections from the substantia nigra pars reticulata and the reticular thalamic nucleus to the parafascicular thalamic nucleus in the rat. Brain Res, 2002, 957 (2): 231-241.
[16] Day M, Wang Z, Ding J, et al. Selective elimination of glutamatergic synapses on striatopallidal neurons in Parkinson disease models. Nat Neurosci, 2006, 9:251-259.
[17] Rosa MV, Yoland S. Neuroglial plasticity at striatal glutamatergic synapses in Parkinson’s disease. Front Syst Neurosci, 2011, 5(68): 1-9.
[18] Jeun SH, Cho HS, Kim KJ, et al. Electrophysiological characterization of AMPA and NMDA receptors in rat dorsal striatum. Korean J Physiol Pharmacol, 2009, 13(3):209-214.
[19] Maria K, Panagiotis K, Panagiotis G, et al. Expression and phosphorylation of glutamate receptor subunits and CaMKII in a mouse model of Parkinsonism. Brain Res, 2014, 1549:22-31.
[20] 王涛, 左萍萍. 帕金森病实验动物模型研究进展. 中国神经免疫学和神经病学杂志, 2008, 15(6): 455-457.
[21] Oscar S, Daniel IL, Jorge FH, et al. Alterations in dendritic morphology of the prefrontal cortical and striatum neurons in the unilateral 6-OHDA-rat model of parkinson’s disease.Synapse, 2007, 61: 450-458.
[22] Vanleeuwen JE, Petzinger GM, Walsh JP, et al. Altered AMPA receptor expression with treadmill exercise in the 1 -methyl-4-phenyl-1, 2, 3, 6-tet,rahydropyridine-lesioned mouse model of basal ganglia injury. J Neurosci Res, 2010,88(3):650-668.
[23] Fisher BE, Petzinger GM, Nlxon K, et al. Exercise-induced behavioral recovery and neuroplasticity in the 1-methyl-4-phenyl-1, 2, 3, 6-tetrahydropyridine-lesioned mouse basal ganglia. J Neurosci Res, 2004, 77, 378-390.
[24] Tillerson JL, Caudle WM, Reveron ME, et al. Exercise induces behavioral recovery and attenuates neurochemical deficits in rodent models of Parkinson’s disease. Neuroscience 2003, 119(3): 899-911.
[25] 陈巍, 乔德才, 刘晓莉. 纹状体神经元可塑性与帕金森病的运动防治研究进展. 中国运动医学杂志, 2014, 33 (7): 729-734.
[26] Vigers AJ, Amin DS, Talley-Farnham T, et al. Sustained expression of brain-derived neurotrophic factor is required for maintenance of dendritic spines and normal behavior. Neuroscience, 2012, 212(4): 1-18.
[27] Real CC, Ferreira AFB, Chaves-kirsten GP, et al. BDNF receptor blockade hinders the beneficial effects of exercise in a rat model of Parkinson’s disease. Neuroscience, 2013, 237(1):118-129.

