丛枝菌根真菌与个体植物的关系及其对群落生产力和物种多样性的影响
杨高文,刘楠,杨鑫,张英俊*
(1.中国农业大学草业科学系,北京 100193;2.南京农业大学草业学院,江苏 南京 210095)
丛枝菌根真菌与个体植物的关系及其对群落生产力和物种多样性的影响
杨高文1,2,刘楠1,杨鑫1,张英俊1*
(1.中国农业大学草业科学系,北京 100193;2.南京农业大学草业学院,江苏 南京 210095)
丛枝菌根真菌(arbuscular mycorrhizal fungi, AMF)是陆地生态系统的重要组成部分,能够与大约80%的陆地植物种类形成AMF-植物共生体。AMF能够影响个体植物的养分吸收,调节物种间的相互作用和植被更新,进而对群落生产力和物种多样性产生重要影响。为了把握AMF与个体植物、植物种间作用以及植物群落关系的研究现状,阐明AMF对群落生产力和物种多样性的作用机制,本研究拟从以下几个方面进行论述。首先,分析了物种水平上AMF与植物间的共生关系及其影响因素,提出预测AMF在不同土壤磷水平下对植物生长影响的概念模型。其次,总结了AMF对植物种间相互作用关系以及幼苗定植的影响。最后,分析了AMF对群落生产力和物种多样性的作用机制,提出相应的预测模型。对于实际生产,本文的研究结果能够应用到牧草生产和草地管理中,为利用人工草地土壤中AMF的养分吸收功能和天然草地的多样性保育及稳定性维持提供了科学根据。对于学术研究,本文综合了国内外最新研究进展,分析了当前研究中存在的科学问题,并对今后的研究方向进行了展望。
丛枝菌根真菌;生产力;多样性;稳定性;幼苗定植
AMF(arbuscular mycorrhizal fungi)属于球囊霉门(Glomeromycota)真菌,侵染植物根系后形成菌根,是自然界普遍存在的生物共生现象,该共生体系提高宿主植物对矿质营养(氮、磷、硫、锌、铜等)的获取能力,增强宿主植物抗逆能力[1-2]。AMF的研究始于1885年Frank发表菌根对树营养的作用,在此后长达120余年的研究中,对AMF的分类、地理分布、与植物的相互作用关系及其生态学功能等进行了大量的研究,Smith和Read[1]在《Mycorrhizal Symbiosis》中对AMF研究进展进行了系统的总结。
目前,已有大量研究探讨了放牧干扰,土壤非生物因子和气候变化对草地生态系统植物群落生产力、多样性和稳定性的影响及其作用机制[3-7],而地下微生物在此过程中的作用还关注较少。土壤微生物,特别是AMF,是草地生态系统的重要组成部分,AMF能够侵染约80%的高等陆生植物种类[1,8],与植物形成AMF-植物共生体,对植物群落生产力形成和多样性保持产生重要影响[9-13]。在植物个体水平,不同的研究中AMF可能增加或抑制植物的养分吸收,从而增加或抑制其生长[1,14-15]。同样的,在植物群落水平,不同的研究中AMF对植物群落生产力或物种多样性的影响也不同[9-10,16]。为了探索AMF与个体植物及植物群落关系的一般性规律,本文提出以下几个科学问题:1)AMF与植物间的共生关系及其影响因素有哪些?2)AMF如何影响植物种间的相互作用和植被更新?3)AMF如何调节植物群落生产力和物种多样性?
理解生态系统生产力、多样性及其稳定性的维持机制是草原生态系统适应性管理的基础,生产力是草地畜牧生产功能的体现,生物多样性是生态系统稳定性的基础[17-18]。本研究结果将有利于指导牧草生产和草地管理。植物个体水平的研究结果,为人工草地生态系统中充分发挥AMF的养分吸收功能,减少化肥的使用量提供科学根据。植物群落水平的研究结果,为预测草地施肥或全球氮沉降增加背景下草地植物群落生产力和多样性的变化提供科学依据。因此,探究AMF对植物生产力和群落物种多样性的影响,将丰富草地生态系统生产力形成、多样性和稳定性维持的理论基础,具有很强的科学价值。为我国草原生态系统的适应性管理提供理论基础,服务于草原畜牧业管理和可持续发展。
1 AMF与植物间的关系
1.1 AMF-植物共生体
AMF与植物间的关系是理解AMF对植物群落水平生产力和多样性作用的基础。AMF侵染植物根系后,与植物形成共生体,其生态学效应包括3种情况:互利共生(mutualism)、偏利共生(commensalism)和寄生关系(parasitism)。在AMF-植物共生体中,AMF为植物提供土壤养分和水分,植物为AMF提供光合产物。植物个体水平的研究表明,AMF-植物共生体系的维持取决于双向互惠机制,植物能够识别对其最有益的AMF种类,并将光合产物优先提供给这类AMF;对于AMF而言,AMF倾向于将土壤养分输送给为其提供光合产物最多的植物,这种双向互惠机制保证了共生体系的稳定性[19]。AMF对植物的作用可以分为以下几个方面。
第一,AMF作为植物养分吸收的“器官”,能够提高植物对土壤养分的吸收。AMF对植物磷吸收的贡献占植物总需要的75%~90%,对氮吸收的贡献达5%~80%[20-22]。AMF也能提高植物对钾、铁、锌、铜、钼等元素的吸收[23-25]。如通过隔室分离法研究发现,根外菌丝吸收转运给植物的磷、氮、钾、锌和铜分别占植物总需要的80%,25%,10%,25%和60%[25]。AMF在根外形成大量的菌丝,可达根系外的11.7 cm远处,从而扩大了养分吸收范围,菌丝网络中土壤养分的传输速度远远高于养分直接在土壤中的移动速度[22]。AMF菌丝能够活化土壤中难以移动的养分(如磷),提高其可利用性,从而改善植物的养分吸收[22,26-27]。
第二,AMF提高植物的水分吸收,增强植物的抗旱性[28]。研究表明,菌丝网络具有传递水分的功能[29],提高植物的水分利用效率[30],AMF对植物水分吸收的作用受到菌丝密度和菌丝活力的调节[31]。
第三,AMF改变植物体内糖和氨基酸的含量及其组成,增加对磷、铜、镁的吸收,减少植物对钠离子和氯离子的吸收,提高植物的耐盐碱性[32-34]。来源不同的AMF对缓解植物盐胁迫的能力不同[35]。从盐分胁迫较高的植物分离出的根内球囊霉菌株(Glomusintraradices)比从非盐胁迫植物分离出的根内球囊霉菌株能更好地缓解植物的盐胁迫,其原因可能是前者对盐胁迫的长期适应性所致[35]。
第四,AMF能够增强植物的自我防御功能,减轻土传病害或动物采食带来的危害[36-38]。AMF通过改变植物根系分泌物减少线虫对其生长的危害[39]。接种AMF后可以增加宿主植物茉莉酸等次级代谢产物的产生和碳氮的代谢,从而增加植物对真菌病害的抵抗[40]。AMF菌丝网络能够在不同植物间传递豌豆蚜虫(Acyrthosiphonpisum)采食的信号,使还未被豌豆蚜虫侵害的植物做好防御措施[41]。进一步研究发现,菌丝网络中的梓醇代谢物可能是作为传递植物被采食信号的物质[42]。还有研究显示接种AMF能够增加植物对病毒的抵抗力[43]。
此外,AMF可以调节土壤的理化性质,有助于保持土壤肥力[44-45],间接作用于植物生长。AMF分泌物可以促进土壤团聚体形成,改善土壤物理状况[46],增加土壤的稳定性[47]。长期的野外监测实验发现菌丝密度与土壤团聚体、碳氮固持均呈显著的正相关关系[48]。盆栽试验表明,接种AMF后土壤中磷和铵的损失分别减少了60.0%和7.5%[49]。
AMF增加植物对养分和水分的吸收、提高其耐盐性、为植物自我保护提供支持,这些作用可以在植物生物量的积累上得到体现。一般地,用菌根生长效应(mycorrhizal growth response,MGR)或菌根依赖性(mycorrhizal dependency,MD)来表示AMF对植物生长表现的影响。与不接种AMF处理相比,植物对接种AMF的生长反应,称为菌根生长效应[1,50],其计算公式为:
MGR(%)=100×(BA-BNA)/BNA
其中,BA表示接种AMF后植物的生物量,BNA表示不接种AMF时植物的生物量。MGR>0表示AMF促进了植物的生长,MGR<0表示AMF抑制了植物的生长,MGR=0表示AMF对植物生长没有影响。
用菌根依赖性表示在特定的土壤养分水平下植物生物量积累对菌根环境的依赖性[51-52],其计算公式如下:
MD(%)=100×(BA-BNA)/BA
其中,MD越大表示植物对AMF的依赖程度越高。
一般来讲,AMF不能营腐生生活,只能从活体植物获得碳源[1]。因此,植物根系中的菌根侵染强度,尤其是土壤中的菌丝密度,可以衡量AMF从植物体获得光合产物的数量[53]。研究表明AMF消耗的光合产物约占植物总光合产物量的20%[54]。
1.2 影响因素
1.2.1 AMF和植物种类 植物种类决定了其对AMF的依赖性。根系的形态学特征影响植物的菌根依赖性,北美草原的暖季型禾草和杂类草根系较粗、分支少,其菌根依赖性比根系分支多的冷季型禾草高[14]。通过对北美高草草原36种禾草和59种非禾本科草本植物的菌根依赖性测定发现,多年生暖季型C4禾草和非禾本科草本植物对接种AMF反应明显,而冷季型C3禾草对AMF接种无显著反应,前者的菌根侵染率也显著高于后者[15]。对这95种植物进行系统发育史分类研究,发现植物的菌根依赖性与其系统发育史密切相关[55]。Hoeksema等[56]通过Meta分析表明,C4禾草、木本植物和杂类草的菌根依赖性均高于C3禾草和豆科植物,说明其对AMF接种的反应更明显。一年生杂类草比多年生灌木的菌根生长效应更明显[57]。该研究还发现,植物的菌根生长效应随着植物的种植密度增加而下降,可见,在研究AMF对植物生长的影响时,同种植物间的相互作用会影响其菌根生长效应[57-59]。幼苗定植实验的结果表明,成株与幼苗对AMF接种的反应不同,说明植物的年龄(物候期)是植物菌根依赖性的影响因子之一[60-62]。
AMF种类及其多样性影响植物的菌根依赖性。虽然在大多数研究中AMF缺乏宿主特异性,同种AMF可以侵染多种植物,同种植物可以被多种AMF侵染,然而不同种类的AMF对植物生长的影响不一致。比如,接种Glomussp. (Basle Pi) 后绿毛山柳菊(Hieraciumpilosella)的生长表现较好,接种Glomussp. (BEG 19) 后生长表现次之,接种Glomusgeosporum和Glomussp. (BEG 21) 后表现最差,而同时接种4种AMF时,植物的生物量最高[63]。可见,AMF种类多样性增加植物在接种后的生长表现。
AMF的本地适应性(local adaptation)影响植物在接种AMF后的生长表现。AMF的本地适应性是指植物在接种与其相适应的AMF种类或菌株时,生长表现更好的现象。比较从盐分较高的环境分离出的AMF菌株和从非盐胁迫环境分离出的菌株对植物生长的反应,接种前者的植物在盐胁迫下生长表现更好,其原因可能是该菌株对盐胁迫的本地适应性所致[35]。与接种其他来源的AMF菌剂相比,植物在接种土著的AMF时其生长表现更好,其可能原因是AMF与植物的协同进化所致[64-65]。
AMF与其他生物互作,间接影响植物的生长表现。如前文所述,梓醇代谢物作为植物被采食信号的物质,可以通过AMF菌丝网络在植物间进行传递,使得还未被采食的植株做好防御,增加植物对昆虫采食的抵抗力[37,42],从而增加植物的生长表现。AMF为植物提供土壤养分支持,增加植物对采食的耐受性[66-67]。最新的研究表明,AMF与固氮菌的协同作用,增加了北美草原豆科植物灰毛紫穗槐(Amorphacanescens)的生物量,而且这种协同作用与土壤养分水平无关[68]。AMF-植物共生体的维持是基于AMF与植物间的双向互惠机制[19],采食引起植物光合器官的减少,将改变植物的光合能力,影响植物为AMF提供的光合产物数量,根据双向互惠机制,AMF对植物的养分供给也将改变,从而影响AMF对植物生长的贡献[69-70]。光照强度以及CO2浓度影响植物的光合潜力,改变植物对AMF的光合产物投入和AMF为植物提供的养分,从而影响植物的菌根生长效应[71-72]。
1.2.2 土壤养分 土壤磷水平影响AMF与植物间的关系。植物根系直接吸收养分和AMF为植物提供养分是菌根植物营养的两条途径,土壤养分增加后,植物根系直接吸收的养分增加,可能减少植物对AMF输送的光合产物[2,73]。磷在土壤中极易被固定,移动性较差,AMF对植物磷吸收的贡献可达80%[61]。与磷相比,AMF对植物氮吸收的贡献较小,但是,氮对于植物光合作用至关重要,氮缺乏造成光合作用下降,植物将减少对AMF的光合产物投入,而降低AMF的功能[71-72],即AMF和植物同时受到氮限制。因此,与土壤氮水平相比,AMF对植物生长的贡献受土壤磷水平影响更明显。
根据前人的研究结果[74-76],将AMF对植物生长的贡献与土壤磷水平的关系分为5种情况(如图1中A, B, C, D, E所示)。图1中A表示随着土壤磷水平增加,AMF对植物生长的贡献呈线性增加,例如,Siqueira和Saggin-Junior[74]研究南美重蚁木(Tabebuiaimpetiginosa)和齿叶蚁木(Tabebuiaserratifolia)在最低的磷水平下,AMF接种对这两种植物的生长无显著影响。随着磷水平增加,在不接种AMF处理中,由于其根系直接吸收的磷极其有限,生物量对磷水平无显著响应,而在AMF接种处理中极大地增加其生物量,并随着磷水平增加而增加[74],但是否有一定的阈值未有报道。土壤磷处理仅仅在AMF接种处理中有显著效应,AMF对这两种植物磷吸收的贡献极大,因此,图1中A所表示的植物种类对AMF的依赖性极高。图1中B表示在磷水平极低时,AMF对植物生长无显著影响,随着磷水平增加,AMF促进植物生长,并且对植物生长的贡献随磷水平增加而增加,当磷水平到达一定的阈值后,AMF对植物生长的贡献保持不变,比如,Siqueira和Saggin-Junior[74]研究中的豆科植物Sennamacranthera和铁架木(Caesalpiniaferrea)。图1中C表示AMF和土壤磷水平对植物生长均没有显著影响,这类植物的根系直接吸收的磷养分能够满足本身的磷需求,比如Ormosiaarborea和Myroxylonperuiferum[74],AMF与植物间形成偏离共生关系,即植物为AMF提供光合产物,而AMF对植物生长无显著影响。图1中D表示AMF与植物间形成寄生关系,AMF抑制了植物的生长,随着磷水平增加,抑制作用降低。例如,Grman[53]观察到两种C3禾草无芒雀麦(Bromusinermis)和偃麦草(Elymusrepens)的生长受到AMF寄生作用的危害,但是随着土壤磷水平增加,这两种植物极大地降低了根系的AMF侵染率和土壤中的菌丝丰富度,即降低了对AMF的光合产物投入,从而降低了AMF寄生作用对植物生长的抑制。该研究还发现,在较低磷水平下AMF促进了两种C4禾草大须芒草(Andropogongerardii)和北美小须芒草(Schizachyriumscoparium)的生长,随着磷水平增加,AMF对这两种草生长的贡献下降,直至在较高磷水平下AMF抑制了其生长[53]。与C3禾草不同,这两种C4禾草不能有效地降低菌根侵染率和菌丝密度,即不能有效地降低对AMF的光合产物投入,所以在高磷水平下AMF寄生作用抑制了其生长[53]。
大须芒草和北美小须芒草属于图1中E所表示的植物种类。也有研究发现,在低磷水平下,AMF极大促进了地三叶(Trifoliumsubterraneum)的生长,而在高磷水平下对其生长无显著贡献[2]。地三叶可能属于图1中E所表示的植物类,由于该研究中磷水平梯度过少,未预测AMF与地三叶是否能够形成寄生关系。
对于AMF而言,土壤磷水平增加后,菌根植物会减少对AMF的光合产物投入,降低植物根系的菌根侵染率和土壤的菌丝密度[1,77],C3和C4禾草可能表现不一致[53]。而随着土壤氮水平的增加,植物对AMF的光合产物投入也表现出相似的规律[71-72]。虽然Meta分析的结果表明施用氮肥比磷肥更能够解释植物的菌根依赖性,但是与氮缺乏相比,植物在磷缺乏时AMF对植物生长的影响更大[56]。只有在氮缺乏而磷充足的情况下,氮肥添加会降低植物对AMF的光合产物投入[71,78],而在磷缺乏时,氮肥添加会增加植物对AMF的光合产物投入[71-72]。可见,土壤氮磷的相对比例,即土壤养分的生态化学计量比(ecological stoichiometry),影响AMF与植物间的关系,将作用于植物的生长表现[72]。Johnson[72]提出交易平衡模型(trade balance model),将土壤氮磷水平对AMF和植物之间关系的影响总结为图2所示的4种情况。
图2中第1种情况表示,当土壤氮磷均是限制因子时,AMF对植物磷吸收的贡献较大,但是由于土壤氮的缺乏,限制了植物的光合作用,导致植物对AMF的光合产物投入较低,形成碳缺乏型的互利共生关系。比如,最新的研究从分子水平和植物生理水平揭示了氮磷同时缺乏时蒺藜苜蓿(Medicagotruncatula)与AMF形成的互利共生关系[73]。图2中第2种情况表示,由于氮缺乏解除,植物光合作用未受到抑制,植物能够投入大量的光合产物给AMF以获得磷养分,形成较强的互利共生关系,与第1种情况相比,AMF对植物生长的贡献可能更大。例如,在磷缺乏时,氮肥添加会增加植物对AMF的光合产物投入[71],符合图2中的第2种情况。图2中第3种情况表示,土壤中磷很丰富而氮缺乏时,植物根系直接吸收的养分能够满足生长的需求,植物不需要从AMF获得磷,植物和AMF均受到氮缺乏时,植物需要继续为AMF提供光合产物,此时,AMF与植物形成偏利共生关系,此种AMF-植物共生体系对AMF更有利[71]。图2中第4种情况表示,氮磷均不是限制因子时,AMF与植物竞争光合产物,抑制植物生长[75,79-80]。
2 AMF对植物种间相互作用的影响
植物间的相互作用关系对于生态系统的物种多样性和稳定性维持至关重要[17-18]。研究表明,AMF影响植物之间的相互作用关系[81-85]。AMF侵染植物以后,在根外产生大量菌丝,形成菌丝网络,能够将同种菌根植物根系连接在一起,也能够将不同种的菌根植物联系在一起[1],如图3所示。菌丝网络具有土壤养分、水分和光合产物的再分配功能,能够将这些营养物质从一株植物转运到相邻的同种或不同种的植物,菌丝网络具有营养物质的再分配功能[29,69,86-87]。
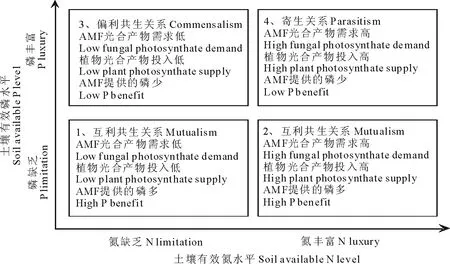
图2 土壤有效氮磷水平对AMF和植物间关系的影响[72]Fig.2 Effects of soil available nitrogen (N) and P level on the AMF-plant symbiosis
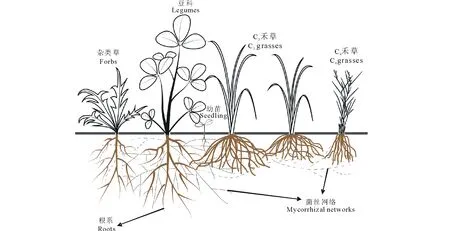
图3 菌丝网络将不同种类的植株或同种植物不同植株的根系连接在一起Fig.3 Mycorrhizal networks linking the roots of different plant species and plants of the same species 虚线表示不同种类的植物或同种类不同植株均被同一种AMF侵染,并通过菌丝网络连接在一起;实线表示植物也能够被其他种类的AMF侵染Dashed line indicates that one AMF species colonizes the roots of different plant species and plants of the same species, and these plants are linked by mycorrhizal networks; solid line indicates plants can be colonized by other AMF species.
AMF对同种植物不同植株间作用的影响。Koide[58]研究发现植物的种植密度决定了其菌根生长效应,在种植密度较低时植物对AMF接种的生长反应最高。Allsopp和Stock[59]的研究也发现相似的规律,随着植物密度的增加,AMF对植物磷吸收的贡献降低,植物的菌根生长效应降低。不同植物种类的表现不同[57,88],例如,对比菊科(Asteraceae)和豆科(Fabaceae)的两种植物发现,植株密度对前者菌根生长效应的影响更显著[57]。野外调查表明甘松草(Nardusstricta)的菌根侵染率随着植株密度的增加而提高[89],说明植物对AMF投入的光合产物随着植株密度的增加而增加,与Allsopp和Stock[59]的研究结果一致。可见,随着植株密度增加,植物从AMF获得的养分减少,而对AMF投入的光合产物增加,根据AMF与植物间的投入-产出模型(cost-benefit models)[90],植株密度增加将降低植物的菌根生长效应。植株密度降低植物的菌根生长效应,说明AMF可能增加了同种植物不同植株间的竞争,也说明AMF参与植物种群内的自疏过程[91-92]。
AMF种类对不同植物种间效应的影响。研究表明,AMF影响植物种间的共存[93-96]。对于两种竞争力不同的植物而言,如果竞争力较弱的植物具有更高的菌根依赖性,那么AMF能够通过增加其养分吸收能力而提高其竞争力,促进这两种植物的共存[95-97];但是,如果竞争力较强的植物具有更高的菌根依赖性,那么AMF增加其养分吸收能力提高其竞争力,进而不利于竞争力较弱的植物的生长,阻碍这两种植物的共存[98]。物种间的共存受AMF种类本身的调节,例如,研究表明接种不同种类的AMF对北美高草草原的暖季型与冷季型禾草的共存影响不同[97]。AMF具有一定的宿主特异性[99],AMF对其特定寄主的生长促进作用更大,即同种AMF对不同植物的影响不同,是AMF调节物种共存的内在机制之一[84,92,100]。研究表明,共生的禾草根系具有不同的AMF群落[101],可能促进了物种间的共存。
AMF的多样性促进植物种间的共存。Wagg等[84]研究AMF对豆科植物三叶草和C3禾草多花黑麦草(Loliummultiflorum)种间相互作用发现,AMF通过增加豆科植物的竞争力而减少了两个物种间竞争力的差异,促进两个物种间的共存,其中具有最高AMF多样性处理对这两个物种的共存最有利。该研究还发现,AMF多样性对物种间关系的影响受到土壤物理条件的调节,在含沙量较低的土壤中接种AMF对物种间更有利[84]。AMF多样性越高,对物种共存的作用越大,可以用AMF选择性效应和互补性效应解释[11]。
菌丝网络的养分再分配作用有利于物种共存。优势种植物建立的菌丝网络,吸收氮磷养分后传递给次优势种植物[87],或者将优势种的光合产物传递给次优势种[102],将有利于物种间的共存[100]。菌丝网络的养分再分配作用的内在机制是AMF与植物之间存在不平衡关系,即植物对AMF的投入和AMF对植物养分吸收贡献的不等性。Walder等[87]通过隔室分离法和同位素示踪法研究C3植物亚麻(Linumusitatissimum)和C4植物高粱(Sorghumbicolor)混播系统发现,C4植物对菌丝网络投入更多的光合产物而氮磷获益小,但是,C3植物对菌丝网络投入的光合产物相对较少而氮磷获益更大,该研究证明了AMF与植物之间存在不平衡关系。该研究结果为解释菌丝网络的养分再分配对物种共存的作用机制奠定了基础。虽然在植物个体水平AMF与植物间的关系符合Fitter[90]提出的投入-收益模型或Kiers等[19]提出的双向互惠机制,但是,Walder等[87]的结果说明存在多个物种的生态系统中AMF与植物存在不平衡关系。此外,AMF菌丝网络将植物受到采食胁迫的信号传递给另外的植物,使还未被侵害的植物做好防御措施[41],促进植物间的共存。
3 AMF与植物群落的更新
植被更新对植物群落结构和多样性的维持有着决定性的作用。群落的物种多样性维持,取决于某段时间内成功定植在群落中的物种数和消失物种数间的平衡关系[103-104]。植物在群落的定植过程中,光和土壤养分的限制不利于植物幼苗期的生长,是植物能否成功定植的决定性因素[105]。已有研究表明AMF有助于群落中植物幼苗的建植[62,106-107]。土壤中存在的AMF菌丝网络能够为植物根系的侵染提供足够的菌剂,使得植物幼苗能够迅速整合到菌丝网络中(图3),在幼苗生长初期,其光合作用较弱,对菌丝网络的光合产物投入较少,而能够获得相对较多的养分供应[62,106]。菌丝网络能够将成株植物固定的光合产物转运到幼苗[69,108],也能将水分转运给幼苗[29],促进幼苗的生长。AMF对幼苗定植的影响受到多种因素的调控。
1.1 组织标本 选取 2013 至 2015年在海军军医大学(第二军医大学)长海医院胰腺外科手术切除的胰腺癌组织标本 126例。其中男 91例,女35例;年龄为 32~75 岁,平均年龄 60.4 岁。纳入标准:(1)均为 10% FFPE 胰腺癌组织标本;(2)经病理学确诊为胰腺导管腺癌;(3)患者临床病理资料保存完整;(4)术前未行放射和化学治疗。排除标准:(1)合并其他原发性肿瘤;(2)临床病理资料不完整。其中 68例病例具有配对的癌旁正常胰腺组织(距癌组织边缘>1.5 cm)和癌旁的胰腺炎性增生病变组织。
不同AMF种类对幼苗定植的影响不同。van der Heijden[62]研究发现,地球霉囊菌(GlomusgeosporumWalker BEG 18和Glomussp. BEG 21)极大地提高了红车轴草(Trifoliumpratense)幼苗的定植,而其他AMF种类(Glomussp. isolate Basle Pi和Glomussp. BEG 19)对红车轴草幼苗的定植无显著影响。Janouskova等[109]研究表明,不同AMF种类对植物幼苗定植的抑制作用也不同。
植物的种类决定AMF对其幼苗定植的作用。van der Heijden[62]研究发现AMF极大地促进了红车轴草幼苗生长,而对直立雀麦(Bromuserectus)、羽状短柄草(Brachypodiumpinnatum)和夏枯草(Prunellavulgaris)等幼苗生长影响较小。Zhen等[60]研究发现,在大于2.5 g N/m2添加水平下,AMF抑制了冷蒿(Artemisiafrigida)幼苗定植,而促进了羊草(Leymuschinensis)和克氏针茅(Stipakrylovii)幼苗的定植。与C3禾草相比,C4禾草和杂类草对AMF接种的反应更明显[56],植物本身的菌根依赖性可能决定了AMF对其幼苗定植的作用。
土壤养分水平调节AMF对植物幼苗定植的作用。Zhen等[60]研究发现,在大于2.5 g N/m2添加水平下,AMF抑制了冷蒿幼苗定植,而小于2.5 g N/m2添加水平下,AMF促进了冷蒿幼苗的建植。土壤养分水平增加可以降低AMF对幼苗定植的促进作用。前人研究也发现了类似规律,在土壤养分水平较低时,菌丝网络促进长叶车前草(Plantagolanceolata)幼苗生长[69,110],而在养分水平较高时幼苗生长受到抑制[108]。
幼苗定植处的周围成株植物通过AMF菌丝网络影响幼苗的定植。Moora和Zobel[111]研究发现,植物幼苗单独生长,即周围没有成株植物时,比在成株植物周围的菌根生长效应更大,其原因可能是植株的密度影响了植物的菌根生长效应[59]。Kytoviita等[112]发现由于成株与幼苗间的竞争作用,幼苗不能从菌丝网络中获益。杨高文[113]研究表明,与其他植物成株建立的菌丝网络相比,冷蒿建植的菌丝网络更有利于冷蒿幼苗的生长,克氏针茅或羊草建立的菌丝网络显著抑制了冰草(Agropyroncristatum)幼苗的生长,而冷蒿或冰草建立的菌丝网络抑制了羊草幼苗的生长。
还有研究表明,AMF能够提高或降低植物的无性繁殖[114-115]。有性繁殖和无性繁殖是植物群落更新的主要方式,植物的无性繁殖和有性繁殖均受到土壤中AMF的调节。根据AMF对植物群落多样性作用的预测模型[116],如果AMF促进群落中优势种植物的更新,AMF不利于植物群落多样性的维持;如果AMF促进群落中次优势种植物的更新,AMF有利于多样性的维持。
4 AMF与植物群落的生产力
AMF种类及其多样性影响植物群落生产力。不同AMF种类对群落生产力的影响不同。Vogelsang等[10]研究发现,接种Glomusclaroideum1和Scutellosporasp. 1降低了植物群落地上生产力,而接种其他AMF增加了生产力。van der Heijden等[9]通过室内控制实验研究发现AMF多样性与植物群落的生产力存在二次曲线关系,群落生产力随着AMF物种数增加而增加,当AMF物种数为8~14时,生产力达到最高值。而原位调查实验的结果表明AMF的物种数与群落的地上或地下生产力均存在显著的线性正相关关系[117]。AMF可能通过不同AMF种类间的选择性效应(selection effects)和互补性效应(complementarity effects)作用于群落生产力。研究表明,与接种1种AMF相比,接种多种AMF后植物的生物量显著增加,不同AMF种类间通过选择性效应和互补性效应,对植物生物量的增加量的贡献分别达82%和85%[11]。
O’Connor等[118]研究表明,由于AMF增加了群落中优势种的地上生物量,而降低了次优势种的地上生物量,AMF对植物群落生产力无显著影响。可见,AMF通过作用于物种间的相互作用关系从而影响群落生产力。此外,AMF对生产力的作用可能存在时间异质性。研究表明,在人工植物群落建立的第1年,AMF增加了群落地上生产力,不同种类的AMF对生产力的促进作用不一致;在群落建立的第2年,与不接种AMF相比,AMF降低了群落的生产力,其原因是菌根依赖性较低的两种植物苔草(Carexflacca)和羊茅(Festucaovina)存活率高,而其他菌根植物存活率较低[119]。
AMF与土壤养分水平互作影响植物群落生产力。在较低磷水平下AMF显著增加了群落的生产力[122],而在较高磷水平下AMF降低了群落的生产力[123-124],说明随着磷水平升高,AMF对群落生产力的贡献可以从正效应到负效应。van der Heijden等[123]研究表明,在低氮水平下AMF增加了群落生产力,而在氮添加后AMF对群落生产力无显著影响。可见,AMF对群落生产力的贡献随氮养分水平增加而降低。将不同土壤养分水平下AMF对植物群落生产力的贡献总结为图4:在较低土壤养分水平下AMF增加群落生产力,随着土壤养分水平增加,AMF对植物群落生产力的贡献下降,直至AMF对群落生产力无显著影响,继续增加土壤养分水平,AMF降低植物群落生产力。
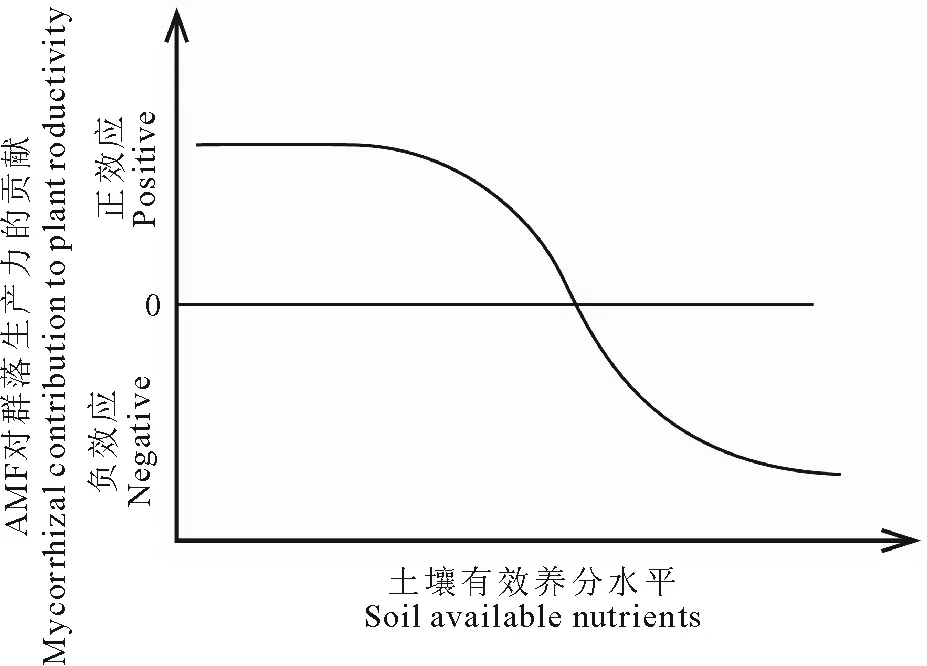
图4 不同土壤有效养分水平下AMF对群落生产力的影响Fig.4 Conceptual model illustrating the effect of soil available nutrients on the mycorrhizal contribution to plant community productivity
随着土壤养分水平的增加,AMF对群落生产力的贡献降低,可以由以下几个方面得到解释。第一,土壤养分水平增加后AMF的功能受到抑制。大量研究表明植物根系的AMF侵染率和土壤中AMF菌丝密度随着土壤养分水平的增加而降低[71,77,125],AMF的养分吸收功能也随之较高低[78]。第二,土壤养分水平增加后AMF与植物间的互利共生关系可能转为偏利共生或寄生关系(如图2所示)[2,72,80],即AMF成为有害微生物,抑制植物的生长,降低群落生产力。第三,土壤养分水平增加后,改变AMF群落结构,选择出养分吸收功能较低的AMF群落[53,78]。第四,AMF的多样性随土壤养分水平的增加而降低[126],根据van der Heijden等[9]的研究结果,AMF多样性与群落生产力存在正相关关系,AMF多样性的降低,可能导致群落生产力的降低。
5 AMF与植物群落的多样性
AMF种类及其多样性影响植物群落多样性。van der Heijden等[9]在《Nature》上发表文章指出AMF多样性决定了植物群落多样性,该文章是探究AMF多样性与植物群落多样性关系的里程碑。研究发现,植物群落的Simpson多样性指数与AMF多样性存在二次曲线关系,Simpson多样性指数随着AMF物种数增加而增加,当AMF物种数为14时,多样性达到最高值。原位调查研究也表明AMF的物种数与植物群落的物种多样性均存在显著的线性正相关关系[117]。Vogelsang等[10]的研究表明了不同种类的AMF对群落多样性的影响不同。该研究还发现,接种1种AMF与接种6种AMF处理下的群落多样性无显著差异,说明了AMF对多样性的贡献可能主要来自于特定的种类,其可能原因是多物种的取样效应(multiple-species sampling effect)所致[10,127]。
AMF通过调节植物之间的相互作用影响群落多样性。例如,在北美高草草原对AMF依赖性较高的C4禾草是优势种,原位施用真菌抑制剂后AMF功能受到抑制,降低了植物群落中优势种的丰度,导致菌根依赖性较低的C3禾草和杂类草等次优势种出现补偿性生长,增加了植物群落的多样性[16]。可见,群落中优势种和次优势种的相对菌根依赖性决定AMF对植物群落多样性的影响。Urcelay和Diaz[116]提出预测AMF对群落多样性影响的概念模型。该模型包含4种情况:1)当植物群落中的大部分物种是非菌根植物或菌根依赖性较低时,AMF对植物群落多样性没有影响,这种情况存在于演替初期的植物群落[128-129]。2)当群落中的优势种是菌根依赖性较高的植物,而次优势种的菌根依赖性较低或是非菌根植物时,AMF通过增加优势种的丰度,从而抑制次优势种的生长,降低多样性,在北美高草草原[16]、澳大利亚干旱草地[118]和欧石楠植物群落[130]观察到这种情况。3)当群落中的次优势种是菌根依赖性较高的植物,而优势种的菌根依赖性较低或是非菌根植物时,AMF通过促进次优势种的生长而提高多样性,在海岸灌丛植物群落发现这种现象[131]。研究以大针茅(Stipagrandis)为优势种的内蒙古草原发现,AMF降低优势种的资源垄断,增加了次优势种的生物量,使得各植物种生物量趋于平均,有利于增加植物群落的多样性,但由于该研究时间较短,未观察到群落多样性的改变[132]。根据模型的第3种情况,AMF可能增加了内蒙古草原植物群落的多样性,还需要进一步实验验证。4)当群落中优势种和次优势种均是菌根依赖性较高的植物时,AMF菌丝网络可能将光合产物或养分转运到次优势种,促进次优势种的生长,提高多样性,例如,Grime等[69]发现接种AMF后光合产物从优势种转运到群落下方的次优势种,接种AMF增加了多样性。
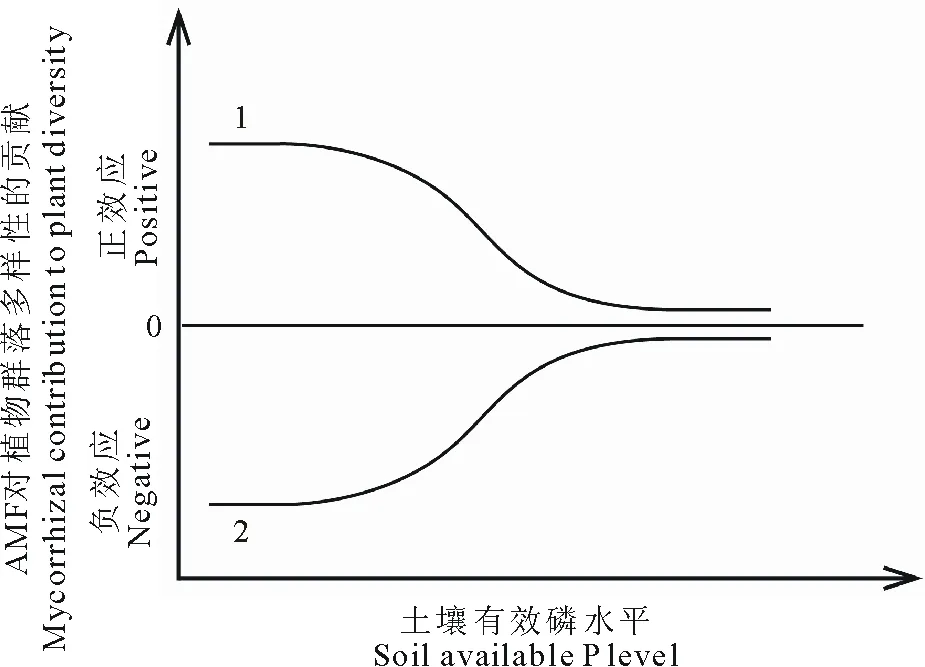
图5 AMF对植物群落多样性的影响受土壤磷水平调节 Fig.5 Mycorrhizal contribution to plant community diversity was mediated by soil available P 线1表示,当群落中次优势种的菌根依赖性较高,而优势种是非菌根植物或其菌根依赖性较低时,在低磷水平下AMF增加群落多样性,随着土壤磷水平增加,AMF对多样性的贡献下降,在高土壤磷水平下AMF对多样性无显著影响;线2表示,当优势种的菌根依赖性较高,而次优势种是非菌根植物或其菌根依赖性较低时,在低磷水平下AMF降低群落多样性,随着土壤磷水平增加,AMF对多样性的负效应减弱,在高土壤磷水平下AMF对多样性无显著影响。Line 1: If the subordinate species in the plant community are highly mycotrophic, and the dominant species are not, then AMF should increase plant diversity at low soil available P levels, and the positive effect of AMF on diversity decreases with the increase in soil available P. Line 2: If the dominant species in the plant community are highly mycotrophic, and the subordinate species are not, then AMF should decrease plant diversity at low soil available P levels, and the negative effect of AMF on diversity declines with the increase in soil available P.
AMF与土壤磷水平互作影响植物群落多样性。Vogelsang等[10]建立了包含20种植物的人工植物群落,发现在不同磷水平下,不同种类的AMF对植物群落多样性的贡献不同。根据前人的研究结果[10,122],将不同土壤磷水平下AMF对植物群落多样性的贡献总结为图5所示的两种情况。当群落中次优势种的菌根依赖性较高,而优势种是非菌根植物或菌根依赖性较低时,在低磷水平下,AMF提高优势种的磷吸收促进其生长,从而增加多样性,随着土壤磷水平增加,AMF对次优势种的作用下降,对多样性的贡献随之下降,在高土壤磷水平下AMF对多样性无显著影响(图5线1)。Collins和Foster[122]通过建立包含9种植物的人工植物群落,模拟北美高草草原植物群落,研究发现菌根依赖性较低的加拿大披碱草(Elymuscanadensis)是优势种,低磷水平下AMF增加了植物群落多样性,随着土壤磷水平增加,AMF对多样性的贡献下降。当优势种的菌根依赖性较高,而次优势种是非菌根植物或菌根依赖性较低时,在低磷水平下AMF降低群落多样性,随着土壤磷水平增加,AMF对多样性的负效应减弱,在高土壤磷水平下AMF对多样性无显著影响(图5线2),这种情况还未有实验进行验证。
土壤磷水平越高,AMF对植物群落多样性的影响越小,与AMF和土壤养分水平互作对生产力的作用规律较一致。然而,该规律不适用于AMF和土壤氮水平互作对生产力的影响。van der Heijden等[123]研究发现,在较低氮添加水平下,AMF对植物群落的均匀度无显著影响,而在较高磷添加水平下,AMF通过提高次优势种豆科植物的生长,从而增加了均匀度。Johnson等[133]研究AMF与CO2浓度互作对物种多样性的影响,发现不增加CO2浓度时,AMF降低了物种多样性,而增加CO2浓度后,AMF增加了多样性。这两份研究结果说明土壤氮或CO2浓度较高时,AMF对多样性的贡献越大。
6 问题和展望
已有研究在欧洲草原[9,123],澳大利亚半干旱草原[118]和北美高草草原[10,16,122]深入探讨了AMF对植物群落结构和多样性的影响。然而,在世界上最大的陆地生态系统——欧亚草原上,还研究得较少。研究欧亚草原土壤中的AMF对植物群落的影响及其作用机制,将有助于理解欧亚草原生产力、多样性及其稳定性的维持机制。
全球氮沉降的增加降低了欧洲草地[3],北美草原[4]和欧亚草原[5]植物群落的物种多样性。来自欧洲草地的研究表明,在豆科牧草丰度较大的草地AMF能够降低氮沉降对植物群落多样性的负效应[123]。草地施肥是草地管理的措施之一,草地施肥或氮沉降增加必然改变土壤中有效养分水平及其化学计量比,将作用于AMF与植物的共生关系[72,79],可能会改变植物群落结构和多样性。研究AMF与土壤有效养分互作对植物群落生产力和多样性的影响,将有助于提出全球氮沉降背景下草地生态系统多样性保持的管理措施。
草原生态系统受到干扰后,生产力和物种多样性的稳定性备受关注,AMF对生态系统稳定性的影响还需要深入研究。van der Heijden等[9]发现植物群落的生产力和多样性均与AMF多样性存在二次曲线关系,在AMF多样性较低时,生产力和多样性随AMF多样性增加而增加,而在AMF多样性较高时,生产力和多样性随AMF多样性增加而变化极小,该结果间接说明AMF多样性损失可能造成植物群落的变异性增加,及稳定性下降。物种的多样性决定了系统稳定性[17-18],AMF能够促进物种共存,维持植物群落的多样性[100,134-135],因此,AMF可能作用于物种多样性而影响系统稳定性,还有待进一步验证。
此外,AMF与土壤生物因子互作影响植物群落生产力。比如,Zaller等[136]研究发现不接种AMF处理中,添加蚯蚓增加了植物群落生产力,而在接种AMF处理中,添加蚯蚓对群落生产力无显著影响。AMF与根瘤菌的协同作用促进豆科植物的生长[68]。AMF与其他土壤生物因子互作对植物群落生产力的影响知之甚少。
AMF与植物间的共生关系是AMF对植物生产力、物种多样性及稳定性作用的基础。已有研究从植物个体水平对AMF-植物共生关系进行了深入的研究[19,137],然而在植物群落水平AMF与植物间的共生关系还研究得很少。利用同位素标记法和分子生物学相结合的方法[87],在群落水平探讨共生关系的形成机制,有助于理解AMF对植物群落结构和组成的作用机制。
[1] Smith S E, Read D J. Mycorrhizal Symbiosis (3rd edition)[M]. New York: Elsevier, 2008.
[2] Smith S E, Smith F A. Roles of arbuscular mycorrhizas in plant nutrition and growth: new paradigms from cellular to ecosystem scales. Annual Review of Plant Biology, 2011, 62: 227-250.
[3] Stevens C J, Dise N B, Mountford J O,etal. Impact of nitrogen deposition on the species richness of grasslands. Science, 2004, 303: 1876-1879.
[4] Suding K N, Collins S L, Gough L,etal. Functional- and abundance-based mechanisms explain diversity loss due to N fertilization. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(12): 4387-4392.
[5] Bai Y F, Wu J G, Clark C M,etal. Tradeoffs and thresholds in the effects of nitrogen addition on biodiversity and ecosystem functioning: evidence from Inner Mongolia grasslands. Global Change Biology, 2010, 16(1): 358-372.
[6] Yang H, Jiang L, Li L,etal. Diversity-dependent stability under mowing and nutrient addition: evidence from a 7-year grassland experiment. Ecology Letters, 2012, 15(6): 619-626.
[7] He D, Li X L, Wan L Q,etal. Influence of urea application on aboveground biomass and important value of the species in the degraded grassland. Acta Prataculturae Sinica, 2009, 18(3): 154-158.
[8] Brundrett M. Mycorrhizal associations and other means of nutrition of vascular plants: understanding the global diversity of host plants by resolving conflicting information and developing reliable means of diagnosis. Plant and Soil, 2009, 320(1-2): 37-77.
[9] van der Heijden M G A, Klironomos J N, Ursic M,etal. Mycorrhizal fungal diversity determines plant biodiversity, ecosystem variability and productivity. Nature, 1998, 396: 69-72.
[10] Vogelsang K M, Reynolds H L, Bever J D. Mycorrhizal fungal identity and richness determine the diversity and productivity of a tallgrass prairie system. New Phytologist, 2006, 172(3): 554-562.
[11] Wagg C, Jansa J, Schmid B,etal. Belowground biodiversity effects of plant symbionts support aboveground productivity. Ecology Letters, 2011, 14(10): 1001-1009.
[12] Johnson N C, Angelard C, Sanders I R,etal. Predicting community and ecosystem outcomes of mycorrhizal responses to global change. Ecology Letters, 2013, 16(Suppl 1): 140-153.
[13] Lin S S, Sun X W, Wang X J,etal. Mycorrhizal studies and their application prospects in China. Acta Prataculturae Sinica, 2013, 22(5): 310-325.
[14] Hetrick B A D, Kitt D G, Wilson G T. Mycorrhizal dependence and growth habit of warm-season and cool-season tallgrass prairie plants. Canadian Journal of Botany, 1988, 66(7): 1376-1380.
[15] Wilson G W T, Hartnett D C. Interspecific variation in plant responses to mycorrhizal colonization in tallgrass prairie. American Journal of Botany, 1998, 85(12): 1732-1738.
[16] Hartnett D C, Wilson G W T. Mycorrhizae influence plant community structure and diversity in tallgrass prairie. Ecology, 1999, 80(4): 1187-1195.
[17] Bai Y F, Han X G, Wu J G,etal. Ecosystem stability and compensatory effects in the Inner Mongolia grassland. Nature, 2004, 431: 181-184.
[18] Tilman D, Reich P B, Knops J M H. Biodiversity and ecosystem stability in a decade-long grassland experiment. Nature, 2006, 441: 629-632.
[19] Kiers E T, Duhamel M, Beesetty Y,etal. Reciprocal rewards stabilize cooperation in the mycorrhizal symbiosis. Science, 2011, 333: 880-882.
[20] van der Heijden M G A, Bardgett R D, van Straalen N M. The unseen majority: soil microbes as drivers of plant diversity and productivity in terrestrial ecosystems. Ecology Letters, 2008, 11(6): 296-310.
[21] Li X L, George E, Marschner H. Extension of the phosphorus depletion zone in VA-mycorrhizal white clover in a calcareous soil. Plant and Soil, 1991, 136(1): 41-48.
[22] Zhang F S, Shen J B, Feng G. Rhizosphere Ecology: Processes & Management[M]. Beijing: China Agricultural University Press, 2009.
[23] Cavagnaro T R, Dickson S, Smith F A. Arbuscular mycorrhizas modify plant responses to soil zinc addition. Plant and Soil, 2010, 329(1-2): 307-313.
[24] Zhu Y G, Smith F A, Smith S E. Phosphorus efficiencies and their effects on Zn, Cu, and Mn nutrition of different barley (Hordeumvulgare) cultivars grown in sand culture. Australian Journal of Agricultural Research, 2002, 53(2): 211-216.
[25] Marschner H, Dell B. Nutrient uptake in mycorrhizai symbiosis. Plant and Soil, 1994, 159(1): 89-102.
[26] Yao Q, Li X L, Feng G,etal. Mobilization of sparingly soluble inorganic phosphates by the external mycelium of an abuscular mycorrhizal fungus. Plant and Soil, 2001, 230(2): 279-285.
[27] Li X L, George E, Marschner H. Phosphorus depletion and pH decrease at the root-soil and hyphae-soil interfaces of VA mycorrhizal white clover fertilized with ammonium. New Phytologist, 1991, 119(3): 397-404.
[28] Garg N, Chandel S. Arbuscular mycorrhizal networks: process and functions. In: Lichtfouse E, Hamelin M, Navarrete M,etal. Sustainable Agriculture Volume 2[M]. Netherlands: Springer, 2011: 907-930.
[29] Egerton-Warburton L M, Querejeta J I, Allen M F. Common mycorrhizal networks provide a potential pathway for the transfer of hydraulically lifted water between plants. Journal of Experimental Botany, 2007, 58(6): 1473-1483.
[30] Birhane E, Sterck F, Fetene M,etal. Arbuscular mycorrhizal fungi enhance photosynthesis, water use efficiency, and growth of frankincense seedlings under pulsed water availability conditions. Oecologia, 2012, 169(4): 895-904.
[31] Querejeta J, Egerton-Warburton L, Prieto I,etal. Changes in soil hyphal abundance and viability can alter the patterns of hydraulic redistribution by plant roots. Plant and Soil, 2012, 355(1): 63-73.
[32] Porcel R, Aroca R, Ruiz-Lozano J. Salinity stress alleviation using arbuscular mycorrhizal fungi. A review. Agronomy for Sustainable Development, 2012, 32(1): 181-200.
[33] Giri B, Mukerji K. Mycorrhizal inoculant alleviates salt stress inSesbaniaaegyptiacaandSesbaniagrandifloraunder field conditions: evidence for reduced sodium and improved magnesium uptake. Mycorrhiza, 2004, 14(5): 307-312.
[34] Diouf D, Duponnois R, Ba A T,etal. Symbiosis ofAcaciaauriculiformisandAcaciamangiumwith mycorrhizal fungi andBradyrhizobiumspp. improves salt tolerance in greenhouse conditions. Functional Plant Biology, 2005, 32(12): 1143-1152.
[35] Estrada B, Barea J, Aroca R,etal. A nativeGlomusintraradicesstrain from aMediterraneansalinearea exhibits salt tolerance and enhanced symbiotic efficiency with maize plants under salt stress conditions. Plant and Soil, 2013, 366(1-2): 333-349.
[36] Rabie G H. Induction of fungal disease resistance inViciafababy dual inoculation withRhizobiumleguminosarumand vesicular-arbuscular mycorrhizal fungi. Mycopathologia, 1998, 141(3): 159-166.
[37] Babikova Z, Johnson D, Bruce T,etal. Underground allies: how and why do mycelial networks help plants defend themselves. Bioessays, 2014, 36(1): 21-26.
[38] Jung S, Martinez-Medina A, Lopez-Raez J,etal. Mycorrhiza-Induced resistance and priming of plant defenses. Journal of Chemical Ecology, 2012, 38(6): 651-664.
[39] Vos C, Claerhout S, Mkandawire R,etal. Arbuscular mycorrhizal fungi reduce root-knot nematode penetration through altered root exudation of their host. Plant and Soil, 2012, 354(1): 335-345.
[40] Li Y J, Liu Z L, Hou H Y,etal. Arbuscular mycorrhizal fungi-enhanced resistance againstPhytophthorasojaeinfection on soybean leaves is mediated by a network involving hydrogen peroxide, jasmonic acid, and the metabolism of carbon and nitrogen. Acta Physiologiae Plantarum, 2013, 35(12): 3465-3475.
[41] Babikova Z, Gilbert L, Bruce T J A,etal. Underground signals carried through common mycelial networks warn neighbouring plants of aphid attack. Ecology Letters, 2013, 16(7): 835-843.
[42] Duhamel M, Pel R, Ooms A,etal. Do fungivores trigger the transfer of protective metabolites from host plants to arbuscular mycorrhizal hyphae. Ecology, 2013, 94(9): 2019-2029.
[43] Elsharkawy M, Shimizu M, Takahashi H,etal. The plant growth-promoting fungusFusariumequisetiand the arbuscular mycorrhizal fungusGlomusmosseaeinduce systemic resistance againstCucumbermosaicvirus in cucumber plants. Plant and Soil, 2012, 361(1-2): 397-409.
[44] Jeffries P, Gianinazzi S, Perotto S,etal. The contribution of arbuscular mycorrhizal fungi in sustainable maintenance of plant health and soil fertility. Biology and Fertility of Soils, 2003, 37(1): 1-16.
[45] Wu Q S, Yuan F Y, Fei Y J,etal. Effects of arbuscular mycorrhizal fungi on aggregate stability, GRSP, and carbohydrates of white clover. Acta Prataculturae Sinica, 2014, 23(4): 269-275.
[46] Bever J D, Schultz P A, Pringle A,etal. Arbuscular mycorrhizal fungi: more diverse than meets the eye, and the ecological tale of why. Bioscience, 2001, 51(11): 923-931.
[47] Chaudhary V B, Bowker M A, O’Dell T E,etal. Untangling the biological contributions to soil stability in semiarid shrublands. Ecological Applications, 2009, 19(1): 110-122.
[48] Wilson G W T, Rice C W, Rillig M C,etal. Soil aggregation and carbon sequestration are tightly correlated with the abundance of arbuscular mycorrhizal fungi: results from long-term field experiments. Ecology Letters, 2009, 12(5): 452-461.
[49] van der Heijden M G A. Mycorrhizal fungi reduce nutrient loss from model grassland ecosystems. Ecology, 2010, 91(4): 1163-1171.
[50] Hetrick B A D, Wilson G W T, Cox T S. Mycorrhizal dependence of modern wheat-varieties, landraces, and ancestors. Canadian Journal of Botany, 1992, 70(10): 2032-2040.
[51] Plenchette C, Fortin J A, Furlan V. Growth responses of several plant species to mycorrhizae in a soil of moderate P-fertility. Plant and Soil, 1983, 70(2): 211-217.
[52] Tawaraya K. Arbuscular mycorrhizal dependency of different plant species and cultivars. Soil Science and Plant Nutrition, 2003, 49(5): 655-668.
[53] Grman E. Plant species differ in their ability to reduce allocation to non-beneficial arbuscular mycorrhizal fungi. Ecology, 2012, 93(4): 711-718.
[54] Jakobsen I, Rosendahl L. Carbon flow into soil and external hyphae from roots of mycorrhizal cucumber plants. New Phytologist, 1990, 115(1): 77-83.
[55] Reinhart K O, Wilson G W T, Rinella M J. Predicting plant responses to mycorrhizae: integrating evolutionary history and plant traits. Ecology Letters, 2012, 15(7): 689-695.
[56] Hoeksema J D, Chaudhary V B, Gehring C A,etal. A meta-analysis of context-dependency in plant response to inoculation with mycorrhizal fungi. Ecology Letters, 2010, 13(3): 394-407.
[57] Perez M, Urcelay C. Differential growth response to arbuscular mycorrhizal fungi and plant density in two wild plants belonging to contrasting functional types. Mycorrhiza, 2009, 19(8): 517-523.
[58] Koide R. Density-dependent response to mycorrhizal infection inAbutilontheophrastiMedic. Oecologia, 1991, 85(3): 389-395.
[59] Allsopp N, Stock W D. Density dependent interactions between VA mycorrhizal fungi and even-aged seedlings of two perennial Fabaceae species. Oecologia, 1992, 91(2): 281-287.
[60] Zhen L N, Yang G W, Yang H J,etal. Arbuscular mycorrhizal fungi affect seedling recruitment: a potential mechanism by which N deposition favors the dominance of grasses over forbs. Plant and Soil, 2014, 375(1-2): 127-136.
[61] van der Heijden M G A, Horton T R. Socialism in soil? The importance of mycorrhizal fungal networks for facilitation in natural ecosystems. Journal of Ecology, 2009, 97(6): 1139-1150.
[62] van der Heijden M G A. Arbuscular mycorrhizal fungi as support systems for seedling establishment in grassland. Ecology Letters, 2004, 7(4): 293-303.
[63] van der Heijden M G A, Boller T, Wiemken A,etal. Different arbuscular mycorrhizal fungal species are potential determinants of plant community structure. Ecology, 1998, 79(6): 2082-2091.
[64] Pankova H, Munzbergova Z, Rydlova J,etal. The response ofAsterAmellus(Asteraceae) to mycorrhiza depends on the origins of both the soil and the fungi. American Journal of Botany, 2011, 98(5): 850-858.
[65] Johnson N C, Wilson G W T, Bowker M A,etal. Resource limitation is a driver of local adaptation in mycorrhizal symbioses. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(5): 2093-2098.
[66] Borowicz V A. The impact of arbuscular mycorrhizal fungi on plant growth following herbivory: a search for pattern. Acta Oecologica, 2013, 52: 1-9.
[67] Bennett A E, Bever J D. Mycorrhizal species differentially alter plant growth and response to herbivory. Ecology, 2007, 88(1): 210-218.
[68] Larimer A L, Clay K, Bever J D. Synergism and context dependency of interactions between arbuscular mycorrhizal fungi and rhizobia with a prairie legume. Ecology, 2014, 95(4): 1045-1054.
[69] Grime J P, Mackey J M L, Hillier S H,etal. Floristic diversity in a model system using experimental microcosms. Nature, 1987, 328: 420-422.
[70] Pietikainen A, Kytoviita M M. Defoliation changes mycorrhizal benefit and competitive interactions between seedlings and adult plants. Journal of Ecology, 2007, 95(4): 639-647.
[71] Johnson N C, Rowland D L, Corkidi L,etal. Nitrogen enrichment alters mycorrhizal allocation at five mesic to semiarid grasslands. Ecology, 2003, 84(7): 1895-1908.
[72] Johnson N C. Resource stoichiometry elucidates the structure and function of arbuscular mycorrhizas across scales. New Phytologist, 2010, 185(3): 631-647.
[73] Bonneau L, Huguet S, Wipf D,etal. Combined phosphate and nitrogen limitation generates a nutrient stress transcriptome favorable for arbuscular mycorrhizal symbiosis inMedicagotruncatula. New Phytologist, 2013, 199(1): 188-202.
[74] Siqueira J O, Saggin-Junior O J. Dependency on arbuscular mycorrhizal fungi and responsiveness of some Brazilian native woody species. Mycorrhiza, 2001, 11(5): 245-255.
[75] Schroeder M S, Janos D P. Phosphorus and intraspecific density alter plant responses to arbuscular mycorrhizas. Plant and Soil, 2004, 264(1-2): 335-348.
[76] Janos D P. Plant responsiveness to mycorrhizas differs from dependence upon mycorrhizas. Mycorrhiza, 2007, 17(2): 75-91.
[77] Ryan M H, Small D R, Ash J E. Phosphorus controls the level of colonisation by arbuscular mycorrhizal fungi in conventional and biodynamic irrigated dairy pastures. Australian Journal of Experimental Agriculture, 2000, 40(5): 663-670.
[78] Corkidi L, Rowland D L, Johnson N C,etal. Nitrogen fertilization alters the functioning of arbuscular mycorrhizas at two semiarid grasslands. Plant and Soil, 2002, 240(2): 299-310.
[79] Grman E, Robinson T M P. Resource availability and imbalance affect plant-mycorrhizal interactions: A field test of three hypotheses. Ecology, 2013, 94(1): 62-71.
[80] Johnson N C, Graham J H, Smith F A. Functioning of mycorrhizal associations along the mutualism-parasitism continuum. New Phytologist, 1997, 135(4): 575-585.
[81] Jacquemyn H, Brys R, Merckx V S F T,etal. Coexisting orchid species have distinct mycorrhizal communities and display strong spatial segregation. New Phytologist, 2014, 202(2): 616-627.
[82] Osanai Y, Bougoure D, Hayden H,etal. Co-occurring grass species differ in their associated microbial community composition in a temperate native grassland. Plant and Soil, 2013, 368(1-2): 419-431.
[83] Montesinos-Navarro A, Segarra-Moragues J G, Valiente-Banuet A,etal. Plant facilitation occurs between species differing in their associated arbuscular mycorrhizal fungi. New Phytologist, 2012, 196(3): 835-844.
[84] Wagg C, Jansa J, Stadler M,etal. Mycorrhizal fungal identity and diversity relaxes plant-plant competition. Ecology, 2011, 92(6): 1303-1313.
[85] Danieli-Silva A, Uhlmann A, Vicente-Silva J,etal. How mycorrhizal associations and plant density influence intra- and inter-specific competition in two tropical tree species:Cabraleacanjerana(Vell.) Mart. andLafoensiapacariA.St.-Hil. Plant and Soil, 2010, 330(1-2): 185-193.
[86] Francis R, Read D J. Direct transfer of carbon between plants connected by vesicular-arbuscular mycorrhizal mycelium. Nature, 1984, 307: 53-56.
[87] Walder F, Niemann H, Natarajan M,etal. Mycorrhizal networks: common goods of plants shared under unequal terms of trade. Plant Physiology, 2012, 159(2): 789-797.
[88] Schroeder-Moreno M S, Janos D P. Intra- and inter-specific density affects plant growth responses to arbuscular mycorrhizas. Botany, 2008, 86(10): 1180-1193.
[89] Genney D R, Hartley S E, Alexander I J. Arbuscular mycorrhizal colonization increases with host density in a heathland community. New Phytologist, 2001, 152(2): 355-363.
[90] Fitter A H. Costs and benefits of mycorrhizas: Implications for functioning under natural conditions. Experientia, 1991, 47(4): 350-355.
[91] Xu L M. Mediation of Arbuscular Mycorrhizal Fungi on Plant Density Effects under Different Water Levels:Phenomena and Mechanism[D]. Hangzhou: Zhejiang University, 2010.
[92] Zhang Q. Plant-Plant Interaction and Arbuscular Mycorrhizal Fungi[D]. Hangzhou: Zhejiang University, 2011.
[93] Hetrick B A D, Wilson G W T, Hartnett D C. Relationship between mycorrhizal dependence and competitive ability of two tallgrass prairie grasses. Canadian Journal of Botany, 1989, 67(9): 2608-2615.
[94] Hetrick B A D, Hartnett D C, Wilson G W T,etal. Effects of mycorrhizae, phosphorus availability, and plant-density on yield relationships among competing tallgrass prairie grasses. Canadian Journal of Botany, 1994, 72(2): 168-176.
[95] Zobel M, Moora M. Interspecific competition and arbuscular mycorrhiza: Importance for the coexistence of two calcareous grassland species. Folia Geobotanica, 1995, 30(2): 223-230.
[96] Moora M, Zobel M. Effect of arbuscular mycorrhiza on inter- and intraspecific competition of two grassland species. Oecologia, 1996, 108(1): 79-84.
[97] Klabi R, Hamel C, Schellenberg M P,etal. Interaction between legume and arbuscular mycorrhizal fungi identity alters the competitive ability of warm-season grass species in a grassland community. Soil Biology and Biochemistry, 2014, 70: 176-182.
[98] West H M. Influence of arbuscular mycorrhizal infection on competition betweenHolcuslanatusandDactylisglomerata. Journal of Ecology, 1996, 84(3): 429-438.
[99] Bever J D, Morton J B, Antonovics J,etal. Host-dependent sporulation and species diversity of arbuscular mycorrhizal fungi in a mown grassland. Journal of Ecology, 1996, 84(1): 71-82.
[100] Hart M M, Reader R J, Klironomos J N. Plant coexistence mediated by arbuscular mycorrhizal fungi. Trends in Ecology & Evolution, 2003, 18(8): 418-423.
[101] Vandenkoornhuyse P, Ridgway K P, Watson I J,etal. Co-existing grass species have distinctive arbuscular mycorrhizal communities. Molecular Ecology, 2003, 12(11): 3085-3095.
[102] Robinson D, Fitter A. The magnitude and control of carbon transfer between plants linked by a common mycorrhizal network. Journal of Experimental Botany, 1999, 50: 9-13.
[103] Tilman D. Species richness of experimental productivity gradients—how important is colonization limitation. Ecology, 1993, 74(8): 2179-2191.
[104] MacArthur R H, Wilson E O. The Theory of Island Biogeography[M]. Princeton: Princeton University Press, 1967.
[105] Turnbull L A, Crawley M J, Rees M. Are plant populations seed-limited? A review of seed sowing experiments. Oikos, 2000, 88(2): 225-238.
[106] Voets L, de la Providencia I, Fernandez K,etal. Extraradical mycelium network of arbuscular mycorrhizal fungi allows fast colonization of seedlings underinvitroconditions. Mycorrhiza, 2009, 19(5): 347-356.
[107] Simard S W, Beiler K J, Bingham M A,etal. Mycorrhizal networks: mechanisms, ecology and modelling. Fungal Biology Reviews, 2012, 26(1): 39-60.
[108] Nakano-Hylander A, Olsson P. Carbon allocation in mycelia of arbuscular mycorrhizal fungi during colonisation of plant seedlings. Soil Biology and Biochemistry, 2007, 39(7): 1450-1458.
[109] Janouskova M, Rydlova J, Puschel D,etal. Extraradical mycelium of arbuscular mycorrhizal fungi radiating from large plants depresses the growth of nearby seedlings in a nutrient deficient substrate. Mycorrhiza, 2011, 21(7): 641-650.
[110] Francis R, Read D J. Mutualism and antagonism in the mycorrhizal symbiosis, with special reference to impacts on plant community structure. Canadian Journal of Botany, 1995, 73(S1): 1301-1309.
[111] Moora M, Zobel M. Can arbuscular mycorrhiza change the effect of root competition between conspecific plants of different ages. Canadian Journal of Botany, 1998, 76(4): 613-619.
[112] Kytoviita M M, Vestberg M, Tuom J. A test of mutual aid in common mycorrhizal networks: established vegetation negates benefit in seedlings. Ecology, 2003, 84(4): 898-906.
[113] Yang G W. Mechanisms of Mycorrhizal Fungi and Soil Nitrogen and Phosphorus Affecting Community Productivity Changes in theStipaSteppe[D]. Beijing: China Agricultural University, 2014.
[114] Streitwolf-Engel R, van der Heijden M G A, Wiemken A,etal. The ecological significance of arbuscular mycorrhizal fungal effects on clonal reproduction in plants. Ecology, 2001, 82(10): 2846-2859.
[115] Sudova R, Vosatka M. Effects of inoculation with native arbuscular mycorrhizal fungi on clonal growth ofPotentillareptansandFragariamoschata(Rosaceae). Plant and Soil, 2008, 308(1): 55-67.
[116] Urcelay C, Diaz S. The mycorrhizal dependence of subordinates determines the effect of arbuscular mycorrhizal fungi on plant diversity. Ecology Letters, 2003, 6(5): 388-391.
[117] Hiiesalu I, Pärtel M, Davison J,etal. Species richness of arbuscular mycorrhizal fungi: associations with grassland plant richness and biomass. New Phytologist, 2014, 203(1): 233-244.
[118] O’Connor P J, Smith S E, Smith F A. Arbuscular mycorrhizas influence plant diversity and community structure in a semiarid herbland. New Phytologist, 2002, 154(1): 209-218.
[119] van der Heijden M G A, Streitwolf-Engel R, Riedl R,etal. The mycorrhizal contribution to plant productivity, plant nutrition and soil structure in experimental grassland. New Phytologist, 2006, 172(4): 739-752.
[120] Tilman D, Lehman C L, Thomson K T. Plant diversity and ecosystem productivity: theoretical considerations. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(5): 1857-1861.
[121] Klironomos J N, McCune J, Hart M,etal. The influence of arbuscular mycorrhizae on the relationship between plant diversity and productivity. Ecology Letters, 2000, 3(2): 137-141.
[122] Collins C D, Foster B L. Community-level consequences of mycorrhizae depend on phosphorus availability. Ecology, 2009, 90(9): 2567-2576.
[123] van der Heijden M G A, Verkade S, de Bruin S J. Mycorrhizal fungi reduce the negative effects of nitrogen enrichment on plant community structure in dune grassland. Global Change Biology, 2008, 14(11): 2626-2635.
[124] Yang G W, Liu N, Lu W J,etal. The interaction between arbuscular mycorrhizal fungi and soil phosphorus availability influences plant community productivity and ecosystem stability. Journal of Ecology, 2014, 102(4): 1072-1082.
[125] Treseder K K. A meta-analysis of mycorrhizal responses to nitrogen, phosphorus, and atmospheric CO2in field studies. New Phytologist, 2004, 164(2): 347-355.
[126] Liu Y, Shi G, Mao L,etal. Direct and indirect influences of 8 yr of nitrogen and phosphorus fertilization on Glomeromycota in an alpine meadow ecosystem. New Phytologist, 2012, 194(2): 523-535.
[127] Reich P B, Knops J, Tilman D,etal. Plant diversity enhances ecosystem responses to elevated CO2and nitrogen deposition. Nature, 2001, 410: 809-812.
[128] Reeves F B, Wagner D, Moorman T,etal. Role of endomycorrhizae in revegetation practices in the semi-arid west.1. comparison of incidence of mycorrhizae in severely disturbed vs natural environments. American Journal of Botany, 1979, 66(1): 6-13.
[129] Allen M F, Clouse S D, Weinbaum B S,etal. Mycorrhizae and the integration of scales: from molecules to ecosystems. In: Allen M F. Mycorrhizal Functioning[M]. London: Chapman & Hall, 1992: 488-515.
[130] Newsham K K, Watkinson A R, West H M,etal. Symbiotic fungi determine plant community structure—changes in a Lichen-Rich community induced by fungicide application. Functional Ecology, 1995, 9(3): 442-447.
[131] Allsopp N, Stock W D. Mycorrhizal status of plants growing in the cape floristic region, South-Africa. Bothalia, 1993, 23(1): 91-104.
[132] Shi W Q. The effects of arbuscular mycorrhizal fungi onStipagrandiscommunity in Inner Mongolia grassland. Ecology and Environmental Sciences, 2010, 19(2): 344-349.
[133] Johnson N C, Wolf J, Koch G W. Interactions among mycorrhizae, atmospheric CO2and soil N impact plant community composition. Ecology Letters, 2003, 6(6): 532-540.
[134] van der Heijden M G A, Wiemken A, Sanders I R. Different arbuscular mycorrhizal fungi alter coexistence and resource distribution between co-occurring plant. New Phytologist, 2003, 157(3): 569-578.
[135] Zobel M, Moora M, Haukioja E. Plant coexistence in the interactive environment: Arbuscular mycorrhiza should not be out of mind. Oikos, 1997, 78(1): 202-208.
[136] Zaller J G, Heigl F, Grabmaier A,etal. Earthworm-mycorrhiza interactions can affect the diversity, structure and functioning of establishing model grassland communities. Plos One, 2011, 6(12): e29293.
[137] Fellbaum C R, Gachomo E W, Beesetty Y,etal. Carbon availability triggers fungal nitrogen uptake and transport in arbuscular mycorrhizal symbiosis. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(7): 2666-2671.
参考文献:
[7] 何丹, 李向林, 万里强, 等. 施用尿素当年对退化天然草地物种地上生物量和重要值的影响. 草业学报, 2009, 18(3): 154-158.
[13] 林双双, 孙向伟, 王晓娟, 等. 我国菌根学研究进展及其应用展望. 草业学报, 2013, 22(5): 310-325.
[22] 张福锁, 申建波, 冯固. 根际生态学—过程与调控[M]. 北京: 中国农业大学, 2009.
[45] 吴强盛, 袁芳英, 费永俊, 等. 菌根真菌对白三叶根际团聚体稳定性、球囊霉素相关土壤蛋白和糖类物质的影响. 草业学报, 2014, 23(4): 269-275.
[91] 徐黎明. 不同水分状况下丛枝菌根真菌对植物密度效应的调节及机理[D]. 杭州: 浙江大学, 2010.
[92] 张倩. 植物相互作用与丛枝菌根真菌[D]. 杭州: 浙江大学, 2011.
[113] 杨高文. 菌根真菌和氮磷对针茅草原群落生产力变化的作用机制[D]. 北京: 中国农业大学, 2014.
[132] 石伟琦. 丛枝菌根真菌对内蒙古草原大针茅群落的影响. 生态环境学报, 2010, 19(2): 344-349.
Relationship between arbuscular mycorrhizal fungi and individual plant and their effects on plant productivity and species diversity of plant community
YANG Gao-Wen1,2, LIU Nan1, YANG Xin1, ZHANG Ying-Jun1*
1.DepartmentofGrasslandScience,ChinaAgriculturalUniversity,Beijing100193,China; 2.CollegeofAgro-grasslandScience,NanjingAgriculturalUniversity,Nanjing210095,China
Arbuscular mycorrhizal fungi (AMF) are important components of terrestrial ecosystems, able to form mycorrhizal symbioses with about 80% of all terrestrial plant species. AMF play an important role in determining plant diversity and productivity through their influence on plant nutrient uptake and the ability to mediate plant-plant interactions. We reviewed the literature on AMF to identify the research gaps concerning the relationships between AMF and individual plants, interplant plant interactions and plant diversity and productivity focusing on three aspects. Firstly, we analyzed AMF-plant interactions and the factors influencing these interactions and developed a conceptual model illustrating the effect of soil available phosphorus levels on the mycorrhizal contribution to plant growth. Secondly, we summarized the effects of AMF on plant-plant interactions and seedling recruitment. Thirdly, we analyzed the effects of AMF on plant diversity and productivity, and developed two conceptual models to predict the effects of soil nutrient levels on the mycorrhizal contribution to plant diversity and productivity. Our results could be applied to forage production and grassland management to provide scientific support for the introduction of AMF when establishing pasture and for conservation biodiversity in native grassland. Suggested research priorities are outlined.
arbuscular mycorrhizal fungi; productivity; diversity; stability; seedling recruitment
10.11686/cyxb2014316
http://cyxb.lzu.edu.cn
2014-07-21;改回日期:2014-09-02
国家自然科学基金(31472137),973项目(2014CB138805)和牧草产业技术体系项目(CARS-35)资助。
杨高文(1986-),男,四川罗江人,讲师,博士。E-mail: yanggw@njau.edu.cn *通讯作者Corresponding author. E-mail: zhangyj@cau.edu.cn
杨高文,刘楠,杨鑫,张英俊. 丛枝菌根真菌与个体植物的关系及其对群落生产力和物种多样性的影响. 草业学报, 2015, 24(6): 188-203.
Yang G W, Liu N, Yang X, Zhang Y J. Relationship between arbuscular mycorrhizal fungi and individual plant and their effects on plant productivity and species diversity of plant community. Acta Prataculturae Sinica, 2015, 24(6): 188-203.

