MsiR高可溶性蛋白突变株的筛选
马 腾,赵亚琪,路福平,蔡 韬*
(1.天津科技大学 生物工程学院,天津 300222;2.中国科学院 天津工业生物技术研究所,天津 300308)
MsiR蛋白来源于中慢生型天山根瘤菌(Mesorhizobium tianshanense)[1],是LysR型转录调控(LysR-type of transcriptional regulators,LTTRs)家族的一员。豆科植物在生长过程中,会在根际分泌一种抗代谢物刀豆氨酸,MsiR能够特异性的识别胞内的刀豆氨酸,启动msiA基因的表达进而将胞内的刀豆氨酸分泌到胞外,使天山根瘤菌在豆科植物的根际成为优势菌,是共生结瘤的基础[2]。LysR家族转录调控蛋白[3]是目前已知的最大的一类原核转录调控蛋白,种类繁多,来源广泛、高度保守[4],参与细胞分裂、生物代谢[5]、群体感应、固氮[6]、毒素[7]产生等多种生命活动,具有较高的学术价值和广泛的应用前景。
目前,转录调控蛋白应用主要有两个方向。其一是利用转录调控蛋白对底物识别的特异性进行生物检测[8]。如SHIN H J等[9]利用萘降解转录调控蛋白(NahR)对水杨酸的特异性识别,构建了水杨酸的生物检测器。其二是用于构建动态精确地调控网络。徐鹏等[10]利用丙二酸单酰辅酶A(malonyl-CoA)转录抑制蛋白(fapR)对细胞内丙二酸单酰辅酶A的专一性结合,开发了控制脂肪酸合成的生物开关。通过动态调控丙二酸单酰辅酶A的含量优化脂肪酸的合成,同时解除了过量前体化合物对细胞生长的抑制。故而,外源蛋白在表达宿主系统中可溶性蛋白的含量能否达到一定水平是影响其应用的重要因素[11]。
本研究以MsiR蛋白作为研究对象,利用mCherry荧光蛋白的单体分子具有高可溶性和高光稳定性的特点[12],构建了MsiR-mCherry融合蛋白,建立了一种能够简单、直观的检测MsiR蛋白在大肠杆菌(Escherichia coli)中的可溶性表达量的方法;并通过易错聚合酶链反应(errorprone polymerase chain reaction,Errorprone-PCR)[13]和致突变菌株XL1-Red两种方式构建了msiR-mCherry基因突变文库,经筛选得到了4株在大肠杆菌(Escherichia coli)中以37 ℃作为诱导温度下可溶性明显提高的蛋白突变体。本研究旨在为LysR家族转录调控蛋白的应用研究提供新的思路,建立一套在大肠杆菌中筛选具有高可溶性的蛋白突变体的可行方案。
1 材料与方法
1.1 材料与试剂
致突变菌株E.coliXL1-Red感受态细胞:安捷伦科技有限公司;E.coliBL21(DE3)、Trans 5α感受态细胞:北京全式金生物技术有限公司;中慢生型天山根瘤菌(Mesorhizobium tianshanense):南京农业大学朱军教授惠赠;质粒pET28a用于突变文库的表达载体、质粒pJZ369用于mCherry基因的PCR模板:本实验室保存。
限制性内切酶NcoI、BamHI、EcoRI、MluI和HindIII:美国Fermentas公司;T4 DNA聚合酶、T4 DNA连接酶、TaqDNA聚合酶、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)set:美国Thermo scientific公司;Fastpfu fly高保真DNA聚合酶:北京全式金公司;异丙基硫代半乳糖苷(isopropyl β-D-1-thiogalactopyranoside,IPTG)、卡那霉素:北京索莱宝科技有限公司;PCR纯化试剂盒及胶回收试剂盒:美国Axygen公司;高纯度质粒小提试剂盒:北京康为世纪科技生物科技有限公司;其他试剂均为国产分析纯。
1.2 仪器与设备
Thermo Evolution RC冷冻大容量离心机:美国Thermo Scientific公司;Master cycler pro梯度PCR仪:德国Eppendorf公司;AKTApurifier100蛋白纯化仪:美国GE公司;Spectra-Max M5连续波长多功能酶标仪:美国MD公司;JN-10高压匀质机:广州聚能生物科技有限公司;THZ-052小型恒温摇床:上海博彩生物科技有限公司;Scientz-IID超声波细胞破碎仪:上海乔跃电子有限公司;JY6000C三恒多用电泳仪:北京君意东方电泳设备有限公司;Smartgel凝胶成像系统:北京赛智创业科技有限公司;小型垂直电泳槽:伯乐生命医学产品(上海)有限公司。
1.3 方法
1.3.1 引物序列
本实验所用引物序列如表1所示。
1.3.2 MsiR及MsiR-mCherry原核表达载体的构建
(1)MsiR原核表达载体的构建
以M.tianshanense基因组DNA为模板,msiR-his-Blunt和msiR-his-EcoRI作为引物,进行msiR-his基因的扩增。PCR反应条件:98 ℃预变性5 min;98 ℃变性20 s,56 ℃退火20 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min。PCR产物经PCR回收试剂盒回收后采用EcoRI 酶切。酶切产物采用1%琼脂糖凝胶进行核酸电泳,胶回收914 bp的片段。pET28a载体采用NcoI单酶切,乙醇沉淀回收后,采用T4 DNA聚合酶进行补平。经酚氯仿抽提后,再采用EcoRI进行酶切,胶回收5 265 bp的片段。将PCR产物酶切片段与载体采用T4 DNA连接酶连接并转化至Trans5α感受态,进行菌落PCR验证,挑取阳性克隆至LB液体培养基培养,菌液送往苏州金唯智生物科技有限公司北京分公司进行测序,将此重组质粒命名为pTM-2。
(2)MsiR-mCherry原核表达载体的构建
以M.tianshanense基因组DNA为模板,msiR-his-Blunt和msiR-mCherry-linker-2作为引物,进行msiR基因的扩增。以质粒pJZ369为模板,msiR-mCherry-linker-1和mCherryhis-BamHI作为引物,进行mCherry基因的扩增。胶回收PCR产物并定量,按物质的量1∶1的比例进行混合,msiR-his-Blunt和mCherry-his-BamHI作为引物,采用Fastpfu fly高保真DNA聚合酶进行msiR-mCherry基因的扩增,将msiRmCherry基因克隆至pET28a载体并将此重组质粒命名为pTM-RM。
1.3.3 MsiR及MsiR-mCherry的表达、纯化及可溶性分析
将重组质粒pTM-2和pTM-RM转化E.coliBL21(DE3),选取16 ℃和37 ℃作为诱导温度诱导表达蛋白。测定mCherry荧光值及光密度值OD600nm。收集菌体,重悬于Tris Buffer[20 mmol/L Tris-HCl pH 8.0;300 mmol/L NaCl;200 mmol/L KCl;10%甘油;1 mmol/L二硫代苏糖醇(DL-dithiothreitol,DTT)]中。采用高压匀质机破碎细胞,12 000 r/min离心1 h,取上清用NI-agrose亲和层析柱进行纯化,以50 mL含有50 mmol/L 咪唑的Tris Buffer清洗层析柱去除杂质蛋白,最后以5 mL含有500 mmol/L咪唑的Tris Buffer洗脱目的蛋白并收集。取沉淀以Tris Buffer重悬至上清相同的体积。
分别取上清、沉淀、全细胞样品加入6倍十二烷基硫酸钠(sodiumdodecylsulfate,SDS)LoadingBuffer,煮沸10 min,12 000 r/min离心10 min后取上清进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE),检测重组蛋白的表达情况。
1.3.4 MsiR-mCherry突变文库的建立及筛选
(1)采用XL1-Red感受态细胞建立突变文库
抽提pTM-RM质粒,按照XL1-red感受态细胞操作手册进行化学转化,涂布于含有卡那霉素的固体LB抗性平板,37 ℃培养过夜,挑取200个单菌落接种至20 mL含有卡那霉素的液体LB培养基中,200 r/min、37 ℃培养24 h。吸取5 μL转接至10 mL含有卡那霉素的LB培养基中,37 ℃培养24 h,重复3次。抽提质粒,以25 μL 洗脱液(Elution Buffer,EB)洗脱电转化至E.coliBL21(DE3)感受态,涂布含有卡那霉素的固体LB抗性平板收集菌体。
(2)易错PCR建立突变文库
以质粒pTM-RM为模板,RM-Error-1和RM-Error-2作为引物,采用TaqDNA聚合酶进行易错PCR。反应总体系1mL;TaqDNA聚合酶(5U/μL)10μL;Tris-HCl(100mmol/L,pH 8.3)100 μL;KCl(2 mol/L)25 μL;MgCl2(200 mmol/L)35 μL;脱氧胞苷三磷酸(deoxycytidine triphosphate,dCTP)(25 mmol/L)40 μL;脱氧胸苷三磷酸(deoxythymidine triphosphate,dTTP)(25 mmol/L)40 μL;脱氧腺苷三磷酸(deoxyadenosine triphosphate,dATP)(5 mmol/L)40 μL;脱氧鸟苷三磷酸(deoxyguanosine triphosphate,dGTP)(5 mmol/L)40 μL;上下游引物(100 μmol/L)各20 μL;DNA模板100 μL(终质量浓度为20 pg/μL);MnCl2(25 mmol/L)20 μL;ddH2O 510 μL。PCR反应条件:95 ℃预变性5 min;95 ℃变性1 min,56 ℃退火1 min,72 ℃延伸3 min,10个循环;72 ℃延伸10 min。PCR产物经PCR回收试剂盒回收后克隆至pET28a载体,涂布含有卡那霉素的固体LB抗性平板收集菌体。
取突变文库于37 ℃活化1 h,涂布于终浓度0.05 mmol/L的IPTG的固体LB平板,37 ℃培养24 h,肉眼观察菌落颜色,挑取红色单菌落。
2 结果与分析
2.1 MsiR及MsiR-mCherry原核重组表达载体的构建和鉴定
PCR扩增得到正确的msiR和msiR-mCherry片段结果见图1a及图1b,在987 bp、1 659 bp处有特异性条带出现。重组质粒经MluI和HindIII双酶切鉴定,进行琼脂糖凝胶电泳,结果见图1c和图1d。由图1c和图1d可知,pTM2质粒在1 760 bp和4 419 bp、pTM-RM质粒在2 440 bp和4 419 bp处分别有特异性条带出现,重组质粒经双酶切产生的片段大小与预期相符。重组质粒经金唯智科技有限公司测序,证实得到目的基因的全长、无突变的阳性克隆。
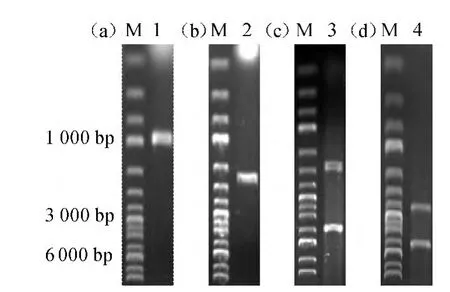
图1 msiR 及msiR-mCherry 基因扩增及重组表达载体酶切验证Fig.1 PCR product and enzyme digestion verification with recombinant vector of msiR and msiR-mCherry
2.2 MsiR及MsiR-mCherry重组蛋白的诱导表达及纯化
MsiR及MsiR-mCherry均能够在E.coliBL21(DE3)中大量表达,结果见图2。由图2可知,MsiR蛋白的分子质量为33 ku,MsiR-mCherry蛋白的分子质量为65 ku。采用16 ℃进行诱导,MsiR可溶性表达的蛋白量约占MsiR总蛋白的1/2;采用37 ℃进行诱导,MsiR绝大部分存在于高压匀浆破碎菌体后的沉淀当中,上清中只检测到微量的MsiR蛋白,表明MsiR在此诱导温度下主要是以包涵体形式存在的。MsiR-mCherry蛋白的表达形式与MsiR一致。
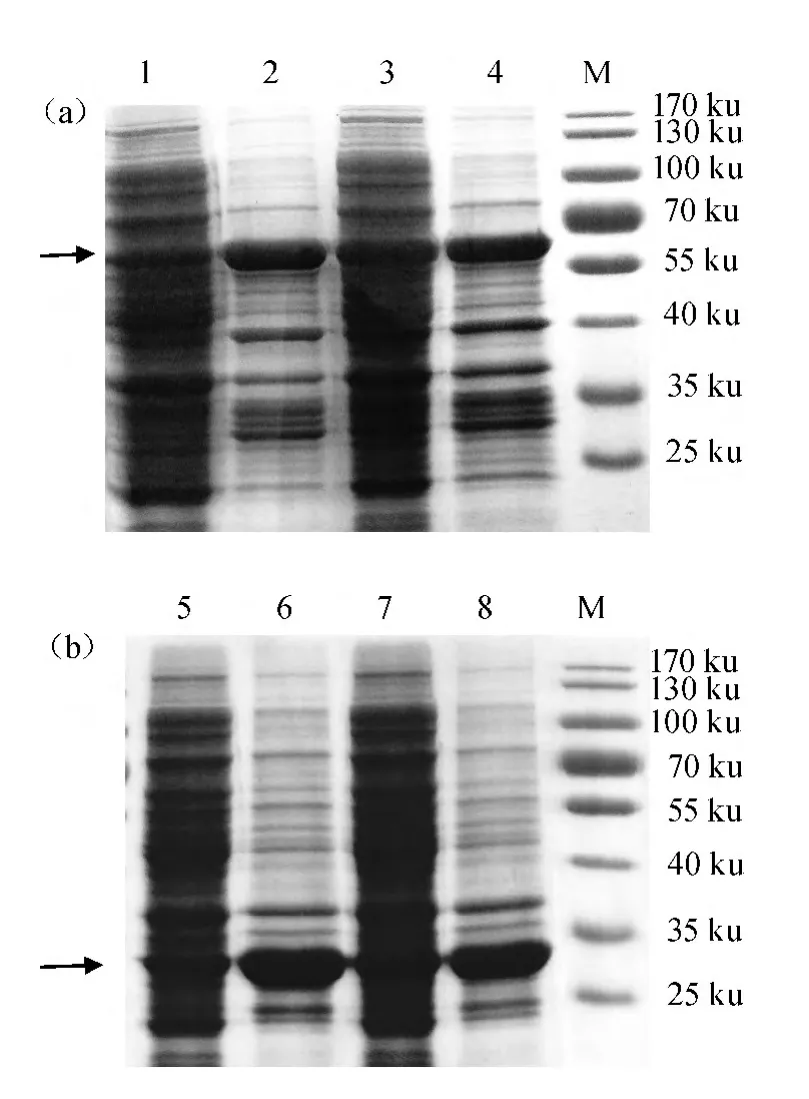
图2 MsiR-mCherry蛋白(a)及MsiR(b)在不同诱导温度下可溶蛋白的含量Fig.2 Concentration of MsiR-mCherry (a) and MsiR (b) soluble protein at different temperature
2.3 msiR-mCherry突变文库筛选的可行性分析
将pET28a、pTM-2、pTM-RM 转 化 至E.coliBL21(DE3),重组菌采用IPTG作为诱导剂,测定16 ℃和37 ℃时的荧光强度,结果见图3。由图3可知,含有pET28a、pTM-2的E.coliBL21(DE3)的重组菌在16 ℃和37 ℃诱导下未能检测到荧光信号;含有pTM-RM的E.coliBL21(DE3)的重组菌在16 ℃能够检测到明显的mCherry荧光信号且远远高于其在37 ℃的mCherry荧光强度。因此,通过测定菌体的荧光强度能够定性、定量的测定MsiRmCherry重组蛋白的可溶性表达量。

图3 16 ℃(a)及37 ℃(b)温度条件下MsiR-蛋白及MsiR-mCherry蛋白表达重组菌的荧光强度Fig.3 mCherry fluorescence intensity of MsiR-mCherry and MsiR recombinant expression strains with 16 ℃(a)and 37 ℃(b)
2.4 msiR-mCherry突变文库的质量分析
将两种构建方式的文库各挑取20个单菌落进行测序,以EP-PCR方式构建的突变文库的突变频率约为2~4个/kb,以XL1-Red方式构建的突变文库的突变频率约为1~5个/kb。而EP-PCR文库及XL1-Red文库突变分布统计结果见图4。由图4可知,发生于C/G的突变占64.7%(33/51),而发生于A/T的突变只占35.3%(18/51),并且发现一个移码突变。而发生于A/T的突变占79.3%(50/63),而发生于G/C的突变只占20.7%(13/63)未发现移码突变。两种突变文库的构建方式基本能够覆盖到所有的突变类型。
2.5 MsiR-mCherry突变株的基因序列比对及突变位点分析
取突变文库于37 ℃活化1 h,涂布于含有卡那霉素和IPTG(0.05 mmol/L)的固体LB平板,37 ℃培养24 h,肉眼观察菌落颜色,挑取红色单菌落。
经过平板筛选,估算阳性菌落所占比例约为0.3‰。目前,已得到4株在大肠杆菌中以37 ℃作为诱导温度下可溶性明显提高的蛋白突变体。采用37 ℃作为诱导温度,突变株进行蛋白表达,测定突变株的荧光强度,而后进行蛋白电泳,结果见图5。由图5a可知,筛选得到的4株蛋白突变体的重组表达菌株在37 ℃的荧光强度相比于野生型蛋白重组表达菌株的荧光强度有了大幅的提升,且由图5b可知,4株蛋白突变体在37 ℃作为诱导温度时可溶性表达量相比于野生型蛋白有了显著的提高,约占重组蛋白总量的1/2。
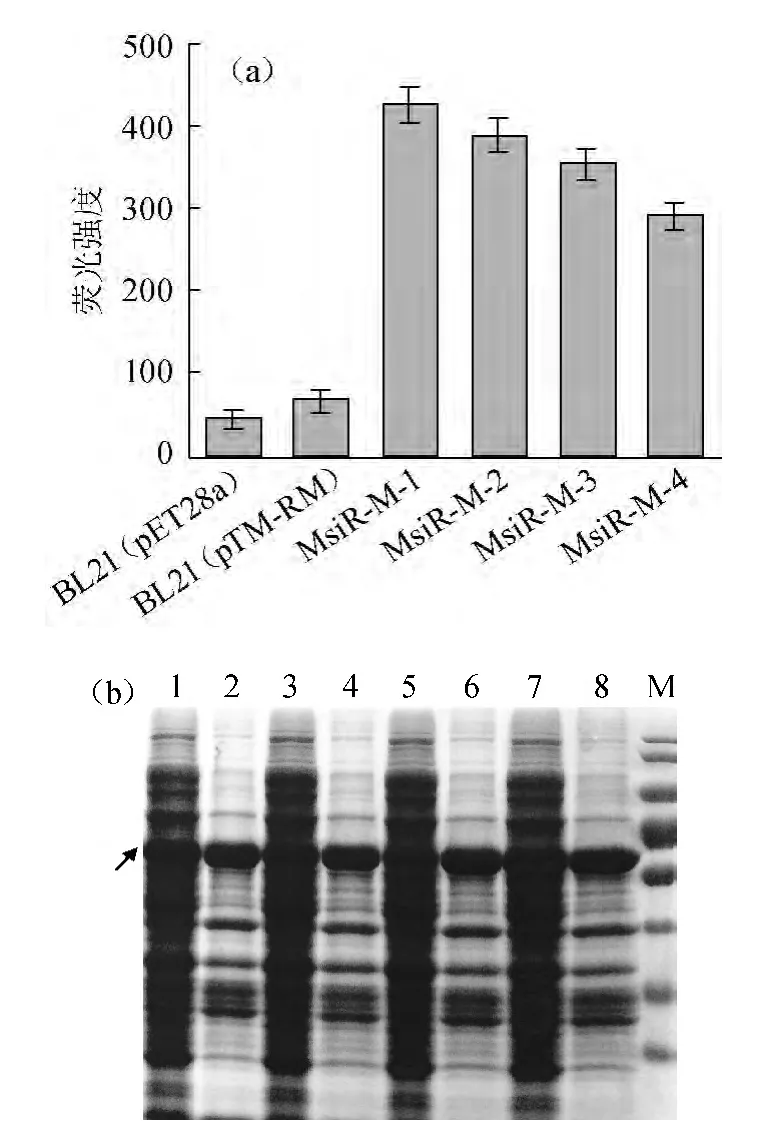
图5 37 ℃下不同突变株的荧光强度(a)及可溶性蛋白表达量(b)Fig.5 mCherry fluorescence intensity (a) and soluble expression (b) of different mutations at 37 ℃
突变基因的突变位点对应的氨基酸变化情况见表2。由表2可知,目前得到了4株影响MsiR可溶性的突变体。通过MsiR蛋白与LysR家族蛋白的同源建模分析,发现氨基酸突变大多发生在MsiR的N端(如A23P、I47V等),这部分区域通常以螺旋-转角-螺旋[14]的形式存在,是MsiR与DNA的作用区域。通过筛选结果推测MsiR的N端是影响蛋白可溶性的关键区域。除此之外,某些突变发生在MsiR N端和C端之间的linker区域(如L78N、M68L),影响蛋白的寡聚化形态[15],寡聚化形态的改变会影响蛋白的聚集状态进而改变其在胞内环境的溶解性。另外一部分处于MsiR的蛋白骨架结构[16]上(如S122D、A172D),这部分突变可能会影响蛋白的空间结构,导致其空间折叠、构象等发生改变,进而带来可溶性的变化。
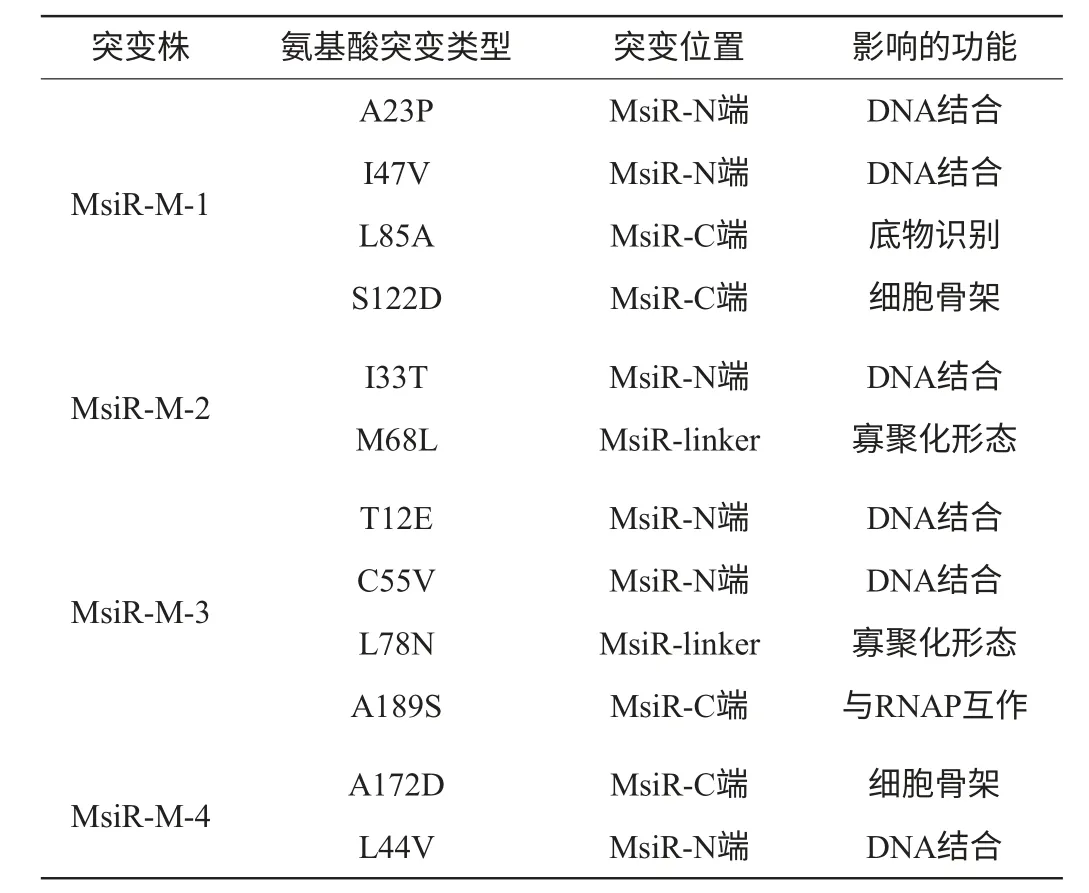
表2 突变情况汇总Table 2 Mutations conditions of MsiR
3 结论
mCherry荧光蛋白的可溶性高,光稳定性强,使用mCherry与外源蛋白形成融合蛋白时,mCherry荧光蛋白的活性与被融合的外源蛋白的功能没有明显的影响。本研究以天山根瘤菌中的MsiR蛋白作为研究对象,验证了通过检测MsiR-mCherry融合蛋白的荧光信号来简单、直观、定量的检测MsiR蛋白在大肠杆菌中的可溶性表达量的可行性。采用易错PCR和致突变菌株两种方式构建突变文库,经筛选得到了4株在大肠杆菌中以37 ℃作为诱导温度下可溶性明显提高的蛋白突变体。此种方法能够实现高通量水平的筛选,误差小,能广泛地应用到各种胞内蛋白高可溶性突变株的筛选。
[1]CHEN W X,WANG E,WANG S Y,et al.Characteristics ofRhizobium tianshanensesp.nov.,a moderately and slowly growing root nodule bacterium isolated from an arid saline environment in Xinjiang,People's Republic of China[J].Int J Syst Bacteriol,1995,45(1):153-159.
[2]CAI T,CAI W,ZHANG J,et al.Host legume-exuded antimetabolites optimize the symbiotic rhizosphere[J].Mol Microbiol,2009,73 (3):507-517.
[3]MADDOCKS S E,OYSTON P C F.Structure and function of the LysR-type transcriptional regulator (LTTR) family proteins[J].Microbiol-Sgm,2008,154(4):3609-3623.
[4]HENIKOFF S,HAUGHN G W,CALVO J M,et al.A large family of bacterial activator proteins[J].P Natl Acad Sci USA,1988,85(18):6602-6606.
[5]IMPERI F,TIBURZI F,FIMIA G M,et al.Transcriptional control of thepvdSiron starvation sigma factor gene by the master regulator of sulfur metabolism CysB inPseudomonas aeruginosa[J].Environ Microbiol,2010,12(6):1630-1642.
[6]KAMBOJ D V,BHATIA R,PATHAK D V,et al.Role ofnodDgene product and flavonoid interactions in induction of nodulation genes inMesorhizobium ciceri[J].Physiol Mol Biol Plants,2010,16(1):69-77.
[7]TAYLOR J L,DE SILVA R S,KOVACIKOVA G,et al.The crystal structure of AphB,a virulence gene activator fromVibrio cholerae,reveals residues that influence its response to oxygen and pH[J].Mol Microbiol,2012,83(3):457-470.
[8]PARK M,TSAI S L,CHEN W.Microbial biosensors:engineered microorganisms as the sensing machinery[J].Sensors,2013,13(5):5777-5795.
[9]SHIN H J.Development of highly-sensitive microbial biosensors by mutation of thenahRregulatory gene[J].J Biotechnol,2010,150(2):246-250.
[10]XU P,LI L,ZHANG F,et al.Improving fatty acids production by engineering dynamic pathway regulation and metabolic control[J].P Natl Acad Sci USA,2014,111(31):11299-11304.
[11]WAEGEMAN H,SOETAERT W.Increasing recombinant protein production in Escherichia coli through metabolic and genetic engineering[J].J Ind Microbiol Biot,2011,38(12):1891-1910.
[12]DUELLMAN T,BURNETT J,YANG J.Quantitation of secreted proteins using mCherry fusion constructs and a fluorescent microplate reader[J].Anal Biochem,2015,473(6):34-40.
[13]KIM M S,LEI X G.Enhancing thermostability ofEscherichia coliphytase AppA2 by error-prone PCR[J].Appl Microbiol Biot,2008,79(1):69-75.
[14]BRENNAN R G,MATTHEWS B W.The Helix-Turn-Helix DNA Binding Motif[J].J Biol Chem,1989,264(4):1903-1906.
[15]KNAPP G S,HU J C.The oligomerization of CynR inEscherichia coli[J].Protein Sci,2009,18(11):2307-2315.
[16]CAILLE O,ZINCKE D,MERIGHI M,et al.Structural and functional characterization ofPseudomonas aeruginosaglobal regulator AmpR[J].J Bacteriol,2014,196(22):3890-3902.

