紫色胡萝卜汁体外抗氧化活性的研究
虎春艳,林玉萍,鲁 瑞,张春梅,罗兴倩,梁 杏,赵声兰*
(1.云南中医学院 药学院,云南 昆明 650500;2.云南中医学院 中药学院,云南 昆明 650500)
萝卜是常见蔬菜之一,《本草纲目》记载,“萝卜大下气、消谷和中、去邪热气”。其种类有胡萝卜、白萝卜、水萝卜、樱桃萝卜等,紫色胡萝卜和橙色胡萝卜是胡萝卜中的两个种类,由于其丰富的营养价值,在北欧等地被广泛种植[1]。紫色胡萝卜富含花青素、β-胡萝卜素、多酚、维生素等物质,此外还含有丰富的钾、镁、钙等矿物质元素。紫色胡萝卜中所含的花青素主要是酰化花青素,其含量占花青素的70%以上,酰化花青素具有较高的稳定性和更好的生物活性[2]。花青素具有抗癌、抗炎、抗氧化及减少动脉粥样硬化等作用[3-5]。人体新陈代谢过程中产生超氧自由基、羟自由基等自由基,这些自由基是很多生理和病理疾病的积极参与者[6]。国内外研究表明,部分植物果实、蔬菜及其提取物具有较强的清除自由基、延缓机体衰老的作用[7-9]。
我国大部分地区种植白萝卜、橙色胡萝卜和紫色胡萝卜,其中紫色胡萝卜在我国滇东北地区广泛种植。国内对橙色胡萝卜和白萝卜研究较多,白萝卜具有较好的清除亚硝酸盐的作用[10],胡萝卜中的多糖具有抗氧化活性[11],萝卜籽提取物还有较好的抑菌效果[12],而紫色胡萝卜其极高的营养价值一直没有被大众所认识。国外大量种植紫色胡萝卜,将其作为一种良好的保健食品[2,4],尤其是紫色胡萝卜汁深受大众喜爱。本实验研究了紫色萝卜汁的体外抗氧化作用,为紫色胡萝卜的进一步开发利用奠定基础。
1 材料与方法
1.1 材料与试剂
紫色胡萝卜、橙色胡萝卜、白萝卜:购买自云南省昭通市。
硫酸亚铁、邻菲啰啉、过氧化氢30%、磷酸二氢钠、磷酸氢二钠、焦性没食子酸、三(羟甲基)氨基甲烷、邻苯三酚、无水乙醇、硫酸、盐酸、福林酚、无水碳酸钠、氯化钾、醋酸钠、冰乙酸等均为国产分析纯试剂。
1.2 仪器与设备
UV759s型紫外-可见分光光度计:上海精科实业有限公司;CP214型号电子天平:奥豪斯仪器(上海)有限公司;TG16-WS高速台式离心机:长沙湘仪离心机仪器有限公司;H.H.S11-4R型电热恒温水浴锅:上海医疗器械五厰;HR2826型飞利浦榨汁机:珠海经济特区飞利浦家庭电器有限公司。
1.3 方法
1.3.1 萝卜汁的制备
紫色胡萝卜洗净去芯,压榨取汁,汁液在离心机中4 000 r/min离心15 min,取上清液,备用。
白萝卜和橙色胡萝卜直接洗净榨汁,4 000 r/min离心处理15 min,取上清液,备用。
1.3.2 紫色胡萝卜总酚含量测定
采用Folin-酚法,按文献[13]测定总酚含量。配制质量浓度分别为10 μg/mL、20 μg/mL、30 μg/mL、40 μg/mL、50 μg/mL的没食子酸工作液,分别精密吸取上述没食子酸工作液1 mL,加入10 mL 的具塞试管内,加入10%Folin-酚试剂5 mL,5~8 min后加入4 mL 7.5%的Na2CO3溶液,蒸馏水定容至25 mL,充分摇匀,避光静置反应2 h,在波长765 nm处测定吸光度值,以没食子酸质量浓度为横坐标(x),以吸光度值为纵坐标(y),制作标准曲线,得回归方程:y=0.011 4x+0.018 9(r=0.999 1),该标准曲线线性范围为吸光度值0~0.915 3。
25 mL具塞试管中加入稀释的紫色胡萝卜汁1 mL,加入10%Folin-酚试剂5 mL,按上述方法测定紫色胡萝卜汁溶液的吸光度值,通过没食子酸标准曲线计算样品的总酚含量。
1.3.3 紫色胡萝卜总花青素含量的测定
采用pH示差法,按文献[14]测定紫色胡萝卜中花色苷的含量。取0.025 mol/L、pH 1.0的HCl-KCl缓冲溶液和0.4 mol/L、pH 4.5 HAc-NaAc缓冲溶液各4.5 mL,分别加入待测样品0.5 mL,在暗处放置30 min,分别测定两样品在波长510 nm和700 nm处的吸光度值。按下式计算稀释液吸光度值A。
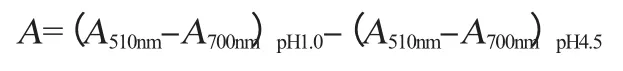
式中:(A510nm-A700nm)pH1.0为样品在pH 1.0的缓冲液中在波长510 nm和700 nm处的吸光度值之差;(A510nm-A700nm)pH4.5为样品在pH 4.5的缓冲液中在波长510 nm和700 nm处的吸光度值之差。待测样品中花色苷的含量为:
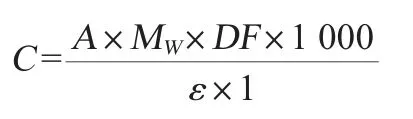
式中:C为待测样品中花色苷的含量,mg/L;MW为样品中主要花色苷矢车菊-3-葡萄糖苷的相对分子质量,为449.2;DF为稀释因子;ε为样品中主要花色苷的的摩尔吸收率,为26 900;l为比色杯厚度,cm。
1.3.4 不同稀释倍数的萝卜汁对·OH的清除作用
羟自由基清除率的测定方法参考文献[15]进行,以不同质量浓度的维生素C为阳性对照,分别在10 mL具塞试管中加不同浓度的萝卜汁0.1 mL,依次加入0.75 mmol/L FeSO41 mL,0.75 mmol/L邻二氮菲1 mL,最后加入0.01%H2O21 mL,37 ℃保温1 h,以4 mL蒸馏水调零。空白管用0.1 mL蒸馏水代替萝卜汁,1 mL蒸馏水代替0.01%H2O2,损伤管用0.1 mL蒸馏水代替萝卜汁,样品空白用1 mL蒸馏水代替0.01%H2O2。·OH清除率计算公式如下:
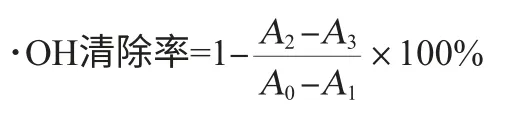
式中:A0为空白管的吸光度值;A1为损伤管的吸光度值;A2为样品空白管的吸光度值;A3为样品对照管的吸光度值。
1.3.5 不同稀释倍数的萝卜汁对H2O2的清除作用
测定方法参考文献[15],以不同浓度的维生素C为阳性对照,分别在25 mL具塞试管中加不同质量浓度的萝卜汁0.5 mL,加入40 mmol/L H2O22.5 mL,加入7 mL蒸馏水,室温反应10 min后在波长230 nm处测定吸光度值。空白组用0.5 mL蒸馏水代替紫色胡萝卜汁,样品空白用2.5 mL蒸馏水代替H2O2。H2O2清除率计算公式如下:
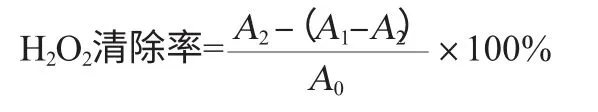
式中:A0为不加萝卜汁的吸光度值;A1为样品对照组的吸光度值,即加萝卜汁又加40mmol/LH2O2;A2为不加40mmol/L H2O2的吸光度值。
1.3.6 不同稀释倍数的萝卜汁对O2-·的清除作用
采用邻苯三酚自氧化法产生O2-·,以不同质量浓度的维生素C为阳性对照,添加不同稀释倍数的萝卜汁进行清除,测定方法参考文献[16],并略做修改。10 mL具塞试管中加入1.5 mL 0.05 mol/L pH 8.2 的Tris-HCl缓冲溶液,1.5 mL蒸馏水,摇匀,25 ℃水浴中保温20 min,取出后立即加入25 ℃预热3 mmol/L邻苯三酚0.3 mL,空白管用10 mmol/L的HCl代替邻苯三酚,迅速摇匀后倒入比色杯中,在波长325 nm处测定吸光度值,计算线性范围内每1 min吸光度值的增加值,即为邻苯三酚的自氧化速率ΔA对照。测定待测样品时加入邻苯三酚前先加入1.5 mL不同稀释倍数的萝卜汁,同时减少同体积的蒸馏水,其余操作同上,测出ΔA样品。超氧阴离子的清除率计算公式如下:
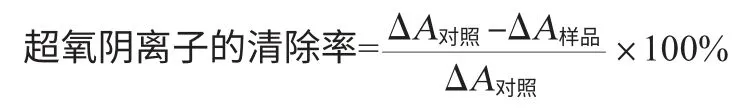
按上式计算出超氧阴离子的清除率。
2 结果与分析
2.1 紫色胡萝卜汁总酚和花青素含量的测定结果
2.1.1 紫色胡萝卜汁总酚含量的测定
根据1.3.2的方法,测定吸光度值,利用没食子酸标准曲线计算紫色胡萝卜总酚含量,结果见表1。紫色胡萝卜汁中,总酚含量为23.90 mg/mL。
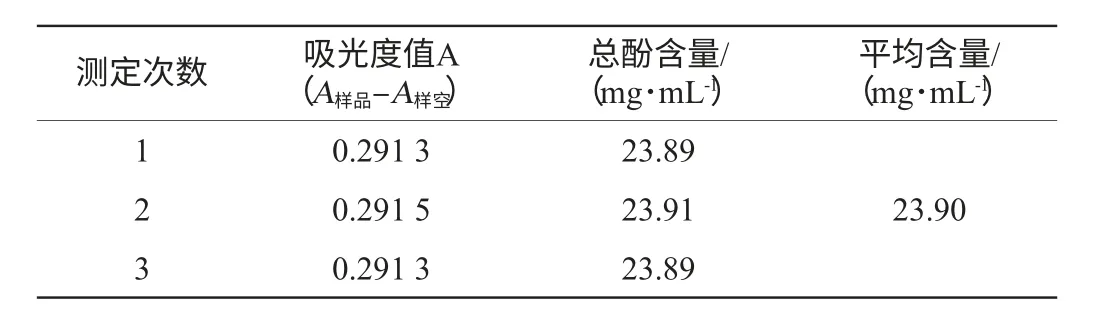
表1 紫色胡萝卜汁总酚含量测定Table 1 Determination of total phenolic contents of purple carrot juice
2.1.2 紫色胡萝卜汁花青素含量的测定
根据1.3.3的方法,测定了不同稀释倍数紫色胡萝卜汁中花青素的含量,结果见表2。紫色胡萝卜中花青素的含量为287.62 mg/L。

表2 紫色胡萝卜汁花青素含量测定Table 2 Determination of anthocyanin content of purple carrot juice
2.2 不同稀释倍数的萝卜汁对·OH的清除率
不同稀释倍数的萝卜汁对·OH的清除率见图1。由图1(A)可知,萝卜汁稀释后,还原能力逐渐降低。加入相同体积和相同稀释倍数的萝卜汁时,紫色胡萝卜汁表现出了较强的抗氧化活性,橙色胡萝卜汁次之,白萝卜汁最低。紫色胡萝卜原汁对·OH的清除率为97.75%,橙色胡萝卜原汁78.67%,白萝卜原汁仅为35.10%。稀释倍数为5倍时,紫色胡萝卜汁清除率可达50%以上,橙色萝卜汁和白萝卜汁均低于20%。
图1(B)为不同质量浓度的维生素C对羟自由基的清除率,在1 000~4 200 mg/L质量浓度范围内线性回归方程为:y=16.059x+0.132 5(R2=0.999 5)。从图1可看出,稀释5倍的紫色胡萝卜汁对·OH的清除率为50%,相当于质量浓度为3 100 mg/L的维生素C对·OH的清除率,IC50为3 100 mg/L。可见,紫色胡萝卜汁对·OH具有较强的清除能力。
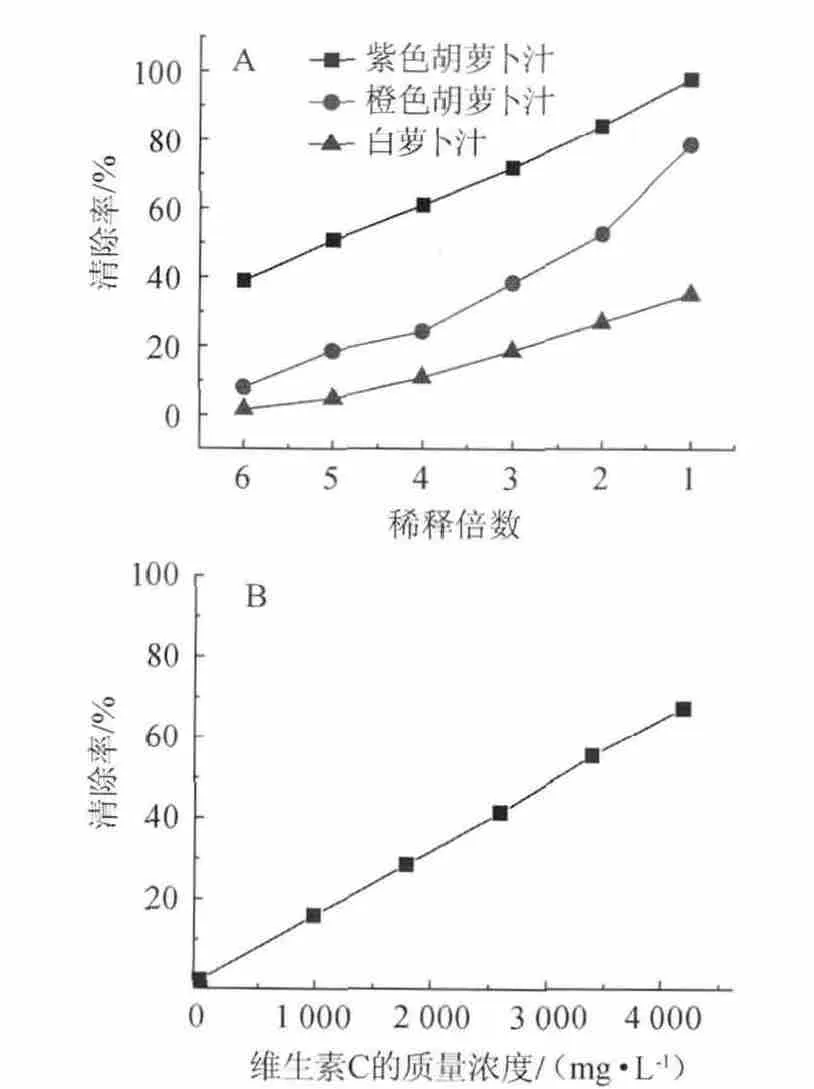
图1 0.1 mL不同稀释倍数萝卜汁(A)和不同质量浓度维生素C(B)对·OH的清除率Fig.1 The scavenging activity of 0.1 ml different dilution radish juice(A) and different concentrations of vitamin C (B) on·OH
2.3 不同稀释倍数的萝卜汁对H2O2的清除率
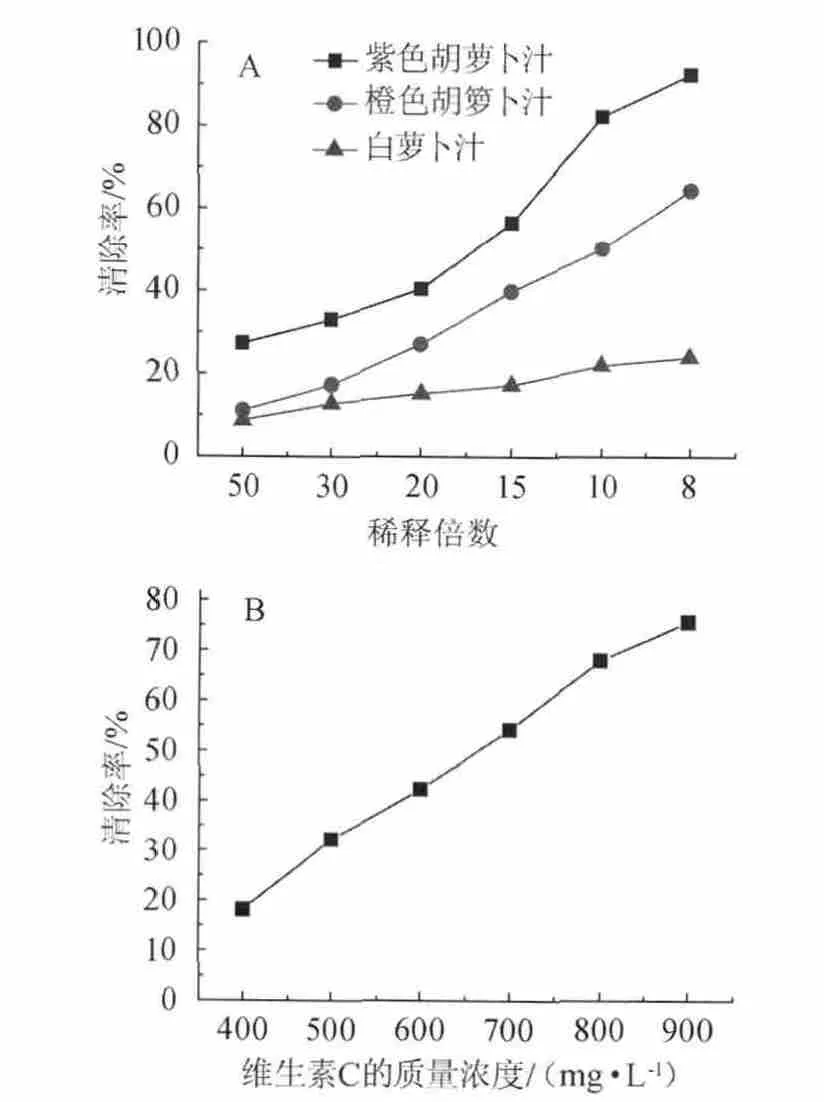
图2 0.5 mL不同稀释倍数萝卜汁(A)和不同质量浓度维生素C(B)对H2O2的清除率Fig.2 The scavenging activity of 0.5 ml different dilution radish juice(A) and different concentrations of vitamin C (B) on H2O2
不同稀释倍数的萝卜汁对H2O2清除率见图2。由图2(A)可知,稀释倍数越大,其对H2O2的清除率越低,随着萝卜汁浓度的增加,其对H2O2的清除率也逐渐增加。紫色胡萝卜汁对H2O2的清除率比橙色和白色萝卜汁的清除率都高,当稀释倍数为50倍时,紫色胡萝卜汁的清除率27.3%,橙色胡萝卜汁的清除率11.06%,白色胡萝卜汁清除率仅为8.06%,当稀释倍数为8倍时,紫色胡萝卜汁的清除率达92.7%,远高于橙色胡萝卜汁和白萝卜汁的清除率。
图2(B)为0.5 mL不同质量浓度的维生素C对H2O2的清除率,在400~900 mg/L质量浓度范围内其线性回归方程为:y=116.32x-27.225(R2=0.995 5),IC50为664 mg/L,当质量浓度为900 mg/L时,其清除率为75.1%。实验结果表明,稀释15倍的紫色胡萝卜汁对H2O2的清除率为56%,相当于700 mg/L的维生素C的清除率。
2.4 不同稀释倍数的紫色胡萝卜汁对超氧阴离子清除率
不同稀释倍数的紫色胡萝卜汁对超氧阴离子清除率见图3。由图3(A)可知,当加入紫色胡萝卜汁的量为1.5 mL时,稀释12倍的紫色胡萝卜汁对超氧阴离子清除率是96.3%。在稀释倍数为12~30的范围内,紫色胡萝卜汁随着稀释倍数的增加,其对O2-·的清除率逐渐减弱。橙色胡萝卜汁及白萝卜汁对超氧阴离子的清除率几乎为0。
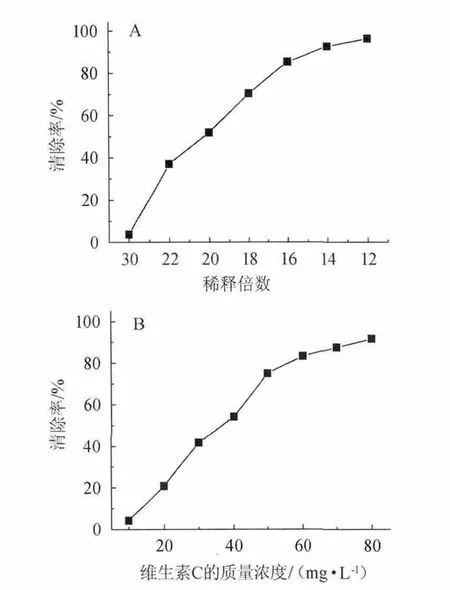
图3 1.5mL不同稀释倍数紫色胡萝卜汁(A)和不同质量浓度维生素C(B)对O2-·的清除率Fig.3 The scavenging activity of 1.5 ml different dilution radish juice(A) and different concentrations of vitamin C (B) on O2-·
图3(B)为不同质量浓度的维生素C对O2-·的清除率曲线,在20~80 mg/L质量浓度范围内线性回归方程为:y=1 770.0x-12.932(R2=0.999 6),IC50为35.6 mg/L。稀释20倍的紫色胡萝卜汁对O2-·的清除率相当于40 mg/L的维生素C对O2-·的清除率。
3 结论
研究了紫色胡萝卜汁体外对·OH、H2O2和O2-·的清除作用,并与橙色胡萝卜汁和白萝卜汁进行对比。结果表明,紫色、橙色胡萝卜汁及白萝卜汁都具有体外抗氧化活性,紫色胡萝卜汁表现出了较高的抗氧化活性。此外,紫色胡萝卜富含多糖等物质,值得进一步的深入研究和开发利用。
[1]RANDI S,GJERMUND V,ELISABETH O,et al.Influence of field attack by carrot psyllid(Trioza apicalisForster)on sensory quality,antioxidant capacity and content of terpenes,falcarindiol and 6-methoxymellein of carrots(Daucus carotaL.)[J].J Agr Food Chem,2005,53(16):2831-2838.
[2]ANNE C K,BEVERLY A C,STEVEN J B,et al.Plasma and urine responses are lower for acylated vs nonacylated anthocyanins from raw and cooked purple carrots[J].J Agr Food Chem,2005,53(16):6537-6542.
[3]KATSUBE N,IWASHITA K,TSUSHIDA T,et al.Induction of apoptosis in cancer cells by bilberry(Vaccinium myrtillus)and the anthocyanins[J].J Agr Food Chem,2003,51(16):68-75.
[4]GHISELLI A,NARDINI M,BALDI A,et al.Antioxidant activity of different phenolic fractions separated from an Italian red wine[J].J Agr Food Chem,1998,46(2):361-367.
[5]张 镜,刁树平.海南蒲桃果实原花青素的体外抗氧化活性[J].食品科学,2012,33(17):101-105.
[6]GELVAN D,SALTMAN P,POWELL S R.Cardiac reperfusion damage prevented by a nitroxide free radical[J].P Natl Acad Sci USA,1991,88(11):4680-4684.
[7]张启贵,魏梓芳,杨婷婷,等.不同品种甘薯汁抗氧化活性的研究[J].食品工业科技,2012,33(22):119-122.
[8]陈健初,夏其乐,潘向荣,等.杨梅果汁的抗氧化特性研究[J].浙江大学学报:农业与生命科学版,2004,30(6):657-661.
[9]谢晓凤,童莲花,童德胜,等.马齿苋总黄酮的提取及其浓缩汁抗氧化性研究[J].食品科技,2013,38(2):192-197.
[10]王长祥,毕海燕.萝卜对亚硝酸盐清除作用的研究[J].中国卫生检验杂志,2009,19(2):443-446.
[11]阚国仕,张瑞雪,陈红漫.胡萝卜多糖硫酸酯化修饰及其抗氧化活性研究[J].食品科技,2012,37(11):170-173.
[12]李东华,叶春苗.萝卜籽中活性成分提取及抑菌效果的研究[J].沈阳化工大学学报,2013,27(1):25-29.
[13]张春梅,陈朝银,赵声兰,等.核桃内种皮多酚提取工艺及体外抗氧化活性的初步研究[J].中国酿造,2014,33(7):130-134.
[14]唐 琳,李子江,赵 磊,等.两种pH 值法测定玫瑰花花色苷含量的比较[J].食品科学,2009,30(18):310-312.
[15]赵声兰,陈进伟,刘 芳,等.猪牙皂多糖提取工艺及体外抗氧化活性的研究[J].云南中医学院学报,2010,33(4):15-18.
[16]赵 鹏,任 鹏,张月萍.原花青素抗氧化活性测定方法比较[J].现代化工,2012,32(5):119-122.

