姜黄素3种单体的分离纯化
方 颖,谢 渝,卢皓瑶,连晓东,林伟民,刘 欣,高向阳*
(1.华南农业大学 公共基础课实验教学中心,广东 广州 510642;2.华南农业大学 食品学院,广东 广州 510642)
姜黄素类化合物是主要由姜科姜黄属植物姜黄(Cuicuma longaL.)的根茎分离出来的酚类化合物,其中最为常见的是姜黄素(curcuminⅠ,CurⅠ)、单脱甲氧基姜黄素(demethoxycurcumin Ⅱ,Cur Ⅱ)和双脱甲氧基姜黄素(bisdemethoxycurcumin Ⅲ,Cur Ⅲ)[1]。据测定,姜黄根茎中姜黄素类化合物的含量约为1%~5%。姜黄色素的三种单体的含量比例分别为77%、18%和5%[2]。现代研究表明,姜黄素作为一种有潜力的制药配剂,具有多方面的生物与医药作用,如抗氧化、抗炎、抗突变、抗人类免疫缺陷病毒(human immunodeficiency virus,HIV)和降低血糖和低密度脂蛋白,并且有助于抑制肿瘤的形成和癌症发生,阻止肿瘤的发展[3-5]。另一方面,姜黄色素的三种单体姜黄素,脱甲氧基姜黄素和二脱甲氧基姜黄素具有不同的生物活性,在高效薄层色谱分离基础上进行的清除1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl radical,DPPH)自由基抗氧化试验,三者抗氧化活性的顺序依次是姜黄素>脱甲氧基姜黄素>二脱甲氧基姜黄素[6]。最近研究证明,在基础癌症的化疗治疗过程中,发现姜黄素、脱甲氧基姜黄素和二脱甲氧基姜黄素能抑制对多种药物呈耐药性的相关蛋白和P-糖蛋白,并表现出理想的功效[7-8]。
目前市售的姜黄色素通常为姜黄素、脱甲氧基姜黄素及双脱甲氧基姜黄素等多种物质的混合物,分离纯化得到姜黄色素单体,对进一步阐释其作用机理,推进姜黄素的实际应用具有重要意义。本实验利用硅胶柱层析对中药材姜黄饮片进行分离纯化研究得到了3种姜黄素单体(姜黄素、脱甲氧基姜黄素和双脱甲氧基姜黄素),并应用高效液相色谱(high performance liquid chromatography,HPLC)法对3种姜黄素单体进行了定性分离分析,获取高纯度的单体成分,为今后应用于姜黄素的药理性质研究打下基础。
1 材料与方法
1.1 材料与试剂
姜黄饮片:广州市内某药店;姜黄素对照品(纯度≥98%):成硕化学与玻璃仪器销售公司;硅胶(100~200目):青岛胜海精细硅胶化工有限公司;DM301大孔树脂:安徽三星树脂科技有限公司;硅胶层析板(25 mm×75 mm):青岛海洋化工厂分厂;DiamonsilC18色谱柱(250 mm×4.6 mm,5 μm);其余试剂均为国产分析纯。
1.2 仪器与设备
101-2-8电热恒温鼓风干燥箱:上海跃进医疗器械厂;24 cm玻璃干燥器(含变色硅胶):重庆益容玻璃制品有限公司;114型摇摆式高速中药粉碎机:浙江瑞安市永历制药有限公司;SB-5200DTD超声清洗机:宁波新芝生物科技股份有限公司;78-1磁力加热搅拌器:金坛市富华仪器有限公司;HWS24型电热恒温水浴锅:上海一恒科技有限公司;752紫外光栅分光光度计:上海精密科学仪器有限公司;R205L星海旋转蒸发仪:无锡星海王生化设备有限公司。
1.3 方法
1.3.1 乙醇超声波法制备姜黄色素粗提取物
将姜黄药材粉碎后用丙酮脱油,称取适量,加入适量体积分数为70%的乙醇浸泡过夜,保鲜膜封住瓶口,以防乙醇挥发;室温条件下,超声提取2次,超声功率为90%,超声频率为40 kHz,每次提取30 min,合并提取液,测定粗提液中姜黄素的浓度。
1.3.2 姜黄色素含量测定方法
姜黄素标准溶液在200~600 nm波长范围内扫描,得到姜黄色素最大吸收峰在波长422 nm处。精密称取40 ℃干燥12 h的姜黄素对照品9 mg左右,以体积分数为95%的乙醇溶解后,配制成1.44 μg/mL、3.60 μg/mL、5.76 μg/mL、7.20 μg/mL、9.00 μg/mL、14.40 μg/mL和18.00 μg/mL的标准溶液。以空白作参比,在波长422 nm处测定各管吸光度值,以质量浓度C(x)对吸光度值(y)进行回归,标准曲线的回归方程为y=0.160 9x-0.005 6,相关系数R2=0.997 3。
1.3.3 大孔树脂的动态吸附
姜黄素粗提液经过旋转蒸发仪浓缩后用DM301大孔树脂进一步纯化。大孔树脂的纯化工艺如下:最佳上样液质量浓度309.5 μg/mL,以2 BV/h的流速进行动态吸附,用体积分数为75%的乙醇以2 BV/h的流速进行解吸附,上样后待提取液均进入树脂柱,静置30 min。先用蒸馏水洗至流出液无色,再用体积分数为75%的乙醇洗脱,分段收集洗脱液,在波长422 nm处测定每管洗脱液的吸光度值,根据标准曲线计算其中姜黄素的含量,以姜黄素质量浓度为纵坐标,管号为横坐标,绘制姜黄素大孔树脂洗脱曲线。合并高峰浓度的洗脱液,旋转蒸发仪浓缩回收乙醇,用硅胶薄层层析法监测纯化的结果。洗脱液浓缩干燥后得纯化后总姜黄素样品,备用。
1.3.4 硅胶柱层析分离姜黄素单体
参考秦晓燕等[9-10]的方法做进一步改良,取经过大孔树脂纯化后的总姜黄素提取物进行硅胶柱层析。硅胶柱柱径为2 cm,硅胶柱高约17 cm,采用干法上样法,姜黄素样品10 mg加少量甲醇溶解,再加硅胶拌样(姜黄素与硅胶的比例约为1∶2),待甲醇挥干后,研磨使之成松散均匀的吸附有姜黄素的硅胶粉末,打开硅胶柱下口,使展开剂刚好覆盖于硅胶柱表面,将姜黄素的硅胶粉末轻轻撒在硅胶层上面,可再撒上少量硅胶以稳定粉末;先用氯仿为洗脱液洗脱,然后以氯仿-甲醇(99∶1,V/V)混合液为洗脱剂洗脱,从有亮黄色溶液流出时,开始收集流出的溶液。每10 mL为一管,分3个梯度进行洗脱。第一个梯度氯仿-甲醇(99∶1,V/V)洗脱时,可看到硅胶柱顶端有明显的色素带被洗下,洗至无明显黄色液体流出时,更换第二个梯度氯仿-甲醇(95∶5,V/V),此时硅胶柱顶端出现另一个颜色稍浅的色素带,将该色素带洗脱完全后,更换第三个梯度氯仿-甲醇(80∶20,V/V)。收集洗脱液,各管洗脱液在波长422 nm处测定吸光度值,以姜黄素吸光度值A422nm为纵坐标,管号为横坐标,绘制洗脱曲线,根据标准曲线计算三种姜黄素单体的含量。根据淋洗曲线,将峰值部分的洗脱液合并,参考ZHANG J S等[11]的方法,利用薄层层析法检验其组分。
1.3.5 样品中姜黄素的相关计算
采用硼酸比色法,测定总姜黄素类粗提液在波长515 nm处的吸光度值,计算乙醇超声波提取姜黄素的得率以及大孔树脂吸附纯化后姜黄素的得率,计算公式如下:

式中:A1为乙醇超声波提取姜黄素的得率,%;V0为两次过滤合并得到粗提液的总体积,mL;C1为粗提液稀释500倍后含有姜黄素的总质量浓度,μg/mL;m为脱油姜黄粉末的质量,g。

式中:A2为大孔树脂吸附纯化后姜黄素的得率,%;m0为两次过滤合并得到粗提液中姜黄素的总含量,mg;V3为洗脱液总体积,mL;C3为洗脱液所含姜黄素的总质量浓度,μg/mL。
1.3.6 姜黄色素三种单体的HPLC分析
方法[12-13]改良色谱条件:色谱柱为Diamonsil[C18(250 mm×4.6 mm,5 μm);流动相为乙腈∶0.4%冰醋酸(48∶52,V/V);流速为1.0 mL/min;检测波长为254 nm;进样量为15 μL;检测温度为30 ℃。
取1 mg/mL姜黄素标准品溶液(姜黄素标准品1 mg,用甲醇溶解并定容于5 mL容量瓶),经0.45 μm微孔滤膜过滤后作为供试品溶液,精密称取10 μL、12 μL、14 μL、15 μL、16 μL、18 μL、20 μL,相当于姜黄素含量10 μg、12 μg、14 μg、15 μg、16 μg、18 μg、20 μg,在选定的HPLC条件下进样分析,以峰面积(y)为纵坐标,姜黄素含量(x)为横坐标进行线性回归分析,确定硅胶柱层析洗脱液的进样量。在选定的HPLC条件下对洗脱液进行测定。
2 结果与分析
2.1 姜黄色素提取物的大孔树脂纯化分析

图1 姜黄素的DM301大孔树脂洗脱曲线Fig.1 Elution curve of curcuminoids purified by macroreticular resins DM301 adsorption
由图1可知,洗脱液中姜黄素质量浓度从第4管开始迅速增大,到第9管达到峰值,随后质量浓度下降也较快,洗脱峰高且窄,拖尾现象不太严重。到第80管之后洗脱液黄颜色很浅,认为姜黄素质量浓度变化不大,含量极少。合并所有洗脱液,测定总体积及姜黄素总质量浓度,计算姜黄素粗提液得率为58.09%,有关文献用类似的纯化工艺得到46.31%的[14],表明经改良用体积分数为75%的乙醇要比用体积分数为70%的乙醇洗脱效果好。
以氯仿-甲醇-甲酸(96∶4∶0.7)为展开剂对大孔树脂吸附后的姜黄素进行薄层层析分析。合并吸光度值较高的几管姜黄素洗脱液,浓缩后进行薄层点板,展开剂上行展开5.2 cm。由图2可见,浓缩后的姜黄素洗脱液经薄层分离后,在自然光下呈现三个黄色斑点,与姜黄素标准品对照一致,说明洗脱液与标准品成分一致,初步判断为姜黄素三种单体,双脱甲氧基姜黄素、单脱甲氧基姜黄素、姜黄素的Rf值分别为0.46、0.65、0.88,两两之间相差大约0.2,与秦晓燕等[9]研究结果相吻合,说明经过大孔树脂的动态吸附,得到纯化后的总姜黄素,并且分离效果好。

图2 姜黄素标准品与大孔树脂吸附洗脱液的薄层层析结果Fig.2 Thin layer chromatography results of curcumin standard and eluent prepared by macroreticular resins adsorption
2.2 三种姜黄素单体硅胶柱层析结果分析
姜黄素浓缩液经过不同梯度氯仿-甲醇洗脱液硅胶柱层析后,分离洗脱曲线见图3。

图3 姜黄素的硅胶柱层析分离洗脱曲线Fig.3 Elution curve of curcuminiods separated by silica gel column chromatography
由图3可知,硅胶柱层析洗脱曲线直观显现出洗脱过程中各组分流出的先后顺序,更换洗脱液梯度,即改变洗脱液的极性,可得到3个色素带,故在洗脱曲线上主要呈现3个峰。
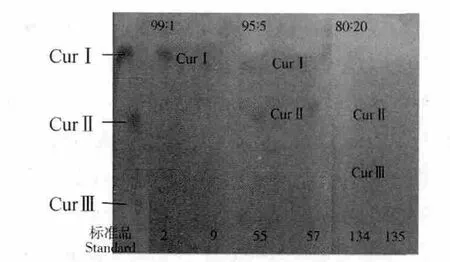
图4 各梯度峰值处洗脱液的薄层层析结果Fig.4 Thin layer chromatography results of eluent after gradient elution at each peak
将峰值附近的洗脱液合并、浓缩,浓缩峰值附近的洗脱液在薄层层析点板,以(氯仿∶甲醇∶甲酸=96∶4∶0.7,V/V)的混合液为展开剂展开,合并具有相同Rf 值的洗脱液组组分,结果如图4所示,表明在不同极性的梯度层析后,姜黄素、单脱甲氧基姜黄素、双脱甲氧基姜黄素三个姜黄素单体均得到较好的分离。
将三种成分各自的合并液旋转蒸发、冷却,得到各单体的晶体,称量姜黄素单体、单脱甲氧基姜黄素单体、双脱甲氧基姜黄素单体的质量分别为6.42 mg、1.94 mg和1.57 mg。三种单体的质量百分比分别为64.2%、19.4%和15.7%(进行硅胶柱层析的姜黄素总质量为10 mg)。
2.3 姜黄色素的高效液相色谱分析
2.3.1 姜黄素标准品的高效液相色谱分析
在选定的HPLC条件下,将1 mg/mL姜黄素标准品溶液进样10~20 μL,选择适宜进样量。以1 mg/mL姜黄素溶液(即总姜黄素含量为15 μg)进样15 μL为例,HPLC检测图谱见图5。

图5 姜黄素标准品的高效液相色谱图Fig.5 HPLC chromatogram of curcumin standard
由图5可知,通过色谱柱姜黄素3个单体的出峰时间在12.500~17.500 min间,其中双脱甲氧基姜黄素Cur Ⅲ出锋时间为12.913 min,单脱甲氧基姜黄素Cur Ⅱ出峰时间为14.501 min,姜黄素Cur Ⅰ出峰时间为16.264 min。研究结论与程匀等[15]研究结果吻合。
将对应的姜黄素单体以峰面积(y)为纵坐标,总姜黄素含量(x)为横坐标绘制单体的高效液相测定标准曲线,进行线性回归分析,结果如图6所示。

图6 姜黄素三种单体峰面积的高效液相标准曲线Fig.6 HPLC standard curve of peak area of three monomers
如图6所示,姜黄素峰面积的线性回归方程为y=1.00×106x+2.00×106,R2=0.996 7;单脱甲氧基姜黄素峰面积的线性回归方程为y=3.03×105x+3.53×105,R2=0.993 7;双脱甲氧基姜黄素峰面积的线性回归方程为y=5.70×104x-6.95×104,R2=0.994 9。总姜黄素在含量10~18 μg范围内三种单体各自的峰面积具有良好的线性关系,相关系数均>0.993。
2.3.2 姜黄素三种单体的高效液相色谱分析
在选定的HPLC条件下,对姜黄素样品分离得到的三种单体进行HPLC分析,结果见图7。

图7 硅胶层析柱氯仿-甲醇(99∶1)(A)、(95∶5) (B)及(80∶20) (C)洗脱液的高效液相色谱图Fig.7 HPLC chromatogram of chloroform-methanol (99∶1) (A),(95∶5) (B) and (80∶20) (C) eluent separated by silica gel column chromatography
由图7与图5可看出,纯化所得的三个单体CurⅠ、CurⅡ、Cur Ⅲ与标准对照品中的保留时间相吻合。而硅胶柱层析中第一个梯度氯仿-甲醇(99∶1)洗脱下来的组分出峰时间也在16.198 min,说明氯仿∶甲醇体积比为99∶1时恰好能洗脱下总姜黄素中的CurⅠ。第二个梯度氯仿-甲醇(95∶5)洗脱下来的组分有两个小峰,其出峰时间分别为14.543 min、16.316 min,故判断该组分中含有CurⅠ和Cur Ⅱ;第三个梯度80∶20洗脱下来的组分有两个小峰,其出峰时间分别为12.913 min、14.516 min,故判断该组分中含有CurⅡ和Cur Ⅲ。
3 结论
采取了以乙醇超声波法浸提姜黄饮片提取姜黄素,超声提取2次,每次提取时间为30 min,超声功率为90%,超声频率为40 kHz,得到姜黄素浓缩液,随后以DM301大孔树脂吸附纯化姜黄素的技术稳定可行,姜黄素转移率为58.09%。利用硅胶层析柱进一步分离姜黄素3种单体成分,姜黄素、脱甲氧基姜黄素及双脱甲氧基姜黄素质量百分比分别为64.2%、19.4%和15.7%,得率较高;薄层层析检测结果显示经柱层析分离的各单体斑点明显、均一,纯度较高,说明硅胶柱层析达到了理想的分离效果。通过高效液相色谱检测结果显示本实验所采用的不同极性的梯度硅胶柱层析法可对3种单体进行充分分离,对于姜黄中药饮片中姜黄素成分的分离纯化是一种可行有效的参考方法。
参考文献:
[1]JAYAPRAKASHA G K,RAO L J M,SAKARIAH K K,et al.Improved HPLC method for the determination of curcumin,demethoxycurcumin,and bisdemethoxycurcumin[J].J Agr Food Chem,2002,50(13):3668-3672.
[2]CHATTOPADHYAY I,BISWAS K,BANDYOPADHYAY U,et al.Turmeric and curcumin:Biological actions and medicinal applications[J].Curr Sci,2004,87(1):44-53.
[3]HIMESH S,SHARAN P S,MISHRA K,et al.Qualitative and quantitative profile of curcumin from ethanolic extract ofCurcuma longa[J].Int Res J Pharm,2011,2(4):180-184.
[4]DUVOIX A,BLASIUS R,DELHALLE S,et al.Chemopreventive and therapeutic effects of curcumin[J].Cancer Lette,2005,223(2):181-190.
[5]MAHESHWARI R K,SINGH A K,GADDIPATI J,et al.Multiple biological activities of curcumin:a short review[J].Life Sci,2006,78(18):2081-2087.
[6]POZHARITSKAYA O N,IVANOVA S A,SHIKOV A N,et al.Separation and free radical-scavenging activity of major curcuminoids ofCurcuma longausing HPTLC-DPPH method[J].Phytochem Anal,2008,19(3):236-243.
[7]CHEARWAE W,WU C P,CHU H Y,et al.Curcuminoids purified from turmeric powder modulate the function of human multidrug resistance protein 1(ABCC1)[J].Cancer Chemoth Pharm,2006,57(3):376-388.
[8]CHEARWAE W,ANUCHAPREEDA S,NANDIGAMA K,et al.Biochemical mechanism of modulation of human P-glycoprotein (ABCB1)by curcumin Ⅰ,Ⅱ,and Ⅲpurified from turmeric powder[J].Biochem Pharmacol,2004,68(10):2043-2052.
[9]秦晓燕,龚菊梅,陈卫东.总姜黄素3 种单体高纯度同时分离方法[J].安徽中医学院学报,2012,31(2):73-77.
[10]PERAT-ALMEID L,CHERUBINO A P F,ALVES R J,et al.Separation and determination of the physico-chemical characteristics of curcumin,demethoxycurcumin and bisdemethoxycurcumin[J].Food Res Int,2005,38(8-9):1039-1044.
[11]ZHANG J S,GUAN J,YANG F Q,et al.Qualitative and quantitative analysis of four species ofCurcumarhizomes using twice development thin layer chromatography[J].J Pharmaceut Biomed,2008,48 (3):1024-1028.
[12]ZHAN P Y,ZENG X H,ZHANG H M,et al.High-efficient column chromatographic extraction of curcumin fromCurcuma longa[J].Food Chem,2011,129(2):700-703.
[13]INOUE K,NOMURA C,ITO S,et al.Purification of curcumin,demethoxycurcumin,and bisdemethoxycurcumin by high-speed countercurrent chromatography[J].J Agr Food Chem,2008,56(20):9328-9336.
[14]程光明.姜黄素的提取纯化、脂质体的制备和组织分布的研究[D].武汉:湖北中医学院硕士论文,2008.
[15]程 匀,袁丽苹.高效相色谱法同时测定协日嘎四味汤胶囊中姜黄素、脱甲氧基姜黄素、二脱甲氧基姜黄素的含量[J].中南药学,2011,9(5):335-338.

