藤椒油的抑菌活性及其稳定性研究
周 婷,蒲 彪,姜欢笑,刘春燕
(四川农业大学 食品学院,四川雅安 625014)
藤椒油的抑菌活性及其稳定性研究
周 婷,蒲 彪*,姜欢笑,刘春燕
(四川农业大学 食品学院,四川雅安 625014)
为了解冷榨藤椒油和溶剂萃取的藤椒油的抑菌活性和抑菌稳定性,通过滤纸片法和试管二倍稀释法测定了藤椒油对3种常见细菌及3种酵母菌的最低抑菌浓度和最低杀菌浓度,采用生长速率法测定对2种霉菌的抑制作用,并以枯草芽孢杆菌和胶红酵母为指示菌,探讨了介质pH、热处理及紫外照射对两种藤椒油的抑菌稳定性的影响。结果表明,藤椒油对8种受试菌均有抑制效果,其中溶剂浸出油的抑菌效果强于冷榨油的。
藤椒油,抑菌活性,稳定性
藤椒(ZanthoxylumarmatumDC Prodr.)是芸香科花椒属下的花椒亚属,是我国花椒品种中的一个优良品种,具有独特的麻香风味。它不仅是著名的油料、香料,也是一种中药材。鲜藤椒果实萃绿色,布满凸点,含油丰富,但是不耐贮藏,因此常制成藤椒油。近年来,四川洪雅藤椒油作为调味料已形成独特的“藤椒菜品”系列[1-3]。
花椒属植物主要活性成分为挥发油、生物碱类化合物、酰胺类化合物、生物碱和黄酮类物质等。花椒作为一种传统中药,具有治疗呕吐、腹泻,镇痛,抗肿瘤等功效,在抑菌杀虫、抗炎等方面也具有较强的药理活性[4-5]。本实验对冷榨藤椒油和溶剂浸出油的抑菌作用和抑菌稳定性进行了初步研究,以期为今后藤椒油应用于天然防腐工业提供科学参考依据。
1 材料与方法
1.1 材料与仪器
冷榨藤椒油(2013年7月21号生产)和鲜藤椒(2013年7月21号于四川省洪雅县采集),由四川洪雅县幺麻子食品有限公司提供;用冷榨技术生产的藤椒油称冷榨油,用溶剂萃取的藤椒油称溶剂浸出油。
金黄色葡萄球菌(Staphylococcusaureus)、大肠杆菌(Escherichiacoli)、枯草芽孢杆菌(Bacillussubtilis)、胶红酵母(Rhodotorulamucilaginosa)、毕赤酵母(Pichiagaleiformis)、清酒假丝酵母(Candidasake)四川农业大学食品学院微生物实验室提供。黑曲霉(Aspergillusniger)、黄曲霉(Aspergillusflavus)购自广东省微生物菌种保藏中心。
牛肉膏蛋白胨培养基(用于细菌培养)、YEPD培养基(用于酵母菌培养)、察氏培养基(用于霉菌培养)。
SW-CJ-IF单人双面超净工作台 苏净安泰空气技术有限公司;YXO.SG41.280高压蒸汽灭菌锅 上海华线医用核子仪器有限公司;500WHHS-2S电子恒温不锈钢水浴锅 上海光地仪器设备有限公司;PYX-DHS-60×75电热恒温培养箱 上海浦东荣丰科学仪器有限公司;DHG-9245A型电热恒温鼓风干燥箱。
1.2 实验方法
1.2.1 溶剂浸出油的提取 以无水乙醚为提取溶剂,采用回流提取法[6]。
1.2.2 藤椒油对细菌、酵母菌的抑菌实验
1.2.2.1 菌种活化和菌悬液制备 将实验所用菌种接种在新鲜的斜面培养基上进行活化,活化两次,细菌37℃下培养24h,酵母菌28℃下培养48h。活化后的菌种用接种环挑取少量菌落至无菌生理盐水中,采用平板计数法,将菌悬液浓度调至106~107cfu/mL[7],备用。
1.2.2.2 藤椒油溶液的制备 以丙酮做溶剂,分别制备100mg/mL冷榨油溶液和100mg/mL溶剂浸出油溶液,并用0.22μm微孔过滤器过滤,备用。
1.2.2.3 抑菌圈测定 采用滤纸片法,取无菌培养皿,迅速倒入灭菌后冷却至45℃左右的培养基15~20mL,冷却凝固后倒置备用。从菌悬液中各取100μL加入到已经冷却好的培养基上,用灭菌涂布棒将其涂布均匀。将灭菌滤纸片(d=6mm)贴于牛肉膏、YEPD培养基上,用移液枪各取20μL 藤椒油溶液吸附于滤纸片上。平板放入冰箱冷藏30min,细菌37℃下培养24h,酵母菌28℃下培养48h,观察各个培养皿中菌的生长情况,用十字交叉法测量抑菌圈的直径(包括滤纸片直径),每菌重复三次,取平均值。以丙酮为对照(CK),每个平板用笔把平板以圆心为中心划出5个均匀的扇形,放置5片滤纸[8]。
1.2.2.4 藤椒油最低抑菌浓度(MIC)的测定 采用试管二倍稀释法,各取10支灭菌试管,取1mL相应液体培养基于每支试管中,分别取1mL藤椒油溶液(100mg/mL)于每组的第1支试管内,混匀,从每组第1管吸取1mL混匀到每组第2管中,依次类推直到第9管,再从第9管吸取1mL混匀液去掉,第10支试管为不含藤椒油溶液的对照组。依次配成藤椒油质量浓度为50、25、12.5、6.25、3.125、1.5625、0.78125、0.39063、0.19531、0mg/mL培养基试管,各加入菌悬液100μL,另取9支试管,稀释步骤按上述进行,此组不加菌液作为藤椒油溶液对照组。试管置于恒温振荡培养箱中培养,细菌37℃下培养24h,酵母菌28℃下培养48h,根据试管内液体的浑浊度判定藤椒油的MIC值(液体澄清,表示无菌生长)[9-10]。
1.2.2.5 藤椒油最低杀菌浓度(MBC)的测定 将1.2.2.4中测出的MIC及以上浓度的培养基表面用无菌生理盐水冲洗,接种到相应的素琼脂培养基上,用灭菌涂布棒涂布均匀,细菌37℃下培养24h,酵母菌28℃下培养48h,观察并记录实验结果,无菌生长的最低浓度即为该物质的最低杀菌浓度。重复上述过程3次,取平均值。
1.2.3 藤椒油对霉菌的抑菌实验
1.2.3.1 菌种活化及菌饼制备 首次活化将黑曲霉、黄曲霉在试管斜面培养基上培养7~10d,二次活化培养7d,用无菌水洗下孢子,得到孢子悬浮液。将孢子悬浮液均匀涂布在察氏培养基上,28℃培养,待菌丝长满培养皿时,4℃冷藏,备用。用时打孔即可。
1.2.3.2 藤椒油对霉菌菌丝生长的抑制率 采用菌丝生长速率法,各取100mg/mL的藤椒油溶液依次稀释成50,25,12.5,6.25,3.125mg/mL的母液。在无菌条件下,按一定比例29∶1(培养基∶样品溶液)与温度在45℃左右的察氏培养基混匀,制成带毒培养基。以丙酮代替样品溶液作为对照。冷却后,用打孔器(5mm)打取菌饼,取菌落边缘生长旺盛的菌丝,然后用接种针挑取菌饼置于带毒培养基中央,菌丝面朝下,于28℃下培养,72h后采用十字交叉法测量菌落直径(含菌饼直径)[11-12],实验重复3次,用下式计算菌丝生长的抑制率:
抑制率(%)=(对照菌落直径-处理菌落直径)/(对照菌落直径-菌饼直径)]×100
1.2.3.3 藤椒油对霉菌的半抑制浓度(IC50) 将抑制百分率换算成抑制几率值,以藤椒油浓度对数为横坐标,抑制几率值为纵坐标,采用Origin Pro 8.6求出毒力回归方程式和霉菌菌丝生长的半抑制浓度(IC50)。
1.2.4 藤椒油抑菌稳定性研究 以枯草芽孢杆菌和胶红酵母为指示菌[13-15]。
1.2.4.1 介质pH对藤椒油抑菌活性的影响 分别用0.1mol/L HCl和0.1mol/L NaOH溶液调节液体培养基的pH,制成pH分别为3.0、5.0、7.0、9.0、11.0的培养液,以未调pH的培养液作为对照。采用试管二倍稀释法测定MIC。
1.2.4.2 热处理对藤椒油抑菌活性的影响 分别将100mg/mL的藤椒油溶液置于60、80、100℃水浴及121℃湿热条件下处理30min,以未加热处理的样品作为对照。采用试管二倍稀释法测定MIC。
1.2.4.3 紫外照射对藤椒油抑菌活性的影响 分别将100mg/mL的藤椒油溶液在紫外灯(254nm)下照射10、20、30、60min,以未经紫外照射的样品为对照。采用试管二倍稀释法测定MIC。
2 结果与讨论
2.1 藤椒油对细菌、酵母菌的抑菌效果
2.1.1 藤椒油抑菌活性的测定 抑菌活性差异显著性分析如表1所示。
从表1可以看出,冷榨油和溶剂浸出油在相同质量浓度(100mg/mL)下,对枯草芽孢杆菌和胶红酵母有明显的抑制作用,对其他四种供试菌也有抑制作用,但是其抑制作用相对较弱一些;对比两种提取工艺藤椒油的抑菌效果,可以看出两种藤椒油除对清酒假丝酵母抑菌效果差异没有显著性外,对其他5种供试菌的抑菌效果差异显著,且溶剂浸出油抑菌效果强于冷榨油。
2.1.2 藤椒油MIC测定结果 表2的MIC进一步证实了两种藤椒油对不同供试菌具有不同的抑菌效果,且溶剂浸出油对6种供试菌的抑制效果明显强于冷榨油。溶剂浸出油对枯草芽孢杆菌的抑制效果最好,MIC为0.78125mg/mL,其次为胶红酵母、金黄色葡萄球菌和大肠杆菌,MIC为1.5625mg/mL,对毕赤酵母和清酒假丝酵母抑制效果最弱,MIC为3.125mg/mL;冷榨油对枯草芽孢杆菌和胶红酵母抑制效果最好,MIC为6.25mg/mL,对其他四种供试菌的MIC达到12.5mg/mL。
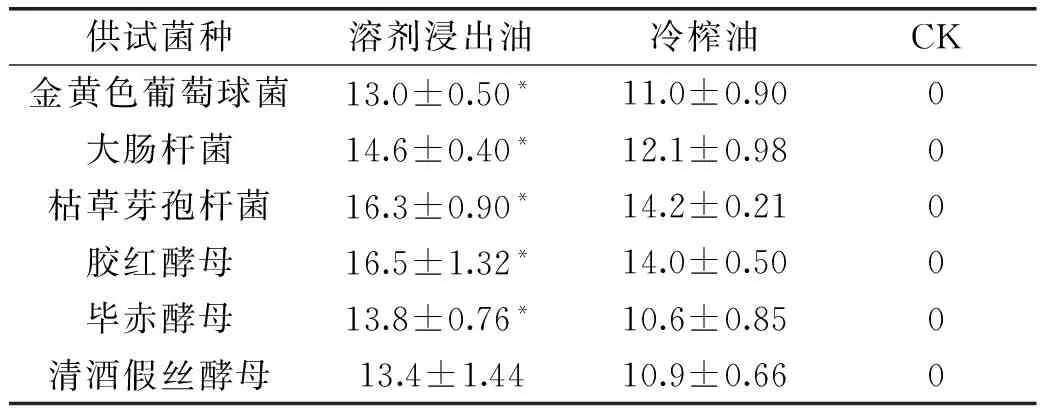
表1 藤椒油抑菌效果测定结果(抑菌圈直径单位:mm)Table 1 The results of antibacterial activity ofZanthoxylum armatum DC Prodr. Oil (diameter of inhibition zone:mm)
注:同行星号*表示两种油的抑菌效果差异显著(p<0.05)。
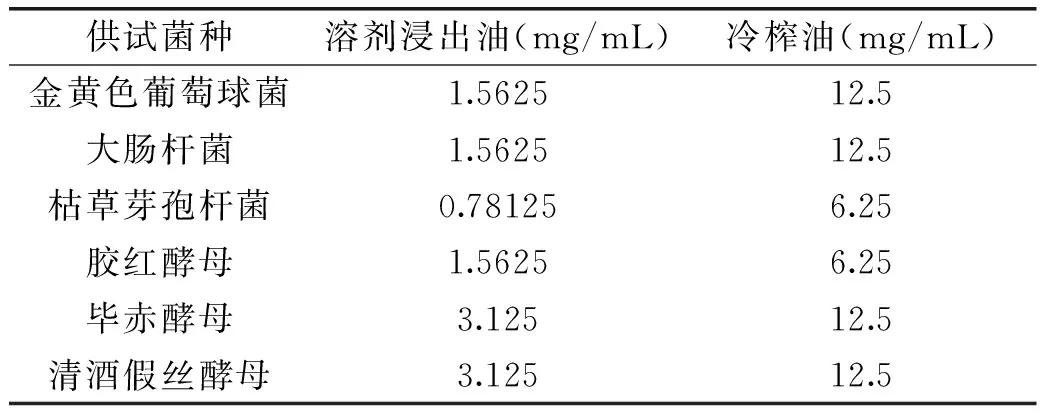
表2 藤椒油对不同供试菌的MIC比较Table 2 MICs of Zanthoxylum armatum DC Prodr. Oil against bacteria and yeasts
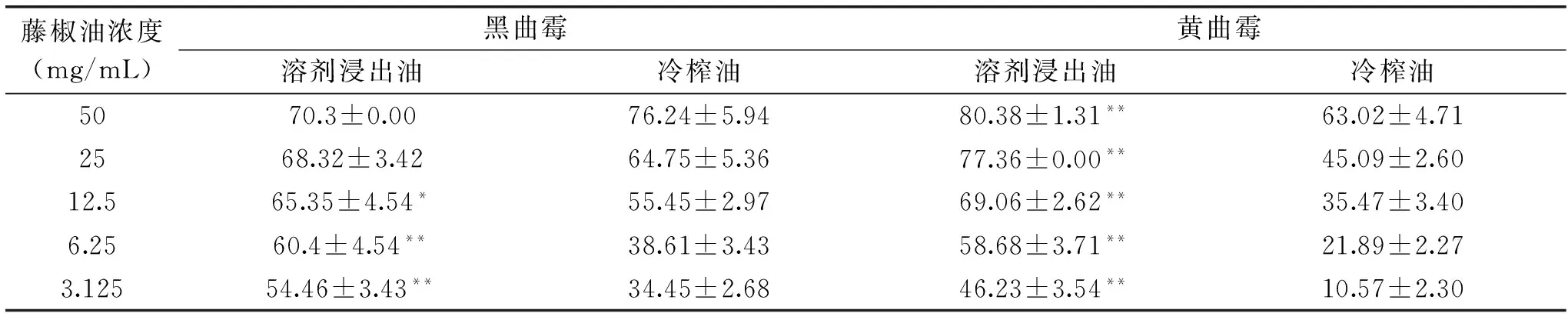
表4 藤椒油对霉菌的抑制率(%)Table 4 The inhibitoty rates of Zanthoxylum armatum DC Prodr. Oil(%)
注:同行星号*表示差异显著(p<0.05),**表示差异极显著(p<0.01)。

表5 藤椒油对霉菌的半抑制浓度(IC50)Table 5 IC50values of Zanthoxylum armatum DC Prodr. Oil on mould(IC50)
2.1.3 藤椒油MBC测定结果 从表3 MBC值可知,溶剂浸出油对枯草芽孢杆菌和胶红酵母杀菌效果最好,MBC为3.125mg/mL,其次为毕赤酵母和清酒假丝酵母,MBC为6.25mg/mL,对金黄色葡萄球菌和大肠杆菌杀菌效果最弱,MBC为12.5mg/mL。而冷榨油对大肠杆菌、枯草芽孢杆菌两种细菌和酵母菌杀菌的作用效果相差不大,MBC为12.5mg/mL,对金黄色葡萄球菌的杀菌效果最弱,MBC达到25mg/mL。
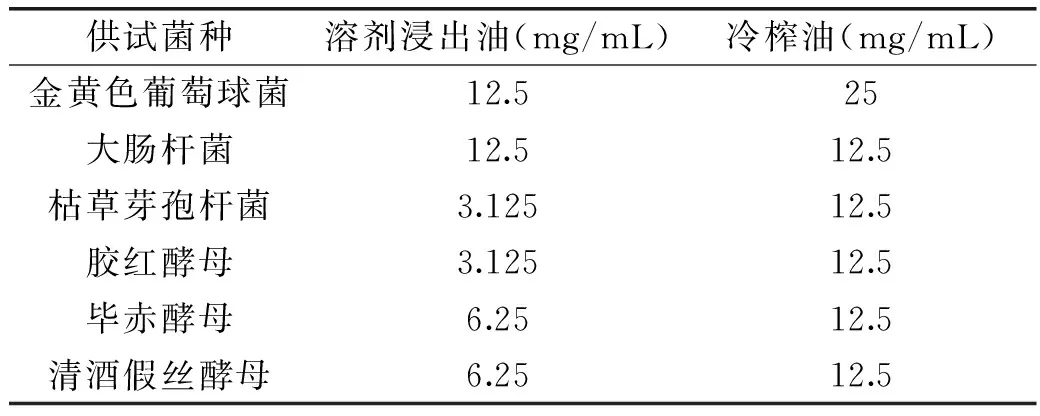
表3 藤椒油对不同供试菌的MBC比较Table 3 MBCs of Zanthoxylum armatumDC Prodr. Oil against bacteria and yeasts
2.2 藤椒油对霉菌的抑菌效果
2.2.1 藤椒油对霉菌抑制作用 由表4可见,两种藤椒油对黑曲霉和黄曲霉具有不同的生物活性,相同质量浓度下,溶剂浸出油对黑曲霉和黄曲霉的抑制作用强于冷榨油,且其抑制作用随质量浓度的增大而增强,其中在12.5~50mg/mL范围内,溶剂浸出油对黄曲霉的抑制作用比对黑曲霉强,在实验浓度范围内,冷榨油对黑曲霉的抑制率却远高于对黄曲霉的。在浓度为50mg/mL时,溶剂浸出油对黑曲霉的抑制率为70.30%,而对黄曲霉的抑制率高达80.38%;在相同质量浓度下,冷榨油对黑曲霉抑制率达到76.24%,对黄曲霉仅为63.02%。差异显著性分析显示,在25~50mg/mL范围内,溶剂浸出油与冷榨油对黑曲霉的抑制作用差异不显著,在12.5mg/mL时差异显著,在3.125~6.25mg/mL范围内,差异极显著。而对黄曲霉的抑制作用在实验浓度范围内,两种油的抑菌效果差异极显著。结果表明,两种藤椒油对黑曲霉和黄曲霉具有较好的抑菌活性。
2.2.2 藤椒油对霉菌的半抑制浓度(IC50) 由表5可知,两种藤椒油对黑曲霉和黄曲霉均具有很好的抑制作用,尤其是溶剂浸出油,对黑曲霉和黄曲霉的IC50分别为0.0829、0.547mg/mL,均低于冷榨油相应的IC50值。
2.3 藤椒油抑菌稳定性
2.3.1 介质pH对藤椒油抑菌活性的影响 由表6、表7可知,介质pH对藤椒油抑菌活性具有一定的影响,碱性条件下溶剂浸出油和冷榨油的抑菌活性增高,但在过酸(pH3)和过碱(pH11)条件下,培养液本身就能抑制枯草芽孢杆菌和胶红酵母的生长,而在中性条件和偏酸性条件下,藤椒油抑菌活性基本不变。

表6 介质pH对藤椒油对枯草芽孢杆菌抑菌活性的影响Table 6 Effect of pH on antibacterial activity of Zanthoxylum armatum DC Prodr. Oil against Bacillus subtilis
注:表中数据表示MIC值,表6~表11同。“-”表示培养液的pH3和pH11时,未加样品溶液,培养液本身就能抑制枯草芽孢杆菌和胶红酵母的生长,表7同。
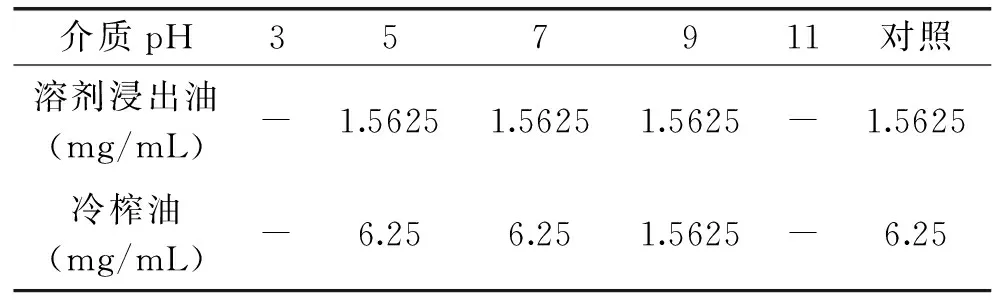
表7 介质pH对藤椒油对胶红酵母抑菌活性的影响Table 7 Effect of pH on antibacterial activity of Zanthoxylum armatum DC Prodr. Oil against Rhodotorula mucilaginosa
2.3.2 热处理对藤椒油抑菌活性的影响 由表8、表9可知,两种藤椒油经不同温度处理后,仍具有良好的抑菌活性,MIC值均等于不经热处理的MIC值,尤其在121℃湿热处理30min后,两种藤椒油抑菌活性基本保持不变,表明藤椒油中的抑菌活性成分具有较高的热稳定性。
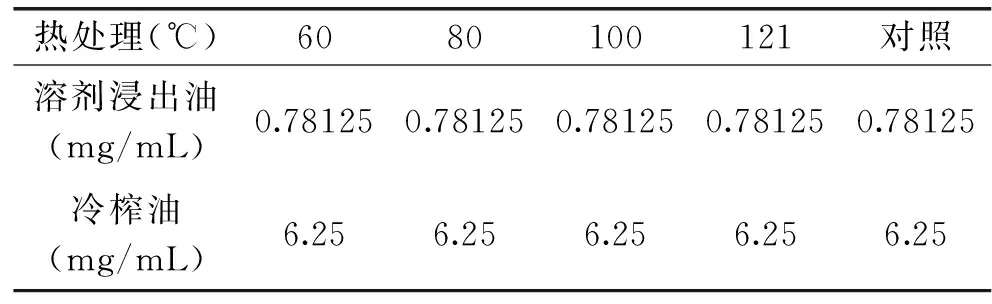
表8 热处理对藤椒油对枯草芽孢杆菌抑菌活性的影响Table 8 Effect of thermal treatment on antibacterial activity ofZanthoxylum armatum DC Prodr. Oil against Bacillus subtilis
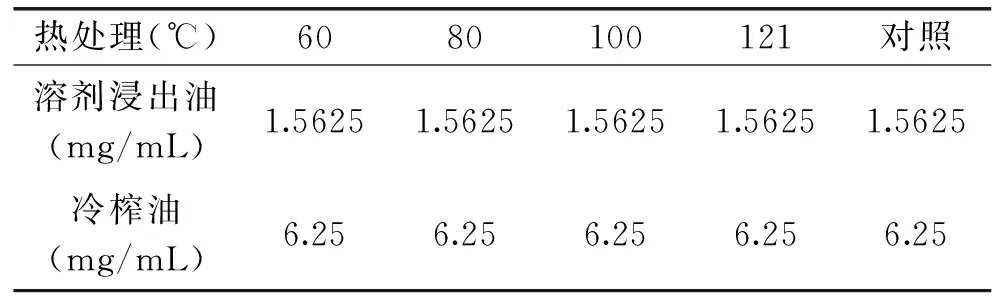
表9 热处理对藤椒油对胶红酵母抑菌活性的影响Table 9 Effect of thermal treatment on antibacterial activity of Zanthoxylum armatum DC Prodr. Oil against Rhodotorula mucilaginosa
2.3.3 紫外照射对藤椒油抑菌活性的影响 表10、表11表明,随紫外处理时间的变化,两种藤椒油的抑菌活性保持不变。说明藤椒油中的抑菌活性成分对紫外线具有极高的稳定性。
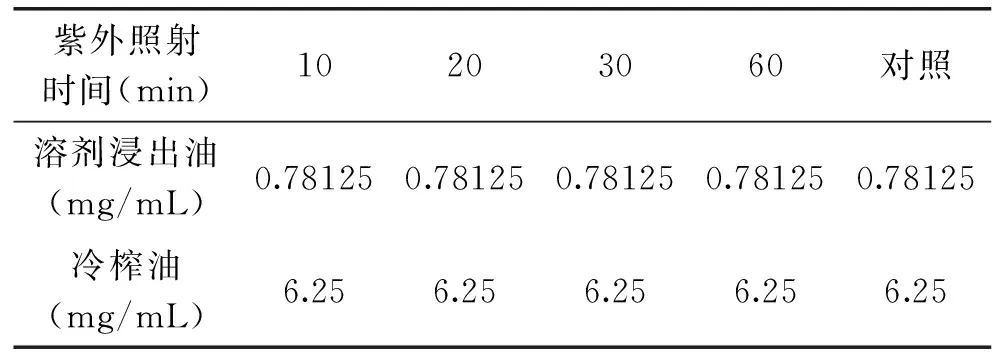
表10 紫外照射对藤椒油对枯草芽孢杆菌抑菌活性的影响Table 10 Effect of ultraviolet on antibacterial activity ofZanthoxylum armatum DC Prodr. Oil against Bacillus subtilis
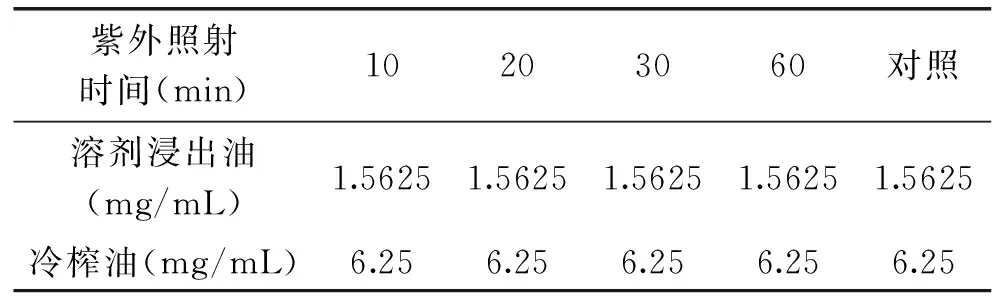
表11 紫外照射对藤椒油对胶红酵母抑菌活性的影响Table 11 Effect of ultraviolet on antibacterial activity of Zanthoxylum armatum DC Prodr. Oil against Rhodotorula mucilaginosa
3 结论
两种藤椒油对不同菌种都具有抑制作用,但溶剂浸出油对细菌、酵母菌和霉菌的抑菌活性强于冷榨油,其中溶剂浸出油对枯草芽孢杆菌的抑制效果最好,MIC为0.78125mg/mL;冷榨油对枯草芽孢杆菌和胶红酵母抑制效果最好,MIC为6.25mg/mL。溶剂浸出油对枯草芽孢杆菌和胶红酵母杀菌效果最好,MBC为3.125mg/mL;冷榨油除对金黄色葡萄球菌的杀菌效果最弱,MBC达到25mg/mL外,对其他五种菌杀菌的作用效果相差不大,MBC为12.5mg/mL。
溶剂浸出油和冷榨油对黑曲霉和黄曲霉具有不同的抑制效果,且随质量浓度的增大而增强,在相同质量浓度下,溶剂浸出油在12.5~50mg/mL质量浓度范围内对黄曲霉的抑制作用比对黑曲霉强,冷榨油在实验浓度范围内对黑曲霉的抑制率却远高于对黄曲霉的。溶剂浸出油对黑曲霉和黄曲霉的IC50分别为0.0829、0.547mg/mL,冷榨油对黑曲霉和黄曲霉的IC50分别为1.0348、1.4437mg/mL。
热处理和紫外照射对两种藤椒油的抑菌活性影响不明显;介质pH对藤椒油抑菌活性具有一定的影响,碱性条件下溶剂浸出油和冷榨油的抑菌活性增高,而在中性条件和偏酸性条件下,藤椒油抑菌活性基本不变。
[1]张华. 青花椒的结实特性及营养成分的研究[D]. 雅安:四川农业大学,2011.
[2]李东,左勇,袁跃,等. 藤椒油生产工艺条件的优化[J]. 中国调味品,2013,38(1):70-73.
[3]郑磊. 藤椒锈病的研究[D]. 雅安:四川农业大学,2012.
[4]Kim,JH. Seasonal variations in the content and composition of essential oil from Zanthoxylum piperitum[J]. Journal of Ecology and Field Biology,2012,35(3):195-201.
[5]Wang S,Xie J,Yang W,et al. Preparative separation and purification of alkylamides from Zanthoxylum bungeanum maxim by high-speed counter-current chromatography[J]. Journal of Liquid Chromatography & Related Technologies,2011,34(20):2640-2652.
[6]高逢敬. 青花椒香气成分的提取、分析及抑菌性研究[D]. 雅安:四川农业大学,2007.
[7]干信,吴士筠,高雯琪. 花椒挥发油抑菌作用研究[J]. 食品科学,2009,30(21):128-130.
[8]祝瑞雪,曾维才,赵志峰,等. 汉源花椒精油的化学成分分析及其抑菌作用[J]. 食品科学,2011,32(17):85-88.
[9]刘伟,苏楠,冯青,等. 纯阳正气胶囊提取及对沙门菌的体外抑菌作用[J]. 中国医院药学杂志,2013,33(17):1401-1405.
[10]曾哲灵,周星,邹强,等. 癸酸聚甘油酯的制备及性能研究[J]. 食品与发酵工业,2011,37(11):46-50.
[11]潘萌. 小果博落回中生物碱的提取分离及抑菌活性研究[D]. 杨凌:西北农林科技大学,2012.
[12]肖碧红,陈彬,雷晓凌,等. 海洋真菌ZJ27次级代谢产物的抑菌活性研究[J]. 海洋科学,2012,36(3):95-98.
[13]陈佳佳,刘凡,廖森森,等. 桑叶提取物抑菌活性以抑菌稳定性研究[J]. 食品工业科技,2012,33(9):88-91.
[14]邝婉湄,邓彩间,林乔禹,等. 红花油茶籽油的抑菌和抗氧化作用研究[J]. 中国油脂,2010,35(9):25-28.
[15]游玉明,黄琳琳. 山胡椒提取物的抑菌活性及其稳定性[J]. 食品与发酵工业,2013,39(5):116-119.
Study on antibacterial activity and stability ofZanthoxylumarmatumDC Prodr. oil
ZHOU Ting,PU Biao*,JIANG Huan-xiao,LIU Chun-yan
(College of Food Science,Sichuan Agricultural University,Ya’an 625014,China)
The antibacterial activity ofZanthoxylumarmatumDC Prodr. oil against common bacteria and yeasts were tested by using inhibition zone experiment and tube double dilution method to determine minimum inhibitory concentration(MIC)and minimum bactericidal concentration(MBC). The antibacterial effect of oil against mould were tested by using growth rate method. The oil was also studied for its stability to thermal treatment,ultraviolet and pH. The results showed thatZanthoxylumarmatumDC Prodr. oil had certain effect on restraining the growth of all the bacteria in the test. While the antibacterial effect of oil extracted from absolute ether were stronger than cold presssed oil.
ZanthoxylumarmatumDC Prodr. oil;antibacterial activity;stability
2014-09-03
周婷 (1989-),女,硕士研究生,研究方向:果蔬加工理论与技术。
*通讯作者:蒲彪(1956-),男,博士,教授,研究方向:果蔬加工、功能性食品。
TS201.3
A
1002-0306(2015)11-0106-05
10.13386/j.issn1002-0306.2015.11.013

