紫茄皮中花青素的纯化及稳定性研究
李 健,王金秋,刘 宁,黎晨晨
(哈尔滨商业大学食品工程学院,黑龙江省普通高等学校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
紫茄皮中花青素的纯化及稳定性研究
李 健,王金秋,刘 宁*,黎晨晨
(哈尔滨商业大学食品工程学院,黑龙江省普通高等学校食品科学与工程重点实验室,黑龙江哈尔滨 150076)
对以紫茄皮为原料提取的花青素进行大孔树脂纯化法纯化,探讨紫茄皮花青素的稳定性。通过静/动态吸附-解吸实验筛选大孔树脂、优化纯化工艺条件,在此基础上,探讨温度、pH、氧化/还原性物质、防腐剂、金属离子、糖等条件对紫茄皮中花青素稳定性的影响。结果表明:在供试树脂中,AB-8大孔树脂为紫茄皮花青素纯化的最适吸附剂,其吸附最优条件为为吸附时间1 h,上样量260 mL,吸附流速1 mL/min;最佳解析条件为,解析时间1 h,洗脱液乙醇体积分数为40%,洗脱液体积为80 mL,吸附流速1 mL/min,纯化后的花青素纯度为95.54%;高温、pH、H2O2、抗坏血酸、苯甲酸钠、Fe3+等导致紫茄皮中花青素稳定性降低。大孔树脂纯化法适合于紫茄皮花青素的纯化。紫茄皮花青素应在4 ℃、pH1.0且避光条件下保存,在储藏过程中应避免接触铁容器,紫茄皮花青素对H2O2、苯甲酸钠很敏感,使用过程中应该避免二者存在。此外,紫茄皮花青素对糖稳定,生产中可依情况适量添加。
紫茄皮花青素,大孔树脂,纯化,稳定性
目前我们市场上普遍使用的色素大多为合成色素,天然色素在市面上的价格普遍较高,尤其是日本等发达国家售价格外昂贵[1]。因此,寻找一种产量大、来源广、价格低的天然色素资源十分迫切[2]。1947年法国科学院研究生院年轻的博士马斯魁勒在花生仁的包衣中首先发现了花青素物质[3]。花青素(Anthocyanidin),是天然色素中应用极其广泛的一类色素,属于酚类化合物中的类黄酮类,其基本结构包含两个苯环,并由一个3碳的单位连结(C6-C3-C6)[4-5]。近年来,天然花青素的研究逐渐获得重视,尤其是在食品、化妆品和医药等行业的应用上[6]。天然花青素具有低毒,色泽鲜艳,保健功能等优势[7-8]。研究表明,花青素主要存在于植物细胞当中,大多来源于新鲜果蔬。茄子(Solanaceae),学名为SolanummelongenaL,是茄属以浆果为果实的一年生草本植物,高60~80 cm,夏秋开花结果,桨果呈球形、椭圆形,果皮多为紫红色,栽培面积广泛[9-12]。茄子皮富含花青素物质,具有抗氧化、保健等功效[13]。因此茄子皮中花青素的提取、纯化及稳定性的研究具有重要意义。
本文旨在以紫茄皮为原料,采用大孔树脂纯化法纯化茄子皮花青素,并且探讨紫茄皮花青素的稳定性,为天然使用色素产品的开发及工业化生产奠定基础。同时,也实现了茄子的综合利用,可以进一步提高茄子深加工技术水平,延展茄子生产的产业链,提高产品附加值。对茄子开发利用具有重要意义。
1 材料与方法
1.1 材料与仪器
新鲜紫茄子(大小一致的长条茄子) 哈尔滨市家乐福超市;大孔树脂 哈尔滨市道外区盛达化验仪器有限公司;蒸馏水 哈尔滨商业大学食品工程学院提供。
矢车菊-3-O-葡萄糖苷(色谱纯,纯度98%) 北京方程生物科技有限公司;氯化铁、氯化钾、氯化钠、氯化铝、硫酸铜 均购于天津市天力化学试剂厂;无水乙醇、冰乙酸、柠檬酸、无水乙酸钠、苯甲酸钠、抗坏血酸 均购于天津市博迪化工股份有限公司;盐酸 天津市科密欧化学试剂有限公司;氯化钙 天津市科密欧化学试剂有限公司。
EF-500摇摆式高速万能粉碎机 温岭市林大机械有限公司;DHG-9123A型电热恒温鼓风干燥箱 上海一恒科学仪器有限公司;LD4-2A低速离心机 北京医用离心机厂;UV-5100B型紫外可见分光光度计 上海元析仪器有限公司;ALC-110.4电子天平 德国SARTORIUS集团;TU-1901双光束紫外可见分光光度计 北京普析通用仪器有限责任公司;HC-TP11-5架盘药物天平 上海精密科学仪器有限公司。KQ-500VDED双频数控超声波清洗器 昆山市超声仪器有限公司。
1.2 实验方法
1.2.1 大孔树脂的活化 将大孔树脂用95%乙醇浸泡24 h,使其充分溶胀,然后以乙醇冲洗至无白色浑浊,并以蒸馏水洗至无醇味;再以5%的盐酸溶液浸泡12 h,蒸馏水洗至中性;最后用2%氢氧化钠溶液浸泡12 h,蒸馏水冲洗至中性,备用[14]。
1.2.2 紫茄皮中花青素的提取 在之前的试验中确定提取参数:将紫茄子在40 ℃条件下干燥24 h,粉碎,过40目筛。在超声功率为350 W、液料比为60∶1 mL/g(溶液体积/紫茄皮质量)、乙醇体积分数为60%的条件下提取42 min,将提取液在3000 r/min条件下离心10 min,取上清液,即为紫茄皮花青素粗提液。
1.2.3 大孔树脂的筛选 本试验选择三种大孔树脂作为实验吸附树脂,树脂吸附性能的优劣由其物理和化学性质所决定,各种树脂的结构功能如表1[15]。

表1 不同树脂的结构功能
准确称取处理过的不同型号的大孔树脂3 g,置于150 mL的锥形瓶中,分别加入30 mL已知吸光度A0的花青素粗提液,密封、25 ℃、100 r/min避光水浴震荡24 h。充分吸附后,过滤,在510 nm下测滤液吸光度A1;用pH1.0蒸馏水洗脱除去水溶性杂质,过滤,将大孔树脂置于150 mL锥形瓶中,加入30 mL pH1.0的体积分数60%的乙醇,密封、25℃、100r/min避光水浴震荡24 h。充分解吸后过滤,在510 nm下测滤液的吸光度A2,按公式(1)计算吸附率α和按公式(2)解吸率β[16]。

式(1)

式(2)
式中:A0-提取液初始吸光度;A1-吸附后滤液吸光度;A2-解吸后滤液吸光度;V0-提取液初始体积,mL;V1-吸附后滤液体积,mL;V2-解吸后体积,mL;α-大孔树脂吸附率,%;β-大孔树脂解吸率,%。
1.2.4 大孔树脂静态吸附、解吸研究 分别研究大孔树脂静态吸附时间(0、1、2、3、4、5h)解吸时间(0、0.5、1、1.5、2、2.5h)及乙醇体积分数(30%、40%、50%、60%、70%、80%)对解吸率的影响。按式(1)计算吸附率α和按式(2)计算解吸率β。各组实验重复三次。
1.2.5 大孔树脂动态吸附、解吸研究 在静态吸附、解吸的基础上进行动态吸附解吸实验,对泄露曲线、吸附流速(0.5、1、1.5、2、2.5mL/min)、洗脱曲线、洗脱流速(0.5、1、1.5、2、2.5mL/min)四个因素进行实验,按公式(1)计算吸附率α和按公式(2)计算解吸率β。各组实验重复三次。
1.2.6 花青素保存率的计算
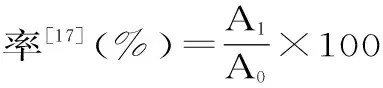
式(3)
式中:A1-保存后花青素吸光度值;A0-保存前花青素吸光度值。
分别考察了温度、pH、光照、氧化性物质、还原性物质、防腐剂、金属离子、糖对花青素稳定性的影响,以未加以上物质的花青素提取液为对照组,采用直接测量法进行检测,按式(3)进行计算,各组实验重复三次。
2 结果与分析
2.1 大孔树脂的筛选结果
选取3种不同的大孔树脂分别对紫茄皮花青素进行吸附及解吸试验,试验结果见表2。

表2 三种树脂静态吸附及解吸结果
由表2可以得出AB-8大孔树脂为最佳纯化花青素的树脂。AB-8大孔树脂吸附量大缘于AB-8是弱极性的树脂,在吸附过程中易和色素形成氢键,结合比较牢固的原因[18]。
2.2 大孔树脂静态吸附平衡时间的确定
固定其他因素不变,以吸附时间为横坐标,吸附率为纵坐标,绘制静态吸附曲线,试验结果如图1所示,在静态吸附过程的前1 h内AB-8大孔吸附树脂对紫茄皮花青素吸附率迅速增加。在吸附时间达到1 h后,AB-8大孔吸附树脂对紫茄皮花青素吸附静态吸附上升趋于缓慢,考虑时间及花青素降解等因素,选取1 h为吸附平衡时间。

图1 大孔树脂静态吸附平衡时间的确定Fig.1 Determination of static adsorption equilibrium time of macroporous resin
2.3 大孔树脂静态解吸平衡时间的确定
固定其他因素不变,以吸附时间为横坐标,解吸率为纵坐标,绘制静态解吸曲线,试验结果如图2所示,在静态解吸过程的前1 h内AB-8大孔吸附树脂对紫茄皮花青素解吸率迅速增加。在解吸时间达到1 h后,AB-8大孔吸附树脂对紫茄皮花青素静态解吸基本达到饱和。在1 h之后随着解吸时间的增加,解吸率基本恒定,因此确定1 h为解吸平衡时间。

图2 大孔树脂静态解吸平衡时间的确定Fig.2 Determination of static equilibrium time of macroporous resin
2.4 乙醇体积分数对大孔树脂解吸效果的影响
固定其他因素不变,以乙醇体积分数为横坐标,解吸率为纵坐标,绘制静态解吸曲线,试验结果如图3所示,在乙醇体积分数40%内AB-8大孔吸附树脂对紫茄皮花青素解吸率迅速增加。在水中乙醇可以与水互溶,而溶液的介电常数随着洗脱剂中乙醇浓度的增大而改变,这使花青素与树脂间的吸附作用减弱,从而增强了对色素的解吸能力[19]。在乙醇体积分数40%之后随着乙醇体积分数的增加,解吸率基本恒定,因此确定乙醇体积分数40%为最佳解吸溶剂。

图3 乙醇体积分数对大孔树脂解吸效果的影响Fig.3 Effect of ethanol volume fraction on the analytical results of macroporous resin
2.5 泄露曲线的测定
每次加入花青素粗提液10 mL,五次一组。当流出液中花青素吸光度值达到上样液花青素吸光度值的1/10时认为已经出现泄漏[20]。从图4可以看出,随上样液体积的增加,流出液中紫茄皮花青素含量增加,即大孔树脂对紫茄皮花青素的吸附效果随上样液体积的增加而下降。当流出液中紫茄皮花青素吸光度值达到上样液紫茄皮花青素吸光度值(1.68)的1/10时认为已经出现泄漏,即上样液体积达到260 mL出现泄漏。因此确定紫茄皮花青素最大上样量为260 mL。

图4 最大上样量体积的确定Fig.4 Determination of maximum sample volume
2.6 吸附流速对大孔树脂吸附效果的影响
从图5可以看出,随上样流速的增加,树脂对紫茄皮花青素的吸附性能下降,原因是流速过快,花青素溶液与树脂还未充分接触就已经流出,使吸附率降低[21]。虽然流速为0.5 mL/min比1 mL/min时吸附效果好,但流速为0.5 mL/min会导致实验的循环周期延长,考虑时间问题,所以将吸附流速控制为1 mL/min。

图5 吸附流速对大孔树脂吸附率的影响Fig.5 Effect of adsorption rate on adsorption rate of macroporous resin
2.7 洗脱曲线的测定
从图6可以看出,随洗脱液体积的增加,流出液中紫茄皮花青素含量先逐渐减少后趋于平稳。当流出液中紫茄皮花青素吸光度不变时,即洗脱液液体积达到80 mL时。因此确定紫茄皮花青素洗脱上样量为80 mL。

图6 洗脱液体积的确定Fig.6 Determination of the volume of the elution liquid
2.8 解吸流速对大孔树脂解吸效果的影响
从图7可以看出,随解吸流速的增加,树脂对紫茄皮花青素的解吸性能下降,原因是流速不同,紫茄皮花青素与树脂的接触时间不同,解吸率也会发生变化。虽然流速为0.5 mL/min比1 mL/min时吸附效果好,但流速为0.5 mL/min会导致实验的循环周期延长,考虑时间问题,所以将吸附流速控制为1 mL/min。

图7 解吸流速对大孔树脂解吸率的影响Fig.7 Analysis of the effect of flow velocity on the resolution of macroporous resin
2.9 温度对紫茄皮花青素稳定性的影响
由图8可以看出,在4 ℃和室温条件下保藏5 h后,紫茄皮中花青素的保存率下降为94.00%、89.91%,但在40℃和80℃条件下保藏5 h后,紫茄皮中花青素的保存率下降至70.75%、61.61%。这说明了紫茄皮花青素对热敏感,因此花青素应在4 ℃条件下保存。

图8 温度对紫茄皮花青素保存率的影响Fig.8 Effect of temperature on purple eggplant skin anthocyanin preservation rate
2.10 pH对紫茄皮花青素稳定性的影响
在不同的pH下,溶液中的花青素所存在的4种结构的主体成分是不一样的[22],反应4 h后进行全波长扫描结果如图9所示:pH在1.0、2.0、3.0时紫茄皮中花青素的最大吸收峰出现在510 nm处且随着pH的升高,吸光度值降低,pH4.0、pH5.0吸收曲线重合,pH6.0时紫茄皮中花青素无明显吸收峰值。由图可知花青素在pH1.0时有比较好的稳定性,由于花青素自结构的不稳定性,在pH较高时花青素不稳定,因此pH对于花青素的影响很显著。

图9 pH对紫茄皮花青素稳定性的影响Fig.9 Effect of pH on the stability of anthocyanin purple eggplant skin
2.11 光照对紫茄皮花青素稳定性的影响
由图10可知,避光对紫茄皮的保存率的影响最小,而室内自然光和室外自然光对紫茄皮花青的影响很大。7 d之后室内自然光和室外自然光保存率为68.64%、67.10%。说明紫茄皮花青素应在避光条件下保存较为稳定。

图10 光照对紫茄皮花青素保存率的影响Fig.10 Effect of light purple eggplant skin anthocyanin preservation rate
2.12 氧化性物质对紫茄皮花青素稳定性的影响
由图11可知H2O2对紫茄皮花青素的稳定性影响很大。花青素溶液放置7 d后不含H2O2溶液的花青素相对保存率为92.01%,含H2O2浓度为0.1、0.2、0.3 mL/25 mL的花青素溶液花青素的保存率仅为36.63%、29.55%和20.38%。因此H2O2对紫茄皮花青素的稳定性存在着很大的破坏作用能促进紫茄皮花青素的降解。根据研究报道,这可能是因为H2O2可直接亲核进攻花青素的C位,花青素开环会生成查耳酮,而查耳酮可进一步降解生成各种无色的酯类物质[23]。

图11 氧化性物质对紫茄皮花青素保存率的影响Fig.11 Effect of oxidizing substances on purple eggplant skin anthocyanin preservation rate
2.13 还原性物质对紫茄皮花青素稳定性的影响
分别加入1、3、5 mg/mL抗坏血酸对紫茄皮花青素溶液花青素保留率的影响,由图12可知,紫茄皮花青素在抗坏血酸溶液中的保留率下降,且抗坏血酸质量浓度越高,其保留率就越低,紫茄皮中花青素的稳定性下降原因可能是抗坏血酸被氧化后产生过氧化氢引起的。

图12 还原性物质对紫茄皮花青素保存率的影响Fig.12 Effect of reducing substances of purple eggplant skin anthocyanin preservation rate
2.14 防腐剂对紫茄皮花青素稳定性的影响
以苯甲酸钠为例,由图13可知,苯甲酸钠对紫茄皮花青素的稳定性影响较大。放置7 d后不含苯甲酸钠溶液的花青素保存率为95.42%,含苯甲酸钠浓度为1、3、5 mL/mg的花青素溶液花青素的保存率仅为10.32%、5.62%和3.34%。由此可见苯甲酸钠对紫茄皮花青素的稳定性存在着很大的破坏作用。因此生产中应尽量避免使用苯甲酸钠做为防腐剂。

图13 防腐剂对紫茄皮花青素保存率的影响Fig.13 Effect of preservatives on purple eggplant skin anthocyanin preservation rate
2.15 金属离子对紫茄皮花青素稳定性的影响
各种金属离子对紫茄皮花青素稳定性的影响如图14~图18,其中空白组为未添加金属离子色素液。添加Fe3+保存率明显下降。因为花青素类与Fe3+金属离子发生化学反应并形成复杂的络合物,而其他金属离子如Cu2+、A13+、Na+、Ca2+对色素溶液的稳定性影响不明显,这和文献[24-25]的结果一致。综上可知,紫茄皮中花青素在生产和使用过程中应避免与铁质设备或容器接触。

图14 Fe3+对紫茄皮花青素保存率的影响Fig.14 Effect of Fe3+ purple eggplant skin ant hocyanin preservation rate
图15 Cu2+紫茄皮花青素保存率的影响Fig.15 Effect of Cu2+ purple eggplant skin ant hocyanin preservation rate

图16 Al3+对紫茄皮花青素保存率的影响Fig.16 Effect of Al3+ purple eggplant skin ant hocyanin preservation rate

图17 Na+对紫茄皮花青素保存率的影响Fig. 17 Effect of Na+ purple eggplant skin ant hocyanin preservation rate

图18 Ca2+对紫茄皮花青素保存率的影响Fig.18 Effect of Ca2+ purple eggplant skin ant hocyanin preservation rate
2.16 糖对紫茄皮花青素稳定性的影响
由图19、图20可知,不含葡萄糖和蔗糖的花青素溶液在室温下放置7 d后,其花青素相对保存率为94.52%,花青素在不同质量浓度的蔗糖和葡萄糖溶液中贮存随时间变化情况,在放置7 d后花青素的保留率仍在85%。说明葡萄糖和蔗糖的存在下较稳定。

图19 蔗糖对紫茄皮花青素保存率的影响Fig.19 Effect of Sucrose on purple eggplant skin anthocyanin preservation rate

图20 葡萄糖对紫茄皮花青素保存率的影响Fig.20 Effect of glucose on purple eggplant skin anthocyanin preservation rate
2.17 大孔树脂纯化紫茄皮中花青素条件的验证
按照实际优化的工艺条件(选取AB-8型号大孔树脂、吸附时间1 h、上样量260 mL,吸附流速1 mL/min解吸时间1 h,洗脱液乙醇体积分数为40%,洗脱液体积为80 mL)进行3次平行试验,得到花青素的纯度平均值为95.67%,该实验得到的工艺参数准确、可靠,具有一定的实用价值。
3 结论
确定了花青素的最佳纯化条件为最佳大孔树脂AB-8;最佳吸附条件为:吸附时间1 h,上样量260 mL,吸附流速控制为1 mL/min;最佳解吸条件为:解吸时间1 h,洗脱液乙醇体积分数为40%,洗脱液体积为80 mL,吸附流速控制为1 mL/min。紫茄皮中花青素对热、pH、光敏感,应在4 ℃、pH1.0、避光条件下保存;对H2O2、苯甲酸钠很敏感,使用过程中应该避免。花青素类与Fe3+金属离子发生化学反应并形成复杂的络合物,影响花青素的稳定性,而其他金属离子对花青素没有多大影响,因此在储藏过程中应避免接触铁容器。另外对糖稳定,生产中可依情况适量添加。
[1]Sarma A D. Antioxidant ability of anthocyanins against ascorbic acid oxidation[J]. Phytochemistry,1997,45(4):671-674.
[2]何伟平,王勤志,朱晓韵,等. 茄子提取物对清除自由基作用的研究[J]. 轻工科技,2012,(4):3-4,7.
[3]韩海华,梁名志,王丽,等. 花青素的研究进展及其应用[J]. 茶叶,2011,37(4):217-220.
[4]杨秀娟,赵晓燕,马越,等.花青素研究进展[J]. 中国食品添加剂,2005(4):4.
[5]王日为,张丽霞,高吉刚. 茶叶中花青素类物质研究展望[J]. 茶叶科学技术,2002(4):5.
[6]张国文,食用色素的研究现状与前景[J]. 粮油食品科技,2004,12(6):70-72.
[7]张茜,赵军锋,李巨勇. 茄子皮花青素提取工艺研究[J]. 生物技术世界,2013,09:41.
[8]Nichenametla,S.N.,T.G. Taruscio,D.L. Barney,J.H. Exon. A review of the effects and polyphenolics in cancer[J]. Crit Rev Food Sci Nutr,2006,46(2):161-183.
[9]许琼.茄子皮天然红色素的提取及稳定性的研究[J]. 安康师专学报,2004,16(1):85-86.
[10]Todaro A,Cimino F,Rapisarda P,et al. Recovery of anthocya-nins from eggplant peel[J]. Food Chemistry,2009,114(2):434-439.
[11]张宇. 珍蔬:茄子[J].上海蔬菜,2003(2):43-44.
[12]申爱民. 我国茄子生产概况及发展趋势[J]. 现代农业科技,2007(21):1.
[13]杨朝霞. 紫甘薯花色苷色素提取纯化工艺研究及组分分析[D]. 青岛:青岛大学,2004.
[14]李敏. 不同花青素提取物的组成、稳定性及抗氧化性比较研究[D].南京:南京财经大学,2013.
[15]李颖畅. 蓝莓花色苷提取纯化及生理功能研究[D].沈阳:沈阳农业大学,2008.
[16]何会. 荔枝果皮中花色苷的分离纯化鉴定及其抗氧化活性[D]. 武汉:华中农业大学,2009.
[17]高东菊,张凤娥,闫颖. 天竺葵红色素的稳定性研究[J]. 湖南农业科学,2014:64-68.
[18]孙健,岳瑞雪,钮福祥,等. 紫甘薯花青素的大孔树脂动态吸附工艺优化[J]. 江苏农业科学,2013,41(6):227-229.
[19]任治军,何开泽,谭健. 大孔吸附树脂精制栀子黄色素[J]. 食品科学,2005,26(11):157-162
[20]王丹,马越,张超,等. 紫玉米苞叶花色苷的纯化鉴定及热稳定性分析[J]. 食品工业科技,2013,34:77-80.
[21]杨智勇,李新生,马娇燕,等. 大孔树脂分离纯化“黑金刚”紫马铃薯花青苷工艺研究[J]. 氨基酸和生物资源,2013,35:1-4.
[22]韩永斌. 紫甘薯花色苷提取工艺与组分分析及其稳定性和抗氧化性研究[D].南京:南京农业大学,2007.
[23]谢程程. 紫甘薯花青素的提取纯化、稳定性及应用研究[D].辽宁:辽宁科技大学,2012.
[24]张玲,邱松山,麦建华,等. 黑布林皮中花青素的提取工艺优化及稳定性研究[J]. 粮食与食品工业,2009,16:36-39.
[25]王露,孙双勋,邵烨丹,等. 红肉桃花色苷的提取纯化及稳定性研究[J]. 食品工业科技,2014,35(24):113-117,122.
Study on the purification and stability of anthocyanins from purple eggplant skin
LI Jian,WANG Jin-qiu,LIU Ning*,LI Chen-chen
(Key Laboratory for Food Science and Engineering of Heilongjiang Province,College of Food Engineering,Harbin University of Commerce,Harbin 150076,China)
The anthocyanins extracted from purple eggplant skin as raw material of macroporous resin purification,and the anthocyanin from purple eggplant skins stability was studied. Through the static / dynamic adsorption and desorption experiments,the optimized conditions of macroporous resin and purification process were optimized,the effects of temperature,pH,oxidation/reduction substances,preservatives,metal ions,sugars on purple eggplant skin anthocyanin stability were investigated. The experimental results showed that selecting AB-8 macroporous resin as adsorbent,the optimal adsorption conditions were the adsorption time of 1 h,260 mL of volumn,adsorption the flow rate of 1 mL/min,the desorption rate of 40%,the elution volume of 80 mL,the adsorption flow rate of 1 mL/min,and the purity of the purified anthocyanin was 95.54%.The anthocyanin in purple eggplant skin was sensitive to heat,acid,alkali,H2O2,ascorbic acid,sodium benzoate,Fe3+.,and it was stable to sugar. The purification method of macroporous resin was suitable for purification of purple eggplant anthocyanin. Anthocyanins of purple eggplant green elements should be in the 4 ℃,pH1.0 and avoid light preservation. In the process of storage,anthocyanin of purple eggplant should avoid contacting with iron container,and eggplant purple anthocyanins are very sensitive to H2O2and sodium benzoate,which should be avoided at the same time during the process. In addition,purple eggplant anthocyanin was stable to the sugar,so the sugar can be added apprpriately.
anthocyanin of purple eggplant;macroporous resin;purification;stability
2015-09-08
李健(1956-),男,本科,教授,研究方向:食品科学,E-mail:lijian4852147@163.com。
*通讯作者:刘宁(1978-),女,博士,副教授,研究方向:农产品化学与综合利用,E-mail:wendingzi666@163.com。
黑龙江省教育厅科学技术面上项目(12541199)。
TS255.1
A
1002-0306(2015)21-0133-07
10.13386/j.issn1002-0306.2015.21.019

