自噬在不同强度运动影响关节软骨细胞功能中的作用
刘申申等

摘要:目的: 探讨自噬在不同运动强度影响关节软骨细胞功能中的作用。方法: 将 SD 大鼠随机分为 4 组: 高强度运动组、中等强度运动组、低强度运动组和对照组,其中的三个运动组大鼠均进行每天 1 h持续 8 w 的跑台运动,运动速度分别为 35 m/min、 25 m/min、 15 m/min,对照组不进行运动干预。分组干预结束后处死大鼠, 取左后肢膝关节软骨组织提取总 RNA 和蛋白,利用 qRT-PCR法检测蛋白多糖和 II 型胶原纤维 mRNA 水平,利用 Western blot 法测定自噬相关标志蛋白 Beclin-1 和微管相关蛋白 1 轻链 3( microtubule-associated protein 1
light chain 3, LC3)的蛋白水平。 结果: 与对照组相比, 低强度和中等强度运动组大鼠膝关节软骨外观无明显差异,蛋白多糖和 II 型胶原纤维 mRNA 水平以及Beclin-1 和 LC3-II/I 蛋白水平明显升高;而高强度运动组大鼠膝关节中出现少量积液,滑膜肿胀,关节软骨表面出现散在微小裂痕和纤维化表现,蛋白多糖和 II型胶原纤维 mRNA 水平以及 Beclin-1 和 LC3-II/I 蛋白水平显著降低。 结论: 低强度和中等强度运动可以通过促进自噬维持软骨细胞分泌功能,而高强度运动则会诱发自噬缺陷并造成软骨组织破坏。
关键词:运动;运动强度;关节软骨; 软骨细胞;自噬
中图分类号:G8042文献标识码:A文章编号:1006-2076(2015)02-0074-05
Abstract:Objective: To determine the role of autophagy in the regulation of articular chondrocyte function with exercises of different intensityMethods:The rats were randomly divided into 4 groups: high, moderate, low intensity exercise groups and the control group The rats of exercise groups were trained in the form of treadmill running, 1 h/d for 8 weeks, with 35 m/min, 25 m/min, and 15 m/min respectively And the rats of the control group were not trained at all Finally, the knee articular cartilage of the left hind limb was harvested to determine the mRNA level of proteoglycan and type II collagen, and the protein level of Beclin-1 and microtubule-associated protein 1 light chain 3 (LC3)Results:Compared with the control group, the gross appearance of the cartilage did not differ in the rats of moderate and low intensity exercise groups And the mRNA levels of proteoglycan and type II collagen and the protein level of Beclin-1 and LC3-II/I were all significantly
收稿日期:2014-11-11
基金项目:[河北省高等学校科学技术研究项目( Z2013009)。
作者简介:[刘申申(1981-),男,河北文安人,硕士,讲师,研究方向体育教学与训练。
作者单位:[1廊坊师范学院体育学院,河北 廊坊065000;2北京中医药大学东方学院,河北 廊坊065000
1School of Physical Education, Langfang Teachers University, Langfang 065000, Hebei, China;2Oriental College,Beijing University of Chinese Medicine,Langfang 065001
upregulated As a contrast, the mRNA and protein levels of those proteins were all significantly decreased, accomplished with arthroedema and cartilage destructionConclusion:The secretory function of the chondrocyte may be improved by low to moderate intensity exercise via an autophagy-dependent manner; however, autophagy defect may be induced by high intensity exercise to mediate cartilage destruction
Key words:exercise;exercise intensity;articular cartilage; chondrocyte; autophagy
[FL(K2]
关节是骨与骨相连接的部位,作为关节的重要组成部分,关节软骨发挥着减轻骨与骨之间摩擦和缓冲运动时产生震动的作用。 膝关节是人体主要的负重关节之一,因此,膝关节软骨除发挥上述作用外,还承担着负重的作用。随着年龄的增长, 累积性运动损伤、关节创伤和制动、关节退行性改变和局部炎症免疫反应等因素共同作用,诱使膝关节出现软骨破坏、关节表面骨赘形成、滑膜细胞增生、关节间隙狭窄等病理改变,即诱发骨关节炎[1]。 骨关节炎是一种常见的慢性关节疾病, 累积性微小损伤、肥胖和负重等外因参与诱导骨关节炎的发病过程,但其具体在骨关节炎发病过程中的作用尚未明确
自噬是细胞为维持自身稳态而选择性降解受损细胞器和生物大分子的一种应激调控机制,当各种应激因素刺激引起细胞损伤时, 细胞自噬水平代偿性提高,细胞主动清除受损的线粒体、内质网和核糖体等细胞器,从而有效延缓或阻断细胞凋亡的发生,有助于细胞功能乃至组织整体功能的维持和恢复[4-6]。 目前研究已经证实,自噬在正常软骨组织中发挥保护性作用,参与局部稳态的维持, 而原发性骨关节炎和年龄、手术相关骨关节炎患者膝关节软骨局部自噬水平明显降低,并可能与软骨细胞凋亡有关[7-8]。然而,自噬在运动相关性累积性微小损伤诱发骨关节炎的发病过程中的作用尚无研究阐明,为了明确上述问题,设计了如下实验。本实验拟利用动物实验探讨不同运动强度运动对大鼠膝关节软骨细胞自噬和软骨细胞分泌功能的影响,以阐明自噬在运动相关性软骨损伤乃至骨关节炎发病过程中的作用。
1材料和方法
1.1动物和材料健康清洁级 8 周龄雄性 SD 大鼠 48 只(体重 180 g~230 g) 购自 西安交通大学医学院实验动物中心; BW-ZH-PT 型动物跑台购自上海软隆科技发展有限公司; RNA 逆转录试剂盒和 SYBR 荧光试剂盒均购自日本 TaKaRa 公司; RIPA 裂解液购自西安沃尔森生物科技有限公司; 兔抗大鼠Beclin-1 多克隆抗体和兔抗大鼠 LC3 多克隆抗体购自美国Abcam 公司,兔抗大鼠 β-actin 抗体购自美国 Santa Cruz公司; 常规试剂均为国产分析纯。
1.2分组和干预所有动物的饲养均在西安交通大学医学院实验动物中心完成,饲养条件满足环境温度 20℃~25℃和相对湿度 50%~55%的条件。经过适应性喂养1 w后, 将所有大鼠随机分为4组: 高强度运动组、中等强度运动组、低强度运动组和对照组(均为n=12)。其中,三个运动组的大鼠均进行每天 1 h持续8w的跑台运动, 运动强度的确定参照 Bedford 等人所用方法[9]。高强度运动组运动速度为 35 m/min,中等强度运动组运动强度为 25 m/min,低强度运动组运动强度为 15 m/min,对照组不进行运动干预。
1.3标本采集和处理 分组干预结束后, 统一断头处死各组大鼠,迅速切取左后肢膝关节软骨, 观察关节软骨表面形态特征,随后立即放入液氮中保存,后期用于提取总 RNA 和总蛋白,分别测定软骨组织 II 型胶原纤维 mRNA、蛋白多糖mRNA 以及 Beclin-1 和微管相关蛋白 1 轻链 3( microtubule-associated protein 1light chain 3, LC3)蛋白水平。
1.4改良异硫氰酸胍一步法提取总 RNA 参照马秦和邱蔚六等人所报道的方法提取软骨组织总 RNA[10],具体步骤如下:切取约 2 g 软骨组织,在液氮中研碎,加入20 mL含4 mol/L异硫氰酸胍的混合液(含25 mmol/L 柠檬酸钠、 5 g/L 十二烷基磺酸钠和 01 mol/L 巯基乙醇),室温缓慢震荡 4 h;再分别加入水饱和酚20 mL、 2 mol/L 醋酸钠溶液 2 mL 和含 20 mL/L 异戊醇的氯仿 5 mL,室温剧烈震荡 10 s 后立即放入冰水混合物中孵育 15 min; 12 000 g离心15 min,将上层无色透明的样本转移到新的 EP管中,加入等体积异丙醇,充分混匀后室温下孵育10 min,再次离心;弃上清,用70%乙醇洗涤沉淀1次,将所提取 RNA 沉淀晾干后,加入 50 μL DEPC溶解RNA,于紫外分光光度计测定RNA纯度,保证A260/280不超过 16,RNA样本保存于-80℃冰箱备用。
1.5总蛋白提取将约 01 g 软骨组织在液氮中研碎后,加入 998 μL RIPA 裂解液(含 1 μL 苯甲磺酰氟),冰上裂解 30 min;将裂解液转移至 EP 管中, 4℃ 14 000 g离心20 min,将上清液转移到新EP管中;加入 1/4 体积 5× 十二烷基磺酸钠上样缓冲液, 95℃ 10 min 使蛋白变性, 保存于-20℃冰箱中备用。
1.6qRT-PCR分别按照以下基因序列合成引物:II型胶原纤维为5-CGAGGTGACAAAGGAGC-3(正义),5-CTGGTTGTTCAGCGACTTGA-3(反义);蛋白多糖为 5-CGCTTGCCAGGGGGAGTTGTATTC-3 (正义),5-GGAGGCCAGGGTAGCATTTTGAGC-3 ( 反 义 ); 内 参 GAPDH 为5-GATGGTGAAGGTCGGTGTG-3(正义), 5-GAGGTCAATGAAGGGGTCG-3(反义)。设置微量反转录反应体系,将 RNA 反转录为 cDNA,在 iQ5 荧光定量RT-PCR 仪上进行 PCR 反应。每个实验重复进行 5 次,每次设置 3 个复孔,以2-ΔΔC(t)法计算目的基因相对表达量,以 GAPDH 为内部对照。
1.7Western blot利用Bradford 法测定蛋白浓度, 取等质量的关节软骨总蛋白进行聚丙烯酰胺凝胶电泳; 以半干转法将蛋白转印到 PVDF 膜, 室温下常规封闭处理2 h,随后分别用抗Beclin-1抗体(1[JX-4]:[JX4]100)、抗LC3抗体(1[JX-4]:[JX4]2 000)或β-actin单克隆抗体(1[JX-4]:[JX4]3 000)4℃孵育过夜,用含Tween-20的磷酸盐缓冲液洗涤后,在室温下加入1[JX-4]:[JX4]8 000稀释的生物素标记的山羊抗兔IgG抗体孵育2 h,用含Tween-20 的磷酸盐缓冲液充分洗涤后,用ECL法显影,在Image-Pro Plus 软件中分析各蛋白条带的积分吸光度值,以β-actin为内对照,目的蛋白与内对照灰度值的比值代表该样本目的蛋白的相对表达量, 以3次重复检测所得平均值为该样本目的蛋白表达水平,样本量为n=5。
1.8统计学分析采用SPSS180统计软件分析,数据以均数±标准差表示, 两组间比较采用 t 检验,以P<005 为差异有统计学意义的判定标准。
2结果
2.1大鼠膝关节软骨大体形态特征
经过 8 w 不同强度运动后, 对照组与低强度、中等强度运动组大鼠膝关节中无明显关节积液,关节软骨表面光滑,滑膜无肿胀,未见软骨表面出现裂痕或纤维化表现;而高强度运动组膝关节腔内可见少许积液,滑膜肿胀,关节软骨表面可见散在微小裂痕和纤维化表现。
2.2大鼠膝关节软骨细胞分泌功能测定
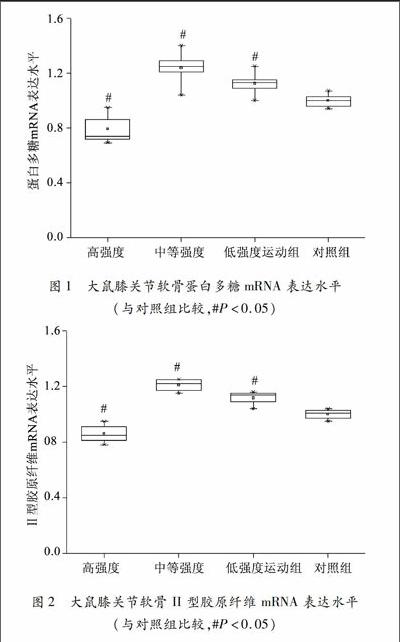
基质和纤维成分是关节的主要组成部分, 主要由软骨细胞合成并分泌。在骨关节炎发病过程中,软骨细胞合成分泌蛋白多糖和II型胶原纤维不足,导致软骨表面破损后不能及时修复,直接引发关节功能降低。为了探索不同强度运动对软骨细胞分泌功能的影响以及自噬在其中的作用,本实验利用 qRT-PCR 法测定了各组大鼠膝关节软骨蛋白多糖和 II 型胶原纤维的 mRNA 表达水平。结果如图1 所示,与对照组相比,低强度和中等强度运动组大鼠膝关节软骨中蛋白多糖mRNA 表达水平明显升高,但高强度运动组显著降低(均为P<005)。 各组大鼠II 型胶原纤维水平变化趋势大致与蛋白多糖相似,低强度和中等强度运动可促使II 型胶原纤维表达水平升高,而高强度运动则显著抑制其表达水平(均为P<005,图2)。
2.3大鼠膝关节软骨自噬水平测定
LC3 是大鼠软骨细胞自噬体形成所必需的组分,在自噬体膜的延长和融合中发挥重要的作用,也因此被视为自噬水平的标志物[11 -12]。Beclin-1 是哺乳动物自噬调控的重要分子,主要参与调节其他自噬蛋白向前自吞噬体膜的募集和定位[13]。为了探讨不同运动强度对大鼠膝关节软骨自噬水平的影响, 本实验利用Western blot 法测定了关节软骨中自噬标志物Beclin-1 和 LC3 的蛋白水平。结果如图 3 所示,与对照组相比,低强度和中等强度运动组大鼠膝关节软骨中 Beclin-1和LC3 的蛋白水平明显升高,而高强度运动组则显著降低(均为P<005)。
3讨论
适当运动有助于维持关节软骨生理功能,而高强度运动可直接引起关节软骨损伤,甚至诱发骨关节炎,然而不同强度运动影响关节软骨功能的机制目前尚未明确[14]。本实验研究发现低强度和中等强度跑台运动可以上调膝关节软骨自噬水平,而高强度跑台运动却显著抑制软骨自噬,软骨细胞分泌功能也出现相同的变化趋势,这说明自噬可能是不同强度运动调节软骨细胞分泌功能的机制之一。
随着现代生活节奏的加快、生活习惯的西方化和户外运动的减少,亚健康群体正在日益扩大。体育运动具有预防和消除亚健康的作用,是促进机体从亚健康状态向躯体健康和心理健康发展的重要手段。近年来,人们主动参加户外活动,提高身心健康水平的意愿愈发强烈,选择适宜的运动强度和方式则成为影响户外活动效果的重要因素[15]。既往研究表明,中等强度有氧运动可以显著改善软骨细胞合成和分泌糖胺多糖, 维持软骨组织正常功能,并具有促进软骨重建的功能[16]。 进一步研究表明,中等强度运动主要通过增加软骨中基质成分(主要为蛋白多糖和 II 型胶原纤维)的表达和合成而实现促进软骨塑性的保护作用[17-19]。本实验利用 SD 大鼠跑台运动构建不同运动强度的动物模型,结果发现低强度和中等强度运动均可促进软骨细胞合成和分泌蛋白多糖和 II 型胶原纤维, 这可能是运动造成软骨磨损和基质消耗后,软骨细胞自身的代偿性保护机制。
[JP+1]自噬是真核细胞中物质分解代谢的主要途径之一,正常细胞中自噬处于较低水平,而当线粒体和内质网等细胞器自然衰老或受损伤后,细胞主动启动自噬相关信号分子,形成自噬体并与溶酶体结合,清除上述细胞器及生物大分子[20]。既往研究表明,适当的自噬水平有助于显著线粒体合成并释放过多的活性氧,并可以维持线粒体功能,防止出现细胞凋亡[21]。本实验发现低强度和中等强度跑台运动可以明显提高软骨组织自噬相关标识蛋白 Beclin-1 和 LC3 的表达水平,这说明适当运动可以提升软骨细胞自噬活性,有助于清除运动中受损的细胞器或细胞外基质,维持软骨组织局部稳态,而软骨组织稳态的维持也是保证软骨细胞代偿性合成并分泌蛋白多糖和 II 型胶原纤维的重要前提和基础。因此,自噬水平的提高可能是低强度和中等强度运动改善软骨代谢的重要机制之一,这为适当运动方式的选择提供了科学的实验依据。[JP]
与低强度和中等强度运动不同,高强度运动主要见于专业运动员。长期从事高强度的冲击性或扭转剪切性运动难免造成膝关节等部位的运动损伤,甚至可以诱发骨关节炎等疾病。膝关节运动损伤主要表现为半月板磨损或撕裂、韧带撕裂或断裂,在上述疾病发生过程中,关节软骨损伤最常见。 关于高强度运动诱发膝关节软骨损伤的机制研究已经发现:高强度运动可以诱导基质金属蛋白酶3表达升高[22],抑制基质金属蛋白酶抑制剂 1 的表达[23],从而促进软骨基质的降解。然而,高强度运动是否影响软骨细胞合成基质成分的能力以及自噬在其中的作用均未完全阐明,本实验结果提示高强度运动可以下调 Beclin-1 和 LC3 蛋白水平,诱导软骨自噬缺陷,这一现象可能会造成软骨组织局部物质分解代谢能力不足,引起受损细胞器和无活性生物大分子蓄积,诱导软骨细胞凋亡,进而加重软骨基质成分合成不足,造成恶性循环,参与运动性软骨损伤和骨关节炎的发病过程[24]。
4总结
综合上述实验结果,低强度和中等强度运动可以诱导软骨自噬活性并发挥一定的保护作用,而高强度运动可引起软骨自噬缺陷继而诱导软骨损伤,这说明不同运动强度对软骨自噬水平的不同调节作用可能是其对软骨功能影响截然不同的机制之一。本研究结果也为进一步探讨自噬在运动相关性软骨损伤和骨关节炎发病过程中的作用提供了一定的科学依据, 而继续研究运动影响自噬的分子机制将是本课题组下一步的研究方向。
参考文献:[HT5"SS]
[1]谈超, 魏伟 骨关节炎的病因研究和治疗的进展[J] 颈腰痛杂志, 2002, 23(2): 166-169
[2]石晓明, 于占革 骨关节炎发病机制的研究进展[J] 中华临床医师杂志:电子版,2013,24(7):11607-11610
[3]刘芳, 吕志刚 骨关节炎发病机制的分子生物学研究进展[J]2004, 30(4): 77-79,82
Mizushima N, Levine B, Cuervo AM,et al Autophagy fights disease through cellular self-digestion[J] Nature, 2008, 451(7182): 1069-1075
[5]Mizushima N Autophagy: process and function[J] Genes & development, 2007, 21(22):2861-2873
[6]Levine B, Klionsky DJ Development by self-digestion: molecular mechanisms and biological functions of autophagy[J] Developmental cell, 2004, 6(4):463-477
[7]Carames B, Taniguchi N, Otsuki S,et alAutophagy is a protective mechanism in normal cartilage, and its aging-related loss is linked with cell death and osteoarthritis[J] Arthritis and rheumatism, 2010, 62(3): 791-801
[8] Carames B, Taniguchi N, Seino D,et alMechanical injury suppresses autophagy regulators and pharmacologic activation of autophagy results in chondroprotection[J] Arthritis and rheumatism, 2012, 64(4): 1182-1192
[9] Bedford TG, Tipton CM, Wilson NC,et al Maxium oxygen consumption of rats and its changes with various experimental procedures[J] Journal of applied physiology, 1979,47(6):1278[LL][HJ195mm]
[10] 马秦, 邱蔚六, 费俭, 等 从人软骨提取总 RNA 和CDMP-1 成熟肽片段的克隆[J] 上海第二医科大学学报, 2000, 20(6): 509-511
[11] Kabeya Y, Mizushima N, Ueno T,et alLC3, a mammalian homologue of yeast Apg8p, is localized in autophagosome membranes after processing[J] EMBO journal, 2000, 19(21):5720-5728
[12]Mann S S, Hammarback J A Molecular characterization of light chain 3 A microtubule binding subunit of MAP1A and MAP1B[J] J biology chemistry,1994, 269(15): 11492-11497
[13]Maiuri MC, Zalckvar E, Kimchi A,et alSelf-eating and self-killing: crosstalk between autophagy and apoptosis[J] Nature reviews molecular cell biology, 2007, 8(9): 741-752
[14]詹荔琼, 党娜, 高美钦, 等 大鼠膝关节软骨与不同强度跑台运动的影响 [J] 中国组织工程研究, 2012, 16(20): 3634-3638
[15]赵宝椿, 李江, 李田 运动干预亚健康研究述评[J] 体育文化导刊,2009(7):34-37,55
[16]唐海峰 大鼠的不同强度运动对早期关节软骨退变影响的实验研究[D]沈阳:中国医科大学,2010
[17] 孟凡强 不同运动负荷所致大鼠关节软骨和滑膜中 comp 表达的改变及其临床意义的研究[D]沈阳:中国医科大学,2012
[18]Hagiwara Y, Ando A, Chimoto E,et alChanges of articular cartilage after immobilization in a rat knee contracture model[J] Journal of orthopaedic research, 2009, 27(2): 236-242
[19]Otterness IG, Eskra JD, Bliven ML,et alExercise protects against articular cartilage degeneration in the hamster[J] Arthritis and rheumatism,1998, 41(11):2068-2074
[20]He C, Klionsky DJ Regulation mechanisms and signaling pathways of autophagy[J] Annual review of genetics, 2009, 43: 67-93
[21]Pattingre S, Tassa A, Qu X,et alBcl-2 antiapoptotic proteins inhibit Beclin 1 -dependent autophagy[J] Cell, 2005, 122(6): 927-939
[22]程宝玉 关节软骨退化性骨性关节炎的修复与运动[J] 中国组织工程与临床康复, 2007,11(49): 9975-9979
[23]邢丹, 马信龙, 马剑雄, 等 不同强度运动对大鼠膝关节软骨 MMP-3、 COL-II、 TIMP-3表达的影响[J] 中华骨科杂志, 2013, 33(2): 171-178
[24]Yang RT, Zhang C, Liu Y,et alAutophagy prior to chondrocyte cell death during thedegeneration of Meckel's cartilage[J]Anatomical record (Hoboken), 2012, 295(5): 734-741

