基于流式细胞术的芒果基因组C值测定
摘 要 以‘串芒、‘象牙22号芒和‘白象牙芒的嫩叶为材料,改进了细胞核提取缓冲液配方, 优化了芒果细胞核提取方法,以基因组C值已知的‘Zea mays L. CE-777为内标,首次建立了适合于芒果的流式细胞术基因组C值测定方法。结果表明:3个芒果品种的二倍体细胞核中DNA含量分别为0.885 821 7、0.884 004 5、0.884 852 5 pg,基因组C值分别为0.433 166 8×109、0.432 278 2×109、0.432 692 9×109 bp;不同芒果品种间的基因组C值无显著差异,但与同科其他种属物种相比差异明显。本研究可为芒果的基因组学研究、细胞生物学研究和种质资源研究提供重要依据。
关键词 芒果;流式细胞术;基因组C值
中图分类号 S667.7 文献标识码 A
Estimation of Genomic C Value of Mangifera indica L.
by Flow Cytometry
LIU Jin, KONG Guanghong, LI Kaixiong, NI Shubang
Yunnan Institute of Tropical Crops, Jinghong,Yunnan 666100,China
Abstract In order to establish the flow cytometry(FCM) method for estimation of mango genomic C value, young leaves of mango cultivar‘Chuanmang,‘Xiangya 22and‘White Xiangyawere used as the materials,based on the improved isolation method and the DNA reference standards from Zea mays L. CE-777. The results showed that the DNA content of diploid mango cultivar ‘Chuanmang,‘Xiangya 22and ‘White Xiangyawas 0.885 821 7 pg,0.884 004 5 pg and 0.884 852 5 pg, respectively,the genomic C value of the three mango cultivars was 0.433 166 8×109 bp,0.432 278 2×109 bp and 0.432 692 9×109 bp, respectively. There was no significant difference in the genomic C value among the three mango cultivars, but there was great difference in that compared with other species in Anacardiaceae family. This study could provide an important reference for the genomic research,cell biology research and germplasm resources research of Mangifera indica L.
Key words Mangifera indica L.;Flow cytometry(FCM);Genomic C value
doi 10.3969/j.issn.1000-2561.2015.09.013
基因组大小(Genome Size)是指某种生物单倍体细胞核或配子中DNA的含量,通常以重量皮克(10-12 g/pg)或核苷酸碱基对数量(109 base pair/Gb)来表示,两者的换算关系为:1 pg=0.978 Gb。由于基因组大小对于每种生物而言是一个常数(Constant),且具有该种的特征(Characteristic),而这2个词都是以字母C开头,因此也常用C值(C-value)来表述某种生物的基因组大小[1]。不同物种的基因组大小存在很大差异,在被子植物中,目前已知的基因组大小差异可达2 000倍左右[2]。基因组大小既与植物的生物学性状存在着较强的相关性[3-4],又与物种的进化位置有一定的关系[5-6],因此已成为近年来的研究热点之一。测定植物基因组大小的传统方法有孚尔根微显影法[7](Feulgen microdensitometry)和化学分析法,流式细胞术(Flow cytometry,FCM)是近年发展起来的新技术,因操作简单、结果准确,其在植物基因组大小预测[8-9]、细胞周期研究[10]、倍性鉴定[11-12]等领域的使用越来越广泛。截至目前,国内外研究者已测定了8 510种植物的基因组C值[2],但相对于共约40万种的植物种类,已被测定基因组C值的仅是其中一小部分。
芒果(Mangifera indica L.)属于漆树科(Anacard
iaceae)杧果属(Mangifera)的高大乔木,也是重要的热带和亚热带水果之一,享有“热带果王”的美誉,已有几千年的栽培历史,主要分布在热带、亚热带国家和地区,中国芒果主要分布在广东、广西、海南、云南、福建等省区[13]。前人的研究表明,尽管芒果是高度杂合体,但目前发现的芒果种质均为二倍体,染色体数目为2n=40,尚未发现有其他倍性的个体[14-15]。由于芒果叶片中含有多种次生代谢物,在细胞核提取和染色过程中存在诸多困难,仅Arumuganathan等[16]于1991年在其研究中提出芒果的基因组大小约为4.39×108 bp,但关于芒果基因组C值流式细胞术测定方法及不同芒果品种基因组C值的研究尚未见相关报道。本研究拟在前期研究的基础上,优化芒果细胞核提取方法和步骤,改进细胞核提取缓冲液配方,首次建立了适用于芒果的流式细胞术基因组C值测定方法,并对3个芒果品种的基因组C值进行测定,为芒果的基因组学研究、细胞生物学研究和种质资源研究提供依据。
1 材料与方法
1.1 材料
1.1.1 待测样品与内标材料 试验于2014年在云南省热带作物科学研究所热带果树研究中心细胞生物学实验室进行。芒果品种‘串芒、‘象牙22号芒、‘白象牙芒的嫩叶采自云南省热带作物科学研究所芒果试验地;内标材料Zea mays L. CE-777由捷克共和国实验植物学研究所(奥洛摩茨)Jaroslav Dolezel惠赠。
1.1.2 仪器与试剂 流式细胞仪型号为BD Accuri C6,荧光染料、尼龙滤膜、鞘液等试剂及耗材分别购自广州吉泰生物科技有限公司和BD医疗器械上海有限公司。
1.2 方法
1.2.1 细胞核提取液配制 为找出测定芒果基因组大小的最佳流式细胞术方法,先后尝试了目前使用范围较广的LB01、Tris-MgCl2、Galbraiths、mG、GPB、WPB、OTTO等多种细胞核提取方法,均未获得成功,OTTO法主要表现为碎片峰过大,而其他方法无法检测到样本峰。因此,在Friedrich[17]和柳觐等[18]方法的基础上对OTTO法的细胞核提取液配方进行了调整,调整后的OTTOⅠ配方为0.1 mol/L柠檬酸+0.02 mol/L Tris+0.6% Tween 20+0.02 mol/L MOPS,OTTOⅡ配方为0.5 mol/L十二水磷酸氢二钠,将二者分别溶解并用0.22 μm滤膜过滤,OTTOⅠ保存在4 ℃,OTTOⅡ于室温保存。
1.2.2 细胞核提取和染色 取长度在3 cm以内的芒果幼叶,剪取1 cm2立即投入盛有1 mL已预冷的OTTOⅠ和0.5 mL OTTOⅡ的塑料培养皿中;用一次性刀片快速切碎后用33 μm的尼龙膜过滤至1.5 mL的EP管中,确保切碎及过滤总耗时不超过45 s,在4 ℃、600 r/min下离心5 min后将上清液吸出丢弃;再加入1 mL已预冷的OTTOⅠ,将EP管缓慢颠倒3次混匀,然后再次于4 ℃、600 r/min下离心5 min,将上清吸出至EP管内残余200 μL为止;再依次加入800 μL OTTOⅡ溶液、2.5 μL 10 mg/mL的RNase和30 μL 2 mg/mL的PI,将EP管缓慢颠倒3次混匀,避光放入4 ℃的冰箱种孵育5 min。若一批制备的样品较多,在将孵育后的细胞核悬液染色后上机测试前可在4 ℃放置2 h,超过2 h荧光信号会明显衰减且杂质峰较多,需重新制样。
1.2.3 流式细胞术检测 将制备好的‘串芒、‘象牙22号芒、‘白象牙芒和‘Zea mays L. CE-777细胞核悬浮液分别上机测试,初步确定其在585 nm(FL2)下细胞核的荧光强度。分别制备‘串芒﹢‘Zea mays L. CE-777、‘象牙22号芒﹢‘Zea mays L. CE-777和‘白象牙芒﹢‘Zea mays L. CE-777的细胞核混合悬液各18份, 测定混合悬液中的各样本峰在585 nm (FL2)下细胞核的荧光强度,每样品至少收集20 000个细胞核。
1.3 数据分析
1.3.1 基因组C值换算 在流式细胞术测定中,因PI是非特异性荧光染料,能均匀地插入双核苷酸的碱基对中,细胞核中的DNA含量与结合在其上的PI荧光染料数量成正比,而PI染料的数量直接表现为荧光强度的大小,即细胞核DNA含量(基因组C值)与荧光强度成正比。计算方法为:待测样品基因组C值=内标样品基因组C值×(待测样品荧光强度/内标样品荧光强度)[18]。
1.3.2 数据收集及分析 运用CFlow Plus 1.0.264.15软件进行数据收集,用Microsoft Excel 2003和SPSS16.0进行数据统计分析。
2 结果与分析
2.1 芒果样品与内标样品荧光强度范围的确定
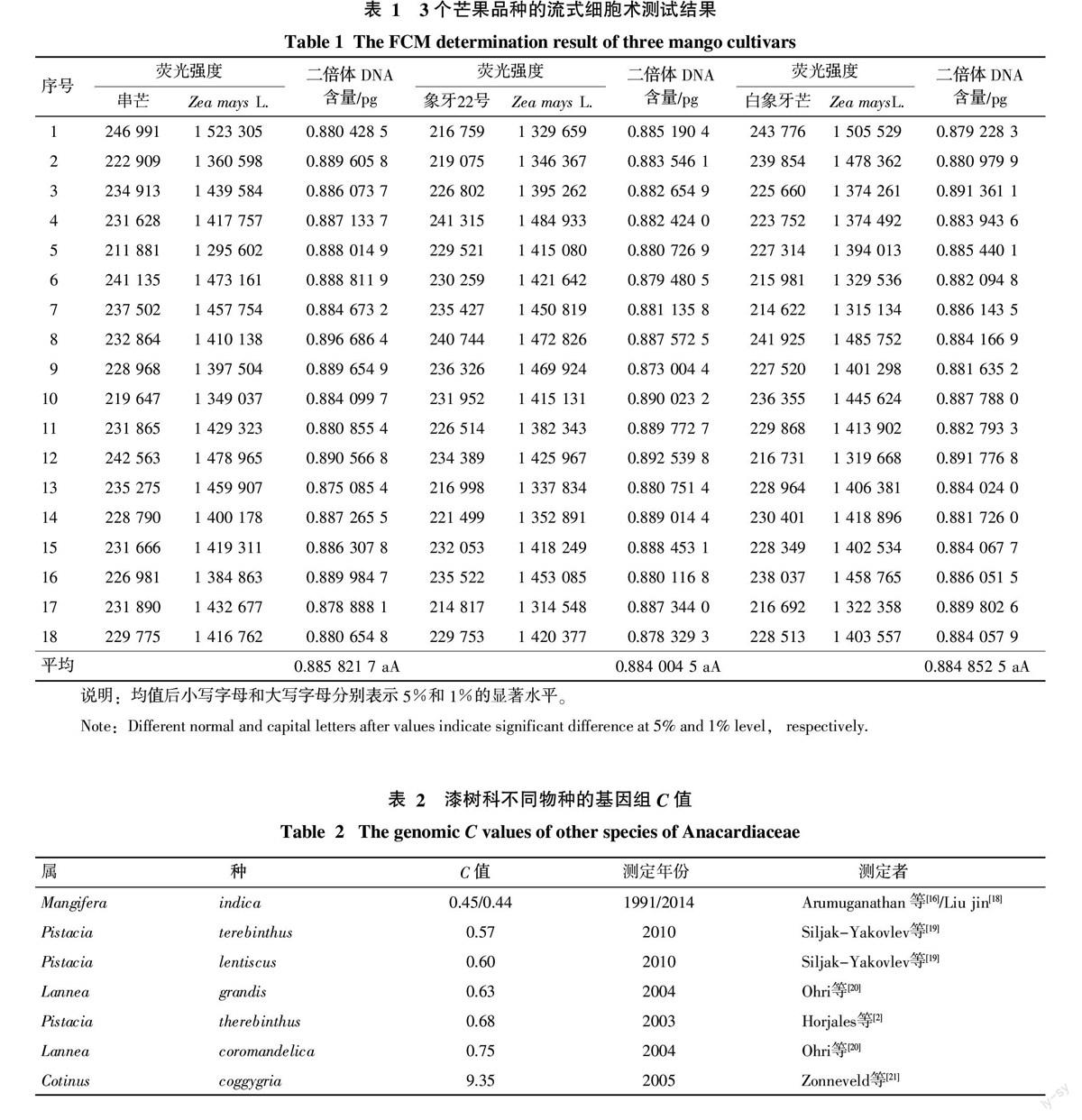
将制备好的‘串芒、‘象牙22号芒、‘白象牙芒和‘Zea mays L. CE-777细胞核悬浮液分别上机测试,初步确定3个待测芒果品种与内标的荧光强度范围,为下一步内标混合样测试提供参考。以‘串芒为例(图1-A),其和内标‘Zea mays L. CE-777(图1-B)的细胞核在585 nm(FL2)下的荧光强度分别是236 207和1 340 517,内标的荧光强度约为待测芒果样本的5.68倍,而荧光强度则表现为流式细胞术检测图中峰的位置,由此可确定芒果与内标的混合样品在流式细胞术检测图中峰的位置无重叠,且区分度良好。在后续的内标混合样流式细胞术检测图中,代表芒果细胞核的峰应位于流式细胞术检测图的左侧,而代表内标Zea mays L. CE-777的峰应位于其右侧。
2.2 芒果基因组C值的确定
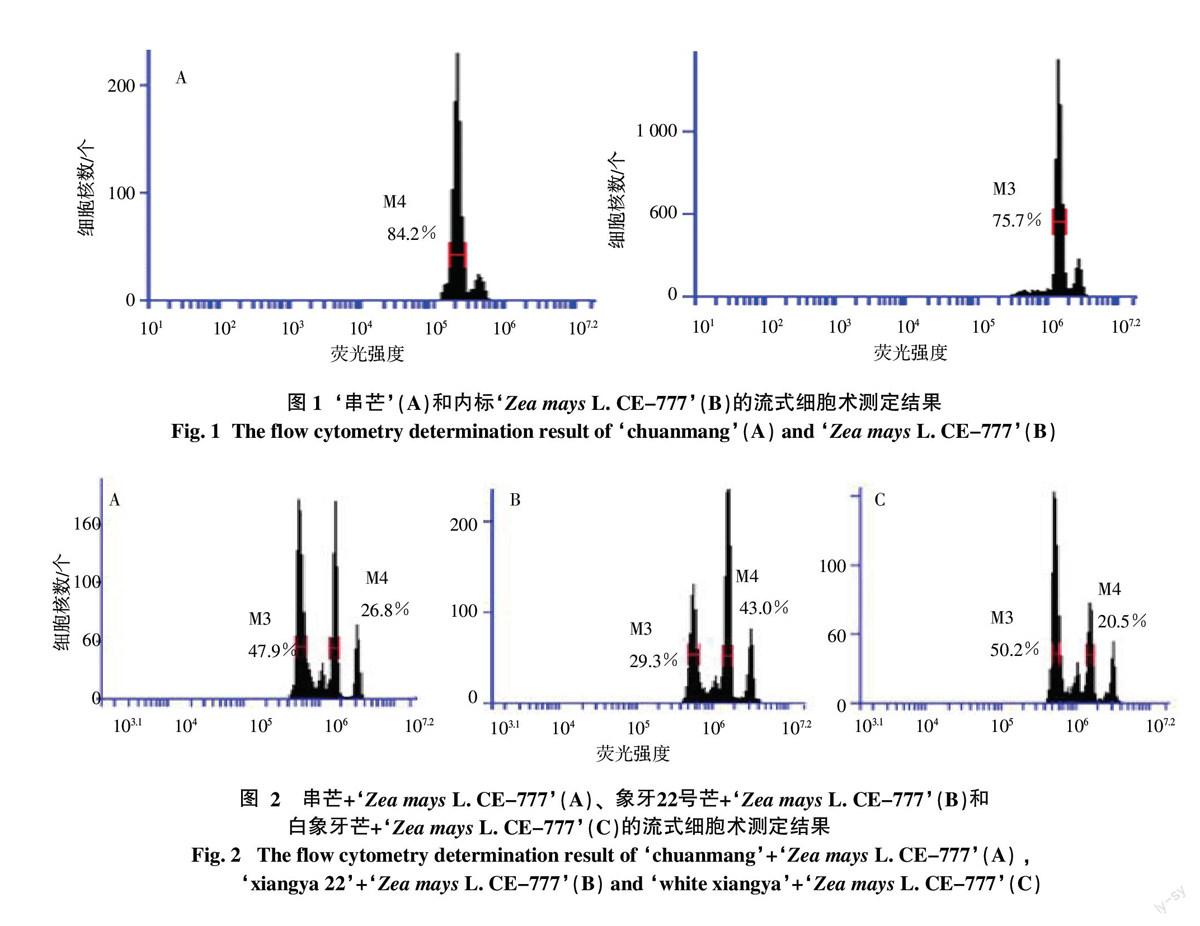
分别将‘串芒﹢‘Zea mays L. CE-777‘、‘象牙22号芒﹢‘Zea mays L. CE-777和‘白象牙芒﹢‘Zea mays L. CE-777的细胞核混合悬液各18份上机测试,测试结果如图2所示,每个芒果品种分别以其中1份样品为例。由2.1的测试结果可知,在图2中,左侧的峰为待测芒果细胞核,右侧的峰为内标‘Zea mays L. CE-777细胞核,2个峰在横轴的位置代表各自细胞核的荧光强度。因细胞核DNA含量(基因组C值)与荧光强度成正比,而内标的基因组C值是已知的,因此可根据待测样品与内标荧光强度的比例来计算待测芒果样本的基因组C值。
Dolezel等[8]研究结果表明,内标‘Zea mays L. CE-777为二倍体,其细胞核DNA含量为2C=5.43 pg。从表1中3个芒果品种各18份内标混合样的测试结果可以看出,‘串芒、‘象牙22号芒、‘白象牙芒的二倍体细胞核中DNA含量为0.885 821 7、0.884 004 5、0.884 852 5 pg,对应的单倍体细胞核DNA含量则分别为为0.442 910 9、0.442 002 3 、0.442 426 3 pg。按1 pg DNA=0.978×109 bp计算,‘串芒、‘象牙22号芒、‘白象牙芒的基因组C值为0.433 166 8×109 、0.432 278 2×109、0.432 692 9×109 bp。利用t检验对3个芒果品种的测试结果进行了比较,发现其基因组大小无显著性差异,说明基因组大小在同一物种内是一个相对恒定的参数。
2.3 与近缘物种基因组C值的比较
芒果属于漆树科植物。漆树科包含66个属500余个种,但目前已被测定基因组大小的仅有7个种(表2),其中基因组C值最小的是芒果(0.44 pg),最大的是观赏树种Cotinus coggygria Scop.(黄栌)(9.35 pg),说明即便是归属于同一科,不同种属物种间基因组C值也存在较大变异,其变异原因需要进一步的进化生物学证据来阐明。
3 讨论与结论
基因组大小测定的传统方法是化学分析法和Feulgen染色法,化学分析法由于受细胞周期的影响,即处于不同周期的细胞其DNA含量不一致,测定结果也会出现相应的偏差[22];Feulgen染色法相对精确,但操作过程过于繁琐且需要较为熟练的操作技能。与传统方法相比,流式细胞术测定法从制样到上机获取数据仅需十几分钟,且结果准确、重现性高。但由于不同物种的叶片结构和次生代谢物组成均不相同,与其对应的细胞核提取液和提取方法也有所不同,可见细胞核提取是流式细胞术的关键步骤。在本研究中,笔者先后尝试了目前使用范围较广的LB01、Tris-MgCl2、Galbraiths、mG、GPB、WPB、OTTO等多种细胞核提取方法,均未获得成功。仅OTTO法可偶尔看到样本峰,但重现性差,且受细胞碎片、次生代谢物等干扰,无法实现精确定量。因此,笔者在柳觐等[18]研究的基础上,再次改进了细胞核提取缓冲液配方,优化了芒果细胞核提取方法和步骤,首次建立了一种适合于芒果的流式细胞术基因组C值测定方法,并取得了良好的效果。
内标样品的选择是流式细胞术测定结果可靠的关键因素。本研究选用了Dolezel等[8]推荐的Zea mays L. CE-777作为对照样品,且通过试验证明,该对照样品与待测芒果样品的流式细胞术检测峰区分度良好、无重叠,可确保试验结果的准确性,因此,本结果具有较高的可靠性。同时,本研究与Arumuganathan等[16]的测定结果也相对一致,Arumuganathan等[16]认为芒果的基因组大小约为0.439×109 bp,造成测定结果存在细微差别的原因可能是所用的测试方法、内标样品和供试芒果品种均不相同。本研究同时测定了‘串芒、‘象牙22号芒、‘白象牙芒3个芒果品种的基因组C值,发现3个品种间无显著差异,说明基因组大小在同一物种内是一个相对恒定的参数。本研究发现,芒果与其他已知的漆树科物种基因组C值差异较大,这可能与不同物种在进化过程中为适应其生存环境所经历的自然突变、多倍化等进化过程有关。
基因组C值是物种最重要的遗传参数之一,芒果作为中国重要的热带水果,其不同品种的基因组C值在国内外尚未见报道,本研究测定的不同品种基因组C值对芒果的起源进化研究和基因组学研究具有重要意义。此外,运用本研究建立的方法可以实现其他芒果品种或杧果属不同物种基因组C值的快速准确测定,该方法亦可广泛用于芒果的种质资源评价、倍性鉴定和突变体筛选等。
参考文献
[1] Greilhuber J, Dolezel J, Lysak M, et al. The origin, evolution and proposed stabilization of the terms genome size and C-value to describe nuclear DNA content[J]. Annals of Botany, 2005, 95(1): 255-260.
[2] Royal Botanic Gardens. Kew: Plant DNA C-values Database[DB/OL]. (2014-09-01)http//: data.kew.org/cvalues.
[3] Beaulieu J M, Leitch I J, Patel S, et al. Genome size is a strong predictor of cell size and stomatal density in angiosperms[J]. New Phytologist, 2008, 179(4): 975-986.
[4] Gruner A, Hoverter N, Smith T, et al. Genome size is a strong predictor of root meristem growth rate[J]. Journal of Botany, 2010, 2010: 1-4.
[5] Biemont C. Genome size evolution: within-species variation in genome size[J]. Heredity, 2008, 101(4): 297-298.
[6] Petrov D A. Evolution of genome size: new approaches to an old problem[J]. Trends in genetics, 2001, 17(1): 23-28.
[7] Baranyi M, Greilhuber J. Flow cytometric and Feulgen densitometric analysis of genome size variation in Pisum[J] Theoretical and Applied Genetics, 1996, 92(3-4): 297-307.
[8] Dolezel J, Greilhuber J, Suda J. Estimation of nuclear DNA content in plants using flow cytometry[J]. Nature Protocols, 2007, 2(9): 2 233-2 244.
[9] Loureiro J, Rodriguez E, Dolezel J, et al. Two new nuclear isolation buffers for plant DNA flow cytometry: a test with 37 species[J]. Annals of Botany, 2007, 100(4): 875-888.
[10] Galbraith D W, Harkins K R, Maddox J M, et al. Rapid flow cytometric analysis of the cell cycle in intact plant tissues[J]. Science, 1983, 220(4 601): 1 049-1 051.
[11] Arumuganathan K, Earle E D. Estimation of nuclear DNA content of plant by flow cytometry[J]. Plant Molecular Biology Reporter, 1991, 9(3): 229-241.
[12] 柳 觐, 孔广红, 倪书邦,等. 澳洲坚果多倍体的化学诱导及流式细胞术鉴定[J]. 热带作物学报, 2013, 34(11): 2 138-2 144.
[13] 马蔚红, 姚全胜, 孙光明. 芒果种质资源果实重要经济性状多样性分析[J]. 热带作物学报, 2005, 26(3): 7-11.
[14]莫 侥, 罗远华, 周世民, 等. 几个芒果品种的胚性及多胚苗遗传分析[J]. 热带亚热带植物学报, 2005, 13(6): 475-479.
[15]黄镜浩, 王松标, 马蔚红, 等. 秋水仙碱对芒果茎尖的诱变作用[J]. 西南大学学报(自然科学版), 2006, 28(6): 926-929.
[16] Arumuganathan K, Earle E D. Nuclear DNA content of some important plant species[J]. Plant Molecular Biology Reporter,1991, 9(3): 208-218.
[17] Friedrich O. DAPI staining of fixed cells for high-resolution flow cytometry of nuclear DNA[J]. Methods in Cell Biology,1990, 33: 105-110.
[18] 柳 觐, 孔广红, 倪书邦, 等. 基于流式细胞术的澳洲坚果基因组C值测定[J]. 中国农学通报, 2013, 29(34): 96-101.
[19] Siljak-Yakovlev S, Pustahija F, Solic E M, et al. 2010. Towards a genome size and chromosome number database of Balkan flora: C-values in 343 taxa with novel values for 242[J]. Journal of Computational and Theoretical Nanoscience, 2010, 3(2): 190-213.
[20] Ohri D, Bhargava A, Chatterjee A. Nuclear DNA amounts in 112 species of tropical hardwoods-New estimates[J]. Plant Biology, 2004, 6(5): 555-561.
[21] Zonneveld B J M, Leitch I J, Bennett M D. First nuclear DNA amounts in more than 300 angiosperms[J]. Annals of Botany, 2005, 96(2): 229-244.
[22]弓 娜, 田新民, 周香艳, 等. 流式细胞术在植物学研究中的应用——检测植物核DNA含量和倍性水平[J]. 中国农学通报, 2011, 27(9): 21-27.

