香蕉和土壤中吡唑醚菌酯的残留分析
赵方方等
摘 要 建立吡唑醚菌酯在香蕉全蕉、蕉肉及土壤中的残留分析方法,测定吡唑醚菌酯在云南、海南两地香蕉及土壤中的残留动态及最终残留。结果表明:在0.01~0.1 mg/kg添加范围内,吡唑醚菌酯在香蕉果、肉、土中的平均回收率为82%~104%,变异系数为1.3%~3.6%;方法最小检出量为1×10-10 g,最低检出浓度为0.01 mg/kg。吡唑醚菌酯在云南和海南两地香蕉中的半衰期分别为17.2、16.7 d,在土壤中的半衰期分别为19.9、17.9 d。施药后35、42、49 d收获的香蕉中吡唑醚菌酯残留量均低于0.02 mg/kg。该方法准确度高,灵敏度高,线性良好。
关键词 吡唑醚菌酯;香蕉;土壤;液相色谱;消解;残留
中图分类号 TQ450 文献标识码 A
Residue Analysis of Pyraclostrobine in Banana and Soil
ZHAO Fangfang, ZHANG Yue, Lü Daizhu, XIE Defang
Analysis & Testing Center, Chinese Academy of Tropical Agricultural Sciences / Hainan Provincial Key
Laboratory of Quality and Safety for Tropical Fruits and Vegetables, Haikou, Hainan 571101, China
Abstract The method for the determination of pyraclostrobine residues in banana fruit, flesh and soil was established. Residue analysis of pyraclostrobine in banana and soil were determined. The field experiments were investigated in Yunnan and Hainan. Average recoveries of pyraclostrobine in banana fruit, flesh and soil were found in the range of 82%~104% at the three spiking levels from 0.01 to 0.1 mg/kg with relative standard deviations of 1.3%~3.6%. The lowest detection limit of instrument for pyraclostrobine was 1×10-10 g, and the limit of quantitation was 0.01 mg/kg. The experiments results demonstrated that the half-lives for banana was 17.2 d in Yunnan, and 16.7 d in Hainan, respectively. And the half-lives for soil was 19.9 d in Yunnan, and 17.9 d in Hainan, respectively. The residue of pyraclostrobine was <0.02 mg/kg in banana, after 35, 42 and 49 d of spray. The method showed high accuracy, high sensitivity and good linearity. The experiments provide scientific basis for evaluating the safety and rationality of using pyraclostrobine in banana.
Key words Pyraclostrobine; Banana; Soil; HPLC; Degradation; Residue
doi 10.3969/j.issn.1000-2561.2015.09.024
吡唑醚菌酯(Pyraclostrobine)化学名称为N-[2-[[1-(4-氯苯基)吡唑-3-基]氧甲基]苯基]-N-甲氧基氨基甲酸甲酯,是由德国巴斯夫公司于1993年开发的兼具吡唑结构的甲氧基丙烯酸酯类杀菌剂[1],能有效防治多种由真菌病原引起的病害如叶枯病、锈病、白粉病、霜霉病等[2]。现已在我国广泛应用于谷物、蔬菜、水果等作物上的病害防治[3-7]。其中,吡唑醚菌酯在防治香蕉黑星病和叶斑病等病害中发挥了积极作用[8-9]。吡唑醚菌酯的广泛使用随之带来的在香蕉等作物及土壤中的残留及安全性受到广泛关注。我国规定吡唑醚菌酯在香蕉中的MRL低至0.02 mg/kg(GB 2763-2014)。
目前,吡唑醚菌酯的检测方法主要采用高效液相色谱法[10-11]、气相色谱法[12]、液相色谱-串联质谱法[13-14]、气相色谱-串联质谱[15]以及表面等离子体共振生物传感技术[16]等。但主要集中在白菜、西瓜、葡萄、草莓等作物上吡唑醚菌酯的研究[4-7]。而在香蕉和土壤中的残留检测技术和残留消解行为尚未见文献报道。鉴于此本研究建立了吡唑醚菌酯在香蕉和土壤中残留及消解动态的高效液相色谱分析方法,并于云南和海南两地进行了田间试验,以期为评价吡唑醚菌酯在香蕉上的安全使用,确保该药的科学合理使用提供理论依据,同时也为吡唑醚菌酯在香蕉上的农药登记提供重要参考。
1 材料与方法
1.1 材料
Waters液相色谱仪(2695紫外检测器);T18高速分散均质机(德国IKA集团);R-210旋转蒸发仪(瑞士Buchi公司);万分之一天平(SHIMAZU);微型旋涡混合仪(上海沪西分析仪器厂有限公司);Strata/NH2固相萃取柱(55 μm, 70 A)500 mg/6 mL;Carbon/NH2固相萃取柱(55 μm, 70 A)500 mg/6 mL;吡唑醚菌酯标准品(德国 Dr.Eh-renstorfer GmbH 公司,纯度99.0%);甲醇、乙腈、正己烷、丙酮(色谱纯);氯化钠(140 ℃烘烤4 h)。试验药剂:吡唑醚菌酯悬浮剂。田间试验香蕉品种:海南为泰国香蕉,云南为巴西香蕉。海南试验地点:海口市;云南试验点:玉溪市。
1.2 方法
1.2.1 田间试验设计 (1)消解动态试验。本试验采取一次施药多次取样的方式进行试验。在香蕉生长状态BBCH编号为70(Growth stages of mono-and dicotyledonous plants)时以1.5倍推荐剂量(250 mg a.i/kg)对香蕉及土壤各均匀喷雾1次,香蕉每小区3株(土壤每小区20 m2),3次重复,对照区施以清水,施药后2 h、1 d、3 d、7 d、14 d、21 d、28 d、35 d、42 d、60 d取样品待测。
(2)最终残留试验。在香蕉生长状态BBCH编号分别为65、69、71、72时以推荐剂量(166.7 mg a.i/kg)、1.5倍推荐剂量(250 mg a.i/kg)施药3、4次,施药间隔10 d。每小区3株香蕉,3次重复,对照区施以清水,末次施药后间隔35、42、49 d分别采集全蕉、蕉肉和土壤样品待测。
(3)样品的制备。①随机采集香蕉树上(不同方向及上、中、下、里、外等不同部位)12条以上已着药的香蕉个体,对香蕉计个数和称量后,将全蕉匀浆混匀(蕉肉:用刀具和刮刀取出蕉肉匀浆),四分法缩分后取250 g样品,-20 ℃冰箱冷冻保存。②土壤样品采用棋盘式选择6~12个点,每点以往复旋转的方式将土钻压入15 cm深度采集土壤,每个重复采集样本1~2 kg,将土壤样品碾碎后过筛,充分混匀后,四分法分取200 g样品,-20 ℃冰箱冷冻保存。
1.2.2 样品分析 (1)提取。香蕉样品:称取20.0 g粉碎的样品置于烧杯中,加入40.0 mL乙腈,高速匀浆2 min后过滤到预装有5~7 g NaCl的具塞量筒(100 mL)中,盖上塞子,剧烈震荡2 min后室温下静置30 min。吸取上清液10.0 mL至100 mL圆底烧瓶中,旋转蒸发至干,加入5.0 mL正己烷-丙酮(60 ∶ 40,V/V)溶解混匀,待净化。
土壤样品:称取20.0 g样品置于200 mL具塞塑料瓶中,加入40.0 mL乙腈,在往复式振荡器上振荡提取30 min,过滤,收集滤液于具塞量筒内,其余步骤同上。
(2)净化。5.0 mL正己烷-丙酮(60 : 40,V/V)溶液预淋洗Strata/NH2固相萃取小柱,当溶剂液面到达柱吸附层表面时,立即倒入待净化液,用100 mL圆底烧瓶收集;用5.0 mL正己烷-丙酮(60 ∶ 40,V/V)冲洗圆底烧瓶残留物后淋洗萃取小柱,重复3次。收集液旋转蒸发至干,2.5 mL色谱甲醇定容,经滤膜(0.22 μm)过滤后待测。
(3)检测条件。液相色谱柱:SunfireTM C18 (4.6 mm×150 mm, 5 μm);紫外检测波长278 nm;流速:1 mL/min;柱温35 ℃;进样量10 μL;流动相:乙腈-水。梯度洗脱程序见表1。
2 结果与分析
2.1 前处理条件的选择
吡唑醚菌酯是一种极性农药,其溶解度为:20 ℃下,二氯甲烷中溶解度≥57 g/100 mL,丙酮中≥65 g/100 mL,乙腈中≥50 g/100 mL;但由于二氯甲烷沸点较低,对环境和实验人员污染较大;丙酮毒性低,但其共萃物较多;因此,选择乙腈作为提取溶剂。对样品的净化,本研究选用NH2和Carbon/NH2固相萃取柱。香蕉全蕉加标0.1 mg/kg及空白样品的净化色谱图如图1所示。可知,两种萃取柱均可与杂质较好分离;Carbon/NH2净化后杂质峰较少,但是目标物的响应值(峰面积)明显降低,回收率仅为35.5%,而NH2柱净化后,回收率达到95%以上,因此选择NH2柱净化。
2.2 HPLC条件的优化
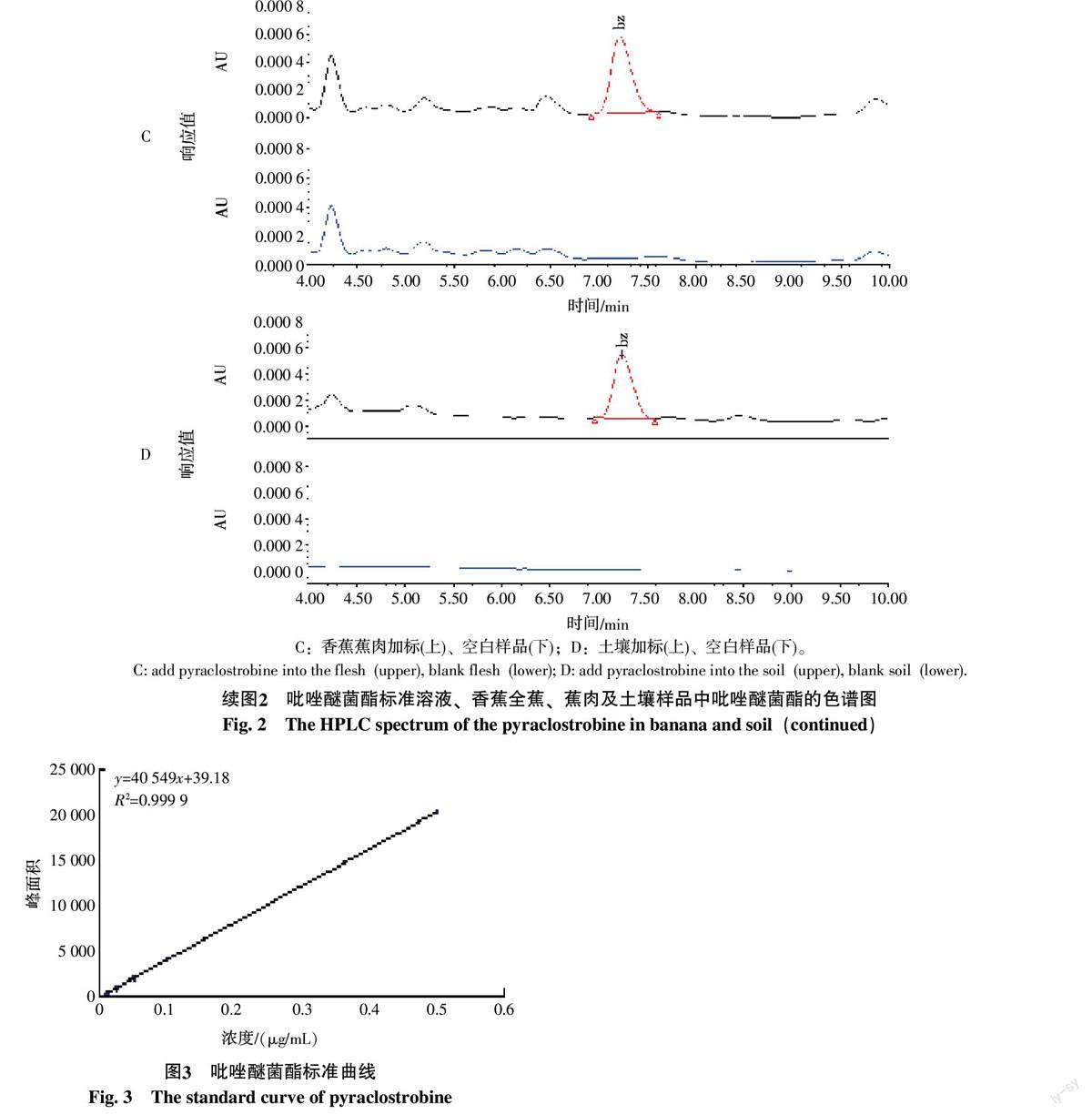
吡唑醚菌酯在紫外检测波长278 nm时响应值最大,因此紫外检测波长选择278 nm。吡唑醚菌酯标准溶液(0.5 μg/mL)、香蕉全蕉、蕉肉和土壤的空白样品及添加回收样品的液相色谱图见图2。样品先以V乙腈 ∶ V水=65 ∶ 35为流动相运行9 min,再调整其体积比为90 ∶ 10进行测定,吡唑醚菌酯在香蕉全蕉、蕉肉和土壤中均与杂质得到了良好的分离(图2-B、C、D);可以看到,吡唑醚菌酯保留时间为7.20 min。
2.3 标准曲线及线性范围
用甲醇做溶剂,以 0.01、0.025、0.05、0.1、0.5 μg/mL标准溶液绘制标准曲线(图3)。由图3可见,吡唑醚菌酯在0.01~0.5 μg/mL的范围内线性良好,相关系数为0.999 9。
2.4 方法准确度、精密度及灵敏度
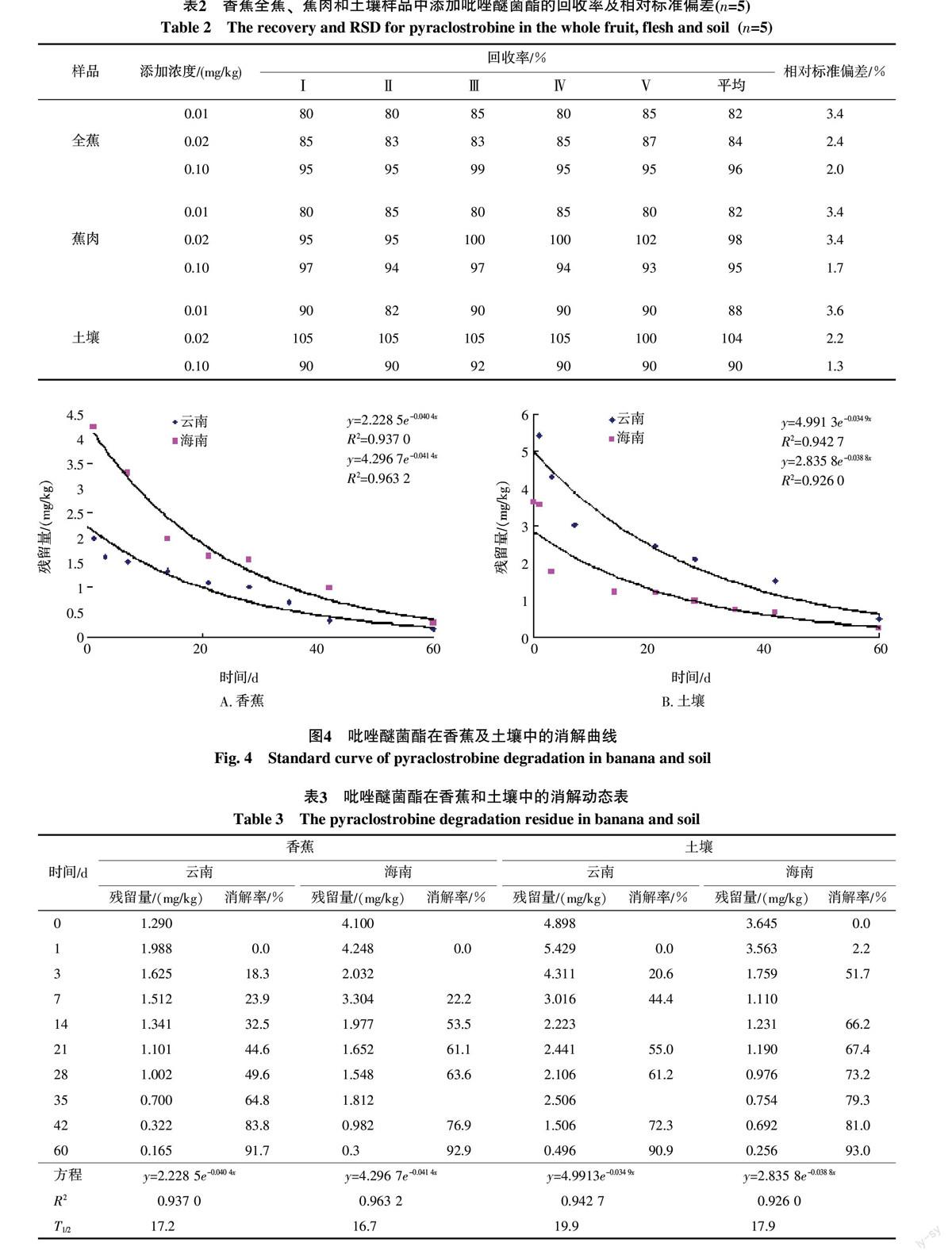
2.4.1 准确度及精密度 在香蕉全蕉、蕉肉和土壤空白样品中添加吡唑醚菌酯标准溶液测定回收率,结果如表2所示。3个添加水平在香蕉全蕉中平均回收率为82%~96%,相对标准偏差为2.0%~3.4%,在蕉肉中平均回收率为82%~98%,相对标准偏差为1.7%~3.4%,在土壤中平均回收率为88%~104%,相对标准偏差为1.3%~3.6%。回收率以及相对标准偏差均在农药残留试验准则允许范围内[17],方法的重复性好,可满足残留分析的要求。
2.4.2 方法灵敏度 方法的灵敏度采用最小检出量和最低检出浓度来表示。以一定量的吡唑醚菌酯标准溶液进样,按3倍噪音所需待测物的浓度计算(进样量10 μL,标准液浓度0.01 μg/mL),吡唑醚菌酯最小检出量为1×10-10 g。在空白样品中添加一定量的吡唑醚菌酯标准溶液,按10倍噪音所需待测物的浓度计算(以mg/kg为单位),香蕉全蕉、蕉肉及土壤中最低检出浓度均为0.01 mg/kg,方法灵敏度符合吡唑醚菌酯农药残留量分析要求。
2.5 吡唑醚菌酯在香蕉和土壤中的消解动态
按照1.2.1-(1)与1.2.1-(2)方法进行施药,同步采集样品进行测定,云南和海南两地的吡唑醚菌酯降解曲线见图4、消解动态表见表3。从图4可见,消解规律符合一级动力学模型,在香蕉中的消解动态方程分别为:云南:y=2.228 5e-0.040 4x,R2=0.937 0,T1/2=17.2 d;海南:y=4.296 7e-0.041 4x,R2=0.963 2,T1/2=16.7 d;在土壤中的消解动态方程分别为:云南:y=4.991 3e-0.034 9x,R2=0.942 7,T1/2=19.9 d;海南:y=2.835 8e-0.038 8x,R2=0.926 0,T1/2=17.9 d。施药后60 d,吡唑醚菌酯在云南、海南两地香蕉上的降解率分别为91.7%和92.9%;在土壤上施药后60 d的降解率分别为90.9%和93.0%。
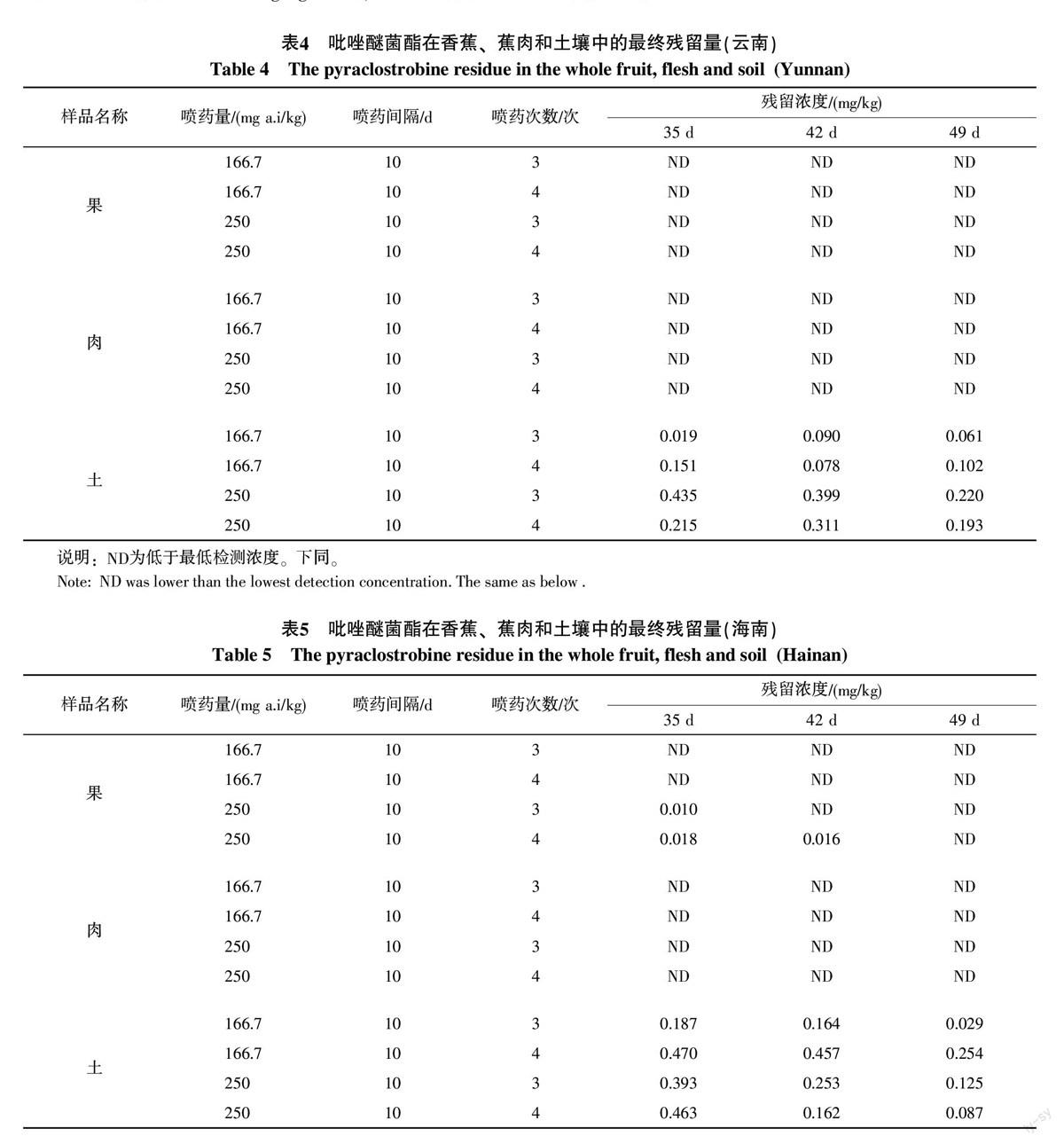
2.6 吡唑醚菌酯在香蕉和土壤中的最终残留
按照试验设计,香蕉和土壤中吡唑醚菌酯的最终残留量见表4和表5。可知,在最后1次施药后35、42和49 d时,吡唑醚菌酯在云南香蕉及蕉肉中的残留量均小于0.01 mg/kg。吡唑醚菌酯在海南香蕉及蕉肉中的残留量分别为:在最后1次施药后35 d时为0~0.018 mg/kg之间;42 d时为0~0.016 mg/kg;49 d时小于0.01 mg/kg。
在距最后1次施药后的第35、42、49天或以后收获香蕉,此时收获的香蕉及蕉肉中吡唑醚菌酯的残留量均未超过0.02 mg/kg(GB 2763-2014中规定吡唑醚菌酯在香蕉中的最大允许残留限量为0.02 mg/kg)。即收获香蕉时距末次喷药35、42、49 d均为安全。
3 讨论与结论
本研究经过优化对比,建立了香蕉和土壤中吡唑醚菌酯残留及消解动态的高效液相色谱分析方法(2 489紫外检测器)。由于吡唑醚菌酯极性较强,提取时常选用丙酮、二氯甲烷、乙腈作为提取溶剂。其中丙酮毒性较低,但共萃物较多;二氯甲烷毒性与乙腈相当,但二氯甲烷沸点低,对实验人员和环境危害较大;因此,选择乙腈作为提取溶剂,而且它在饱和NaCl溶液的存在下可增强其离子化效应,使其与水更好更快的分层,同时也使农药目标物更完全地溶于乙腈中,除去溶于水的一部分干扰杂质,以便进行下一步的净化。
对样品的净化,本研究选用氨基(NH2)和碳黑-氨基(Carbon/NH2)固相萃取柱。由实验结果可知,Carbon/NH2柱净化后杂质峰较少,但是目标物的峰面积明显降低,回收率仅为35.5%,这可能是因为Carbon/NH2固相萃取柱内填充了高纯的石墨化碳颗粒,可同时降低干扰物及目标物的响应值,因此,本实验选择NH2固相萃取柱,该柱对香蕉样品中吡唑醚菌酯具有良好的净化效果,回收率完全满足农药残留分析的要求。
在设定的色谱条件下,样品的最小检出量为1×10-10 g,最低检出浓度为0.01 mg/kg,样品平均添加回收率为82%~104%,相对标准偏差为1.3%~3.6%;方法的灵敏度、精密度和回收率均符合农药残留分析的要求。参照国家香蕉中吡唑醚菌酯的残留限量标准(GB 2763-2014中规定吡唑醚菌酯在香蕉中的最大允许残留限量为0.02 mg/kg),本方法完全适用于香蕉及土壤中吡唑醚菌酯残留分析。
吡唑醚菌酯在云南和海南两地香蕉中的半衰期分别为17.2 d和16.7 d,在土壤中的半衰期分别为19.9 d和17.9 d。在云南和海南两地的最终残留结果表明,按推荐剂量和1.5倍推荐剂量,对香蕉进行3次和4次喷药,末次施药后35、42、49 d采样,在香蕉及蕉肉中吡唑醚菌酯的残留量均<0.02 mg/kg。本研究为评价吡唑醚菌酯在香蕉上的安全使用,确保该药的科学合理使用均提供了重要参考依据。
参考文献
[1] 李亮亮, 王明林, 于建垒, 等. 60%唑醚·代森联WG在大蒜及土壤中的残留[J]. 农药, 2013, 52(2): 116-118.
[2] 吴 迪, 聂向云, 张希跃, 等. 土壤中吡唑醚菌酯的残留分析方法和消解动态研究[J]. 农药科学与管理, 2012, 33(7): 25-28.
[3] 吴 迪, 莘 婧, 潘洪吉, 等. 凝胶渗透色谱-固相萃取-高效液相色谱法测定花生中的吡唑醚菌酯残留[J]. 农药学学报, 2012, 14(6): 681-684.
[4] 张少军, 郑振山, 陈勇达, 等. 杀菌剂吡唑醚菌酯在大白菜上的残留动态[J]. 中国蔬菜, 2011(18): 77-80.
[5] 张志勇, 王冬兰, 刘贤进, 等. 西瓜与土壤中吡唑醚菌酯残留的分析方法[J]. 安徽农业科学, 2010, 38(34): 19 386-19 387.
[6] 李瑞娟, 于建垒, 宋国春.葡萄和土壤中吡唑醚菌酯的高效液相色谱残留分析方法[J]. 农药科学与管理, 2010, 31(6): 33-36.
[7] 张志恒, 李红叶, 吴 珉, 等. 百菌清、腈菌唑和吡唑醚菌酯在草莓中的残留及其风险评估[J]. 农药学学报, 2009, 11(4): 449-455.
[8] 彭埃天, 李 鑫, 刘景梅, 等. 25%吡唑醚菌酯乳油对香蕉黑星病毒力测定与防治试验[J]. 植物保护, 2008, 34(2): 134-137.
[9] 洪胜福. 香蕉黑星病发生规律及其防治技术[J]. 福建热作科技, 2010, 35(2): 14-15.
[10]李瑞娟, 于建垒, 宋国春, 等. 60%唑醚·代森联水分散粒剂中吡唑醚菌酯在葡萄和土壤中的残留分析[J]. 环境化学, 2010, 29(4): 619-622.
[11]闫晓阳, 徐金丽, 徐光军, 等. 高效液相色谱法检测吡唑醚菌酯在烟叶和土壤中的残留及消解动态[J]. 农药学学报, 2013, 15(5): 528-533.
[12] 王 岩, 姚威风, 梁 爽, 等. 甘蓝和土壤中吡唑醚菌酯·烯酰吗啉残留分析[J]. 农药, 2011, 50(1): 46-57.
[13] 洪文英, 吴燕君, 章 虎, 等. 嘧菌酯和吡唑醚菌酯在黄瓜中的残留降解行为及安全使用技术[J]. 浙江农业学报, 2012, 24(3): 469-475.
[14]张育乐, 黄超群, 朱晓雨, 等. 固相萃取-液相色谱-串联质谱法测定中药材中7种甲氧基丙烯酸酯类杀菌剂的残留量[J]. 色谱, 2013, 31(3): 264-269.
[15] Viňas P, Campillo N, Martínez-Castillo N, et al. Method development and validation for strobilurin fungicides in baby foods by solid-phase microextraction gas chromatography-mass spectrometry[J]. J Chromatogr A, 2009 (1): 140-146.
[16] Mauriz E, Garcia-Fernandez C, Mercaderj V, et al. Direct surface plasmon resonance immunosensing of pyraclostrobin residues in untreated fruit juices[J]. Anal Bioana Chem, 2012, 404(10): 2 877-2 886.
[17] NY/T 788-2004农药残留试验准则[S]. 北京: 中国农业出版社, 2004: 5.

