绿绒海芋Alocasia micholitziana的组织培养及其植株再生的研究
杨建芬 郭彭斐 张兵划 张寿洲
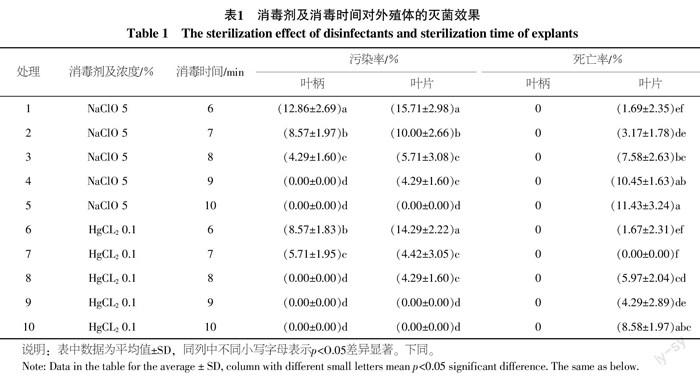
摘 要 以绿绒海芋Alocasia micholitziana的叶片、叶柄为外殖体,研究不同灭菌剂对外殖体消毒效果的影响、不同激素及浓度配比的培养基对愈伤组织诱导、不定芽分化及增殖的影响。结果表明:(1)消毒处理时叶柄适于用0.1% HgCl2浸泡处理8 min,叶片则为7 min;(2)叶柄、叶片在所试培养基中均能诱导出愈伤组织,最佳诱导培养基为MS+2 mg/L 6-BA+2.0 mg/L 2,4-D+0.1 mg/L NAA,叶柄愈伤组织诱导率可达100%;(3)从愈伤组织诱导不定芽的最佳培养基为MS+2 mg/L 6-BA+0.4 mg/L NAA,诱导率可达100%;(4)在培养基MS+2 mg/L 6-BA+0.4 mg/L NAA上,芽增殖效果最佳,苗生长健壮;(5)最佳生根培养基为1/2MS+0.5 mg/L IBA,移栽后苗容易成活;(6)苗移栽时以泥炭土 ∶ 珍珠岩 ∶ 蛭石(3 ∶ 1 ∶ 1)成活率较高,可达98%以上,而且小苗生长健壮。
关键词 绿绒海芋;叶柄、叶片;组织培养;植株再生
中图分类号 S665 文献标识码 A
Tissue Culture and Plantlet Regeneration of
Alocasia micholitziana
YANG Jianfen,GUO Pengfei,ZHANG Binhua,ZHANG Shouzhou*
Laboratory of Southern Subtropical Plant Diversity, Fairylake Botanical Garden, Shenzhen
& Chinese Academy of Sciences, Shenzhen, Guangdong 518004, China
Abstract An efficient protocol was established for the regeneration of an ornamental and food crop plant, Alocasia micholitziana using the leaves and petiole explants. The influence of both plant sterilization agents and various growth hormones at different concentrations on callus induction, adventitious bud differentiation and their proliferation were examined. The results revealed that soaking of plant explants in 0.1% of HgCl2 solution for 8 min was suitable for sterilization. The highest bud induction(100%)was achieved in three plant growth hormone combinations of 6-BA(2 mg/L), 2,4-D(2 mg/L)and NAA(0.1 mg/L)in the MS culture medium. The optimum concentration for the highest induction(100%)of adventitious bud was 2 mg/L of 6-BA with 0.4 mg/L of NAA. The root was successfully induced in the half strength MS medium augmented with 0.5 mg/L of IBA. The in vitro regenerated plants were transf erred to the pot containing peat soil, perlite, and vermiculite(3 ∶ 1 ∶ 1)which showed the maximum survival rate(98%).
Key words Alocasia micholitziana; Petioles; Leaf; Tissue culture; Plant regeneration
doi 10.3969/j.issn.1000-2561.2015.08.015
绿绒海芋Alocasia micholitziana(Green velvet)是天南星科海芋属植物,原产热带地区,为多年生草本,叶片姿态优美、叶色浓绿,叶面有丝绒般感觉,叶脉银白、清晰如画,极富诗情画意,为风格独特的观叶植物。室内摆设,高贵典雅。可水栽,淋洗盆土后,种于玻璃瓶中更显清洁清爽,是观赏价值较高的室内观叶植物。绿绒海芋(图版1-F)是从国外新引进开发的园艺品种,目前处于种苗繁育阶段,仅有少量种苗供应市场。常规繁殖主要是通过分株方式和播种,其种子来源有限,自然分株率又低,周期长,很难满足市场需要。利用组培方式可以快速繁殖种苗,达到推广应用的目的。海芋属植物组培报道的有海芋(Alocasia indica Schott)[1-3]、亚马逊海芋(Alocasia amazonica)[4]、紫色茎秆海芋(Alocasia macrorrhiza)[5]、黑绒观音莲(Alocasia ‘Black Velver)[6], 绿绒海芋的组培技术研究国内尚未见涉及,而国外已有报道[7],但其愈伤组织诱导时间长达4个月,出愈率仅71%,本研究的最佳培养基MS+2 mg/L 6-BA+0.4 mg/L NAA,至45 d时愈伤组织诱导率可达100%,大大缩短了离体培养时间,并且丛生芽增殖率也高,更适于工厂化规模生产。
1 材料与方法
1.1 材料
供试材料为从台湾辜严倬云保种中心引种回来的绿绒海芋,栽种于深圳市中科院仙湖植物园引种区。
1.2 方法
1.2.1 外殖体的消毒处理 当绿绒海芋新长出的幼叶完全展开5 d左右,将叶片和叶柄一起剪下。清洗干净表面尘土后,用洗洁精水泡洗5~10 min,再用自来水冲洗,直到彻底将洗洁精清洗干净为止。在无菌操作室内,将叶柄和叶片分开,分别用0.1%升汞溶液、5% NaClO溶液浸泡6~10 min,灭菌水冲洗4~6次,消毒滤纸吸干表面水分,将叶片切成1 cm×1 cm左右的方块,叶柄切成1 cm左右的段,然后分别接入不同培养基中。随时观察记录,35 d后统计结果。
污染率=(污染外殖体数/接种总数)×100%;剔除污染外殖体后,死亡率=(死亡外殖体数/未污染外殖体数)×100%。
1.2.2 愈伤组织及不定芽的诱导 以MS为基本培养基,设置①6-BA 1.5 mg/L与2,4-D(0.5、1.0、1.5、2.0、2.5)mg/L和②6-BA 2.0 mg/L与2,4-D(0.5、1.0 、1.5、2.0、2.5)mg/L共10个处理,研究不同激素及浓度配比的培养基对愈伤组织诱导和不定芽分化的影响。不定芽的统计以肉眼可辩独立单芽为准。
分化率=(分化愈伤组织块数/接种愈伤组织块数)×100%。
1.2.3 不定芽的继代增殖 以MS为基本培养基,设置①6-BA 1.5 mg/L、2,4-D 2 mg/L与NAA(0.1、0.2、0.3、0.4、0.5)mg/L和②6-BA 2.0 mg/L、2,4-D 2 mg/L与NAA(0.1、0.2、0.3、0.4、0.5)mg/L等共10个处理,研究不同激素及浓度配比对绿绒海芋芽增殖的影响,以筛选出芽增殖效果最佳培养基。
1.2.4 生根培养 以1/2MS为基本培养基,设置IBA(0.1、0.2、0.3、0.4、0.5)mg/L 5个处理,研究不同浓度的IBA对不定芽生根的影响。
1.2.5 培养条件 以上培养基均添加3%蔗糖,琼脂粉5.5 g/L,pH值调至5.8。培养温度25(±2)℃,光照时间16 h/d,光照度37~40 μmol/m2·s。
所有试验的每个处理不少于10瓶,并重复5次。外殖体每瓶接种一个,不定芽的继代增殖及生根培养每瓶接种5~7个。
1.3 数据处理
数据采用SPSS 21.0数据统计软件进行方差分析和多重比较分析(Duncan's)法。
2 结果与分析
2.1 外殖体消毒效果
外殖体消毒效果如表1所示。叶柄外殖体在所有处理中的死亡率均为0,在处理4、处理8、处理9、处理10中的污染率为0,与其它处理差异显著,综合试验及观察以0.1% HgCL2消毒8 min降低绿绒海芋叶柄外殖体污染效果较好;叶片外殖体在处理5、处理9、处理10中的污染率为0,与其它处理差异显著,死亡率以处理7为最低,综合污染率及死亡率考虑,叶片以0.1% HgCL2消毒7 min降低污染效果较好。
2.2 不同激素类型对离体叶柄、叶片愈伤组织诱导及芽分化的影响
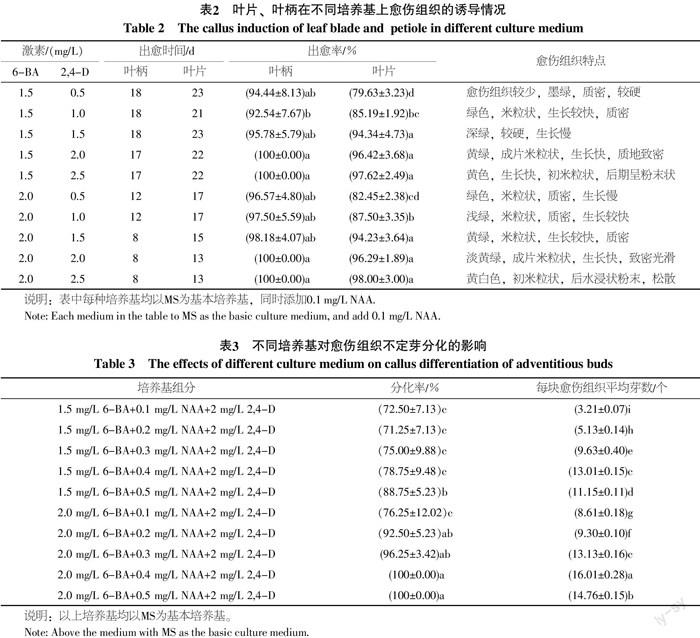
消毒后的外殖体接入培养基中进行培养,45 d后统计分析结果如表2。6-BA与2,4-D的不同浓度组合,对绿绒海芋的外殖体叶柄和叶片愈伤组织诱导差异显著。尤其是当2,4-D的浓度大于2.0 mg/L时,差异明显,其中叶柄作为外殖体时,愈伤组织诱导率最高达100%(图1-A),叶片作为外殖体时,愈伤组织诱导率最高达98%。从愈伤形成所用时间来看,6-BA浓度为2.0 mg/L时,叶柄和叶片愈伤组织诱导的时间明显短于6-BA浓度为1.5 mg/L时。从愈伤组织特点、形成时间、及出愈率3方面综合看,以MS+2 mg/L 6-BA+2.0 mg/L 2,4-D+0.1 mg/L NAA为最佳培养基,差异明显。
将光滑致密的愈伤组织转入不定芽分化培养基中进行培养,结果如表3。当培养基为MS+2.0 mg/L 6-BA+0.4 mg/L NAA+2 mg/L 2,4-D和MS+2.0 mg/L 6-BA+0.5 mg/L NAA+2 mg/L 2,4-D时,愈伤组织分化率为100%,与其它培养基组合差异显著,当培养基为MS+2.0 mg/L 6-BA+0.4 mg/L NAA+2 mg/L 2,4-D时,平均芽数为16.01,与其它培养基差异显著,是绿绒海芋最适合的分化培养基(图1-B)。
2.3 不定芽的继代增殖
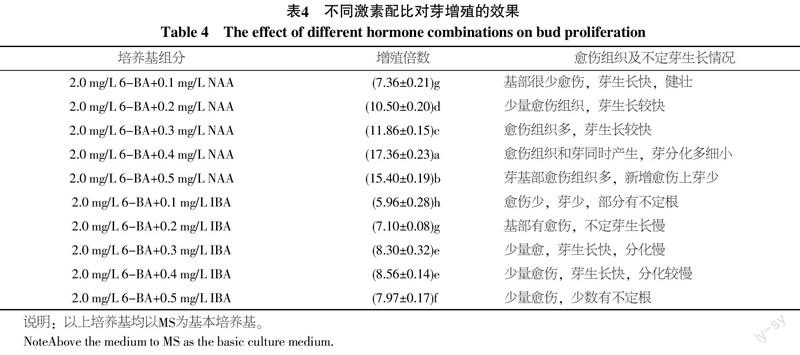
将初代培养的不定芽切割成单芽以后,接入增殖培养基上进行增殖培养,25 d后增殖结果如表4。不定芽继代增殖的结果因激素配比不同而异,以MS+2.0 mg/L 6-BA+0.4 mg/L NAA增殖率最高(图1-C),达17.36,其次为MS+2.0 mg/L 6-BA+0.5 mg/L NAA,达15.40,MS+2.0 mg/L 6-BA+0.1 mg/L IBA处理最低,仅为5.96。在所试验的激素浓度范围内,NAA的增殖倍数整体高于IBA,且不同浓度之间差异显著。
2.4 不同激素浓度对不定芽生根的影响
将生长健壮的不定芽切割成单芽后,接入生根培养基中进行培养,25 d后统计结果如表5。不同IBA浓度对绿绒海芋的不定芽生根有影响,生根率在浓度0.3 mg/L、0.4 mg/L、0.5 mg/L之间无差异,均达100%,与前两个浓度之间差异显著。综合对比表5中各项指标,以1/2MS+0.5 mg/L IBA为生根最优培养基。
2.5 移栽
待苗生根20 d左右,大部分叶片增厚变硬时,从培养瓶中取出,由于小苗根部缠绕在一起,先以流水冲净培养基再分开小苗,移栽的基质以蛭石 ∶ 珍珠岩(5 ∶ 1)、泥炭土 ∶ 珍珠岩 ∶ 蛭石(3 ∶ 1 ∶ 1)或腐叶土 ∶ 蛭石(3 ∶ 1)为比例,在阴凉通风处培养,温度保持l8~20 ℃以上,每天需洒水或喷雾,成活率均可达到98%以上,但以泥炭土 ∶ 珍珠岩 ∶ 蛭石(3 ∶ 1 ∶ 1)中的苗生长最为健壮(图1-E)。
3 讨论与结论
海芋属植物离体培养的外殖体有花序[1]、块茎[2]、根状茎[3]、顶芽和侧芽[5]、子球茎[6]和叶柄、叶片[7]。杨翠芹等[3]在海芋的预试验表明,叶柄与叶片培养不但诱导不出愈伤组织,且会随时间延长逐渐死亡;Nguyen Thi Phuong Thao等[7]仅从叶柄诱导出愈伤组织,也没有获得叶片愈伤组织的成功。以绿绒海芋的叶柄、叶片作为外殖体,获得成功的关键在于外殖体取材时间,以幼叶展开5~10 d最好,太早幼叶太过幼嫩,消毒后易变黑死亡,即使不变黑也会先从周缘变黄或变褐,逐渐向中心部位扩展,直至干枯死亡,部分黄化的叶片整体发白,失去活力;叶柄太嫩时,端部易变黄,甚至褐色,虽不至于干枯死亡,但影响愈伤组织形成时间和速度。同时以叶柄、叶片作为外殖体,相对于其它部位具有取材不受时间限制,不会破坏整个植株,而且接种量大的优点。
2,4-D、6-BA、NAA、TDZ、KT等都被用来研究海芋属愈伤组织的诱导与再生,叶柄、叶片愈伤组织诱导研究较少,即使有诱导率也较低。Nguyen Thi Phuong Thao等[7]以2,4-D与KT各0.5 μ/L的激素组合,用叶柄诱导愈伤组织,最高诱导率才达71%,且需暗培养4个月才诱导出愈伤组织。而本试验以叶柄、叶片为外殖体,在MS+2 mg/L 6-BA+2.0 mg/L 2,4-D+0.1 mg/L NAA培养基中培养,最短8 d开始产生愈伤组织,至45 d时愈伤组织诱导率可达100%。这可能与生长素和细胞分裂素的种类及浓度不同有关。
参考文献
[1] 张新英. 海芋的离体培养及其试管苗水培研究[D]. 福州: 福建农林大学硕士学位论文, 2009.
[2] 高 铤, 陈继敏, 杨镇明. 海芋的组织培养与快速繁殖[J]. 植物生理学通讯, 2006, 42(5): 9-10.
[3] 杨翠芹, 刘运权, 方 颖, 等. 海芋根状茎的离体培养与植株再生[J]. 北方园艺, 2007(5): 212-213.
[4] 朱根发, 张远能, 邹春萍, 等. 亚马逊海芋的组织培养和快速繁殖[A]. 广州: 广州农业科学院花卉研究所建所20周年论文选集(1984-2004)[C]. 2004.
[5] 王玉英, 许帮丽, 褚素贞, 等. 紫色茎秆海芋组织培养不同培养基的诱导增殖生根效果研究[J]. 西部林业科学, 2008, 37(4): 89-92.
[6] 黄青峰. 黑绒观音莲顶芽培养和快速繁殖[J]. 福建热作科技, 2002, 27(3): 9-10.
[7] Nguyen Thi Phuong Thao, Yukio Ozaki, Hiroshi Okubo. Callus induction and plantlet regeneration in ornamental Alocasia micholitziana. Plant Cell[J]. Tissue and Organ culture, 2003, 73: 285-289.

