扇棘单睾吸虫Real-time PCR 与常规PCR 检测方法的建立
李树清,梅雪芳,林颖峥,石云良,黄腾飞,王巧全,张 强,陈志飞,宋 青,唐智芳,黄维义*
(1.上海出入境检验检疫局,上海200135;2.广西大学动物科学技术学院,广西南宁530005;3.广西大学食品质量与安全研究中心,广西南宁530005;4.罗氏诊断产品(上海)有限公司,上海200335)
扇棘单睾吸虫(Haplorchis taichui,Ht)隶属于异形科(Heterophyidae)单睾属(Haplorchis),是重要的人兽共患寄生虫。异形科吸虫被联合国粮农组织(FAO)及世界卫生组织(WHO)列为全球最重要的24种食源性寄生虫之一[1]。成虫主要寄生于人、鼠、狗、猫等的宿主肠道内,囊蚴寄生于淡水鱼以及一些海水鱼,人和动物因食入带有囊蚴的鱼类而感染[2]。该虫近年来在东南亚国家和地区频繁被报道,感染十分严重。菲律宾和老挝所调查区域虫卵阳性感染率为36%~69.9%,且驱虫后均获得扇棘单睾吸虫[3-5]。泰国北部所调查人群中有63.11%感染扇棘单睾吸虫[6]。我国也有人感染扇棘单睾吸虫的报道[2,7]。但是目前对该寄生虫的了解甚少,临床诊断仍是以粪便虫卵检测作为判断依据[8],而成虫的区分则要经固定压片和染色鉴定,这都对鉴定者的经验和技术要求较高,且需花费大量的时间[9]。在过去的治疗过程中,有相当一部分“扇棘单睾吸虫患者”被误当做“肝吸虫患者”进行治疗,这可能会加重药物对病人的毒副作用,也造成了不必要的经济损失[2]。基于DNA 的分子检测方法的高效性和准确性,已被用于鉴定各种各样的虫种[9-10],在异形吸虫的鉴定和区分方面,许多学者对分子检测方法进行过探索[11-12]。本文在前人研究的基础上,建立real-time PCR 及 常 规PCR 方 法,以 期 寻 求 可 以 用 于不同实验室条件的快速可靠的鉴别扇棘单睾吸虫感染的方法。
1 材料与方法
1.1 材料
1.1.1 试验用虫种 扇棘单睾吸虫、横川后殖吸虫(Metagonimus yokogawai)、钩棘单睾吸虫(H.pumilio)、华支睾吸虫(Clonorchis sinensis)、瓦氏瓦特松吸虫(Watsonius watsoni)、棘口属吸虫(Echinostomasp.)、背孔属吸虫(Notocotylus sp.)、心形咽口吸虫(Pharyngostomum cordatum)、野牛平腹盘吸虫(Homalogasterpaloniae sp.)由广西大学寄生虫实验室保存。东方次睾吸虫(Metorchisorientalis tanabe)、卫 氏 并 殖 吸 虫(Paragonimus westermani);异尖线虫(Anisakis sp.)、宫脂线虫(Hysterothylaciumsp.)由上海出入境检验检疫局保存。虫体均保存于700mL/L的酒精中。
1.1.2 临床样品 2012年6月至2013年11月从广西南宁北湖、白苍岭等农贸市场搜集猫犬内脏中的吸虫17条。
1.1.3 主要试剂及仪器 SYBR Premix Ex TaqⅡ(2x),ROX Reference DyeⅡ(50x),Taq 酶、dNTP等均购自大连TaKaRa工程有限公司,DNA 提取试剂购自Quangen公司。
ABI ViiA7 Real-time PCR 仪,Eppendorf AG 22331Hamburg常规PCR 仪,PowerPac BIO-RAD电泳仪及G:BOX 凝胶成像系统。
1.2 方法
1.2.1 虫体DNA 的提取 从700mL/L的酒精保存液中取出单个虫体,放入去离子水中洗涤2次~3次,每次间隔30min。按照Quangen DNA 提取试剂盒使用说明书提取虫体基因组DNA,置-20℃[13]保存备用。
1.2.2 引物设计 应用Premier 5.0 软件,针对ITS1目标片段,设计特异性引物,上游引物(ht1-F):5′-ATATTGTTGCCTCCATGGCTGAC-3′;下游引 物(ht6-R):5′-CTGTACGTAGGTACACGTGTG-3′,可扩增出279bp的片段。引物交由上海生工生物工程技术服务有限公司合成。
1.2.3 阳性克隆质粒制备 使用广西大学寄生虫实验室设计的18S~28S通用引物HTF1F/HTF1R(上 游 序 列:5′-CTT GAT CAT TTA GAG GAA GT-3′;下 游 序 列:5′-GCT TAA GTT CAG CGG GT-3′)对扇棘单睾吸虫的虫种DNA 进行PCR 扩增,其产物(包含18S部分序列,ITS1全序列,5.8S全序列,ITS2全序列,28S部分序列,共4 203bp)序列分析验证后,通过常规基因克隆制备技术得到阳性质粒,以此作为阳性核酸对照。基因序列上传至GenBank(登录号为:KC999100)。
1.2.4 引物退火温度的优化及PCR 反应体系的优化 退火温度(Tm)从30℃~75℃,间隔5℃为一个反应,选择出一个条带比较亮的温度区段,这个区段再以2℃为一个间隔进行反应,根据条带亮度选取最佳的退火温度(图1)为60℃,从而确定反应程序为:
Real-time PCR 扩增条件:50℃2min;95℃10 min;95℃15s,60℃1 min,40 个循环;熔解曲线:95℃15s,60℃1min,95℃15min。
常规PCR 扩增条件:95℃5 min;95℃30s,60℃30s,72℃45s,共40个循环;72℃7min。
Real-time PCR和常规PCR 分别采用25μL和30μL 反应体系,适当调整引物量、模板量等,从而确定最佳反应体系为:
常规PCR 反应体系:2×Premix 15μL;上、下游引物各1μL,模板2μL,补灭菌蒸馏水至30μL。
Real-time PCR 反 应 体 系:SYBR Premix Ex TaqⅡ(2×)12.5μL,ROX Reference DyeⅡ(50×)0.5μL,上、下游引物各0.5μL,模板1μL,补灭菌蒸馏水至25μL。

图1 引物退火温度梯度PCRFig.1 Gradient annealing temperature of conventional PCR
1.2.5 PCR 特异性验证 利用建立的反应体系和条件对1.1.1 中的虫体样本进行引物的特异性检测,结果显示为阳性的DNA 样本进行测序比对。
1.2.6 PCR 敏感性测定 经分光光度计测得扇棘单睾吸虫质粒DNA 浓度,然后将其进行10倍系列稀释,用优化好的条件进行PCR 扩增。按照拷贝换算公式,即:每微升样品中拷贝数=样品浓度(ng/μL)×6.02×1023(阿伏伽德罗常数)×10-9/(660×重组质粒碱基数)换算成拷贝,得出real-time PCR 和常规PCR 反应的敏感性。
1.2.7 Real-time PCR 的重复性及标准曲线 将扇棘单睾吸虫阳性质粒进行10-2~10-6系列稀释,每个稀释度重复3次进行real-time PCR 检测。对结果进行统计学分析,计算每个稀释度Ct值的标准偏差(S)和变异系数(CV),并建立检测的标准曲线。
1.2.8 临床样品检测 根据形态学特征对1.1.2中获得的虫体样本进行初步鉴定后,提取DNA,用本 文 建 立 的real-time PCR 和 常 规PCR 方 法 分 别 进行检测鉴定。同时,使用ITS2通用引物3S/A28[14]及自行设计的18S~28S通用引物HTF1F/HTF1R(上 游 序 列:5′-CTT GAT CAT TTA GAG GAA GT-3′;下 游 序 列:5′-GCT TAA GTT CAG CGG GT-3′)扩增,并将测序结果与GenBank中序列进行比对,验证所建立的方法。
2 结果
2.1 PCR 特异性测定
常规PCR 结果(图2)显示,除了扇棘单睾吸虫阳性质粒外,引物只能特异扩增扇棘单睾吸虫DNA,将此样本PCR 产物测序比对,结果与阳性质粒的序列一致,证明引物能特异扩增扇棘单睾吸虫。
Real-time PCR 与 常 规PCR 检 测 结 果 一 致,只有扇棘单睾吸虫质粒或DNA 有扩增,熔解温度分别为85.62℃和85.23℃,其他对照虫体DNA 无扩增(图3)。

图2 常规PCR 特异性检测Fig.2 The specificity of conventional PCR
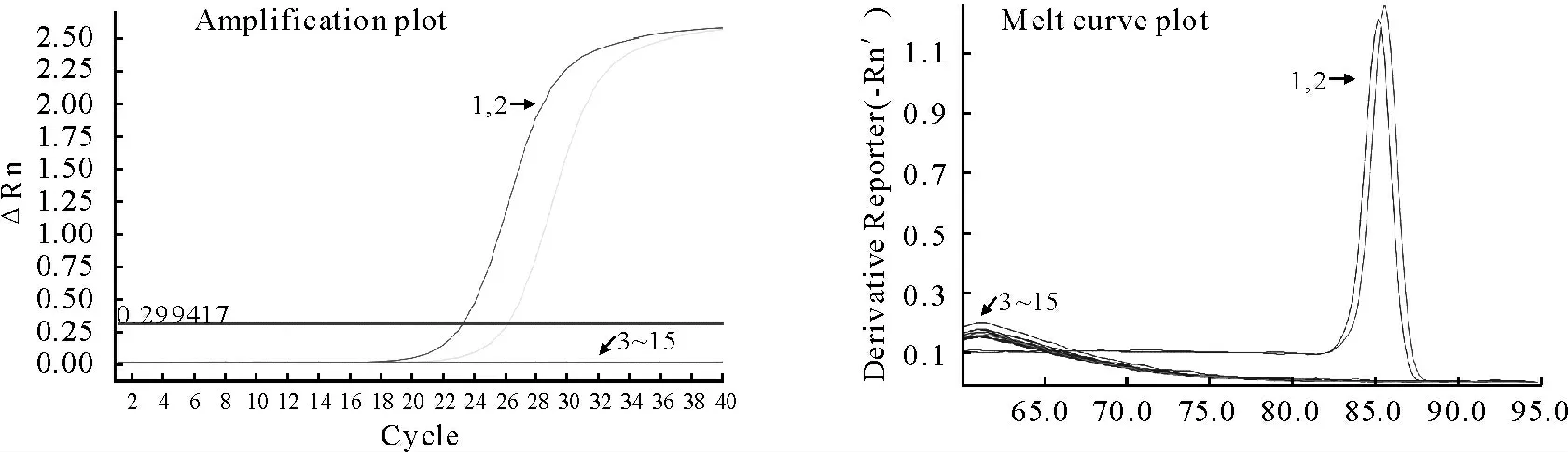
图3 Real-time PCR特异性检测Fig.3 The specificity of real-time PCR
2.2 PCR 敏感性测定
扇棘单睾吸虫质粒DNA 经分光光度计测得其浓度为20ng/μL,经10 倍系列稀释后,常规PCR和real-time PCR 均可检测到108稀释倍数的质粒DNA(图4、图5)。其中常规PCR 使用2μL 模板,即可检测到4×10-4pg,86 拷贝;real-time PCR 使用1μL模板,即可检测到2×10-4pg,43拷贝。阳性质粒的熔解温度介于85.58℃~85.39℃之间。
2.3 Real-time PCR的重复性及标准曲线

图4 常规PCR 敏感性检测Fig.4 Sensitivity of conventional PCR
对10-2~10-6阳性质粒(即4.3×107~4.3×103拷贝/μL)共5各浓度梯度的质粒进行扩增,每个浓度重复3次。分别得到5个梯度的Ct值,计算标准差与变异系数。5 个梯度的变异系数均小于0.6%,表明该体系具有较好的重复性(图6)。根据阳性质粒5个梯度(10-2~10-6)扩增的Ct值,系统自动生成标准曲线(图7),图中显示,标准曲线的斜率为-0.350 4,截距为37.092,相关系数为0.998,扩增效率为92.914%,标准误差为0.039。初始模板拷贝数(X)与Ct值之间的线性关系表达式为:Ct=-3.504×logx +37.092。表明质粒的浓度与Ct值具有很好的相关性,扩增效率满足要求。
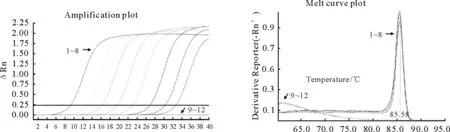
图5 Real-time PCR敏感性检测Fig.5 Sensitivity of real-time PCR

图6 Real-time PCR的重复性Fig.6 The repetitiveness of real-time PCR

图7 Real-time PCR的标准曲线Fig.7 The standard curve of real-time PCR
2.4 临床样品检测及验证结果
从犬猫内脏收集的17条成虫样本经形态学鉴定、real-time PCR和常 规PCR 扩 增、及 通 用 引 物 扩增产物测序结果完全一致。检测结果经测序比对发现,能得到目的条带的样品为扇棘单睾吸虫(Gen-Bank登录号:KJ631741),没有目的条带的虫体经通用引物扩增并测序比对,分别鉴定为钩棘单睾吸虫 (GenBank 登 录 号:KJ137221,KJ137222,KJ137223,KP165437,KP165438,KP165439),横川后殖吸虫(Genebank登录号:KJ631734,KJ631735,KJ631736, KJ631737, KJ631738, KJ631739,KJ631740),华 支 睾 吸 虫(KJ137224,KJ137225,KJ137226),心形咽口吸虫(KJ137229,KJ137230,KJ137231)等。
3 讨论
分子生物学检测法具有准确、快速、高效和便于操作的特点,且对操作者的形态学鉴定的经验和技术要求较低,不需要花费大量的人力和时间。Wongsawad C等[12]认为,PCR 方法能够提高粪便中虫卵检测的准确性。在扇棘单睾吸虫的分子方法研究中已经有学者对其进行了研究和报道,Sato M等[8]利用粪便虫卵检查与PCR 检测相结合,增加了检测的灵敏性。Van V K 等[15]采用基于ITS2序列的PCR 方法对扇棘单睾吸虫不同发育阶段进行研究,这对阻断疾病传播有重要意义。
通过设计特异性引物来进行分子生物学鉴定还可以省去测序的过程,达到更方便快捷的目的,很多虫种的鉴定都采用过这种方法[16]。目前为止,国内外还没有针对扇棘单睾吸虫的特异性鉴别方法的报道。本研究选择序列长度较长且和多种吸虫区分度较大、进化和变异较快、适合虫种的种间区分的ITS1序列作为特异性引物设计的靶序列,自行设计了可以特异扩增ITS1序列的引物。该引物不仅能特异扩增扇棘单睾吸虫ITS1的序列,而且还兼顾了 常 规PCR 和real-time PCR 对 引 物 的 要 求,可 以同时应用于两种方法。通过对反应条件的优化,使常规PCR 的敏感性达到与real-time PCR 同一数量级,为不同条件的实验室的应用提供了可能。
本研究所建立的两种方法经GenBank比对未发现能扩增出其他的相近虫种,在特异性检测结果中显示扇棘单睾吸虫与后睾科、次睾科、棘口科等12种寄生虫成虫及囊蚴很好的区分,并且特异性检测所选虫种是与所研究目标吸虫同一科属,或者寄生虫的成虫或囊蚴阶段能够混合感染同一宿主进而可干扰检测的虫种,初步证明具有较好的特异性。本试验构建的检测方法运用于犬、猫肠道吸虫成虫临床检查,经验证可以特异、敏感、快速地检测到扇棘单睾吸虫。可结合形态学更快速准确地应用于寄生虫的区系调查。
2010年数据显示,亚洲是世界水产养殖产量的主体,所占份额高达89%。亚洲的泰国、越南、菲律宾等东南亚国家为世界领先的鱼类生产国,其产品多以外销为主,而这些国家淡水鱼中扇棘单睾吸虫囊蚴高的感染率对世界人民的健康都是一个不容忽视的威胁。但是目前对扇棘单睾吸虫的快速、准确地检测的研究报道还很少。本研究所建立的方法为扇棘单睾吸虫成虫的鉴别提供一种快速、准确的鉴别方法,为下一步淡水鱼中囊蚴的检疫和鉴定奠定了基础。
[1] Joint FAO/WHO Expert Meeting on Foodborne Parasites.Preliminary report:multicriteria-based ranking for risk management of food-borne parasites[R/OL].[2014-02-23]http://apps.who.int/iris/handle/10665/112672.
[2] 杨益超,李树林,谭裕光,等.广西肝吸虫流行区人群及淡水鱼扇棘单睾吸虫感染调查[J].应用预防医学,2012,18(2):75-77.
[3] Belizario V Y,de Leon W U,Bersabe M J,et al.A focus of human infection by Haplorchis taichui(Trematoda:Heterophyidae)in the southern Philippines[J].J Parasitol,2004,90(5):1165-1169.
[4] Rim H J,Sohn W M,Yong T S,et al.Fishborne trematode metacercariae in Luang Prabang,Khammouane,and Saravane Province,Lao PDR[J].Korean J Parasitol,2013,51(1):107-114.
[5] Chai J Y,Yong T S,Eom K S,et al.Hyperendemicity of Haplorchis taichui infection among riparian people in Saravane and Champasak province,Lao PDR[J].Korean J Parasitol,2013,51(3):305-311.
[6] Radomyos B,Wongsaroj T,Wilairatana P,et al.Opisthorchiasis and intestinal fluke infections in northern Thailand[J].Southeast Asian J Trop Med Public Health,1998,47(1):103-103.
[7] 黎学铭,杨益超,蓝春庚,等.广西发现扇棘单睾吸虫[J].中国寄生虫学与寄生虫病杂志,2004,22(1):61-62.
[8] Sato M,Pongvongsa T,Sanguankiat S,et al.Copro-DNA diagnosis of Opisthorchis viverrini and Haplorchis taichui infection in an endemic area of Lao PDR[J].Southeast Asian J Trop Med Public Health,2010,41(1):28-35.
[9] 李树清,李雯雯,陈志飞,等.入境黄鳝颚口线虫检疫及虫种鉴定[J].中国寄生虫学与寄生虫病杂志,2012,29(5):358-362.
[10] 李雯雯,李树清,张子群,等.黑龙江与广州颚口线虫幼虫分离株的形态学观察及其分子鉴定[J].中国预防兽医学报,2012,34(2):104-107.
[11] Thaenkham U,Phuphisut O,Pakdee W,et al.Rapid and simple identification of human pathogenic heterophyid intestinal fluke metacercariae by PCR-RFLP[J].Parasitol Int,2011,60(4):503-506.
[12] Wongsawad C,Wongsawad P,Chuboon S,et al.Copro-diagnosis of Haplorchis taichui infection using sedimentation and PCR-based methods[J].Southeast Asian J Trop Med Public Health,2009,40(5):924-928.
[13] 彭武丽,邓明俊,季新成,等.牛新孢子虫病和弓形虫病双重PCR 检测方法的建立与应用[J].动物医学进展,2013,34(6):58-62.
[14] Sugiyama H,Morishima Y,KameokaY,et a1.Polymerase chain reaction(PCR)based molecular discrimination between Paragonimus westermani and P.miyazakii at the metacercarial stage[J].Mol Cell Probes,2002,16(3):231-236.
[15] Van V K,Dalsgaard A,Blair D,et al.Haplorchis pumilio and H.taichui in Vietnam discriminated using ITS-2 DNA sequence data from adults and larvae[J].Exp Parasitol,2009,123(2):146-151.
[16] 刘志刚,吴 彦,孙青松.粪便中华支睾吸虫虫卵DNA 的提取及PCR 检测方法的优化[J].动物医学进展,2013,34(4):87-89.

