五加科植物发状根诱导研究进展
蒋景龙,蒋 超,沈季雪,徐卫平
(陕西理工学院生物科学与工程学院,陕西汉中723001)
五加科植物发状根诱导研究进展
蒋景龙,蒋 超,沈季雪,徐卫平
(陕西理工学院生物科学与工程学院,陕西汉中723001)
五加科植物多为重要的中药材,利用发根农杆菌诱导五加科药用植物产生发状根,并从中获取有用的次生代谢产物,是保护五加科珍稀药用植物资源和实现有效次生代谢物质工业化生产的有效途径。该文在概述发根农杆菌转化药用植物研究历程和转化机理研究的基础上,对近年来在发根农杆菌诱导五加科植物的种类及诱导率、影响发根农杆菌诱导五加科植物的各种因素和利用发根农杆菌诱导五加科植物获得再生植株等方面研究进行了重点分析,并对今后亟需研究的几个重点方向进行了展望,以期为五加科药用植物的良性开发和合理利用提供参考。
五加科;发根农杆菌;冠瘿碱;乙酰丁香酮;诱导率
五加科(Araliaceae)植物约有80属900余种,仅中国就有23属160余种[1]。已知可供药用的植物有114种(包括20个变种,1个变型),其中不乏多种名贵中药材,如人参(Panax ginseng)、西洋参(P.quiquefolium)、三七(P.notoginseng)、细柱五加(Eleutherococcus nodiflorus)、东北刺人参(Oplopana elatus)、刺五加(Eleutherococcus senti-cosus)和龙牙楤木(Aralia mandshrica)等。近年研究表明,五加科植物大多具有抗肿瘤、抗衰老、降血脂、活血补气和利脾补肾等医药作用[2]。五加科药用植物多为多年生,生长周期较长,野生资源遭受无计划采挖,不少名贵药材已濒临绝迹[3]。为保护和开发利用这些药材,常利用人工栽培和组织培养技术进行引种扩繁,但组织培养过程中,培养周期长、药用次生代谢物含量不稳定以及再生苗成活率较低等因素都极大地限制了该技术的工业化发展。随着生物工程技术的不断发展,利用发根农杆菌诱导药用植物产生毛状根,并对毛状根进行离体培养,大量提取重要药用成分,是药用植物资源可持续发展的有效途径之一。
发根农杆菌(Agrobacterium rhizogenes)属于根瘤菌科(Rhizobitaceae)农杆菌属(Agrobactedum)革兰氏阴性菌,能侵染绝大多数的双子叶植物和少数单子叶植物以及个别裸子植物,使植物合成冠瘿碱并产生许多不定根。这种不定根生长迅速,不断分支成毛状,故称之为发根或毛状根。发状根是由发根农杆菌含有的Ri质粒引起的[4]。发状根具有生长快速、自身合成植物激素、遗传性状和生化特性稳定、合成次生代谢物质能力强等特点,更重要的是,发状根的次生代谢物的含量不仅更高,而且还能产生某些植物愈伤组织所不能合成的有效成分。本文就发根农杆菌转化药用植物研究进程、发根农杆菌转化机制、发根农杆菌诱导五加科植物种类、诱导条件的优化和五加科再生植株诱导方面的研究做了综述,以期为五加科药用植物的良性开发和合理利用提供参考。
1 发根农杆菌转化药用植物研究历程
1987年,日本学者Yoshikawa等[5]首次通过人参愈伤组织成功诱导出了发根。2001年,王冲之等[6]以西洋参胚为材料,用含Ri质粒的发根农杆菌及经过胡萝卜提取液处理的菌株感染的无菌苗切段,在含6mg/L萘乙酸(NAA)的培养基上培养获得了发根。刘峻等[7]利用含Ri质粒的发根农杆菌感染人参,首次从人参的带叶幼茎部位诱导出发状根,并利用PCR证实Ri质粒携带的rolc序列已整合到人参转化株的染色体中。2003年,Seo等[8]分别用刺五加的下胚轴和胚根均诱导出发状根,且前者诱导率更高。2005年,于树宏等[9]通过发根农杆菌对虎杖进行遗传转化,发现其成熟叶片的发状根平均诱导率为55.66%。2008年,王伟等[10]发现用发根农杆菌R15834诱导喜树胚轴能获得30.83%诱导率。2012年,芦韦华等[11]以新疆紫草为材料,采用二阶段液体培养法首次建立了新疆紫草发状根培养技术体系。2013年Danijela等[12]用百金花属植物也诱导出了发状根。2014年Veremeichik等[13]建立了茜草的发根转化体系。2015年Dmitrovic等[14]用绿藜诱导出发根且测得其总酚代谢量远远高于野生型植株。到目前为止,国内外己有30余科40个属[15]的药用植物如人参(Panax ginseng)、丹参(Salvia miltiorrhiza)、绞股蓝(Gynostemma pentaphyllum)、红花亚麻(Linum grandiflora)、青蒿(Artemisia carvifolia)、新疆雪莲(Saussurea involucrata)、王不留行(Vaccaria segetalis)、秦艽(Gentiana macrophylla)、积雪草(Centella asiatica)以及何首乌(Fallopia multiflorum)等的发状根诱导获得成功[16-18]。
2 发根农杆菌转化机理
Ri质粒是位于发根农杆菌染色体之外的独立的双链环状DNA,一般在180~250kb之间[19]。Ri质粒主要有复制起始区(Ori区)、接合转移区、冠瘿碱分解区和2个主要功能区[转移区(T-DNA区)和致病区(Vir区)]等几部分。其中T-DNA区是一段不连续的DNA,依次包括TL-DNA区、生长素区、激动素区、冠瘿碱区和TR-DNA区(图1,A),Vir区主要编码T-DNA转入并整合到植物基因组上的各种功能性蛋白(图1,B)。
发根农杆菌诱导五加科植物产生发状根的过程可以概括为5个阶段9个步骤(图1,C)。第一阶段为信号的产生和接收。植物受伤处的细胞会产生一些糖类或酚类如乙酰丁香酮等物质,农杆菌识别和接收这些小分子信号物质,然后产生纤维丝吸附在易感染的植物细胞上。同时,农杆菌形态因诱导物的诱导作用向线形转变,线形的一端附着于植物细胞表面。第二为T-DNA复合体的初加工阶段。信号分子进入发根农杆菌后,VirA和VirG2蛋白组成双组分信号系统,激活靶向在T-DNA边界序列的限制性内切酶VirD1和VirD2,T-DNA在二者的剪切下边界序列脱落,同时释放单链T-DNA(ssTDNA)。然后,VirD2以极性共价键的方式附着在ssT-DNA的5′端,形成不成熟的T-DNA前体。第三阶段为T-DNA前体进入植物细胞胞质。VirB和VirD4等效应蛋白将T-DNA前体包裹在VirF的效应下通过IV型分泌系统以线性的方式穿过2层细胞膜“注射”到植物细胞胞质中,随后VirF、VirE2、VirE3和VirD5蛋白也以同样的方式进入植物细胞。第四阶段为T-DNA由胞质进入细胞核。单链的T-DNA前体与VirE2蛋白结合,高度螺旋化形成成熟的双链T-DNA,在VirD2和VirE2蛋白核定位信号的作用下移向细胞核,VirE3发挥作用保护T-DNA免受核酸酶的降解,VirF和T-DNA复合体经过核孔复合体进入到细胞核中。第五阶段为T-DNA的整合与表达。在VirD2和VirE2等蛋白的定位下,T-DNA复合体靶向植物染色体特定区域并与之结合,同时Vir蛋白从T-DNA复合体上解离,而T-DNA整合到宿主基因组中。T-DNA上携带的外源基因表达并合成冠瘿碱、生长素和激动素等物质以促进发状根的形成[20-22]。
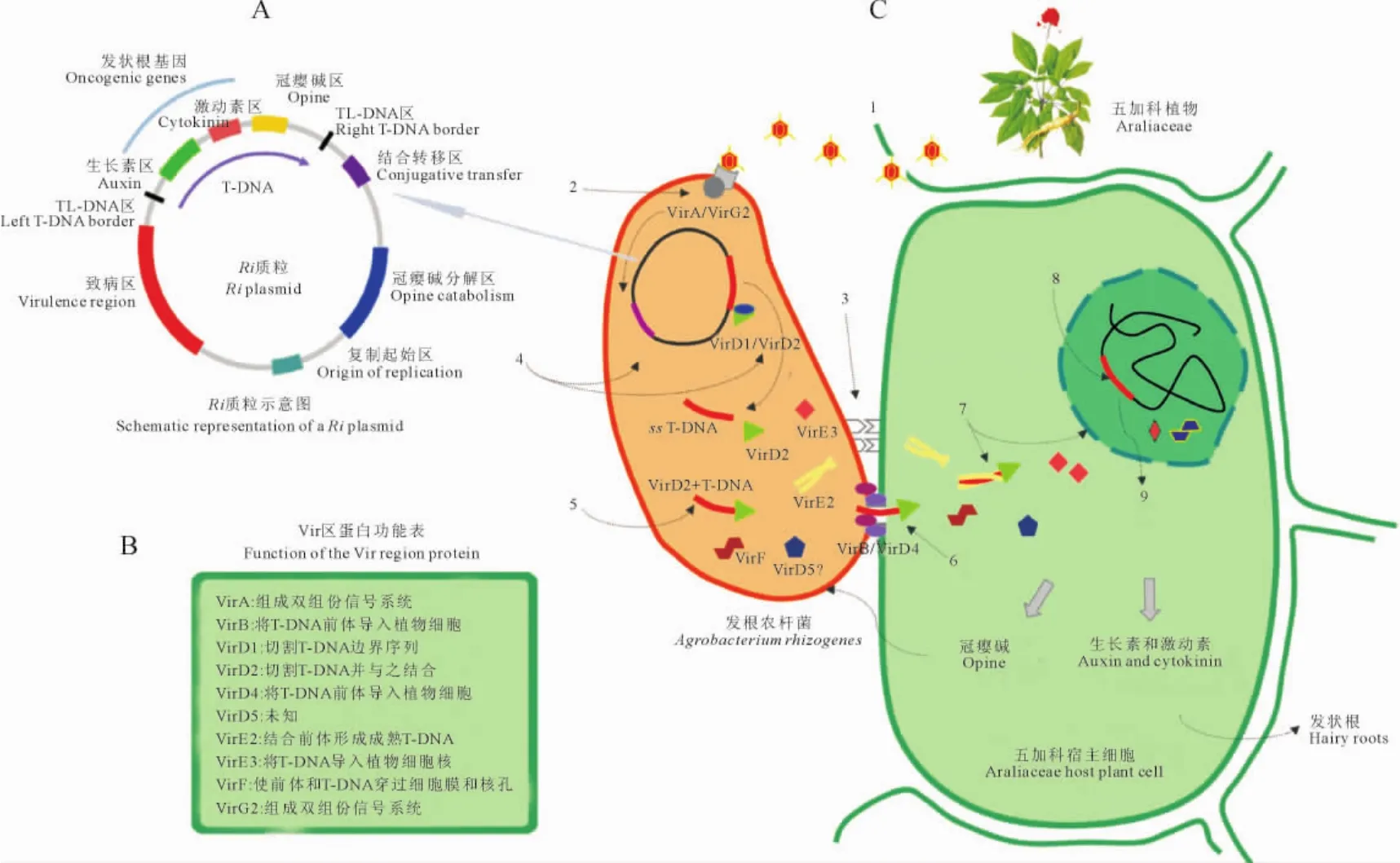
图1 发根农杆菌的结构及转导发根机制(根据Pacurar[21]图示改进)发根农杆菌转导的9个步骤为:1.受伤的植物细胞产生信号分子;2.信号分子被发根农杆菌识别、接受;3.发根农杆菌吸附在细胞表面;4.激活Vir蛋白加工ssT-DNA。5.形成不成熟的T-DNA复合体;6.T-DNA进入细胞;7.装配成熟的T-DNA复合体和核输入;8.T-DNA整合到植物基因组中;9.发根农杆菌基因的表达和蛋白质的合成Fig.1 Transformation mechanism of A.rhizogenes(modification based on the diagram described by Pacurar[21])The 9transformation steps of A.rhizogenes:1.Wounded plant cell produces signal molecules;2.Signal molecules are recognized by the bacterial receptors;3.A.rhizogenes attaches to the plant cell;4.Activated Vir proteins process the ss T-DNA;5.Formation of the immature T-complex;6.T-DNA transfer;7.Assembly of the mature T-complex and nuclear import;8.Random T-DNA integration in the plant genome;9.Expression of the bacterial genes and synthesis of bacterial proteins
3 发根农杆菌诱导五加科植物种类及诱导率的研究
目前,已有近百种药用植物成功诱导出发状根,但五加科药用植物诱导比例仅为2.7%[23],其中人参、西洋参、竹节参、龙牙揔木和刺五加等已成功诱导出发状根,且诱导率随种类、外植体和菌种的不同呈现一定的差异性(表1)。
3.1 人参
Jeong等[24]利用农杆菌KTCT2744转化人参的参根片诱导出发状根,在一定条件下培养,生命力旺盛,生长良好。赵寿经等[25]选取2年生人参的参根,用发根农杆菌A4菌株感染参根片,成功获得了人参发根且诱导率为18.3%,而郜玉钢等[26]选用3年生的人参根通过同样方法也诱导出了发状根,但未报道诱导率。据报道一些研究员[8]用发根农杆菌R15834菌株处理带叶和不带叶的人参幼茎也能诱导出发状根,诱导率为8.0%~28.0%,而用菌株R1610、LBA918、R1000、A4、R15834处理人参根的薄壁组织、子叶、真叶、无菌苗却没有获得发状根。在上述研究中,只有菌株KTCT2744、R15834和A4可转化人参发状根,且不同外植体诱导率高低依次为:带叶幼茎>参根片>幼茎,说明不同发根农杆菌对人参的不同部位敏感性不同,可能KTCT2744、A4和R15834分别对人参的根片和幼茎的较为敏感。发状根是在外植体的生理下端形成,所以参根片的诱导率高于幼茎,而叶片内源性激素类物质的运输也有助于发状根生成。
3.2 西洋参
赵寿经等[27]和贾冬梅等[28]用A4菌液以西洋参的参根片、茎和叶作为外植体诱导发状根,只有参根片上长出白色发根,诱导率最大为15.9%,谢海云等[29]用R1601诱导叶片和幼茎,1块外植体上长出了1条或几条的发状根。王冲之等[30]用R15834诱导叶柄、叶片和子叶,发现子叶未诱导出发根,叶的诱导率仅为4.8%,而叶柄诱导率最高达到了33.3%。我们分别用A4菌液和GIM菌液感染2年生的西洋参参根、西洋参无菌苗的子叶、下胚轴和1.0mg/L 2,4-D诱导的胚性愈伤组织,结果发现愈伤组织的诱导率最高,子叶次之,参根的诱导率最低,同时A4菌液诱导率比GIM菌液的要高(实验结果尚未发表)。上述研究表明:R1601、A4、R15834对西洋参不同外植体的诱导率高低依次为:叶柄>参根片>叶,这可能是因为叶柄细胞再生能力强,有明显的创伤反应,伤口附近的细胞较易脱分化形成较多的感受态细胞和发根农杆菌对根细胞较强的特异性以及根的创伤反应等因素造成的。
3.3 其他种类
除人参和西洋参外,广大学者对五加科其他植物种类发状根的诱导也有研究。张来等[31]用改造的发根农杆菌C58C1处理竹节参的地上茎部分,发现伤口处长出发状根,其诱导率高达90.0%。Kang等[32]用R15834菌诱导龙牙揔木的根和叶柄,诱导率分别为26.7%和10.0%,而在无R15834感染的根和叶柄中均未发现发根的形成。罗丽等[33]用C58C1和R1601接种刺五加均未诱导出发状根,但用R15834却成功的诱导出发根,且诱导率为10.0%,再以R15834菌株作为试验菌株,对刺五加叶片、茎段、叶柄进行感染,发现叶片的诱导率最高为16.0%,其次是叶柄为12.0%,茎段最低为10.0%。从以上研究可以看出:发根农杆菌R15834和C58C1对五加科不同种类的外植体敏感性明显不同,其大小为:竹节参>龙牙揔木>刺五加,而与人参和西洋参不同的是:刺五加的叶片、龙牙揔木的根和竹节参的地上茎都表现出了较高的诱导率,而叶柄的诱导率并不太高,这可能与五加科植物的种间差异性有关。
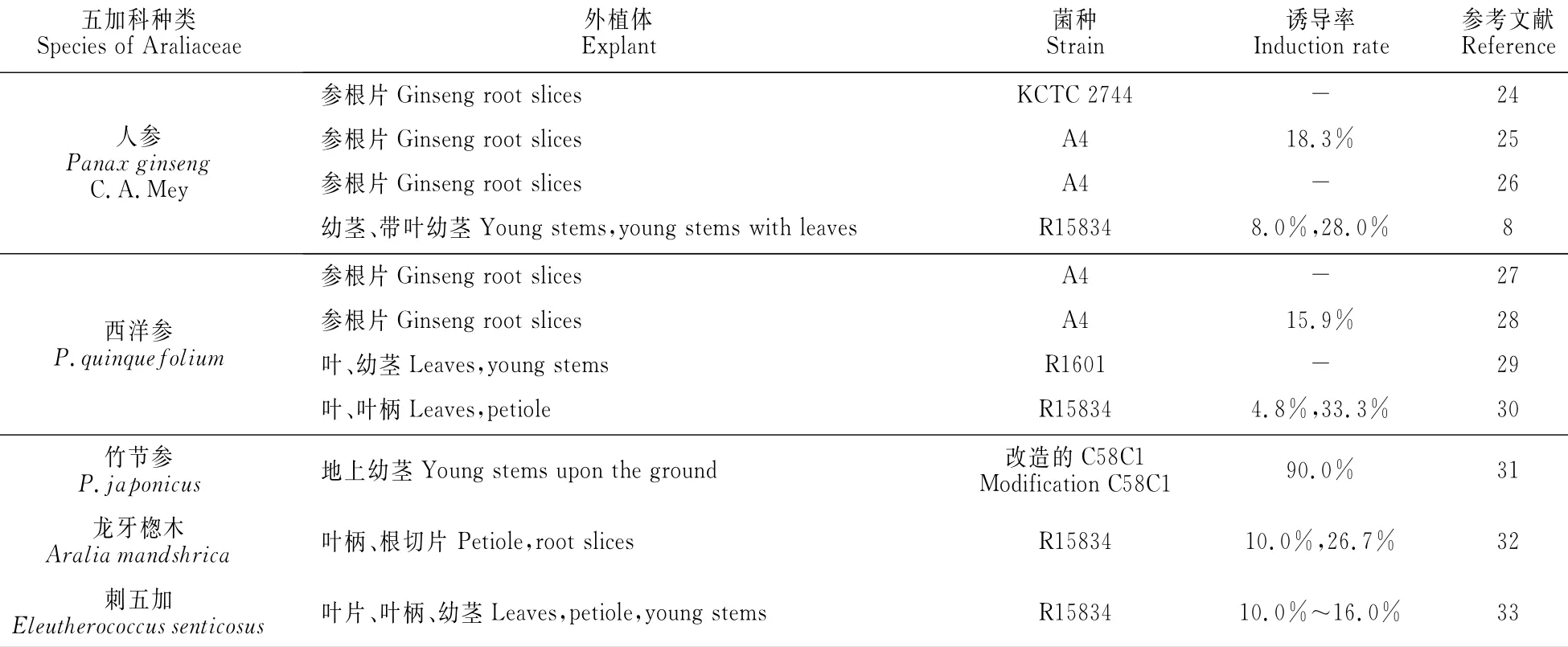
表1 发根农杆菌诱导五加科植物种类及诱导率Table 1 Species and induction rate of Araliaceae plant induced by A.rhizogenes
4 影响发状根诱导的因素
近年来,人们开始关注发根农杆菌对五加科发状根诱导率的研究,以获取优质品系和大量有用的次生代谢产物。众所周知,在诱导五加科发状根的过程中,不同菌株及菌液浓度、外植体取材部位、处理方式、预(共)培养时间、不同浓度的激素和乙酰丁香酮以及不同光照条件等因素都影响发状根的诱导率,故优化诱导条件对提高五加科诱导率至关重要。
4.1 不同菌株及菌液浓度
目前,诱导五加科药用植物发状根的常用菌株主要有A4、R15834、C58C1、R1601、KCTC 2744、LBA918和R1000等7种(表2)。在已诱导出的五加科植物发状根中,33%使用的是A4菌株,22%使用的是发根农杆菌R15834,14%使用的R1601,其余菌株的使用均在10%以内,众多学者的研究表明:A4和R15834菌株对五加科发状根诱导率更高,且稳定性更好,但张来等[31]用改良的C58C1菌处理竹节参,发根诱导率高达90%。除了菌株种类之外,其浓度也影响发状根的诱导率,大多学者以菌液浓度OD600=0.6来转化外植体,罗丽等[33]发现:当OD600<0.6时,转化率随着菌液OD600值的增加而急剧上升,当OD600=0.6左右转化率最高;而菌液浓度OD600值达到0.8后,若再增大菌液浓度,此时转化率又呈现急剧下降趋势,也有关于以每毫升菌液107个、OD600=0.01和OD600=1.0等浓度转化外植体,其诱导率较高的报道[8,25,32]。
4.2 外植体预培养时间、共培养时间和感染时间
农杆菌感染外植体后,伤口处的细胞因为过敏反应而导致褐化,严重影响发根的形成及转化率。将过夜培养的发根农杆菌加入新鲜的YEB液体培养基中,置于(180±20)r/min的摇床上,(25± 2)℃,0~4d[27,29,30,33]的预培养,能够较好地解决褐化问题,并且能够改变外植体的转化率。共培养时间长短与转化频率相关,这是因为发根农杆菌的TDNA转移与整合需要一定的时间,共培养时间不足,则不能完成T-DNA转移与整合,发状根的转化不能实现,延长共培养时间能提高转化频率。张来等[31]用C58C1菌液浸染竹节参地上幼嫩茎段时发现,在0~5min,无法诱导出发状根,5~35min,均能诱导出发状根,但在5~25min,诱导率随时间呈正相关,而在25~35min,诱导率却逐渐降低,25 min为最佳,诱导率为90%。罗丽等[33]在研究刺五加的发状根诱导条件时,发现共培养时间处在0~4 d之间时,转化率随着共培养时间的延长而逐渐升高,当共培养时间为4d时,转化率达到最高为14%。共培养时间超过4d后,转化率急剧下降。王冲之等[30]用R15834菌诱导西洋参发根时,发现3d是最佳的共培养时间,而且发状根多分枝,且生长十分旺盛。而刘峻等[34]采用共培养30d也诱导出了人参的发状根。
4.3 外源植物激素、抗生素及乙酰丁香酮(As)
在共培养阶段加入适量的外源植物激素对转化有一定的影响。萘乙酸(NAA)、激动素(KT)和油菜素类脂(BL)对发状根的生长有促进作用,王冲之等[30]用添加1mg/L 2,4-D、0.1mg/L KT的MS培养基,未能诱导出发状根,而使用添加6mg/L NAA的MS培养基进行农杆菌与外植体共培养,成功地获得了发状根。刘峻等[34]发现在含NAA、KT的条件下,外植体的愈伤化程度最高,分裂态细胞最多,转化率也最高,达到58%。周倩耘等[35]发现BL单独使用时,在低浓度下即表现出促进生长的活性。BL浓度为0.001mg/L时,诱导发根效果显著,其与不同浓度的吲哚丁酸(IBA)也表现出协同作用。乙酰丁香酮(AS)是一种酚类化合物,可诱发农杆菌内Ri质粒DNA上Vir区基因的活化和高效表达。罗丽等[33]发现,As能有效地提高刺五加发状根的转化频率,当As浓度处在0~400μmol/L时,转化率逐渐上升,当As浓度达到400μmol/L时,转化率最大达到24%,As浓度的进一步加大,其转化率呈急剧下降的趋势。
4.4 其他
影响农杆菌转化的因素还有很多,例如培养基的类型、pH、培养温度和光照等对发根诱导和生长。王冲之等[30]研究表明西洋参发状根在SJ-1和B5培养基生长状况较好,且发状根在B5增长速度较SJ-1高。孙彬贤等[36]发现人参发状根以MS为培养基,培养6周后收获较为合适。
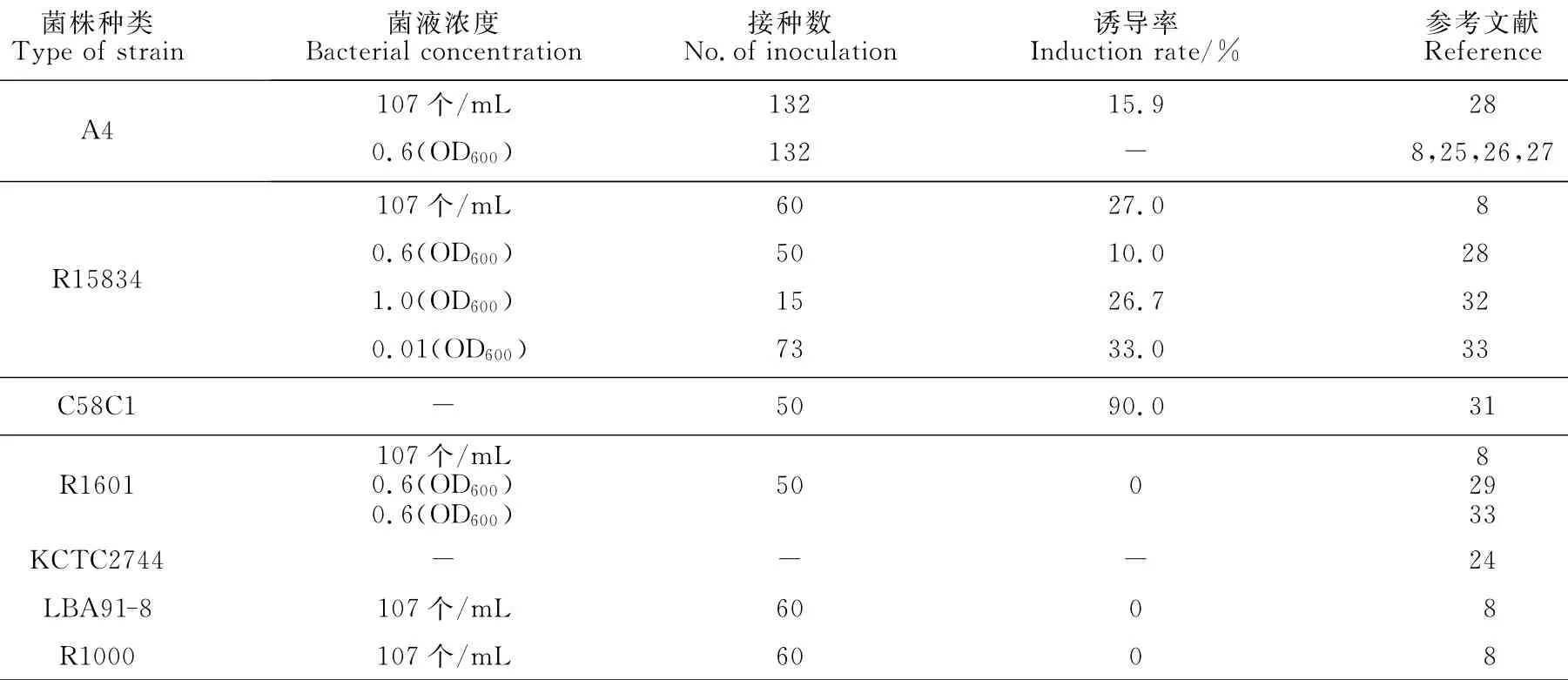
表2 菌液浓度对发状根诱导率的影响Table 2 Effect of different concentrations of A.rhizogenes on induction rate of hairy roots
5 发根农杆菌诱导五加科再生植株的研究及展望
迄今,广大学者对发根农杆菌诱导药用植物发根的产生已进行了大量研究,但通过发根农杆菌诱导五加科植物获得再生植株的报道较少。2009年,王建华[37]以人参、西洋参发根为外植体通过体细胞胚发生途径均获得了再生植株,并证实了他们的体细胞胚途径经历了类似合子胚的过程,且在基因表达上存在明显差异性。2011年,谢海云等[29]通过发根农杆菌诱导出西洋参的发状根,由间接器官发生途径诱导出不定芽,最终获得了再生植株。以发状根为外植体通过体细胞胚或者器官发生途径获得五加科再生植株目前还只是出于初级阶段。
近年来,发根农杆菌介导五加科药用植物方面研究取得了长足的进展,尤其是在人参、西洋参的发状根诱导和次生代谢产物生产方面进行了大量研究,但距离大规模工业化生产还有一定差距。在今后的研究中,以下几个方面应该得到更多的关注:(1)发根农杆菌菌株的改进与发掘。近年来,随着农杆菌侵染植物细胞机制的研究不断取得突破,可以设计新的方法和技术来控制DNA整合,发掘出适合不同植物并提高遗传转化效率的遗传转化新工具[38]。例如,已发现的超毒农杆菌菌株可以通过产生并向寄主细胞输送某些蛋白而提高侵染力,这些蛋白是易转化植物细胞因子的衍生物,为那些难转化植物带来了曙光。(2)发状根诱导条件方面研究。发根农杆菌诱导五加科植物的效率普遍不高,需要改变诱导条件、诱导方式,建立高效的转化体系,最大限度地提高发状根的诱导率。同时不断筛选高产、生长快速、耐剪切力的单克隆发状根无性系为大规模工业化生产奠定基础。(3)目前,药用植物发状根前期诱导和培养的报道居多,进行培养工艺优化方面的研究较少,严重地制约了大规模工业化生产。一些物理因素(如光强、温度)和化学因素(如培养基、碳源、氮源、激素、前体、诱导子等)、生物反应器的类型等均会对发状根的增殖和次生代谢物质的合成产生影响。因此,应该在发状根发酵培养技术优化方面需要进行重点研究。
[1] TAO L(陶 雷),YANG Y(杨 扬),YOU X L(由香玲).Advances for somatic embryogenesis of Araliaceae species[J].Chinese Agricultural Science Bulletin(中国农学通报),2014,30(25):7-11(in Chinese).
[2] SONG J(宋 娟),LEI X J(雷秀娟),YIN H X(尹红新),et al.Advances in study of medicinal plant suspension culture in Araliaceae[J].Special Wild Economic Animal and Plant Research(特产研究),2014,36(1):67-73(in Chinese).
[3] TANG CH X(唐春梓),LIN X M(林先明),YOU J W(由金文),et al.Resources protection and utilization of Araliaceae medical plants[J].Hubei Agricultural Sciences(湖北农业科学),2007,46(4):592-594(in Chinese).
[4] LIU L L(刘莉莉),LI CH Y(李昌禹).Development status of the hairy root[J].Northern Horticulture(北方园艺),2014,38(24):178-182(in Chinese).
[5] YOSHIKAWA T,FURUYA T.Saponin production by cultures of Panax ginsengtransformed with Agrobacterium rhizogenes[J].Plant Cell Reports,1987,20(6):449-453.
[6] WANG CH ZH(王冲之),DING J Y(丁家宜).Effects of different media and phytohormons on the growth and ginsenoside content of Panax quinquefoliumL.hairy root[J].Journal of Plant Resources and Environment(植物资源与环境学报),2001,10(4):1-4(in Chinese).
[7] LIU J(刘 峻),DING J Y(丁家宜),XU H(徐 红),et al.Genetic transformation of Panax gingseng C.A.meyer induced by root inducing plasmid(Ri)of Agrobacterium rhizogenes[J].China Journal of Chinese Materia Medica(中国中药杂志),2001,26(2):23-26(in Chinese).
[8] SEO J W,SHIN C G,CHIN Y E.Mass production of adventitions roots of Eleutherococcus senticosus through the bioreactor culture[J].Plant Biotechnol.,2003,5(3):187-191.
[9] YU SH H(于树宏),ZHAO L L(赵丽丽),WANG W(王 伟),et al.Factors affecting high-frequency induction of hair-like roots of Reynoutria japonica Houtt[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2005,25(9):1 740-1 746(in Chinese).
[10] WANG W(王 伟),LU Y(陆 杨),LI L(李 礼),et al.Induction of hairy roots fromCamptotheca acuminataand the content of camptothecin[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2008,28(12):2 416-2 422(in Chinese).
[11] LU W H(芦韦华),PAN X(潘 颀),WANG F(王 芳),et al.Influence of culture condition on Arnebia euchroma Hairy roots growth and Shikonin content[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2012,32(8):1 686-1 691(in Chinese).
[12] DANIJELA M,BRANISLAV S,MARIJANA S,et al.Secoiridoid glycosides production by Centaurium maritimum(L.)Fritch hairy root cultures in temporary immersion bioreactor[J].Process Biochemistry,2013,48(10):1 587-1 593.
[13] VEREMEICHIK G N,SHKRYL Y N,PINKUS S A,et al.Expression profiles of calcium-dependent protein kinase genes(CDPK1-14)in
Agrobacterium rhizogenes pRiA4-transformed calli of Rubia cordifolia under temperature-and salt-induced stresses[J].Journal ofPlant Physiology,2014,171(7):467-474.
[14] DMITROVIC S,MITIC N,BUDIMIR S,et al.Morpho-histological and bioherbicidal evaluation of wild-type and transformed hairy roots of goosefoot[J].South African Journal of Botany,2015,96(11):53-61.
[15] GUO SH H(郭生虎),WANG J D(王敬东),MA H A(马洪爱).Induction and in vitro culture of hairy roots of Glycyrrhiza uralensis Fisch[J].Scientia Agricultura Sinica(中国农学通报),2014,30(28):153-158(in Chinese).
[16] PAN Y(潘 野),WANG X F(王晓峰),LIN L(林 丽),et al.Research progress of hairy roots induced by Agrobacterium rhizogenes[J].Liaoning Agricultural Sciences(辽宁农业科学),2007,(5):31-33(in Chinese).
[17] JIANG Y N(姜伊娜),WU T L(武天龙).Research progress on hairy root and its application[J].Journal of Agricultural Science and Technology(中国农业科技导报),2009,11(1):27-32(in Chinese).
[18] KONG W Q(孔卫青),YANG J H(杨金宏),LU C D(卢从德).Establishment of Agrobacterium rhizogenes-mediated hairy roots inducement system for mulberry[J].Acta Bot.Boreal.-Occident.Sin.(西北植物学报),2010,30(11):2 317-2 320(in Chinese).
[19] PAVLOVA O A,MATVEYEVA T V,LUTOVA L A.rol-genes of Agrobacterium rhizogenes[J].Russian Journal of Genetics:Applied Research,2014,4(2):137-145.
[20] LI W L(李文龙),WANG Y Y(王媛媛),ZHANG F F(张芳芳),et al.Study on hairy roots of medicinal plant technology[J].Journal of Anhui Agricultural Science(安徽农业科学),2015,3(15):44-46(in Chinese).
[21] PACURAR D I,THORDAL C H,PACURAR M L,et al.Agrobacterium tumefaciens:From crown gall tumors to genetic transformation[J].Physiological and Molecular Plant Pathology,2011,76(2):76-81.
[22] ZHAO P(赵 佩),WANG K(王 轲),ZHANG W(张 伟),et al.Review and inspiration of plant proteins involved in the transformation processing of T-DNA initiated by Agrobacterium[J].Scientia Agricultura Sinica(中国农业科学),2014,47(13):2 504-2 518(in Chinese).
[23] ZHANG M(张 萌),GAO W(高 伟),WANG X J(王秀娟).Medicinal plant hairy roots generating and their applications[J].China Journal of Chinese Materia Medica(中国中药杂志),2014,39(11):1 956-1 960(in Chinese).
[24] JEONG G T,PARK D H,RYU H W,et al.Optimum conditions for transformed Panax ginseng Hairy roots in flask culture[J].Applied Biochemistry and Biotechnology,2002,100(1-3):1 129-1 139.
[25] ZHAO SH J(赵寿经),LI CH Y(李昌禹),QIAN Y CH(钱延春),et al.Induction of hairy roots of Panax ginsengand studies on suitable culture condition of Ginseng hairy roots[J].Chinese Journal of Biotechnology(生物工程学报),2004,20(2):215-220(in Chinese).
[26] GAO Y G(郜玉钢),SUN ZH(孙 卓),ZANG P(臧 埔),et al.Induction and molecule detection of Ginseng hairy roots[J].Journal of Anhui Agricultural Science(安徽农业科学),2010,38(17):8 970-8 972(in Chinese).
[27] ZHAO SH J(赵寿经),HOU Y(侯 艳),JIA D M(贾冬梅),et al.Induction of hairy root of Panax quinquefoliumL.and effects of different extrinsic regulators on the growth and ginsenoside content of hairy root[J].Nature Product Research and Development(天然产物研究与开发),2010,22(1):98-103(in Chinese).
[28] JIA D M(贾冬梅),ZHAO SH J(赵寿经),QIAN Y CH(钱延春),et al.Induction of hairy roots of Panax quinquefoliumby Ri plasmid and research on suitable culture condition of Panax quinquefoliumhairy roots[J].Journal of Jilin Agricultural University(吉林农业大学学报),2010,32(1):58-61(in Chinese).
[29] XIE H Y(谢海云),WANG Y(王 义),LI W(李 维),et al.Study on oranogensis and plant regeneration of hairy roots in Panax quinqedfoliumL.[J].Northern Horticulture(北方园艺),2011,35(10):164-166(in Chinese).
[30] WANG CH ZH(王冲之),DING J Y(丁家宜).Studies on Panax quinquefoliumL.hairy root transformed by Ri plasmid I.establishment and identification of transformed hairy root of Panax quinqedfoliumL.[J].Pharmaceutical Biotechnology(药物生物技术),1999,6(2):80-84(in Chinese).
[31] ZHANG L(张 来),ZHANG X Q(张显强),LUO ZH W(罗正伟),et al.Culture of hairy roots of Panax japonicus and ginsenoside Re synthesi[J].China Journal of Chinese Materia Medica(中国中药杂志),2012,35(18):2 383-2 387(in Chinese).
[32] KANG H J,ANBAZHAGAN V R,YOU X L,et al.Production of transgenic Aralia elata regenerated from Agrobacterium rhizogenesmediated transformed roots[J].Plant Cell,Tissue and Organ Culture,2006,85(2):187-196.
[33] LUO L(罗 丽),ZHOU ZH Y(周正渝).Study on inducing hairy roots of Acanthopanax senticosus[J].Chinese Agricultural Science Bulletin(中国农学通报),2013,29(10):178-181(in Chinese).
[34] LIU J(刘 峻),DING J Y(丁家宜),ZHOU Q Y(周倩耘),et al.Studies on influence of funal elicitor on hairy root of Panax ginsengbiosynthesis ginseng saponin and biomass[J].China Journal of Chinese Materia Medica(中国中药杂志),2004,29(4):302-304(in Chinese).
[35] ZHOU Q Y(周倩耘),DING J Y(丁家宜),LIU J(刘 峻),et al.Efect of brassinolide on the growth and ginsenoside content of Panax quinquefoliumhairy root[J].Plant Physiology Communications(植物生理学通讯),2003,39(3):193-196(in Chinese).
[36] SUN B X(孙彬贤),YANG G X(杨光孝),WANG Q L(汪沁琳),et al.Study on Panax ginsenghairy root and glycoside production[J].Chinese Traditional Patent Modicine(中成药),2003,25(9):58-60(in Chinese).
[37] 王建华.人参、西洋参发根体细胞胚胎发生及植株再生研究[D].吉林:吉林大学,2009.
[38] LIU W(刘 伟),HAO J P(郝建平).Advance of studies and applications of Agrobacterium rhizogenes[J].Journal of Shanxi Agricultural Sciences(山西农业科学),2007,35(7):13-16(in Chinese).
(编辑:宋亚珍)
Advances in Studies on Hairy Roots Induction of Araliaceae
JIANG Jinglong,JIANG Chao,SHEN Jixue,XU Weiping
(School of Biological Science and Engineering,Shaanxi University of Technology,Hanzhong,Shaanxi 723001,China)
Most of Araliaceae plants are important medicinal herbs.Agrobacterium rhizogenes have been used to induce plants of Araliaceae produced hair root,in which the important secondary metabolites are obtained.It is one of the effective ways to protect rare medicinal resources of Araliaceae plant and to achieve effective industrial production of secondary metabolites.In this paper,an overview of rhizogenes transformation history and transformation mechanism in medicinal plants is given as the basis.Meanwhile the present researches on species and induction rate,various factors and regeneration plants in Araliaceae plants induced by rhizogenes are analyzed.In addition,some suggestions on further research in several key fields are presented.All above will provide a reference for the exploiting and developing medicinal plant in Araliaceae.
Araliaceae;Agrobacterium rhizogenes;opine;acetosyringone;induction rate
Q813.1;Q949.763.2
A
10.7606/j.issn.1000-4025.2015.06.1276
1000-4025(2015)06-1276-07
2015-01-13;修改稿收到日期:2015-04-16
陕西省科技厅自然科学基础研究计划(2014JQ3113);陕西省教育厅自然科学研究(14JK1158);陕西理工学院研究生创新基金(SLGYCX1422)
蒋景龙(1980-),男,博士,讲师,硕士生导师,主要从事西洋参无性快速繁殖与发根农杆菌转化研究。E-mail:jiangjinglong511@163.com

