阿德呋啉-β-环糊精包合物的制备及其在鸡体内药动学研究
苏婷婷,阮祥春,周飞亚,晏 苒,曾明华
(安徽农业大学 动物科技学院,安徽 合肥 230036)
阿德呋啉-β-环糊精包合物的制备及其在鸡体内药动学研究
苏婷婷,阮祥春,周飞亚,晏 苒,曾明华
(安徽农业大学 动物科技学院,安徽 合肥 230036)
【目的】 研制阿德呋啉-β-环糊精包合物(阿德呋啉-β-CD),探讨其在鸡体内的药动学特征。【方法】 以溶液搅拌法制备阿德呋啉-β-CD包合物;以β-CD与阿德呋啉物质的量比、包合温度、冰醋酸与水的体积比和搅拌时间为影响因素,以综合评分(包合率和增溶倍数之和)为指标,通过正交试验优化制备条件;采用紫外光谱、薄层色谱和相溶解度法对制备的包合物进行验证。将10只试验鸡均分为2组,分别单次口服8 mg/kg阿德呋啉和阿德呋啉-β-CD包合物,采用液相色谱-串联质谱(HPLC-MS/MS)方法检测不同时间点的血药质量浓度,用3p97药代计算程序进行分析,计算主要药代动力学参数。【结果】 阿德呋啉经包合作用形成了新的物相,优选的阿德呋啉-β-CD制备工艺为:β-CD与阿德呋啉物质的量比为1.5∶1,搅拌时间为8 h,冰醋酸与水体积比为2∶8,包合温度为65 ℃。阿德呋啉-β-CD包合物在鸡体内的药动学特征符合口服吸收二室模型,其主要药代动力学参数峰质量浓度(Cmax)为(246.76±17.88) ng/mL,达峰时间(T(peak))为(0.312±0.004) h,曲线下面积(AUC)为(1 614.91±1.232) (ng·h)/mL,相对生物利用度(F)为146.4%。【结论】 成功制备了阿德呋啉-β-CD包合物,其在鸡体内达峰时间缩短,峰质量浓度提高,表明包合后阿德呋啉在鸡体内的吸收速度、程度和生物利用度均提高。
阿德呋啉;β-环糊精;包合物;鸡;HPLS-MS/MS;药代动力学
鸡球虫病(Coccidiosis of fowl)是由一种或几种艾美尔属球虫寄生于鸡肠道上皮细胞引起的原虫病,在世界各地普遍发生,致病率和死亡率较高,严重危害养禽业[1]。生产中人们常用抗球虫药物防治鸡球虫病,但由于对抗球虫药物的长期盲目选用及不合理使用,造成球虫对多数药物产生了耐药性,最终导致防治失败。所以开发高效低毒的新抗球虫药并合理使用这些药物,是保证球虫病防治效果的最佳途径。阿德呋啉(Adprin)是一种新型抗球虫药物,由安徽农业大学兽医药理实验室研制,其化学名为9-(2-氯-6-氟苯基)腺嘌呤, 主要干扰球虫核酸腺嘌呤合成,抑制次黄嘌呤在球虫体内的转运,干扰球虫核酸的合成,阻止球虫发育,效果与国外的阿普希特(Arprinocid)类似。本课题组前期研究已证实,阿德呋啉为高效低毒的抗球虫药,且和其他药物不产生交叉耐药性[2]。该药理化性质稳定,但水溶性差,在临床应用和鸡体吸收方面存在困难。β-环糊精(β-CD)及其衍生物(β-CDD)是近些年发展较快的新型药物包合材料,其对热稳定,且对肾无毒副作用[3],β-CD包被难溶性药物可改善药物的溶解度、溶出速率与生物利用度。本试验以β-CD为包合材料,研制阿德呋啉-β-CD包合物,并进一步探究了包合物在鸡体内的药代动力学特征,旨在为新药新剂型的开发和临床制定合理给药方案提供依据。
1 材料与方法
1.1 材 料
1.1.1 药物与试剂 阿德呋啉,含量98%(安徽农业大学药理实验室精制);β-CD,批号QB1613-92(孟州市华兴生物化工有限责任公司);甲醇为色谱纯试剂,其余试剂均为分析纯。
1.1.2 仪 器 主要仪器有:10 cm×20 cm硅胶GF254薄层板(上海工硕生物技术有限公司)、ZF-6紫外灯(上海楚柏实验室设备有限公司)、HJ-5磁力搅拌器(常州国华电器有限公司)、UVmini-1240紫外分光光度计(日本岛津有限公司)、API3000三重四级杆串联质谱仪(美国应用生物系统公司,配Agilent 1100型高效液相色谱仪和电喷雾离子源)、MS3 Basic型漩涡混合器(德国IKA公司)、CR22G型高速冷冻离心机(日本日立公司)。
1.1.3 试验动物 1日龄罗曼蛋雏鸡购自安徽禽业有限公司,饲喂不含药物的饲料,自由饮用温水,饲养至60日龄。
1.2 阿德呋啉-β-CD包合物的制备
1.2.1 标准曲线的建立 以甲醇-水溶液(V(甲醇)∶V(水)=1∶1)为溶剂,将阿德呋啉配制成5,10,20,50和100 μg/mL系列标准溶液,用紫外分光光度计于261 nm波长处测定其吸光度(OD261),以阿德呋啉标准溶液质量浓度为横轴(x),以OD261为纵轴(y),利用Excel 2007绘制阿德呋啉紫外吸收标准曲线,拟合回归方程。
1.2.2 阿德呋啉-β-CD包合物的制备方法 采用溶液搅拌法[4]制备阿德呋啉-β-CD包合物。称取一定量阿德呋啉溶于少量冰醋酸,制成溶液Ⅰ;按投料比称取适量β-CD于80~100 mL蒸馏水中,水浴加热使其完全溶解,制成溶液Ⅱ。60 ℃恒温搅拌条件下,缓缓将溶液Ⅱ滴加至溶液Ⅰ中。滴加完毕后,继续60 ℃恒温搅拌4~6 h,再于4 ℃冰箱静置冷藏,析出药物晶体后抽滤,用少量冰醋酸淋洗,去除游离的阿德呋啉,最后于70 ℃烘箱中烘干,过孔径为 0.2 mm的筛,即得阿德呋啉β-CD包合物。
1.2.3 最佳制备工艺的筛选 以综合评分(增溶倍数与包合率之和)为考察指标,以β-CD与阿德呋啉物质的量比(A)、包合温度(B)、冰醋酸与水的体积比(C)和搅拌时间(D)为影响因子,按L9(34)正交设计进行试验,确定阿德呋啉-β-CD包合物的最佳制备工艺。试验因素及水平见表1。溶解度的测定方法为:分别取过量阿德呋啉和制得的包合物于50 mL容量瓶中,加蒸馏水定容,28 ℃条件下超声处理(45 kHz,30 min),静置,取上层液用0.45 nm微孔滤膜过滤,取1 mL滤液于100 mL容量瓶中,加甲醇-水溶液(V(甲醇)∶V(水)=1∶1)定容,用紫外分光光度计于261 nm处测定吸光值,带入标准曲线计算溶解度。
增溶倍数=包合物溶解度/阿德呋啉溶解度。
包合率=包合物中阿德呋啉的量/阿德呋啉投入量×100%。

表1 制备阿德呋啉-β-CD包合物正交试验的因素及水平Table 1 Factors and levels of orthogonal design for adprin-β-CD complex preparation
1.2.4 包合物的验证 (1) 紫外光谱分析。按照包合物制备工艺中β-CD与阿德呋啉物质的量比,称取β-CD和阿德呋啉于广口瓶中,摇晃使之混合均匀,得到物理混合物。分别取阿德呋啉、β-CD、阿德呋啉与β-CD物理混合物和阿德呋啉-β-CD包合物的甲醇-水溶液(V(甲醇)∶V(水)=1∶1),在200~500 nm波长范围内进行紫外光谱扫描。
(2) 薄层色谱分析[5]。将阿德呋啉、β-CD、阿德呋啉与β-CD的物理混合物和阿德呋啉-β-CD包合物分别加甲醇制成2 mg/mL的溶液,备用。分别吸取以上4种溶液各5 μL于同一硅胶GF254薄层板[6]上点样,以氯仿-甲醇-异丙醇-浓氨水-水混合物(体积比为25∶9∶4∶1∶1)为展开剂展开(展开距离为12.5 cm),取出,晾干,在紫外灯254 nm波长下观察,比较4种被检物质的杂质斑点。
(3) 相溶解度分析[7-8]。配制0,0.005,0.01,0.015,0.02,0.03和0.04 mol/L β-CD水溶液,分别加入过量阿德呋啉,28 ℃条件下超声(45 kHz,2 h)处理后用0.45 nm微孔滤膜过滤,用甲醇-水溶液(V(甲醇)∶V(水)=1∶1)稀释100倍后,于261 nm处测定吸光值,根据吸光值和稀释倍数计算各溶液中阿德呋啉的溶解度。以β-CD浓度为横坐标(x),阿德呋啉溶解度为纵坐标(y)做图,得相溶解度曲线和线性方程。
1.3 阿德呋啉-β-CD包合物在鸡体内的药动学
1.3.1 鸡血浆中阿德呋啉质量浓度测定方法 采用液相色谱-串联质谱(HPLC-MS/MS)法测定鸡血浆中阿德呋啉质量浓度[9]。
(1)HPLC-MS/MS条件。色谱柱Luna C18(2)柱(5 μm,150 mm×2.00 mm);柱温38 ℃;流速200 μL/min;流动相A为体积分数0.1%甲酸-甲醇溶液,流动相B为体积分数0.1%甲酸水溶液;等度洗脱程序:以流动相A与流动相B混合液(体积比为75∶25)洗脱10 min。多反应监测(MRM)模式;离子化模式:ESI(+);雾化气流速:N250.0 L/min;喷雾电压:5 500 V;辅助气流速:N250.0 L/min;气帘气流速:N225.0 L/min;碰撞气流速:N210 L/min。
(2)血浆中阿德呋啉标准曲线的建立。取饲养至60日龄的非试验鸡的血液,2 500 r/min离心15 min后留上层血浆作为空白血浆,-20 ℃冰箱保存备用。向空白血浆中加入不同质量浓度阿德呋啉标准工作液,得到1,10,20,50,100,200,400和600 ng/mL的系列基质标准工作液,进行HPLC-MS/MS分析,以阿德呋啉质量浓度为横坐标(x),色谱峰面积为纵坐标(y),利用Excel 2007绘制标准曲线,拟合标准方程。
(3) HPLC-MS/MS的回收率及日内、日间精密度试验。用空白血浆配制0.25,0.5,1,2 ng/mL阿德呋啉样品。取2.0 mL样品,向其中加1 mL甲醇超声(45 kHz,5 min)提取,取提取液过SPE柱,流速为1 mL/min,用10 mL甲醇-水溶液(V(甲醇)∶V(水)=1∶1)淋洗SPE柱,负压抽干,用5 mL洗脱液洗脱,于40 ℃下用N2吹干[10]。用甲醇2 mL溶解SPE柱中的残余物,过0.22 μm的纤维素滤膜后进行HPLC-MS/MS分析。依据特征离子质量色谱峰信噪比(S/N,S为信号强度,N为背景噪声强度)>3得到检出限,S/N>10得到定量限。用鸡的空白血浆配制50,200和400 ng/mL阿德呋啉标准液,每个质量浓度做5个平行样,按上述方法处理样品后进样测定,计算回收率。一天内重复做3次,计算日内精密度;连续做3 d ,计算日间精密度。
1.3.2 给药方案与血样采集 将饲养至60日龄的10只试验鸡随机分为2组,即试验组和对照组,给药前禁食12 h,不禁水。试验组饲喂阿德呋啉-β-CD包合物,对照组饲喂阿德呋啉原药,均为一次性口服给药,给药剂量为8 mg/kg。分别于给药前0 h以及给药后0.25,0.5,1,2,4,6,8,10,12,24和48 h,于鸡的前翅静脉定点采血3 mL,置于添加了肝素钠的离心管中,2 500 r/min离心15 min,留取上层血浆作为血浆样品,-20 ℃冰箱保存备用。
1.3.3 方法适用性试验 取空白血浆、灌服阿德呋啉标准品后血浆样品、灌服阿德呋啉后的血浆样品、灌服阿德呋啉-β-CD包合物后的血浆样品,分别按1.3.1(3)中的方法处理后,进行HPLC-MS/MS分析。
1.3.4 药代动力学参数的测定 将给药后采得的血浆样品按1.3.1(3)中的方法处理后进行HPLC-MS/MS仪分析,得到不同时间点的血药浓度。药时数据采用3p97药代计算程序进行房室模型拟合,得出鸡一次性口服阿德呋啉及包合物后的药时曲线图,并比较2组数据的主要药代动力学参数。
2 结果与分析
2.1 阿德呋啉紫外吸收标准曲线的建立
以阿德呋啉标准溶液质量浓度为横轴(x),以OD261为纵轴(y),利用Excel 2007绘制的阿德呋啉紫外吸收标准曲线见图1,拟合得到的线性回归方程为:y=0.006 03x+0.024 7,r2=0.999 9。说明5~100 μg/mL阿德呋啉与OD261线性关系良好。
2.2 阿德呋啉-β-CD包合物最佳制备工艺的确定
由表2可知,4个因素对包合结果(表2)的影响是A>D>C>B,优选制备工艺为:A2D3C2B1,即 β-CD 与阿德呋啉物质的量比为1.5∶1,搅拌时间为8 h,冰醋酸与水体积比为2∶8,包合温度为65 ℃。最佳工艺制备的阿德呋啉-β-CD包合物的增溶倍数为17.7倍,包合率为71.4%。
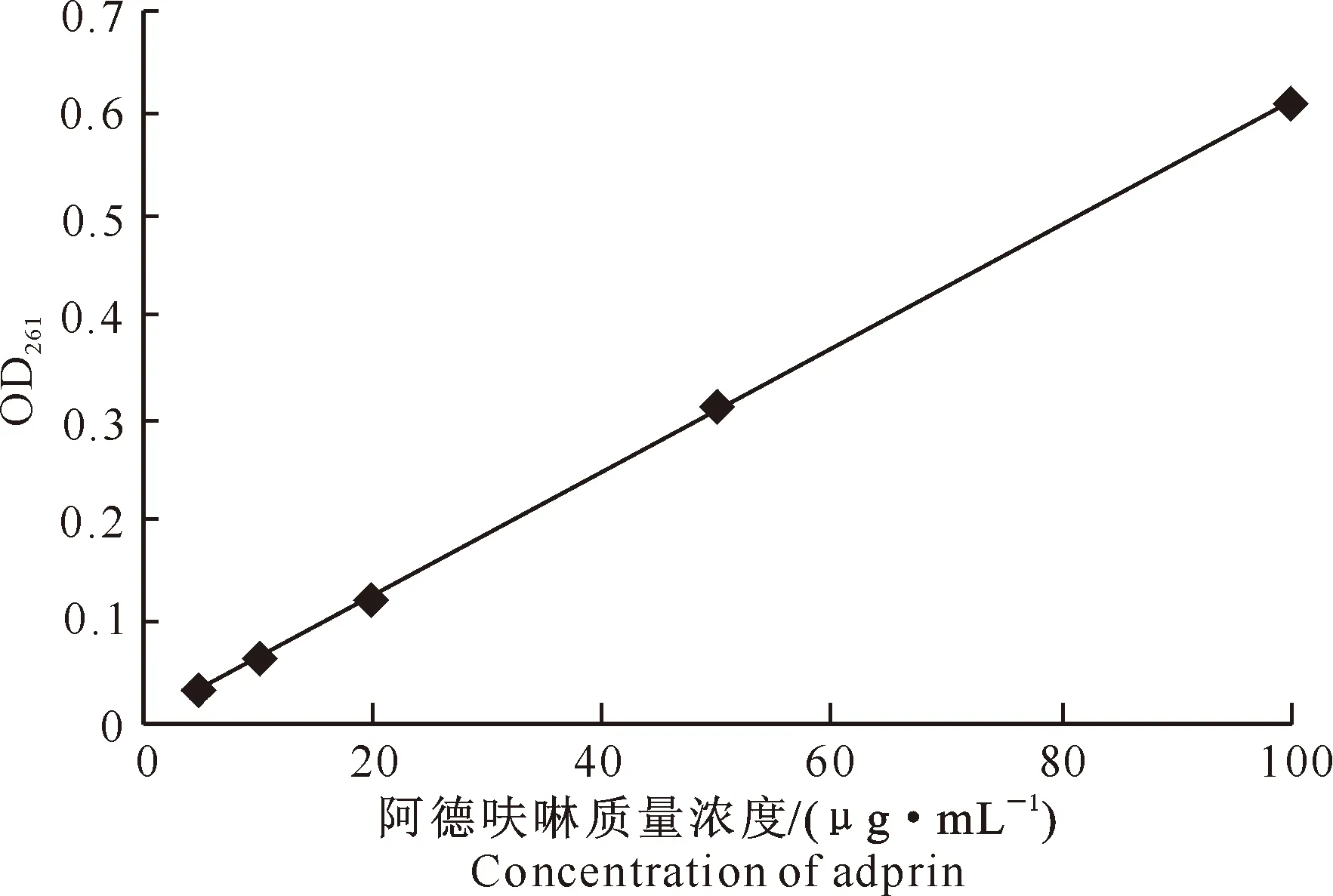
图1 阿德呋啉的紫外吸收标准曲线Fig.1 Standard UV absorption curve of adprin
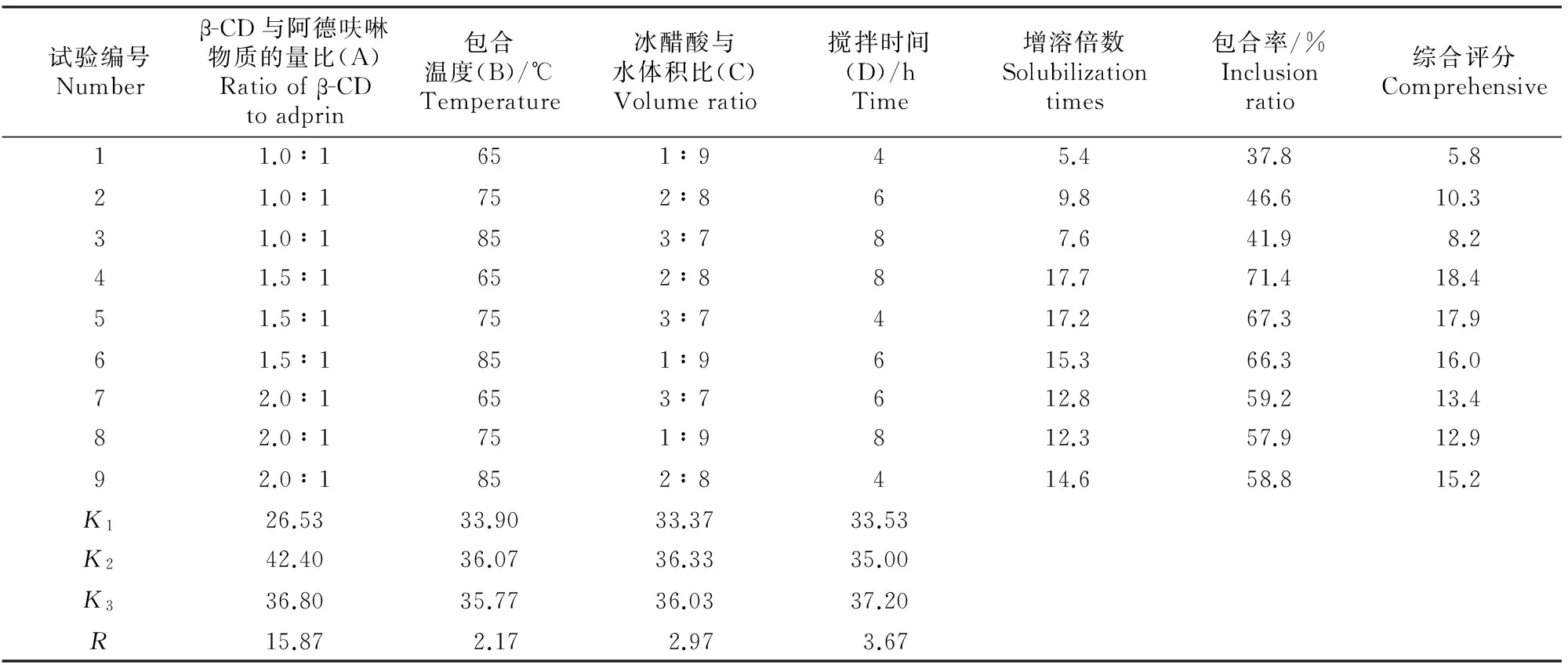
表2 阿德呋啉-β-CD包合物制备工艺筛选的L9(34)正交试验结果Table 2 Results of L9(34) orthogonal experiment for selecting the best preparation conditions of adprin-β-CD
2.3 阿德呋啉-β-CD包合物的验证
2.3.1 紫外光谱分析 结果显示,β-CD在波长200~500 nm的紫外区无吸收,说明辅料β-CD不干扰阿德呋啉的测定。阿德呋啉、阿德呋啉与β-CD的物理混合物以及阿德呋啉-β-CD包合物的紫外光谱图一致(图2),均在261 nm处有一个最大吸收峰,证明包合物中的主药阿德呋啉未发生化学变化,该包合物是通过物理包合作用形成的。
2.3.2 薄层色谱分析 薄层图谱结果(图3)显示,在展开剂相同的条件下,阿德呋啉及其与β-CD物理混合物的甲醇溶液都有相同的杂质斑点,而包合物和β-CD的甲醇溶液则无杂质斑点。表明阿德呋啉已被β-CD包合而不能显示杂质斑点。
2.3.3 相溶解度分析 绘制相溶解度曲线(图4),按照Higuchi分类法[11]可知该相溶解度曲线为典型的AL型,阿德呋啉溶解度随β-CD浓度的增加呈线性增大,线性方程为y=0.040 3x+0.000 5,r2=0.976 8,其中x为β-CD浓度,y为阿德呋啉溶解度。由公式K=斜率/[截距(1-斜率)],计算出40 ℃下包合物的表观稳定常数K为83.98。说明在该浓度范围内,原药阿德呋啉与β-CD可形成包合物。

图2 β-CD、阿德呋啉及其二者物理混合物和包合物的紫外扫描结果A.β-CD; B.阿德呋啉;C.阿德呋啉与β-CD的物理混合物;D.阿德呋啉-β-CD包合物Fig.2 UV scanning spectrum of β-CD,adprin,physical mixture and inclusion complexA.β-CD;B.Adprin;C.Physical mixture;D.Inclusion complex
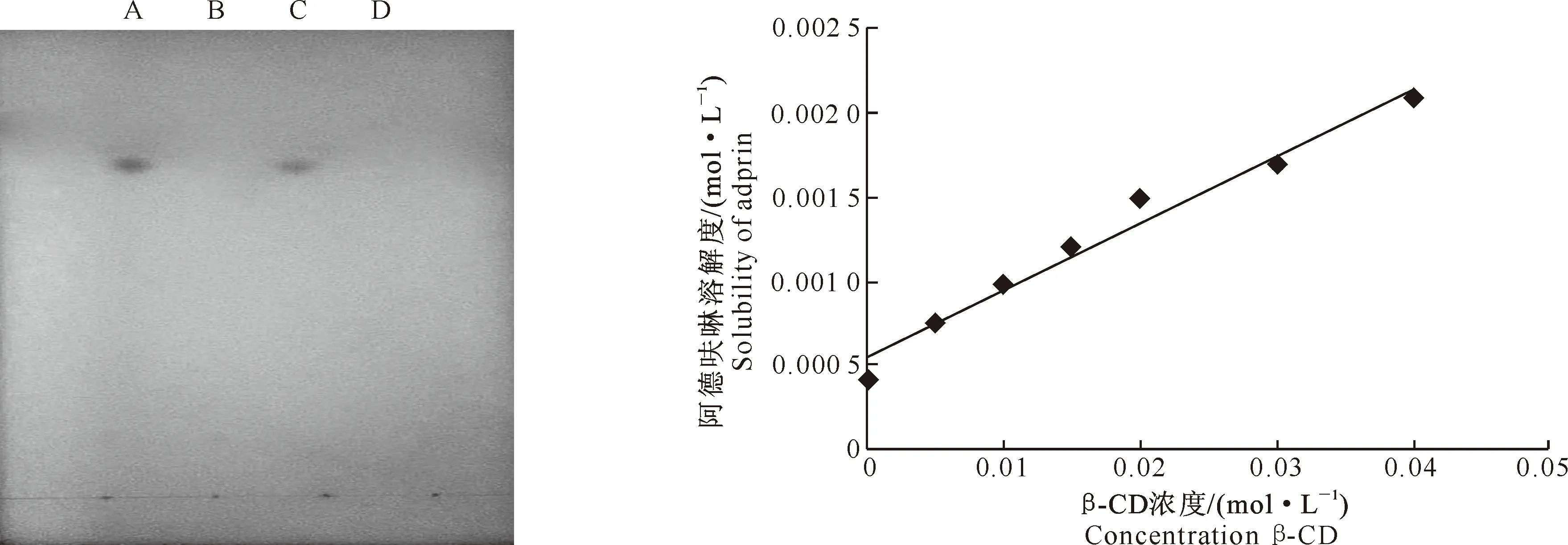
图3 阿德呋啉、β-CD及其二者物理混合物和包合物的薄层色谱图A.阿德呋啉;B.β-CD;C.阿德呋啉与β-CD的物理混合物;D.阿德呋啉-β-CD包合物Fig.3 Thin layer chromatogram of adprin,β-CD,physical mixture of adprin and β-CD,and inclusion complexA.Adprin;B.β-CD;C.Physical mixture;D.Inclusion complex
2.4 阿德呋啉-β-CD包合物在鸡体内的药动学研究
2.4.1 血浆中阿德呋啉标准曲线的建立 以阿德呋啉质量浓度为横坐标(x),色谱峰面积为纵坐标(y),利用Excel 2007绘制的血浆中阿德呋啉紫外吸收标准曲线见图5,拟合得线性回归方程为y=0.394 5x+0.763 2,r2=0.999 7(>0.999),表明峰面积与阿德呋啉质量浓度线性关系良好。

图5 鸡血浆中阿德呋啉的紫外吸收标准曲线Fig.5 Standard UV absorption curve of adprin in chicken plasma
2.4.2 HPLC-MS/MS的回收率以及日内、日间精密度试验结果 计算得到的最低检测限(S/N=3)为0.7 ng/mL,最低定量限(S/N=10)为2.3 ng/mL。HPLC-MS/MS方法对血浆中50,200和400 ng/mL 阿德呋啉的回收率分别为(96.28±0.24)%,(92.86±0.17)%和(89.77±0.69)%;日内精密度分别为3.16%,5.87%和3.47%;日间精密度分别为4.68%,5.23%和6.14%(表3)。证明该方法回收率良好,灵敏度高,可用于灌服阿德呋啉-β-CD包合物后鸡血浆中阿德呋啉质量浓度的测定。
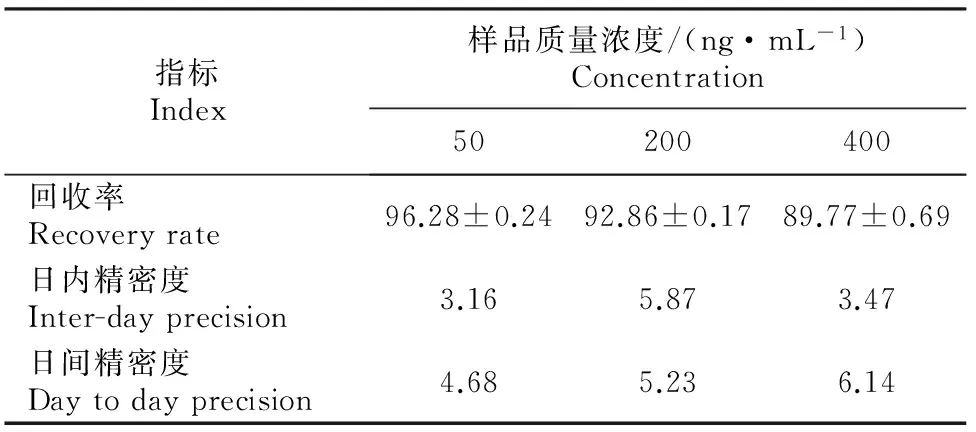
表3 阿德呋啉在鸡血浆中的回收率和精密度(n=3)Table 3 Recovery and precision test of adprin in chicken plasma (n=3) %
2.4.3 HPLC-MS/MS的适用性 由图6可知,在设定的色谱、质谱条件下,空白血浆对药物测定无干扰,药物分离良好。表明该方法适合鸡血浆中阿德呋啉的检测。
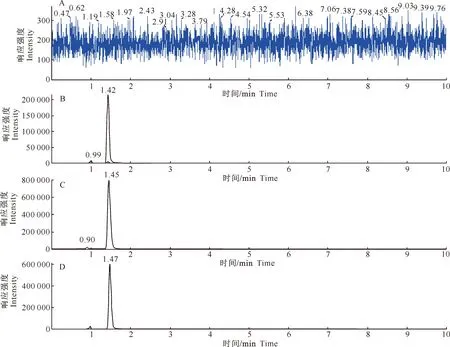
图6 空白及灌服阿德呋啉和包合物后鸡血浆样品的色谱图
A.空白血浆;B.灌服阿德呋啉标准品后血浆样品;C.灌服阿德呋啉后血浆样品;D.灌服阿德呋啉-β-CD包合物后血浆样品
Fig.6 Chromatograms of blank plasma and plasma samples of chickens in oral dosing adprin group
A.Blank plasma;B.Plasma sample of standard adprin;C.Plasma sample of oral adprin;D.Plasma sample of oral inclusion
2.4.4 主要药动学参数测定 根据鸡一次性口服阿德呋啉及阿德呋啉-β-CD包合物后不同时间的血药质量浓度(C)绘制药时曲线(图7),药时数据经3p97药代计算程序处理,二者的结果均符合口服给药二室模型(权重=1/C/C),模拟方程分别为C=2 682.293e-0.538t+18.851e-0.042t-2 701.144e-0.634t和C=231.738e-0.379t+27.054e-0.038t-258.792×e-42.167t。
利用各时间点平均血药浓度计算主要药动学参数,结果见表4。表4显示,阿德呋啉包合前后T(peak)分别为(1.777±0.063)和(0.312±0.004) h,Cmax为(156.878±13.69)和(246.763±17.88) ng/mL。以阿德呋啉原料为参比,计算包合物的相对生物利用度F(AUC包合物/AUC原药×100%)为146.4%。
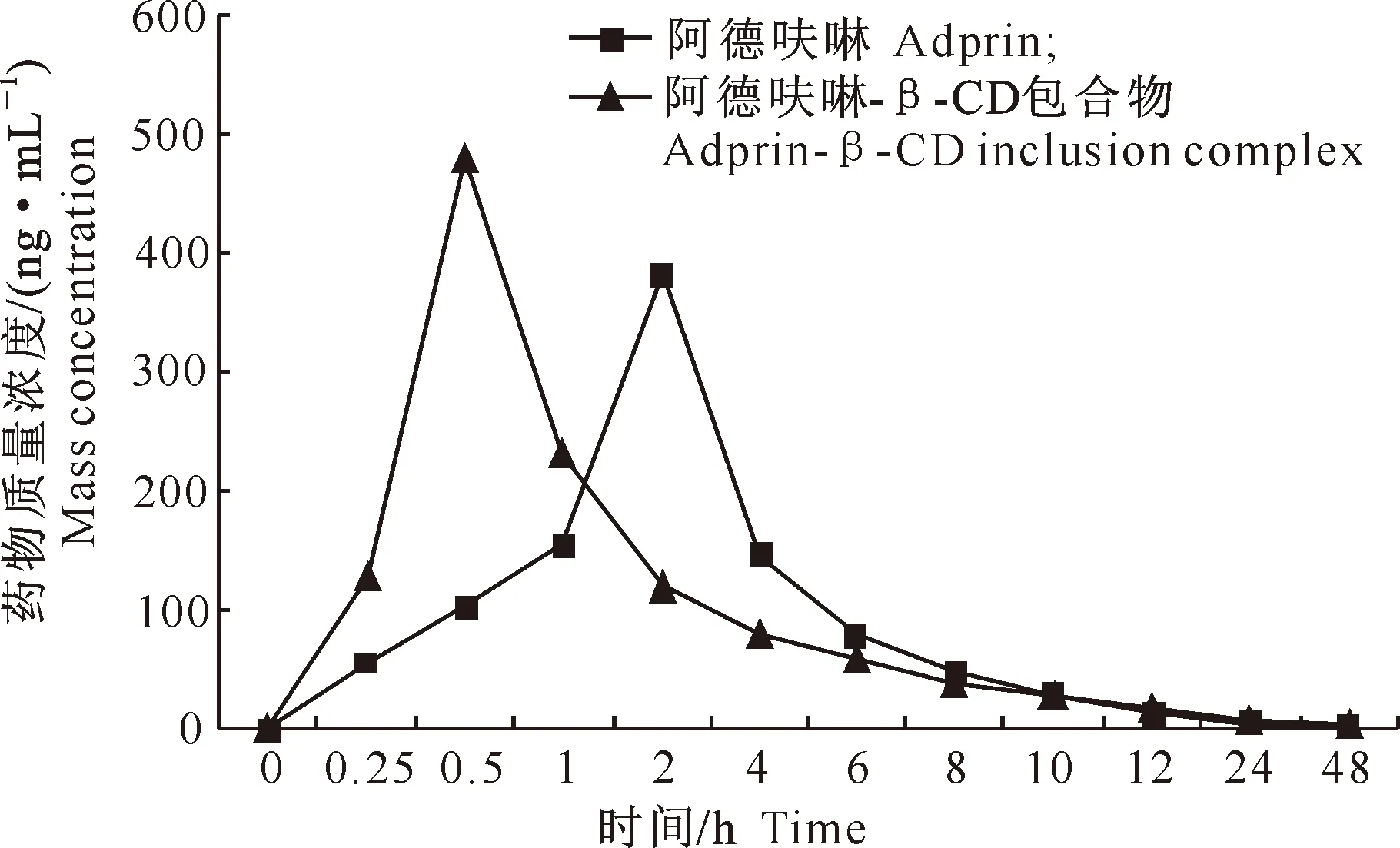
图7 鸡单剂量(8 mg/kg)灌服阿德呋啉及包合物后的药时曲线
Fig.7 Concentration-time curve of adprin and inclusion in chickens at a dose of 8 mg/kg
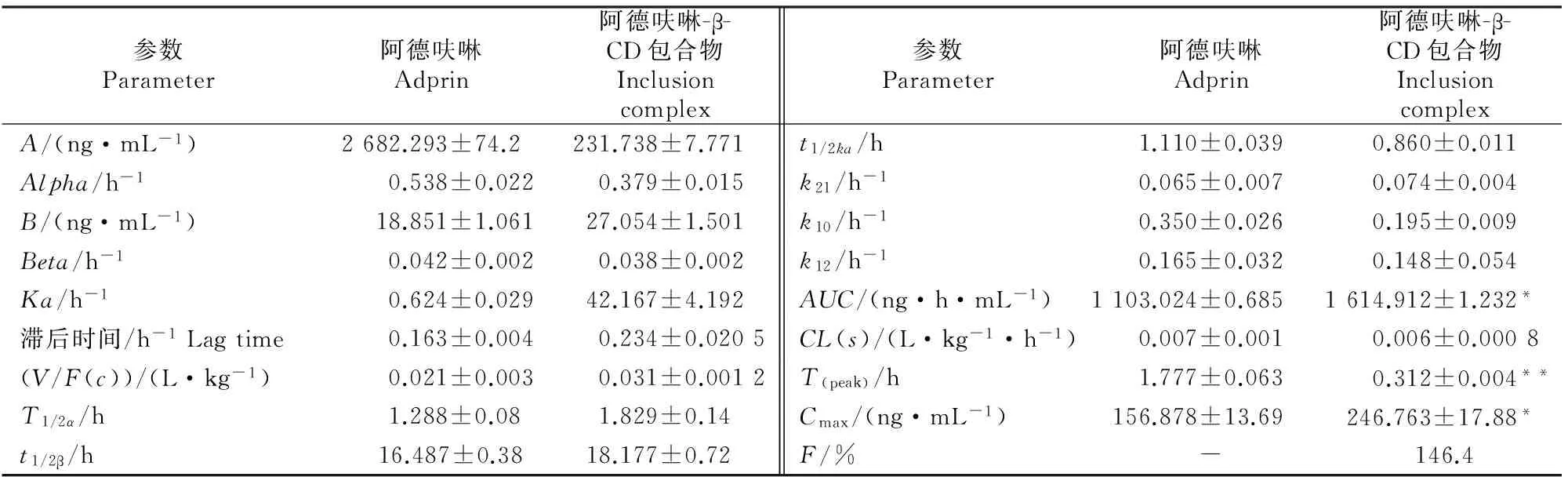
表4 鸡单剂量(8 mg/kg)灌服阿德呋啉及包合物后的药代动力学参数表(n=5)Table 4 Pharmacokinetics parameters of adprin and inlusion complex after a dose of 8 mg/kg (n=5)
注:A.分布相质量浓度;Alpha.分布速度常数;B.消除相质量浓度;Beta.消除速度常数;Ka.吸收速率常数;V/F(c).表观分布体积;T1/2α.分布半衰期;t1/2β.清除半衰期;t1/2ka.吸收半衰期;k21.由周边室向中央室转运的一级速率常数;k10.由中央室消除的一级速率常数;k12.由中央室向周边室转运的一级速率常数;AUC.药时曲线下面积;CL(s).清除率;T(peak).达峰时间;Cmax.峰质量浓度;F.相对生物利用度。**表示阿德呋啉与包合物的T(peak)差异极显著(P<0.01);*表示阿德呋啉与包合物的Cmax和AUC差异显著 (P<0.05)。
Note:A.Distribution phase content;Alpha.Distribution rate constant;B.Elimination phase content;Beta.Elimination rate constant;Ka.Absorption rate constant;V/F(c).Apparent volume of distribution;T1/2α.Distribution half-life;t1/2β.Elimination half-life;t1/2ka.Absorption half-life;k21.The primary rate constant of the transport of the central compartment by the peripheral chamber;k10.The primary rate constant of the central chamber elimination;k12.The primary rate constant of the transport of the peripheral chamber by the central compartment;AUC.Area under curve;CL(s).Total body clearance;T(peak).Peak time;Cmax.Peak quality concentration;F.Relative bioavailability.** indicates very significant difference onT(peak)between adprin and inclusion atP<0.01;* indicates significant difference onCmaxandAUCbetween adprin and inclusion atP<0.05.
3 讨论与结论
3.1 包合物的筛选制备与鉴定
β-CD分子是外表面亲水而内表面疏水的空腔,一定大小的难溶性药物分子经其包合后,可以不同程度地提高药物的水溶性和生物利用度[12]。本研究通过正交试验,以综合评价(增溶倍数与包合率之和)为考察指标,筛选出了制备阿德呋啉-β-CD包合物的最佳工艺条件:β-CD与阿德呋啉物质的量比为1.5∶1,搅拌时间为8 h,冰醋酸与水的体积比为 2∶8,包合温度为65 ℃。制备的包合物在水中溶解度比阿德呋啉增大了17.7倍,包合率达71.4%。本试验采用紫外分光光度法、薄层色谱法[13]和相溶解度法对所制备的阿德呋啉-β-CD包合物进行验证,结果证实包合物制备成功。其中关于阿德呋啉的薄层色谱鉴别方法目前尚无相关报道,笔者经过反复预试验建立了鉴定阿德呋啉的薄层色谱法,该方法简单易行,分离效果良好,适用于阿德呋啉的初步鉴定。
3.2 包合物的药代动力学特征分析
本试验采用HPLC-MS/MS测定鸡血浆中药物质量浓度,优化了吴丽君等[14]对阿德呋啉在鸡体内药动学研究中的血浆处理方法,该方法更加方便、安全、高效,结果分离良好,峰形理想,灵敏度、回收率和精密度提高,适用于对阿德呋啉-β-CD包合物在鸡体内药动学的研究。药时数据经3p97药代计算程序处理后,得出阿德呋啉和阿德呋啉-β-CD包合物在鸡体内都属于口服吸收二室模型,与吴丽君等[14]研究结果基本一致。从本研究的药代参数来看,阿德呋啉-β-CD包合物达峰时间T(peak)缩短,由原药的(1.777±0.063) h减少至(0.312±0.004) h,且峰质量浓度Cmax由(156.878±13.69) ng/mL提高到(246.763±17.88) ng/mL。证明阿德呋啉经β-CD包合后,在鸡体内的吸收速度和程度都有所提高,而消除速度常数(Beta)并没有明显差异,阿德呋啉-β-CD包合物可以维持较长时间的有效血药浓度,这可能是因为包合物拥有更好的溶解性,从而改善了药物在体内的溶出和吸收[15]。以阿德呋啉为参比,阿德呋啉-β-CD包合物的相对生物利用度(F)为146.4%,证实阿德呋啉-β-CD包合物的药物生物利用度提高,而二者的清除速率CL(s)相当,也验证了阿德呋啉-β-CD包合物是通过物理包合形成的,并未改变药物在体内的消除过程[16]。
本试验通过对阿德呋啉-β-CD包合物的研制及其在鸡体内药动学研究,成功制得阿德呋啉-β-CD包合物,提高了阿德呋啉的水溶性和生物利用度。为新药新剂型的开发提供了参考,也为提高临床治疗效果及制定合理临床给药方案打开了思路。
[1] 索 勋.鸡球虫病学 [M].北京:中国农业大学出版社,1998.
Suo X.Coccidia and coccidia and coccidiosis of domestic fowl [M].Beijing:China Agriculture University Press,1998.(in Chinese)
[2] 吴丽君,曾明华,江善祥,等.阿德呋啉对人工感染鸡球虫病的疗效试验 [J].中国兽药杂志,2011,45(9):29-31.
Wu L J,Zeng M H,Jiang S X,et al.Efficacy of adprin on artificial coccidiosis in chicken [J].Chinese Journal of Veterinary Drug,2011,45(9):29-31.(in Chinese)
[3] 何仲贵.环糊精包合技术 [M].北京:人民卫生出版社,2008.
He Z G.Cyclodextrin inclusion technique [M].Beijing:The People’s Medical Publishing House,2008.(in Chinese)
[4] Li N,Zhang Y H,Wu Y N,et al.Inclusion complex of trimethoprim with β-cyclodextrin [J].J Pharm Biomed Anal,2005,39:824-829.
[5] 魏海涛,宋 敏,李亮华,等.氟苯尼考-β-环糊精包合物的研制 [J].华南农业大学学报,2009,30(4):94-97.
Wei H T,Song M,Li L H,et al.Preparation of inclusion complex of florfenicol-β-cyclodextrin [J].Journal of South China Agricultural University,2009,30(4):94-97.(in Chinese)
[6] 邹玉珠,符华林,张 伟,等.甲氧苄啶羟丙基-β-环糊精包合物的制备及在家兔体内的药代动力学研究 [J].中国兽医科学,2010,40(12):1285-1290.
Zou Y Z,Fu H L,Zhang W,et al.Preparation of trimethoprim-hydroxypropy-β-cyclodextrin inclusion complex and its pharmacokinetics in rabbit [J].Chinese Veterinary Science,2010,40(12):1285-1290.(in Chinese)
[7] Rajewski R A,Stella V J.Pharmaceutical applications of cyclodextrins 2:Invivodrug delivery [J].Journal of Pharmaceutical Sciences,1996,85(11):1142-11691.
[8] 王 娜,谭群友,刘 娟,等.利福平-羟丙基-β-环糊精包合物的制备和评价 [J].中国现代应用药学,2010,27(2):128-131.
Wang N,Tan Q Y,Liu J,et al.Preparation and evaluation of rifampicin hydroxypropy-β-Cyclodextrin inclusion compound [J].China JMAP,2010,27(2):128-131.(in Chinese)
[9] Mary M,Lesa C,John O M,et al.Determination of 20 coccidiostats in egg and avian muscle tissue using ultra high performance liquid chromatography-tandem mass spectrometry [J].Journal of Chromatography A,2012,1253:94-104.
[10] 陈水娟,付栋君,高姗姗,等.难溶性药物BMCP25二甲基-β-环糊精包合物的表征及在大鼠体内的药动学 [J].中国医药工业杂志,2013,44(2):171-174.
Chen S J,Fu D J,Gao S S,et al.Characterization and pharmacokinetics of dimethyl-β-cyclodextrin inclusion complexes of water insoluble drug BMCP25 in rats [J].Chinese Journal of Pharmaceuticals,2013,44(2):171-174.(in Chinese)
[11] Zhang X Y.Increased stability and solubility of dihydroartemisinin in aqueous solution through the formation of complexes with 2-hydroxypropy-β-cyclodextrin [J].Journal of Chinese Pharmaceutical Sciences,2009,18:170-176.
[12] 张海亮,薛 芬,李引乾,等.伊维菌素HP-β-CD包合工艺的优化 [J].畜牧与兽医,2009,41(8):5-8.
Zhang H L,Xue F,Li Y Q,et al.Optimization for preparation process of ivermectin enveloped with hydroxypropy-β-cyclodextrin [J].Animal Husbandry and Veterinary Medicine,2009,41(8):5-8.(in Chinese)
[13] 罗 媛,郑 林,兰燕宇,等.菊黄上清含片中冰片-β-环糊精包合物的制备工艺 [J].贵阳医学院学报,2010,35(2):137-140.
Luo Y,Zheng L,Lan Y Y,et al.Study on preparation technology of Borneo-β-cyclodextrin inclusion complex in Juhuang Shangqing buccal tablet [J].Journal of Guiyang Medical College,2010,35(2):137-140.(in Chinese)[14] 吴丽君,曾明华,晏 苒,等.阿德呋啉血药浓度的测定及其在鸡体内药动学研究 [J].南京农业大学学报,2013,36(5):125-128.
Wu L J,Zeng M H,Yan R,et al.Determination of the plasma adprin concentrations and studies on its pharmacokinetics in chickens after oral administration [J].Journal of Nanjing Agricultural University,2013,36(5):125-128.(in Chinese)
[15] Cui H M,Wu F L.Pharmacokinetics of Eb and its hydroxyp-ropy-β-cyclodextrin inclusion complex in rats [J].Journal of Chinese Pharmaceutical Sciences,2010,19(1):52-58.
Preparation of adprin-β-cyclodextrin inclusion complex and its pharmacokinetics in chicken
SU Ting-ting,RUAN Xiang-chun,ZHOU Fei-ya,YAN Ran,ZENG Ming-hua
(CollegeofAnimalScienceandTechnology,AnhuiAgriculturalUniversity,Hefei,Anhui230036,China)
【Objective】 The aim of this study was to prepare the inclusion complex of adprin-β-cyclodextrin and evaluate its pharmacokinetic behavior in chicken.【Method】 Adprin-β-cyclodextrin inclusion complex was prepared using solution-stirring method.The influence factors were ratio of the amount of substance,temperature,volume ratio of acetic acid to water,and mixing time.The best preparation method was determined by orthogonal test using comprehensive score (sum of inclusion rate and solubilization ratio) as index.The identification of the inclusion complex was carried out by ultraviolet spectra,thin layer chromatography,and phase solubility method.The blood samples from 10 chickens fed with a single dose of either adprin or adprin-β-CD inclusion complex solusion were collected to measure adprin concentrations in plasma by HPLC-MS/MS.The pharmacokinetic parameters were analyzed with 3p97 software.【Result】 The inclusion complex was successfully prepared.The optimum preparation conditions were:molar ratio of β-cyclodextrin to adprin 1.5∶1,ratio of glacial acetic acid to water 2∶8,inclusion temperature 65 ℃,and time 8 h.The major pharmacokinetic parameters of adprin-β-cyclodextrin were:Cmax(246.76±17.88) ng/mL,T(peak)(0.312±0.004) h,andAUC(1 614.91±1.232) (ng·h)/mL,and relative bioavailability of adprin-β-cyclodextrin 146.4%.【Conclusion】 Adprin-β-CD inclusion complex was prepared successfully,and it could significantly improve the solubility bioavailability of adprin in chicken.
adprin;β-cyclodextrin;inclusion complex;chicken;HPLS-MS/MS;pharmacokinetics
2014-01-25
安徽省教育厅重点项目“高效低毒抗球虫新兽药的研发”(KJ2012A115)
苏婷婷(1990-),女,安徽宣城人,在读硕士,主要从事兽医药理学研究。E-mail:1015432812@qq.com
曾明华(1957-),男,安徽合肥人,副教授,主要从事基础兽医药理、药剂学与动物毒理学研究。 E-mail:zmhzmh@ahau.edu.cn
时间:2015-06-30 13:47
10.13207/j.cnki.jnwafu.2015.08.032
S858.31;S859.79+5
A
1671-9387(2015)08-0063-08
网络出版地址:http://www.cnki.net/kcms/detail/61.1390.S.20150630.1347.032.html

