毛果杨HDA901基因的克隆和表达分析
吕世博,毛昱力,姜廷波,马旭俊
(东北林业大学 林木遗传育种国家重点实验室,哈尔滨150040)
组蛋白乙酰化是一种重要的表观遗传修饰,包括组蛋白乙酰化和去乙酰化2个动态的、可逆的过程。组蛋白去乙酰化酶(histone deacetylase,HDAC)介导组蛋白去乙酰化,与组蛋白乙酰基转移酶(histone acetyltransferase,HAT)共同作用来调节组蛋白乙酰化的状态。组蛋白乙酰化状态能够影响染色质结构以及基因转录,进而调节多种生命活动。HAT 是将乙酰基辅酶A 上的乙酰基团转移到组蛋白的赖氨酸残基上;而HDAC的作用是将组蛋白赖氨酸残基上的乙酰基团去除。HDAC 介导的组蛋白去乙酰化使染色质结构处于紧缩状态,不利于转录因子或转录调节因子与DNA 结合,因此,一般被认为与基因的抑制或沉默有关。近年来,组蛋白去乙酰化酶的功能研究越来越受到重视。研究表明HDAC在植物的生长、发育和胁迫应答反应中发挥十分重要的调节作用[1]。
HDAC是一个多基因家族,根据与酵母HDAC(RPD3、HDA1 和SIR2)序列的同源比较,植 物HDAC可分为3 个亚家族:RPD3/HDA1、SIR2 和HD2。其中RPD3/HDA1亚家族是一种Zn2+-依赖性组蛋白去乙酰化酶,其酶活性的发挥依赖于Zn2+的存在。RPD3/HDA1 亚家族基因表达水平的改变(如表达上调或下降),均能影响植物的生长和发育,并产生表型的改变[2-3]。RPD3/HDA1类型的组蛋白去乙酰化酶在植物生物胁迫(病虫害)和非生物胁迫(高盐、干旱、低温)反应中也具有十分重要的调节作用[4-9]。目前,HDAC研究主要集中在玉米、拟南芥、水稻等草本植物中,而木本植物HDAC 的研究鲜有报道。杨树具有生长快、抗性强等特点。但杨树组蛋白去乙酰化酶基因的克隆和功能研究未见报道。本研究克隆了毛果杨RPD3/HDA1类型的组蛋白去乙酰化酶基因HDA901的编码区序列,并对其进行了生物信息学分析以及亚细胞定位和盐胁迫下的表达分析,为深入研究组蛋白去乙酰化酶基因在杨树盐胁迫反应中的功能奠定了基础。
1 材料和方法
1.1 材 料
毛果杨组培幼苗由东北林业大学林木遗传育种国家重点实验室程玉祥教授提供。选取株高和生长状态一致的4周龄毛果杨幼苗,200 mmol/L NaCl处理0、12和48h,3个重复。分别剪取处理后植株的叶片、茎和根,液氮速冻后保存于-80℃,用于总RNA 的提取。
1.2 方 法
1.2.1 毛果杨HDA901基因的克隆 采用Trizol试剂提取NaCl处理后毛果杨叶片、茎和根的总RNA。采用PrimeScript RT reagent Kit(TaKaRa)试剂盒将所提取的总RNA 反转录为cDNA,作为模板用于毛果杨HDA901基因序列的克隆和实时荧光定量PCR 分析。
以毛果杨cDNA 为模板,采用上游引物(5′-GCTCTAGAATGGAGCTTCAAACTTTCCG-3′)和下游引物(5′-GGGGTACCTCAGAGGGAATGTATGTGTT-3′),扩增毛果杨HDA901 基因全长编码序列(ORF)。使用DNA 凝胶回收试剂盒(Omega)回收PCR 产物,然后克隆到pMD18-T Vector(TaKaRa)载体上,并转入到大肠杆菌DH5α 中。PCR 验证阳性克隆送至北京六合华大基因科技股份有限公司进行测序。
1.2.2 毛果杨HDA901蛋白序列生物信息学分析利用ExPaSy提供的在线程序ProtParam(http://web.expasy.org/protparam/)对毛果杨HDA901蛋白的一级结构、分子量和等电点进行分析。利用NCBI的保守结构域数据库Conserved Domain Database(CDD)(http://www.ncbi.nlm.nih.gov/cdd/)对毛果杨HDA901蛋白的结构域进行分析。通过染色质数据库ChromDB(http://www.chromdb.org/)的Blasp程序获得毛果杨HDA901同源蛋白的氨基酸序列。利用软件DNAMAN 对毛果杨HDA901与其他植物中的同源蛋白进行多重序列比对分析;利用软件MEGA 5.0对毛果杨HDA901与其他植物中的同源蛋白进行系统进化树分析。利用在线启动子分析软件PlantCare(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)对毛果杨HDA901基因的启动子进行分析。利用在线软件WoLF PSORT(https://wolfpsort.org/)预测毛果杨HDA901 蛋白的亚细胞定位。
1.2.3 毛果杨HDA901 的亚细胞定位 毛果杨HDA901基因的ORF 序列与GFP 构建成融合表达载体。采用基因枪法转化洋葱内表皮,使其瞬时表达。在激光共聚焦显微镜下观察融合蛋白在洋葱内表皮细胞中的定位。
1.2.4 实时荧光定量PCR 分析 运用软件Primer 5设计实时荧光定量PCR 上游引物(CAGCTGGAGCAGGACTAACC)和下游引物(GCCCTTTTGGAATAGCATGA)。分 别 提 取200 mmol/L NaCl处理0、12 和48h 的毛果杨根、茎和叶的总RNA,反转录成cDNA 作为模板,采用SYBR PremixExTaqTMkit试剂盒(Takara)进行实时荧光定量PCR 分析。PCR 反应条件为95℃预变性3 min;95℃变性30s,55℃退火30s,72℃延伸30 s,44个循环。以18S作为内参基因,每个样品重复3 次。通过Ct值来确定基因的表达水平,以2-ΔΔCt法计算NaCl处理不同时间毛果杨HDA901基因的相对表达量。采用t检验分析毛果杨HDA901基因在盐处理不同时间表达水平的显著性。
2 结果与分析
2.1 毛果杨HDA 901基因的克隆与序列分析
采用毛果杨HDA901特异性引物,以毛果杨叶片cDNA 为模板,通过PCR 方法获得HDA901基因开放阅读框(ORF)扩增片段(图1)。测序结果表明,毛果杨HDA901基因ORF序列全长为1 245bp,编码1个由414个氨基酸组成的蛋白质(图2)。
2.2 毛果杨HDA901的生物信息学分析
通过在线ExPaSy的ProtParam 软件对毛果杨HDA901基因编码蛋白的分子量和等电点进行分析表明,该蛋白的理论分子量为45.2kD,理论等电点为5.77。利用NCBI的保守结构域数据库(Conserved Domain Database,CDD),对HDA901 蛋白的保守结构域进行预测。结果表明,在氨基酸序列的第61和378之间存在一个组蛋白去乙酰化酶结构域(HDAC_ClassⅡ),该结构域属于Agrelinase_HDAC超家族。
利用DNAMAN 软件,将毛果杨HDA901基因的编码蛋白与来自6个物种的HDAC 蛋白进行多重序列比对分析,结果表明这些组蛋白去乙酰化酶在氨基酸序列上具有高度保守性(图3)。对应于毛果杨HDA901的152-216位氨基酸残基处,来自不同植物的HDAC蛋白存在一段长为65个氨基酸残基的高度保守序列,这一段序列极有可能是该蛋白的重要功能位点。毛果杨HDA901 与桃PpHDA5807的氨基酸序列一致性最高(90%);与玉米ZmHDA118、拟南芥AtHDA14、水稻OsHDA714具有较高的一致性,分别为88%、87%、85%;与火炬松PtHDA1801 和云杉PaHDA 的一致性也较高,分别为84%和81%。系统进化树分析表明,相同科的植物可以聚为一类,如火距松和云杉都属于松科。单子叶植物(玉米和水稻)的HDAC 在进化上处于一个分支;双子叶植物毛果杨HDA901 与拟南芥AtHDA14的亲缘关系最近(图4)。

图1 毛果杨HDA901的PCR 扩增结果Fig.1 PCR amplification of HDA901 fromP.trichocarpa

图2 毛果杨HDA 901基因的ORF序列和编码氨基酸序列Fig.2 The ORF sequence and deduced amino acid sequence of HDA 901in P.trichocarpa

图3 毛果杨HDA901与其它物种中HDAC的氨基酸序列比对Fig.3 Amino acid sequence alignment of HDA901and HDACs from the other plants
利用在线启动子分析软件PlantCare,对毛果杨HDA901基因的启动子进行分析(表1)。毛果杨HDA901基因的启动子序列来自Phytozome(http://phytozome.jgi.doe.gov/pz/portal.html)数据库,选取HDA901上游3 000bp序列作为其启动子进行分析。在HDA901启动子序列中,有显著的启动子元件TATA-box、CAAT-box、增强子以及TCrich repeat序列。在HDA901启动子区域中,还存在大量的与光反应相关的元件,如3-AF1binding site、ACE、AT-rich element、Box 4、Box I、G-box 和I-box等。根据这些结果推测,毛果杨HDA901基因很可能参与杨树的光反应。此外,在HDA901启动子区域还存在其他一些元件,如GA调节元件GARE-motif、ABA 反应元件ABRE、热响应元件HSE、真菌诱导元件Box-W1、以及胚乳发育的相关元件Skn-1_motif。这些元件的存在表明毛果杨HDA901参与多个生物学反应过程,涉及到光调节、植物激素反应、胁迫反应以及早期发育中的生物学调控。

图4 毛果杨HDA901与其它植物同源蛋白的系统进化树分析Fig.4 Phylogenetic tree analysis of HDA901 and HDACs from the other plants
2.3 毛果杨HDA901的亚细胞定位
利用在线软件WoLF PSORT对毛果杨HDA901亚细胞定位进行了预测分析。预测结果表明,HDA901 不存在于细胞核和细胞质中,主要位于线粒体,同时也穿梭于叶绿体和线粒体之间。为了确定毛果杨HDA901蛋白在细胞内的分布,构建了HDA901-GFP的瞬时表达载体,观察HDA901在洋葱表皮细胞中的表达。结果显示HDA901既没有定位于细胞核中,也没有定位在细胞质中(图5)。毛果杨HDA901在细胞内的分布有别于其他植物组蛋白去乙酰化酶,预示着其可能具有不同的功能。
2.4 毛果杨HDA 901基因在盐胁迫下的表达
采用实时荧光定量PCR 的方法,分析了200 mmol/L NaCl处理不同时间毛果杨HDA901基因在幼苗根、茎和叶中的表达情况,结果表明HDA901基因的表达受盐胁迫的调节(图6)。在盐胁迫下,根和茎中HDA901基因的表达模式相同,而与叶中的表达模式不同。在根和茎中,NaCl处理抑制HDA901基因的表达,随着盐处理时间的增加其表达量持续下降;盐处理12h和48h后,毛果杨HDA901基因的表达量显著低于处理前(0h)的表达量。而在叶中,NaCl处理12h时,HDA901基因的表达量显著增强,盐处理48h后其表达量回落。这些结果表明HDA901参与盐胁迫反应,在不同器官其表达水平受到不同的调节。

表1 毛果杨HDA 901基因启动子序列的顺式作用元件Table 1 Cis-acting elements in the promoter of HDA 901in P.trichocarpa

图5 毛果杨HDA901的亚细胞定位Fig.5 Sub-cellular localization of HDA901
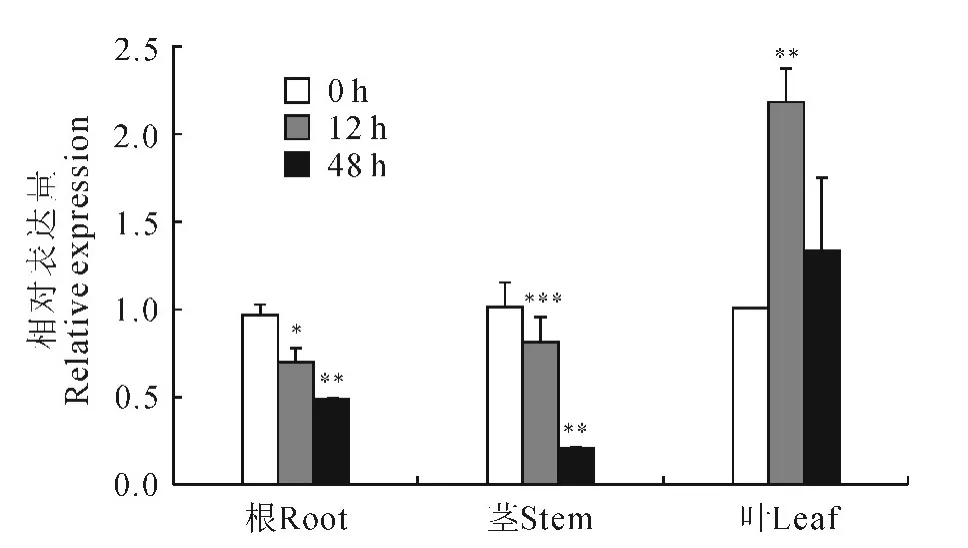
图6 盐胁迫下毛果杨HDA901基因的表达Fig.6 The expression of HDA901gene under salt stress
3 讨 论
在多种植物中的研究表明组蛋白去乙酰化酶主要分布于细胞核内,也在细胞质、细胞器(如叶绿体和线粒体)中有分布,或穿梭于细胞核与细胞质之间[1]。利用生物信息学软件WoLFPSORT,对毛果杨HDA901蛋白的亚细胞定位进行了预测分析,结果显示HDA901蛋白不存在于细胞核和细胞质中,主要位于线粒体,同时也穿梭于叶绿体和线粒体之间。此外,分析毛果杨HDA901基因在洋葱表皮细胞中的表达,结果证实了HDA901确实没有定位于细胞核和细胞质中。由于洋葱表皮细胞没有叶绿体,线粒体也不易观察,因此无法确定HDA901在叶绿体和线粒体中的分布情况。HDA901 很可能分布于线粒体和(或)叶绿体中,参与这些细胞器基因表达的调控。为了进一步确定毛果杨HDA901的亚细胞分布,明确其是否在叶绿体或线粒体中存在,可以将HDA901 遗传转化到植物中并稳定表达,或进行原生质体瞬时表达,从而确定HDA901在细胞内的哪些部位发挥其功能。
拟南芥等植物的研究表明组蛋白去乙酰化酶在生物和非生物胁迫反应中发挥十分重要的调节作用。本研究对盐胁迫下毛果杨HDA901基因的表达结果表明,毛果杨HDA901基因的表达受盐胁迫的调节,而且HDA901基因表达模式在不同组织会有不同,根和茎HDA901基因的表达受盐胁迫的抑制,叶HDA901基因的表达受盐胁迫的诱导,这与水稻中的研究一致。Fu等[10]的研究表明水稻叶片HDA714的表达也受盐胁迫的诱导。此外,启动子序列分析显示毛果杨HDA901基因的启动子序列中含有多个与光反应、生物或非生物胁迫相关的顺式作用元件,暗示HDA901还可能参与光反应或生物胁迫应答反应。当外界刺激存在时,胁迫相关的转录因子或转录调节蛋白可能通过与这些顺式作用元件的结合,调控毛果杨HDA901的转录。
[1]MA X,LÜS,ZHANG C,etal.Histone deacetylases and their functions in plants[J].PlantCellRep.,2013,32(4):465-478.
[2]HU Y,QIN F,HUANG L,etal.Rice histone deacetylase genes display specific expression patterns and developmental functions[J].Biochem.Biophys.Res.Commun.,2009,388(2):266-271.
[3]ROSSI V,LOCATELLI S,VAROTTO S,etal.Maize histone deacetylase hda101is involved in plant development,gene transcription,and sequence-specific modulation of histone modification of genes and repeats[J].PlantCell,2007,19(4):1 145-1 162.
[4]CHEN L T,WU K.Role of histone deacetylases HDA6and HDA19in ABA and abiotic stress response[J].PlantSignal.Behav.,2010,5(10):1 318-1 320.
[5]CHEN L T,LUO M,WANG Y Y,etal.Involvement ofArabidopsishistone deacetylase HDA6in ABA and salt stress response[J].J.Exp.Bot.,2010,61(12):3 345-3 353.
[6]WU K,ZHANG L,ZHOU C,etal.HDA6is required for jasmonate response,senescence and flowering inArabidopsis[J].J.Exp.Bot.,2008,59(2):225-234.
[7]TO T K,NAKAMINAMI K,KIM J M,etal.ArabidopsisHDA6is required for freezing tolerance[J].Biochem.Biophys.Res.Commun.,2011,406(3):414-419.
[8]ZHOU C,ZHANG L,DUAN J,etal.HISTONE DEACETYLASE19is involved in jasmonic acid and ethylene signaling of pathogen response inArabidopsis[J].PlantCell,2005,17(4):1 196-1 204.
[9]KIM K C,LAI Z,FAN B,etal.ArabidopsisWRKY38and WRKY62transcription factors interact with histone deacetylase 19in basal defense[J].PlantCell,2008,20(9):2 357-2 371.
[10]FU W,WU K,DUAN J.Sequence and expression analysis of histone deacetylases in rice[J].Biochem.Biophys.Res.Commun.,2007,356(4):843-850.

