离子液体中酶法催化合成糖酯的研究进展
左 竹,覃小丽,王家续
(西南大学食品科学学院,重庆 400715)
离子液体中酶法催化合成糖酯的研究进展
左 竹,覃小丽*,王家续
(西南大学食品科学学院,重庆 400715)
离子液体作为一类极具有发展潜力的绿色溶剂,其用于酶催化反应介质有着传统有机溶剂和功能性离子液体无法超越的优势。综合对国内外近十几年公开发表的有关离子液体中酶法催化合成糖酯的文献,从常见离子液体分类,离子液体对酶活性、稳定性和选择性的影响,以及糖酯酶法催化合成的方法及研究现状进行了归纳与总结,同时指出了今后在离子液体中糖酯酶法催化合成领域值得研究的重要内容。
糖酯,离子液体,酶催化合成
糖酯通常由亲水的糖基和疏水的脂肪酸残基构成,因此具有良好的双亲性,是一种优良的表面活性剂。糖酯的乳化性能尤其良好,具有极好的乳化、去污、扩散、起泡等多种性能[1],在食品生产加工中必不可少,如,蔗糖酯作为润滑剂和分散剂应用在糕点和糖果中。此外,部分糖酯还具有抗氧化、抗血栓、杀菌等功能[2]。糖酯近年在食品、医药、化妆品等行业有着广泛的应用。目前,工业上糖酯合成主要采用化学法,如溶剂法、微乳化法和无溶剂法。溶剂法工艺简单、反应条件温和,但是多采用毒性较大的有机溶剂作为反应介质。例如,Snell法[3]中以二甲基甲酰胺(DMF)作溶剂,限制了糖酯在食品和医药等领域的应用。微乳化法则采用水或醇代替了DMF为反应介质,但因生产工艺难以掌握(如反应中需维持微乳状态)等导致体系不够稳定,同样存在反应效率低等问题。无溶剂法虽然不需要有机溶剂或大量水为反应介质,但其体系较粘稠,通常需要在较高的反应温度下进行反应。随着生物技术和介质工程的突破性发展,以脂肪酶作为生物催化剂及离子液体作为新型反应介质成为新的研究热点。酶是一种高效、高选择性、反应条件温和以及对环境友好的生物催化剂,而且有助于简化反应流程、减少副产物等。与传统有机溶剂相比,离子液体除了具有非挥发性、低熔点、高热稳定性等优点外,另一个显著优点是对碳水化合物溶解性良好[4]。此外,离子液体可回收重复利用且对酶的活性和选择性影响较小[5]。与传统化学法相比,离子液体中酶法合成糖酯具有反应条件温和、能耗少、区域选择性高、副产物少等优点。近年来,既作为溶剂又具有催化性能的功能性离子液体,如酸性离子液体([BMIM][AlCl4]、磺酸类Brønsted酸性离子液体等)是酯类催化领域中研究重点之一[6-8],其突出特点是结构和催化活性可根据研究目的需要具有可调性,较好的化学稳定性。然而,与脂肪酶相比,其催化酯类合成不具有区域选择性,从而影响目标产物的纯度。
糖酯是酯类的一种重要类型,但目前对离子液体中酶法催化合成糖酯的研究报道较少。本文就酶催化合成酯类反应中离子液体的类型,离子液体对酶的活性、稳定性和选择性的影响,以及离子液体中酶法催化合成糖酯的国内外研究现状进行总结,以期为推动离子液体中糖酯酶法合成的进一步研究提供有益参考与借鉴。
1 常见离子液体的分类

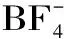
2 离子液体对酶催化性能的影响
离子液体中酶的性质(活性、稳定性、选择性等)受到多方面因素的影响。一般来说,离子液体通过与酶、底物和产物的相互作用来影响酶的性质,而这种相互作用与离子液体种类(阴、阳离子组成)及其性质,如极性、疏水性、氢键强度、阴离子亲核性、黏度、酶的溶解性等密切相关[10]。酶的性质受离子液体的影响较为复杂,是受到这些单个参数影响或多个参数的共同作用的结果。
2.1 离子液体中酶的活性
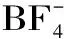
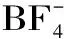
此外,酶在离子液体中的活性还与离子液体对酶的溶解能力有关。脂肪酶在[Bmim][PF6]和[Bmim][BF4]离子液体中具有较高催化活性,往往与离子液体对酶的低溶解能力有关[21],而[Emim][EtSO4]、[EtNH3][NO3]和[Bmim][NO3]能溶解脂肪酶(C. Antarctica lipase B)从而使其失活[22]。
2.2 离子液体中酶的稳定性
疏水性和亲水性离子液体对脂肪酶稳定性的影响有着不同的表现。有研究[23]表明,来源于Bacillusstearothermophilus的酯酶在[Bmim][PF6]中的半衰期>240 h,是其在正己烷和甲基叔丁基醚(MTBE)中半衰期的30和3倍;[Bmim][PF6]和[Bmim][BF4]中酶的稳定性明显高于在正己烷和MTBE中的稳定性,主要由于离子液体属于极性物质,与蛋白分子之间的静电作用增强,进而促使蛋白质结构更趋于柔性,然而正己烷和MTBE不能与酶蛋白形成氢键,因此它们之间的静电作用较弱而使得蛋白结构趋于刚性。对于具有相同有机阳离子的离子液体([Bmim][PF6]和[Bmim][BF4]),该酶在[Bmim][BF4]中的半衰期(220 h)较小,这主要是由于亲水性[Bmim][BF4]剥夺酶分子表层的必需水,影响了酶的结构和功能;而疏水性[Bmim][PF6]对酶分子的必需水剥夺程度低,为酶提供了更温和的催化环境。另一研究也报道了类似的结果,即含有液体培养基的脂肪酶(Pseudomonasaeruginosalipase)分别在30 ℃的[Bmim][PF6]、[Omim][PF6]和正己烷中搅拌48 h,该脂肪酶在这3种介质中的酶活性残留大小顺序为:[Bmim][PF6]>[Omim][BF4]>正己烷[24]。Sheldon等[25]将游离酶(SP 525)置于在更高温度(80 ℃)下的[Bmim][PF6]中,当保温20 h时,酶活性是对照组(未处理酶)活性的120%,当继续保温至100 h时,其活性也不会降低,然而在叔丁醇中酶失活基本呈线性下降;在80 ℃保温40 h后,与未经处理的SP 435相比,Novozym 435在[Bmim][PF6]中的活性达到最大活性(350%),放置5 d后仍可以保留初始活性的210%。为了改善离子液体中酶的稳定性,可通过对酶的改性和溶剂的调节等方面进行。Lee等[26]发现采用溶胶-凝胶技术在离子液体中固定化的脂肪酶(Candida rugosa lipase)在50 ℃的[Omim][Tf2N]中保持5 d后,仍保留初始酶活力的80%,而未在离子液体中固定化的脂肪酶几乎没有活性。在离子液体中溶胶-凝胶法制备的固定化脂肪酶具有更高的活性与稳定性,其原因可能是离子液体在凝胶化过程不仅起到模板的作用,通过孔隙填充减少凝胶的收缩,而且充当稳定剂保护脂肪酶免受严重失活。
2.3 离子液体中酶催化的选择性
脂肪酶具有高度的立体选择性和区域选择性。在糖酯的酶法合成反应中,利用酶的区域选择性更容易得到特定位置的光学纯糖酯。离子液体影响脂肪酶的区域选择性[27],但其影响的机理现在尚未明确,目前为止有一种较为可能的解释是:离子液体具有与脂肪酶分子相匹配的特异溶剂性,从而引起脂肪酶特异性地产生特定的产物[28]。研究发现酶催化的区域选择性在多种离子液体中都能得到不同程度的提高,Chiappe等[29]分别以[Bmim][PF6]、[Bmim][N(TF)2]、[Bmim][BF6]和Tris-HCl为反应介质,以环氧化物水解酶催化外消旋环氧化物的不对称水解反应,研究发现,不同来源与纯度的环氧化物水解酶对反应速率及产物对映体选择性有所差别,其中来源于水芹的粗酶在[Bmin][PF6]中的选择性最大[(1S,2R)-型产物ee值为90%],而在[Bmim][N(TF)2]、[Bmim][BF6]和Tris-HCl中(1S,2R)-型产物ee值分别为60%、60%和72%。在糖酯的酶法合成中,脂肪酶通常优先作用于糖类化合物的伯羟基,但是,当伯羟基被保护时,酶的选择性受到糖苷配基和溶剂性质等影响。Kim等[30]研究发现,在来源于Candidarugosa的脂肪酶催化C6位-OH被保护的糖苷类化合物酰化过程中,分别以[Bmim][PF6]和[Moemim][PF6]为反应介质的酶选择性酰化糖苷显著高于在有机溶剂(氯仿、四氢呋喃)中。Li等[31]考察了5种脂肪酶(Novozym 435、Lipozyme TL IM、Lipozyme RM IM、Lipozyme IM和Pseudomonascepacialipase)分别在两种反应介质(四氢呋喃,四氢呋喃-[C4mim][PF6])中催化去氧尿氟苷及其类似物的苯甲酰化反应,结果显示在四氢呋喃-[C4mim][PF6]混合溶剂中,来源于Pseudomonascepacia的脂肪酶展现了较高的区域选择性(81%~99%),并且脂肪酶的区域选择性随着底物的疏水性增加而增加。
3 离子液体中酶法合成糖酯的方法
3.1 单一离子液体中酶法合成糖酯
糖酯的传统合成主要在有机溶剂体系中进行,但所使用的大多数有机溶剂毒性较大,对糖酯的品质及环境有不良影响。因此,在反应介质方面做了相关研究并进行了改进,在不断的探索中,大量研究实验表明以离子液体作为反应介质能较好地符合“绿色”合成途径。Ganske等[32]报道了分别以[Bmim][BF4]和[Bmim][PF6]离子液体为反应介质,分别以月桂酸乙烯酯和肉豆蔻酸乙烯酯为酰基供体,采用聚乙二醇修饰的Candidaantarcticalipase B(CAL-B-PEG)催化合成脂肪酸葡萄糖酯,糖酯转化率分别为30%和35%;研究还表明当以游离脂肪酸作为酰基供体时,该酶在给定的离子液体中不能催化合成糖酯。国内的学者也对离子液体中酶法合成糖酯的研究进行了有益探索。黄广君等[33]考察了酶制剂种类(南极假丝酵母脂肪酶CAL-B、Novozym 435、Lipozyme TL IM),离子液体种类([Bmim][PF6]、[Bmim]Cl、[Bmim][BF4])、温度、底物摩尔比、酶浓度对糖酯产率的影响,结果表明在离子液体[Bmim][BF4]中Lipozyme TL IM选择性催化蔗糖和月桂酸乙烯酯合成6-O-蔗糖月桂酸单酯的效果最佳,主要原因是[Bmim][BF4]亲水性较强,对蔗糖的溶解度较大;在优化的条件(温度为45 ℃,蔗糖、月桂酸乙烯酯摩尔比为1∶4,酶浓度为60 mg/mL下,其产率可达50%。曾文恬等[34]以离子液体[Bmim][TfO]为反应介质,考察了3种脂肪酶(Candidaantarcticalipase B、Thermomyceslanuginosus和Mucormiehei)催化合成糖酯的产率,研究表明以脂肪酶Candidaantarcticalipase B在该种离子液体中催化合成糖酯产率最高,在最佳条件(温度40 ℃、酶浓度50 mg/mL、葡糖糖与棕榈酸乙烯酯摩尔比1∶3)下,6-O-葡萄糖棕榈酸酯产率可达到31.5%左右。离子液体作为反应介质虽然可实现糖酯的酶法催化合成,但是,反应效率和糖酯产率较低。然而,与以有机溶剂为反应介质的糖酯酶法合成反应比较,应用离子液体于酶催化反应有利于提高糖酯安全性以及减少环境污染。因此,以离子液体作为绿色溶剂,酶法催化合成糖酯的转化率还有待提高的空间。
为了提高离子液体中酶法催化合成糖酯的反应效率,近年来各国学者围绕酶法催化合成糖酯的反应介质、底物传质等方面进行了研究。糖类底物在反应介质中低溶解度是阻碍糖酯的酶法催化效率的重要因素之一。为了提高糖类溶解在离子液体的浓度,Lee等[35]提出先将含有糖的水溶液与离子液体混合,然后将混合液中的水除去的方法,其研究结果显示,在25 ℃时,葡萄糖在过饱和的[Emim][TfO]、[Bmim][TfO]中的浓度比其直接溶解于离子液体中的浓度(6.1、4.8 g/L)分别高出了19、10倍。通过这种方法制得的过饱和葡萄糖溶液在相当长时间内没有显著损失;进一步的实验研究表明,与仅使用饱和葡萄糖溶液相比,在含有过饱和葡萄糖的[Bmim][TfO]离子液体中,以月桂酸乙烯酯或月桂酸为酰基供体,利用Novozym 435脂肪酶催化合成葡萄糖月桂酸酯,反应转化率由8%提高到了96%。他们通过这种方法不仅使葡萄糖在离子液体中的溶解度提高了400%,而且脂肪酶催化反应的产物转化率也得到了显著提高。
基于底物的溶解度最大化和酶催化活性发挥最佳两方面考虑,其他研究者[36]采用两步法在离子液体中酶法催化合成淀粉月桂酸酯,以改善底物(淀粉)的溶解度以及减缓酶活性失活,从而提高反应效率。首先,用极性较强的[Bmim]Cl对淀粉进行预处理,使得淀粉分子中羟基中的氢键断裂,从而溶解淀粉,高直链淀粉的最大溶解度可达11.0/100 g。然后,在极性较小的[Bmim][BF4]中,脂肪酶(Candidarugosalipase)催化经[Bmim]Cl预处理后的淀粉粉末与月桂酸合成淀粉月桂酸酯,在优化反应条件下,淀粉酯的最大取代度为0.171,并且两步法中使用的离子液体可进行回收和重复使用。
尽管许多研究表明,离子液体是生物催化良好的反应介质,但脂肪酶在其中的反应速率通常比其在常规有机溶剂中的低,因此提高离子液体中酶催化活性仍是商业化生产糖酯中具有挑战性的问题。将超声应用于酶催化反应中强化质量传递这一技术在近年来国内外都有研究[37-39]。然而,超声应用于酶催化反应中仍在探索,在离子液体中超声辅助酶催化反应研究较少。Lee等[40]研究应用超声辅助法提高Novozym 435在离子液体中催化过饱和葡萄糖溶液和月桂酸乙烯酯(或月桂酸)合成糖酯的活性,结果显示,与常规的磁力搅拌相比,超声条件下[Bmim][PF6]中酶的反应初速率增大了7.75倍,[Bmim][TfO]中酶的活性提高了4.7倍。此外,该研究结果还表明超声辐射不会影响该脂肪酶在离子液体中的稳定性,通过优化超声的频率和功率有望在离子液体提高脂肪酶的催化效率,尤其在受底物溶解度低而限制质量传质的离子液体中。
3.2 混合离子液体中酶法合成糖酯
研究报道有些离子液体能很好地溶解碳水化合物,但同时对酶的活性和稳定性存在明显的负面影响[41],因此,以单一的离子液体为反应介质难以同时满足碳水化合物溶解度大与酶催化效率高这两个要求。研究发现Novozym 435在水溶性离子液体[Bmim][TfO]中的活性较好,而其在疏水性离子液体[Bmim][Tf2N]中稳定性较好,因此,采用多种离子液体以适当的比例混和作为反应介质,能使脂肪酶的活性及稳定性发挥至较佳水平;[Bmim][TfO]与[Bmim][Tf2N]按1∶1(v/v)混合作为溶剂时,Novozym 435催化葡萄糖和月桂酸乙烯酯的反应中,Novozym 435重复使用5次后,反应转化率为59%,仍有85%的初始酶活保留,然而在[Bmim][TfO]中仅有36%的初始酶活保留,反应转化率降低至31%左右[42]。因此,采用多种离子液体的混合物要比单种离子液体作为反应介质能更有利于脂肪酶催化合成糖酯,提高糖酯合成产率。Lu等[43]也采用混合离子液体([Bmim]Ac和[Bmim][BF4])作为反应介质,考察反应条件(脂肪酶用量、反应温度、[Bmim]Ac和[Bmim][BF4]比例、棕榈酸甲酯和淀粉摩尔比、反应时间)对淀粉酯取代度的影响,在最佳条件下淀粉酯取代度最大可达到0.144。以混合离子液体为反应介质克服了单种离子液体为媒介在提高底物溶解度和保持酶活之间的矛盾。然而,从商业化生产管理角度,采用多种离子液体为溶剂,不便于实际操作与管理。因此,如何设计既能提高底物溶解度又能保持酶的催化性能的离子液体还有待进一步研究,概括起来主要从以下两个方面开展:蛋白质工程,包括酶的固定化、界面激活和表面活性修饰等;溶剂工程,包括添加助剂和微乳体系等。
3.3 两相体系中酶法合成糖酯
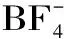
4 展望
离子液体作为糖酯的酶法催化合成反应中有发展前途的新型绿色反应介质。其在酶法催化合成过程中具有操作条件简便,较好解决脂肪酶在有机溶剂中的稳定性差、活性低、立体选择性差等问题。此外,离子液体的极性较大可以解决因碳水化合物溶解度低而限制其在水相中不反应的问题。与传统有机溶剂化学法相比,离子液体作为反应介质保证了糖酯在食品、医药等行业的应用。
离子液体在酶法催化合成糖酯的应用研究时间不长,相关研究还有待进一步深入研究,重点集中在以下几个方面:离子液体的结构对酶的活性中心及空间构象的影响,脂肪酶高级结构在离子液体中的变化情况以及酶法催化合成糖酯的催化机理、反应动力学研究,并结合分子对接手段实现快速筛选适用于糖酯合成的离子液体和脂肪酶;离子液体对底物的溶解性、酶的活性与稳定性的影响存在负相关性,因此,基于离子液体对脂肪酶及其催化反应的作用机理,采用计算机模拟等手段设计和开发对底物具有良好溶解性能以及使脂肪酶保持高效催化活性的新型离子液体。例如,阴离子为Cl-、OAc-或HCOO-的离子液体往往对碳水化合物溶解能力较好,但与此同时会使酶失活。因此,可以通过在阳离子基团侧链上接枝一定链长的烷基或烷氧基以降低离子液体中氢键力和亲核性强的阴离子浓度以获得新型离子液体;就目前情况而言,离子液体成本较高,且在适合溶解多糖的离子液体中因其中的阴离子(如Cl-、OAc-)对酶分子的强烈氢键作用、通过亲核攻击酶结构中正电荷区等因素使得脂肪酶在其中催化反应的活性降低与循环使用次数减少,酶的催化反应效率及稳定性有待加强,这对工业化生产带来极大的挑战。因此,在酶的改性、适合应用于糖酯酶催化的新型离子液体的开发、反应介质(溶剂)的调节,新型反应器的设计、微波和超声等辅助强化手段等方面的研究是今后该领域的研究重点之一,以期提高离子液体中酶法催化合成糖酯的催化效率。
[1]Ferrer M,Soliveri J,Plou F J,et al. Synthesis of sugar esters in solvent mixtures by lipases fromThermomyceslanuginosusandCandidaantarcticaB,and their antimicrobial properties[J]. Enzyme and Microbial Technology,2005,36(4):391-398.
[2]赵冰,张可,王静,等. 阿魏酸糖酯体外抗氧化性质的研究[J]. 食品科学,2010,31(21):94-97.
[3]Osipow L,Snell F D,York W C,et al. Methods of preparation fatty acid esters of sucrose[J]. Industrial & Engineering Chemistry,1956,48(9):1459-1462.
[4]Zhu S,Wu Y,Chen Q,et al. Dissolution of cellulose with ionic liquids and its application:a mini-review[J]. Green Chemistry,2006,8(4):325-327.
[5]Kim K W,Song B,Choi M Y,et al. Biocatalysis in ionic liquids:markedly enhanced enantioselectivity of lipase[J]. Organic Letters,2001,3(10):1507-1509.
[6]Wu Q,Chen H,Han M H,et al. Transesterification of cottonseed oil catalyzed by Brønsted acidic ionic liquids[J]. Industrial & Engineering Chemistry Research,2007,46(24):7955-7960.
[7]Tao D J,Wu J,Wang Z Z,et al. SO3H-functionalized Brønsted acidic ionic liquids as efficient catalysts for the synthesis of isoamyl salicylate[J]. RSC Advances,2014,4(1):1-7.
[8]王文魁,包宗宏. 氯铝酸离子液体催化大豆油制备生物柴油[J]. 中国油脂,2007,32(9):51-53.
[9]田中华,华贲,王键吉,等. 室温离子液体物理化学性质研究进展[J]. 化学通报,2004,67:9.
[10]Zhao H. Methods for stabilizing and activating enzymes in ionic liquids-a review[J]. Journal of Chemical Technology Biotechnology,2010,85(7):891-907.
[11]Lozano P,De Diego T,Carrié D,et al. Over-stabilization ofCandidaantarcticalipase B by ionic liquids in ester synthesis[J].Biotechnology Letters,2001,23(18):1529-1533.
[12]Nara S J,Harjani J R,Salunkhe M M. Lipase-catalysed transesterification in ionic liquids and organic solvents:a comparative study[J]. Tetrahedron Letters,2002,43(16):2979-2982.
[13]Yang Z,Yue Y J,Huang W C,et al. Importance of the ionic nature of ionic liquids in affecting enzyme performance[J]. The Journal of Biochemistry,2009,145(3):355-364.
[14]Zhao H,Song Z. Nuclear magnetic relaxation of water in ionic-liquid solutions:determining the kosmotropicity of ionic liquids and its relationship with the enzyme enantioselectivity[J]. Journal of Chemical Technology Biotechnology,2007,82(3):304-312.
[15]Li N,Du W,Huang Z,et al. Effect of imidazolium ionic liquids on the hydrolytic activity of lipase[J]. Chinese Journal of Catalysis,2013,34(4):769-780.
[16]Wang J,Wang H,Zhang S,et al. Conductivities,volumes,fluorescence,and aggregation behavior of ionic liquids[C4mim][BF4]and[Cnmim]Br(n=4,6,8,10,12)in aqueous solutions[J]. The Journal of Physical Chemistry B,2007,111(22):6181-6188.
[17]Yang C,Yang J,Sun X,et al.(1S,2S)-Diphenylethylenediamine modified Ir/SiO2catalyst for asymmetric hydrogenation of acetophenone and its derivatives[J]. Chinese Journal of Catalysis,2012,33(7-8):1154-1160.
[18]De los Ríos A P,Hernández-Fernández F J,Martínez F A,et al. The effect of ionic liquid media on activity,selectivity and stability ofCandidaantarcticalipase B in transesterification reactions[J]. Biocatalysis Biotransformation,2007,25(2-4):151-156.
[19]Toral A R,De los Ríos A P,Hernández F J,et al. Cross-linkedCandidaantarcticalipase B is active in denaturing ionic liquids[J]. Enzyme and Microbial Technology,2007,40(5):1095-1099.
[20]Lau R M,Van Rantwijk,Seddon K R. Lipase-catalyzed reactions in ionic liquids[J]. Organic Letters,2000,2(26):4189-4191.
[21]Erbeldinger M,Mesiano A J,Russell A J. Enzymatic catalysis of formation of Z-aspartame in ionic liquid-an alternative to enzymatic catalysis in organic solvents[J]. Biotechnology Progress,2000,16(6):1129-1131.
[22]Lau R M,Sorgedrager M J,Carrea G,et al. Dissolution ofCandidaantarcticalipase B in ionic liquids effects on structure and activity[J]. Green Chemistry,2004,6(9):483-487.
[23]Persson M,Bornscheuer U T. Increased stability of an esterase from Bacillus stearothermophilus in ionic liquids as compared to organic solvents[J]. Journal of Molecular Catalysis B:Enzymatic,2003,22(1-2):21-27.
[24]Singh M,Singh R S,Banerjee U C. Stereoselective synthesis of(R)-1-chloro-3(3,4-difluorophenoxy)-2-propanol using lipases from Pseudomonas aeruginosa in ionic liquid-containing system[J]. Journal of Molecular Catalysis B:Enzymatic,2009,56(4):294-299.
[25]Sheldon R A,Lau R M,Sorgedrager M J,et al. Biocatalysis in ionic liquids[J]. Green Chemistry,2002,4(2):147-151.
[26]Lee S H,Doan T T N,Ha S H,et al. Using ionic liquids to stabilize lipase within sol-gel derived silica[J]. Journal of Molecular Catalysis B:Enzymatic,2007,45(1):57-61.
[28]Kennedy J F,Kumar H,Panesar P S,et al. Enzyme-catalyzed regioselective synthesis of sugar esters and related compounds[J]. Journal of Chemical Technology and Biotechnology,2006,81(6):866-876.
[29]Chiappe C,Leandri E,Lucchesi S,et al. Biocatalysis in ionic liquids:the stereoconvergent hydrolysis of trans-β-methylstyrene oxide catalyzed by soluble epoxide hydrolase[J]. Journal of Molecular Catalysis B:Enzymatic 2004,27(4):243-248.
[30]Kim M-J,Choi M Y,Lee J K,et al. Enzymatic selective acylation of glycosides in ionic liquids:significantly enhanced reactivity and regioselectivity[J]. Journal of Molecular Catalysis B:Enzymatic,2003,26(3):115-118.
[31]Li N,Ma D,Zong M-H. Enhancing the activity and regioselectivity of lipases for 3′-benzoylation of floxuridine and its analogs by using ionic liquid-containing systems[J]. Journal of Biotechnology,2008,133(1):103-109.
[32]Ganske F,Bornscheuer U T. Lipase-catalyzed glucose fatty acid ester synthesis in ionic liquids[J]. Organic Letters,2005,7(14):3097-3098.
[33]黄广君,王涛,姚评佳,等. 离子液体中酶法合成蔗糖-6-月桂酸单酯的研究[J]. 广西大学学报,2010,35(3):455-461.
[34]曾文恬,姚评佳,魏远安. 离子液体中葡萄糖棕榈酸酯的酶法合成及表征[J]. 广西大学学报,2011,36(3):470-476.
[35]Lee S H,Dang D T,Ha S H,et al. Lipase-catalyzed synthesis of fatty acid sugar ester using extremely supersaturated sugar solution in ionic liquids[J]. Biotechnol Bioeng,2008,99(1):1-8.
[36]Lu X,Luo Z,Fu X,et al. Two-step method of enzymatic synthesis of starch laurate in ionic liquids[J]. Journal of Agricultural and Food Chemistry,2013,61(41):9882-9891.
[37]Kwiatkowska B,Bennett J,Akunna J,et al. Stimulation of bioprocesses by ultrasound[J]. Biotechnology Advances,2011,26(9):768-780.
[38]Yu D H,Wu H,Wang S,et al. Ultrasonic irradiation with vibration for biodiesel production from soybean oil by Novozym 435[J]. Process Biochemistry,2010,45(4):519-525.
[39]Batistella L,Lerin L A,Brugnerotto P,et al. Ultrasound-assisted lipase-catalyzed transesterification of soybean oil in organic solvent system[J]. Ultrasonics Sonochemistry,2012,19(3):452-458.
[40]Lee S H,Nguyen H M,Koo Y-M,et al. Ultrasound-enhanced lipase activity in the synthesis of sugar ester using ionic liquids[J]. Process Biochemistry,2008,43(9):1009-1012.
[41]Zhao H. Effect of ions and other compatible solutes on enzyme activity,and its implication for biocatalysis using ionic liquids[J]. Journal of Molecular Catalysis B:Enzymatic,2005,37(1-6):16-25.
[42]Lee S H,Ha S H,Hiep N M,et al. Lipase-catalyzed synthesis of glucose fatty acid ester using ionic liquids mixtures[J]. Journal of biotechnology,2008,133(4):486-489.
[43]Lu X,Luo Z,Yu S,et al. Lipase-catalyzed synthesis of starch palmitate in mixed ionic liquids[J]. Journal of Agricultural and Food Chemistry,2012,60(36):9273-9279.
[44]Ganske F,Bornscheuer U T. Optimization of lipase-catalyzed glucose fatty acid ester synthesis in a two-phase system containing ionic liquids and t-BuOH[J]. Journal of Molecular Catalysis B:Enzymatic,2005,36(1):40-42.
[45]Abdulmalek E,Saupi H S M,Tejo B A,et al. Improved enzymatic galactose oleate ester synthesis in ionic liquids[J]. Journal of Molecular Catalysis B:Enzymatic,2012,76:37-43.
Research progress in lipase-catalyzed synthesis of sugar esters in ionic liquid
ZUO Zhu,QIN Xiao-li*,WANG Jia-xu
(College of Food Sciences,Southwest University,Chongqing 400715,China)
As one of the most potential green solvents,ionic liquid has been used as reaction medium in lipase-catalyzed synthesis with some unsurpassed advantages in comparison with traditional organic solvents. Based on the related literature on lipase-catalyzed synthesis of sugar esters in ionic liquid in recent decade,the review focused on summarizing common type of ionic liquids used in lipase-catalyzed ester synthesis,effect of ionic liquids on the activity,stability and selectivity of lipases,and enzymatically synthetic methods of sugar esters. Finally,further studies on enzymatic synthesis of sugar ester in ionic liquid were proposed.
sugar ester;ionic liquid;lipase-catalyzed synthesis
2014-12-09
左竹(1994-),女,在读本科生,研究方向:食品质量与安全,E-mail:zuozhu_zoe1994@163.com。
*通讯作者:覃小丽(1984-),女,博士,讲师,主要从事食品营养化学和油脂酶法催化改性相关研究,E-mail:qinxl@swu.edu.cn。
西南大学第七届本科生科技创新基金(1317002);中央高校基本科研业务费专项资金(SWU113036,XDJK2014B019)。
TS202.3
A
1002-0306(2015)15-0390-06
10.13386/j.issn1002-0306.2015.15.074

