小麦抗冻基因sod的克隆及表达分析
蔡 华,王方平,余 意,赵维萍
小麦是我国主要粮食作物,近年种植面积逐渐扩大。但部分小麦品种的抗冻性较差,加上某些人为与自然因素(如抢墒、早播等),以及冬春季灾害性天气频繁出现,低温冻害对小麦生产的影响越来越大,已成为影响小麦生产最主要的灾害之一[1]。
抗冻基因是一种诱发基因,只有在特定条件(主要是低温和短日照)的作用下,才能启动其表达[2]。在抗冻基因表达前,植物的抗冻能力仅仅是一种潜能或基础[3]。近年来,随着对植物抗冻机理研究的不断深入,以及分子生物学技术广泛应用于作物抗冻性研究,利用基因克隆技术提高作物的抗冻性也取得了突破性进展[4]。在植物的冻害机理研究上,许多研究表明超氧化物歧化酶(superoxide dismutase,SOD)、过氧化氢酶(catalase,CAT)、抗坏血酸过氧化酶(ascorbate peroxidase,APX)、谷胱甘肽还原酶(glutathione reductase,GR)等酶活性的高低与植物抗冻性密切相关[5-10],其中,SOD被普遍认为是一类重要的抗冻因子。SOD是一种十分重要的生物体防止氧化损伤的酶类,是生物体内超氧阴离子的清除剂。低温条件下,细胞内活性氧的产生和清除平衡遭到破坏,膜系统稳定性受到影响,活性氧积累,使膜脂发生过氧化和脱脂作用,从而破坏膜结构,而SOD可清除活性氧,维护膜系统的稳定性[11]。此外,SOD在植物抗低温、干旱等逆境方面也有重要作用[12-15]。国内有关小麦 SOD的研究,大多集中于生产应用[16]。本研究选取安徽省近年推广的生态类型不同的8个小麦品种,抽穗前在实验室模拟自然冻害条件进行胁迫处理,提取其总RNA,反转录后克隆sod基因,再进行半定量研究,分析不同生态类型小麦品种sod基因表达状况,并与未经冻害胁迫处理的小麦进行比较,分析sod基因对小麦抗冻的作用,并为小麦抗冻机理研究提供理论依据。
1 材料和方法
1.1 实验材料
试验选用烟农19、济麦22、淮麦30、皖农垦2号、中国春、扬麦15、煤生P2-1和郑麦9023等8个安徽省推广小麦品种,精选后于10月下旬播于装有表土施足基肥的盆钵中,每盆10株,连盆埋于滁州学院小麦试验基地,盆口与地面平齐,其他田间管理参照大田,试验材料田间生长情况见图1。

图1 小麦田间盆栽
1.2 实验方法
1.2.1 低温胁迫处理
于次年3月份,从田间连盆挖出已拔节的小麦苗,分成实验和对照两组,放入恒温培养箱处理。实验组先后设置如下处理:25℃处理24h,10℃处理12h;5℃处理12h;-1℃处理24h。期间按白天给光,夜间不给光。在-1℃处理期间,间隔6小时左右观察一次,如发现有明显叶片冻坏,即剪尚未冻伤的余叶,放入-80℃或液氮保存,留待抽提RNA用。对照组一直放在25℃处理72h。两组小麦处理完成后,均剪取适量的叶片放入超低温冰箱保存,留待抽提RNA用。
1.2.2 sod基因的克隆
取0.5g叶片样品置于液氮中,研磨至粉末状,用RNAiso Plus(TaKaRa公司)提取总RNA,并参照TIANScript RT Kit(TIANGEN 公司)操作步骤合成cDNA;根据GenBank中已有sod序列(AF092524),利用Primer 5.0软件设计克隆小麦sod基因的引物SOD(表1)。再以上述cDNA为模板,以上述SOD引物为引物,配制10μL PCR体系,选取同上的PCR仪进行PCR扩增。扩增片段利用AXYGEN生物技术(杭州)有限公司提供的AxyPrep DNA凝胶回收试剂盒回收纯化。将纯化后的目的DNA样品连接到TaKaRa公司提供的pMDTM18-T上,TA克隆后送往英潍捷基(上海)贸易有限公司测序鉴定。

表1 扩增抗冻基因及内参基因所用的引物
1.2.3 sod基因表达水平的检测
用Tubulin(小麦微管蛋白)基因作为内参,以反转录产物单链cDNA为模板进行PCR扩增,使不同的样品所扩增Tubulin的电泳条带亮度一致,进一步确定所需单链cDNA的模板量,然后进行各样品的sod基因的半定量实验。
2 结果与分析
2.1 不同品种小麦对冻害处理的反应
冻害胁迫处理完全后,对本试验在实验室中模拟自然变温处理的8个不同小麦品种进行受冻情况调查,结果发现,同一时期播种的相同时间进行冻害处理的8个不同小麦品种中,扬麦15冻死株高达12株,郑麦9023冻死株10株,中国春冻死株9株,淮麦30冻死株有10株,济麦22冻死株3株,煤生P2-1冻死株和5株,皖农垦冻死株有3株,而烟农19未观察到冻死株,仅叶尖受冻枯死(见表2)。这恰好与小麦的春化类型基本相关,小麦春化类型分为春性、弱春性、半冬性、冬性小麦。在本实验中,春性小麦有扬麦15;弱春性小麦有郑麦9023、淮麦30和中国春;半冬性小麦有济麦22、煤生P2-1和皖农垦2号;冬性小麦有烟农19。
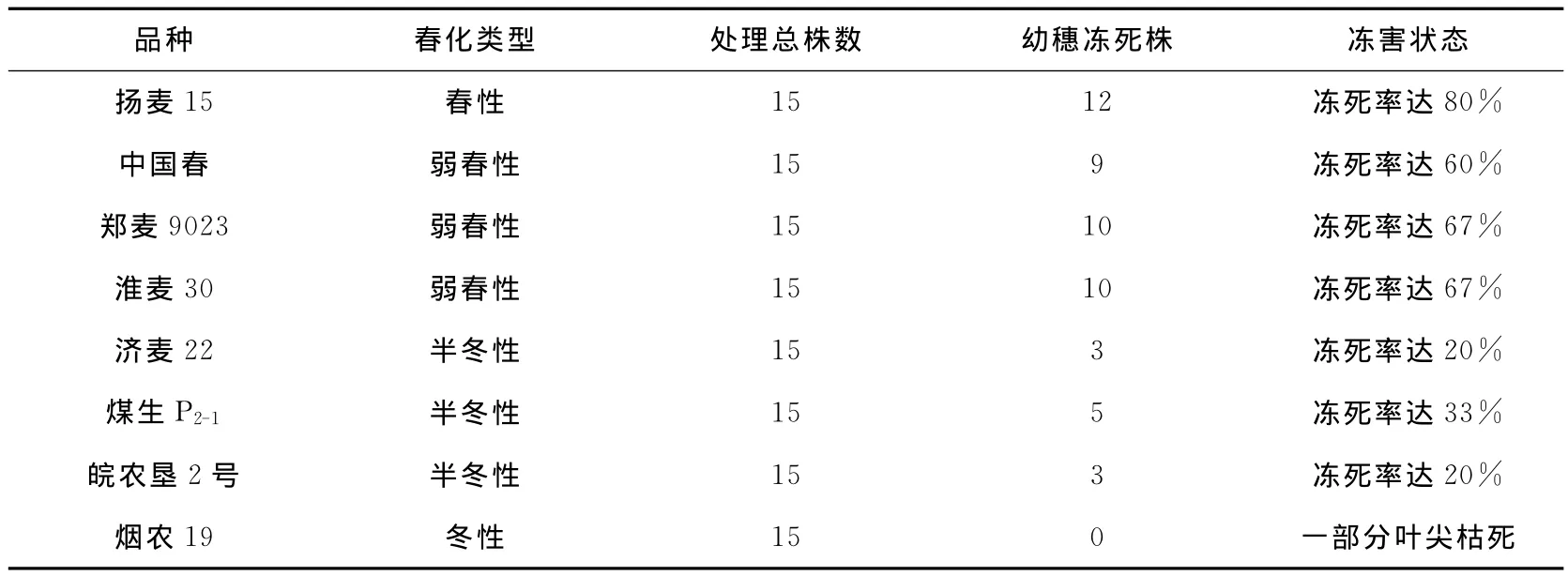
表2 8个不同品种小麦冻害处理后幼穗冻死状态及冻害程度
2.2 sod基因cDNA片段的克隆
提取小麦的总RNA凝胶电泳结果如图1所示。
(1、2、3、4、5、6、7、8分别为实验组烟农19、济麦22、淮麦30、皖农垦2号、中国春、扬麦15、煤生P2-1、郑麦9023小麦叶片 RNA 条带,a、b、c、d、e、f、g、h分别为对照组烟农19、济麦22、淮麦30、皖农垦2号、中国春、扬麦15、煤生P2-1、郑麦9023小麦叶片RNA条带,M为Trans 2KMarker)
利用表1中SOD引物,从小麦叶片内扩增到预期的sod基因cDNA片段(见图2)。
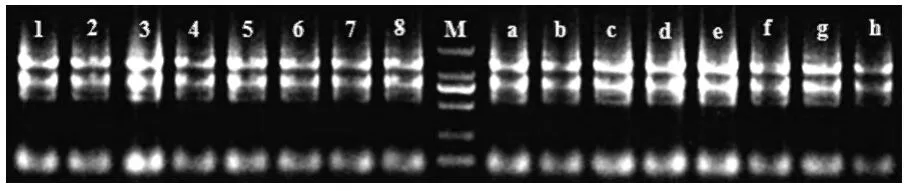
图2 小麦叶片RNA提取凝胶电泳结果图
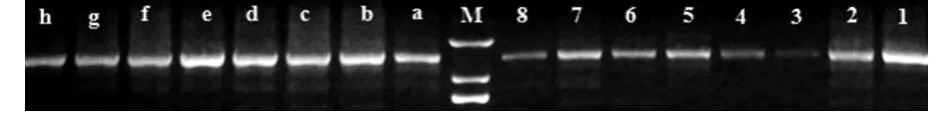
图3 SOD引物PCR凝胶电泳结果图
(1、2、3、4、5、6、7、8分别为实验组烟农19、济麦22、淮麦30、皖农垦2号、中国春、扬麦15、煤生P2-1、郑麦9023样品cDNA用SOD引物PCR凝胶电泳条带,a、b、c、d、e、f、g、h分别为对照组烟农19、济麦22、淮麦30、皖农垦2号、中国春、扬麦15、煤生P2-1、郑麦9023样品cDNA用SOD引物PCR凝胶电泳条带,M为Trans 2KMarker)
测序后经同源性比较显示,扩增的片段与已报道相关基因同源性均在90%以上,表明扩增的片段准确无误,可用于以下半定量PCR比较试验。
2.3 冻害处理前后sod基因的转录水平的变化
(1、2、3、4、5、6、7、8分别为实验组烟农19、济麦22、淮麦30、皖农垦2号、中国春、扬麦15、煤生P2-1、郑麦9023样品cDNA用SOD引物PCR凝胶电泳条带,a、b、c、d、e、f、g、h分别为对照组烟农19、济麦22、淮麦30、皖农垦2号、中国春、扬麦15、煤生P2-1、郑麦9023样品cDNA用SOD引物PCR凝胶电泳条带,M为Trans 2KMarker)
由图4可见,经过冻胁迫后,各处理叶片内sod转录水平表达量几乎没有多大的变化。弱春性、半冬性和冬性中各小麦品种之间相比,小麦植株叶片内sod基因在冻胁迫期间表达量基本一致,然而本实验中的春性小麦扬麦15的对照组比实验组转录水平表达量低。
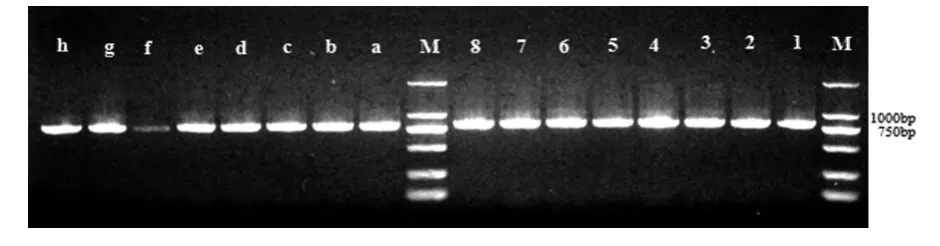
图4 SOD引物半定量PCR凝胶电泳图
3 讨论
在本实验的8个小麦中,扬麦15春性强,烟农19为冬性小麦,而郑麦9023、淮麦30和中国春皆为弱春性小麦,济麦22、煤生P2-1和皖农垦2号都是半冬性小麦。在冻害处理之后,扬麦15的冻死率最高,与其抗冻类型表现一致。而其他小麦品种没有明显差异,因此,可以初步得出推论:冻害胁迫后,春性小麦的sod基因转录水平会明显升高。
春性小麦、弱春性小麦和半冬性小麦在冻害处理后期,小麦植株的抗冻性显著下降,因而植株冻害比较严重甚至冻死。而冬性小麦烟农19在冻害处理后期抗冻性下降速率较为迟缓,所以植株未受冻害,仅一部分叶片枯死。在此次冻害处理中,春性小麦扬麦15冻死率最高,抗冻性下降速率最快,而冻害处理后的扬麦15的sod基因表达量明显下降。这与预期的实验结果基本一致。
植物的抗冻性是由很多个基因调控的数量性状,已有研究表明sod基因的表达与植物的抗冻性密切相关。但是这些物质在不同的植物中就会表现出不同的抗冻效果。Gabriela等[19]的研究表明sod参与了玉米的抗冻过程,而张燕等[6]认为sod可能没有参与Ca2+诱导的烟草的抗冻过程。
本次实验的结果表明,未经低温诱导,春性小麦植株叶片内sod基因的转录水平表达量明显比其他春化类型的小麦植株要低,而经过低温诱导后,春性小麦植株叶片内的sod基因的转录水平表达量显著升高,这与植株间的抗冻基因的性质基本一致,而酶的活性也显示的相似的结果[5,20]。因此,可以推测sod参与了小麦植株的抗冻过程,可以作为小麦植株抗冻性的鉴定指标。本文还发现弱春性、半冬性和冬性小麦不管是否进行低温诱导,这些类型的小麦叶片中的sod基因的转录水平表达量都无明显的变化,进而可以推测sod基因虽然参与了小麦植株的抗冻过程,但是可能不是小麦抗冻性的唯一的鉴定指标。
[1] 罗东亮,袁文先,赵朝峰,等.小麦冻害研究初报[J].河南农业科学,1997.2:8-9.
[2] 周德宝,张二红.植物抗寒性与抗寒基因的表达和调控[J].生物技术通报,2006:14-16.
[3] 卢存福,王红,简令成,等.植物抗冻蛋白研究进展[J].生物化学与生物物理进展,1998(04):17-23.
[4] 刘建芳,周瑞莲,赵梅.作物抗冻机理及抗冻基因研究进展[J].鲁东大学学报(自然科学版),2010,6(3):258-265.
[5] 刘艳阳,李俊周,陈磊,等.低温胁迫对小麦叶片细胞膜脂质过氧化产物及相关酶活性的影响[J].麦类作物学报,2006,26(4):70-73.
[6] 张燕,方力,李天飞,等.钙对低温胁迫的烟草幼苗某些酶活性的影响[J].植物学通报,2002,19(3):342-347.
[7] Prasad T.K..Role of catalase inducing chilling tolerance in pre-emergent maize seedlings[J].Plant Physiol,1997,114(4):1369-1376.
[8] 陈禅友,汪汇东,丁毅.低温胁迫下长豇豆幼苗可溶性蛋白质和细胞保护酶活性的变化[J].园艺学报,2005,32(5):911-913.
[9] 任丽丽,高辉远.低温弱光胁迫对野生大豆和大豆栽培种光系统功能的影响[J].植物生理与分子生物学学报,2007,33(4):333-340.
[10] 曾韶西,王以柔.低温胁迫对黄瓜子叶抗坏血酸过氧化物酶活性和谷胱甘肽含量的影响[J].植物生理与分子生物学学报,1990,16(1):37-42.
[11] 黄文功,殷奎德,高中超.植物抗冻基因工程研究进展[J].生物技术通报,2006(2):1-4.
[12] E B Gralla,D J Thiele,D J Thiele,et al.ACE1,a copperdependent transcription factor,activates expression of the yeast copper,zinc superoxide dismutase gene[J].Proc Natl Acad Sci USA,1991(88):8558-8562.
[13] C Spiegelhalder,B Gerstenecker,B Gerstenecker,et al.Purification of Helicobacter pylori superoxide dismutase and cloning and sequencing of the gene[J].Infect Immun,1993,61(12):5315-5325.
[14] Majed M AbuKhader,John Heap,John Heap,et al.Crystallization and preliminary X-ray characterization of the Bacillus amyloliquefaciens YwrO enzyme[J].Appl Microbiol,2007(63):746-750.
[15] T.S.Nedeva,V.A.Savov,A.V.Kujumdzieva-Savova1,et al.Screening of thermotolerant yeasts as producers of superoxide dismutase[J].FEMS Microbiology Letters,1993(107):49-52.
[16] 张博润,谭华荣.超氧化物歧化酶的研究进展和应用前景[J].微生物学通报,1992,19(6):352.
[17] 陈贵,康宗利,张立军.低温胁迫对小麦生理生化特性的影响[J].麦类作物,1998,18(3):42.
[18] 李璐,王晓军;赵民安.植物抗冻基因[J].植物生理学通讯,2004,40(5):643.
[19] Garibela P.,et.al..Low temperature-induced changes in the distribution of H2O2and antioxidants between the bundle sheath and mesophyll cells of maize leaves[J].J Exper Bot,2001(51):107-113.
[20] 杜朝昆,李忠光,龚明.水杨酸诱导的玉米幼苗适应高温和低温胁迫的能力与抗氧化酶系统的关系[J].植物生理学通讯,2005,41(1):19-22.

