姜辣素对培根风干成熟过程中微生物及生物胺形成的抑制效应
王永丽,李 锋,乔维维,陈 肖,黄明明,黎良浩,章建浩,*
(1.南京农业大学食品科技学院,国家肉品质量与安全控制工程技术研究中心,江苏 南京 210095;2.山东农业大学食品科学与工程学院,山东 泰安 271018)
姜辣素对培根风干成熟过程中微生物及生物胺形成的抑制效应
王永丽1,李 锋2,乔维维1,陈 肖1,黄明明1,黎良浩1,章建浩1,*
(1.南京农业大学食品科技学院,国家肉品质量与安全控制工程技术研究中心,江苏 南京 210095;2.山东农业大学食品科学与工程学院,山东 泰安 271018)
以五花肉为原料,腌制时添加不同含量(100、300、500 mg/kg)的姜辣素进行风干成熟,测定样品理化指标、微生物及生物胺含量变化情况,研究姜辣素对培根风干成熟过程中微生物及生物胺形成的抑制效应。结果表明:与对照组相比,姜辣素能显著抑制菌落总数和肠杆菌(P<0.05);在风干培根样品中共检测到腐胺、尸胺、组胺、酪胺、精胺5 种生物胺;生物胺总量随着风干时间的延长呈显著增加趋势(P<0.05),100、300、500 mg/kg处理组与对照组总生物胺含量存在显著性差异(P<0.05)。300 mg/kg处理组总生物胺含量最低,为94.13 mg/kg,相对于对照组降低了34.56%,且此时腐胺、尸胺、酪胺、组胺和精胺含量也得到了很好的抑制,相对于对照组分别下降了26.60%、40.59%、37.08%、72.19%和23.59%。添加姜辣素能显著降低样品中挥发性盐基氮含量(P<0.05),对于提高培根的品质及安全性具有较好的效果。
培根;腌制风干;姜辣素;生物胺;微生物
培根是欧美国家的一种重要腌腊肉制品,是猪肉经过腌制、烟熏成熟等工艺加工而成,在我国也有类似西式培根的腌腊肉产品,主要集中在我国西南地区。腌腊肉制品存在脂质过度氧化、微生物污染及有害成分含量高等问题而被消费者高度关注。肉制品中的生物胺主要由氨基酸在肌肉内源酶和微生物产生的外源酶催化下发生脱羧反应而产生,肉制品发生腐败时其中的一些氨基酸脱羧酶阳性细菌会大量增殖,其产生的脱羧酶促进氨基酸脱羧,从而推动生物胺的大量积累[1]。当人体摄入过量的生物胺时,会引起头疼、恶心、心悸、血压变化和呼吸紊乱等过敏反应[2-3]。酪胺和组胺被认为是致突变剂的前体物,其他多聚胺类如腐胺、尸胺、精胺、亚精胺也会与某些亚硝基化合物反应产生致癌性的N-二甲基亚硝胺、N-亚硝基吡咯烷和N-亚硝基哌啶[4]。已有研究一般只考虑到组胺和酪胺具有毒性,但美国食品药品监管局(US-Food and Drug Administration,US-FDA)的研究指出,一些生物胺如腐胺和尸胺单独存在时也会导致人体的疾病[5]。
目前许多研究指出,天然植物提取物对生物胺的形成具有较好的抑制效果[6-7]。姜辣素是生姜中大量存在的具有辣味物质的总称;姜酚是姜中主要活性成分,具有很强的抗氧化活性,其酚类结构和β-羟基酮结构能够清除生物体中羟自由基和超氧阴离子自由基及降低脂质过氧化物。姜辣素的抗氧化能力优于VC和VE,并且具有一定的抑菌作用[8]。姜辣素还具有降低胆固醇、抗肿瘤、抗炎症等作用[9],将姜辣素应用于培根,为降低风干发酵肉制品微生物活性,抑制生物胺积累,提高品质提供了可能。本实验旨在研究姜辣素对培根风干成熟过程中微生物及生物胺的作用效果,以期为实际生产实践提供理论依据。
1 材料与方法
1.1材料与试剂
新鲜五花肉,购于江苏省食品集团有限公司。
姜辣素(总酚含量≥98%) 南京泽朗生物科技有限公司;平板计数琼脂(plate count agar,PCA)、结晶紫中性红葡萄糖琼脂(violet red bile glucose agar,VRBGA) 北京陆桥技术有限责任公司;生物胺标准品:色胺、苯乙胺、腐胺、尸胺、组胺、酪胺、亚精胺、精胺和丹磺酰氯 美国Sigma公司;乙腈和丙酮为色谱纯;氨水、高氯酸、氢氧化钠、碳酸氢钠和氯化镁等为分析纯。
1.2仪器与设备
Waters Alliance 2695液相色谱系统 美国Waters公司;Agilent Zorbax Eclipse XDB-C18柱(250 mm× 4.6 mm,5 ☒m) 美国Agilent公司;pH计 梅特勒-托利多仪器(上海)有限公司;SPX-250型恒温恒湿箱 上海博讯实业有限公司医疗设备厂;KH-400KDB型高功率数控超声波清洗器、生化培养箱 昆山禾创超声仪器有限公司;Allegra 64R型高速冷冻离心机 美国Beckman Coulter公司;IKAT18basic型高速分散机 德国IKA公司;DHG-9030A型电热恒温鼓风干燥箱 上海一恒科技有限公司;JA2203N电子天平 上海民桥精密科学仪器有限公司。
1.3方法
1.3.1干腌培根加工方法
将新鲜五花肉分割成20 cm×15 cm×5 cm长方块,平均质量1.2 kg,在4 ℃条件下冷却24 h。冷却结束,从中随机抽取12 块作为对照组:用质量分数2%的食盐在其表面擦涂,4 ℃、相对湿度85%~90%条件下腌制3 d 。腌制结束后将样品转移到控温控湿培养箱中进行风干成熟,时间12 d,其间温湿度程序为起始温度13 ℃、环境相对湿度85%,然后随着风干成熟时间的延长温度每天升高1.5 ℃、相对湿度每天降低0.5%。其余肉块随机分成3 组,每组12 块,每组在腌制阶段分别用100、300、500 mg/kg的姜辣素均匀涂抹肉块表面,腌制和风干成熟步骤同样品对照。
在工艺过程中于主要工艺点(原料、腌制后、风干6 d和风干12 d)随机抽取3 块样品,然后分别取等量表面和中间部位的肌肉将其切碎、混匀即为样品,用不透光真空袋真空包装,-40 ℃条件下冷藏备用。
1.3.2理化指标测定
水分含量参照ISO 1442:1997 Meat and Meat Products-Determination of Moisture Content方法进行测定[10]。
pH值测定:精确称取10.0 g样品于80 mL离心管中,然后加10 mL蒸馏水用高速分散机匀浆1 min,匀浆结束后立即用pH计测定匀浆物的pH值,每次测定重复3 次。
1.3.3挥发性盐基氮(total volatile basic nitrogen,TVBN)含量测定
参照陈莎莎等[11]的方法并稍作修改。具体如下:称取10.0 g样品于250 mL具塞锥形瓶中,加入90 mL 0.6 mol/L高氯酸溶液,漩涡振荡2 min,4 000 r/min离心,取5 mL上清液与5 mL 10 g/L的氧化镁悬浊液一并加入消化管中,进行测定。
1.3.4微生物测定
按照GB 4789.2—2010《食品微生物学检验 菌落总数测定》进行[12],稍作修改,称取25 g样品放入无菌培养皿中剪碎,倒入225 mL无菌生理盐水中,200 r/min,摇匀20 min,再依次作各种稀释度的溶液;菌落总数采用平板计数琼脂培养计数,肠杆菌用结晶紫中性红葡萄糖琼脂培养计数,结果以lg(CFU/g)表示。
1.3.5生物胺含量测定
1.3.5.1标准溶液配制与柱前衍生
参照卢士玲[13]的方法并稍作修改。配制质量浓度分别为0.5、1.0、2.5、5.0、10、20 μg/mL的混合标准溶液,取1 mL标准品混合溶液,加入200 μL 2 mol/L NaOH使之呈碱性,再加入300 μL饱和NaHCO3溶液进行缓冲,然后再加入2 mL的丹磺酰氯溶液(10 mg/mL溶于丙酮),在40 ℃、黑暗条件中反应45 min,然后加入100 μL的体积分数为25%的氨水以中止反应,静置30 min后用乙腈定容至5 mL,然后用0.22 μm的滤膜过滤,用于分析检测。
1.3.5.2样品处理
取5 g绞碎样品加入20 mL 0.4 mol/L的高氯酸(HClO4),彻底匀浆,然后于超声波提取仪中超生提取30 min,冷冻离心机(4 ℃,3 000 r/min)离心10 min,沉淀部分如前述的方法再提取一遍。取两次的上清液用0.4 mol/L的高氯酸(HClO4)定容至50 mL。取1 mL样液按1.3.5.1节方法进行柱前衍生。
1.3.5.3色谱条件
色谱柱为Agilent ZORBAX Eclipse XDB-C18(4.6 mm×250 mm,5 μm),流速为1 mL/min,紫外检测波长为254 nm,进样量20 μL,柱温35 ℃,流动相A为水,B为乙腈,采用梯度洗脱,洗脱程序见表1。
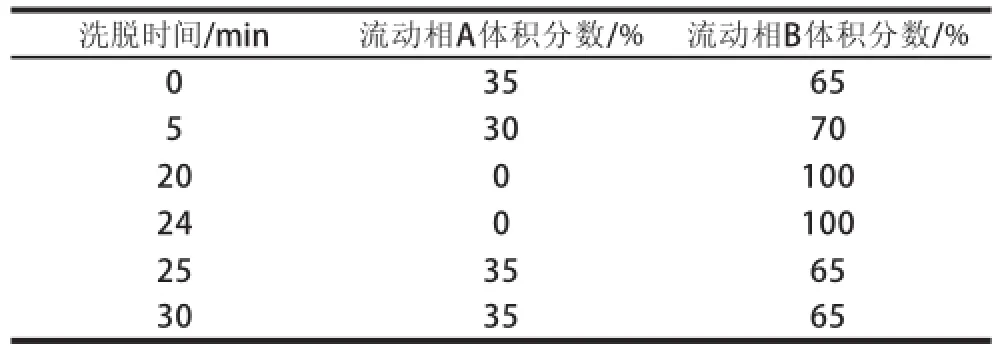
表1 梯度洗脱程序Table1 Gradient elution program
1.4数据统计分析
利用Sigma Plot软件作图,用SAS 8.2统计软件进行方差分析(ANOVA),不同平均值之间利用Fisher’s最小显著差异法(least significant difference,LSD)进行差异显著性检验。
2 结果与分析
2.1不同姜辣素添加量对加工过程中培根理化指标的影响
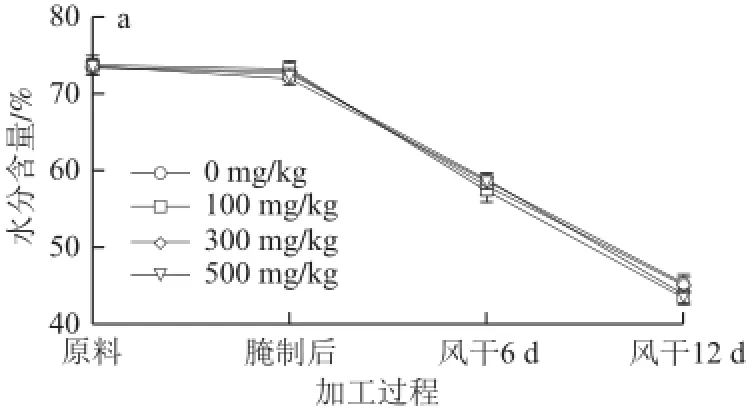
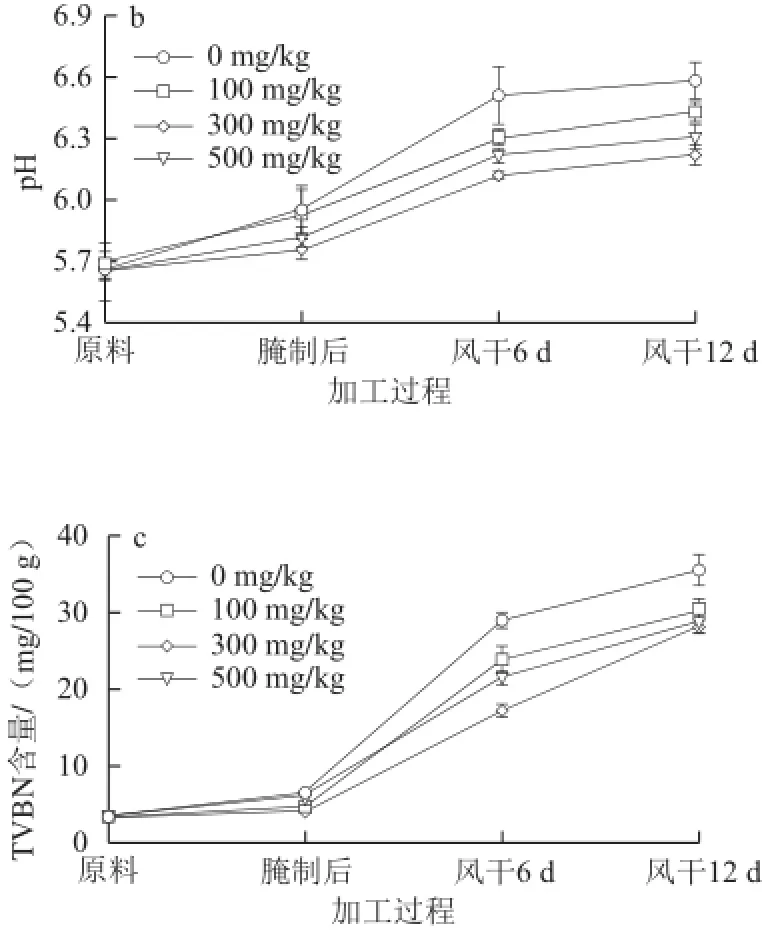
图1 姜辣素不同添加量对风干培根加工过程中理化指标的影响Fig.1 Changes in physicochemical indices during dry-curing of bacons affected by adding different amounts of gingerol
由图1a可知,水分含量在整个加工过程中呈下降趋势,到风干成熟结束时对照样品中的水分含量为45.3%,相比原料阶段(73.6%)下降了38.5%。整个过程中,水分在腌制阶段变化不显著,在风干成熟阶段显著下降(P<0.05)。不同含量的姜辣素对水分含量变化的影响无显著差异(P>0.05)。
由图1b可知,pH值在整个加工过程呈上升趋势,原料与终产品差异显著(P<0.05)。在风干过程中腐败微生物生长代谢的外源蛋白酶会产生氨基酸、挥发性含氮化合物等碱性物质,使产品pH值逐渐升高;风干中后期,各处理组pH值显著低于对照组(P<0.05),说明姜辣素能抑制腐败微生物繁殖,减少胺的积累。
由图1c可知,TVBN含量随风干成熟时间的延长显著增加,与对照组相比,添加姜辣素可显著降低培根在风干过程中TVBN的含量(P<0.05)。添加300 mg/kg姜辣素处理组样品TVBN含量最低,风干12 d时为28.18 mg/100 g,相对于对照组(35.54 mg/100 g)降低了20.7%,当姜辣素添加量增加到500 mg/kg时,样品中TVBN含量又出现上升的趋势,但这两个处理组差异不显著(P>0.05)。TVBN是用于表征肉品腐败程度最常用的指标,TVBN值越高,肉的新鲜度越差。猪肉中含有丰富的蛋白质,在风干成熟过程中由于微生物生长引起脱羧、脱氨作用,导致蛋白质分解,生成大量的多肽、游离氨基酸和TVBN等物质,从而造成培根的腐败变质[14]。水分含量、pH值均会影响样品TVBN含量,水分含量高,微生物的生理代谢旺盛,而低pH值会抑制微生物的新陈代谢[15],降低TVBN积累。
2.2不同姜辣素添加量对培根加工过程中微生物的影响
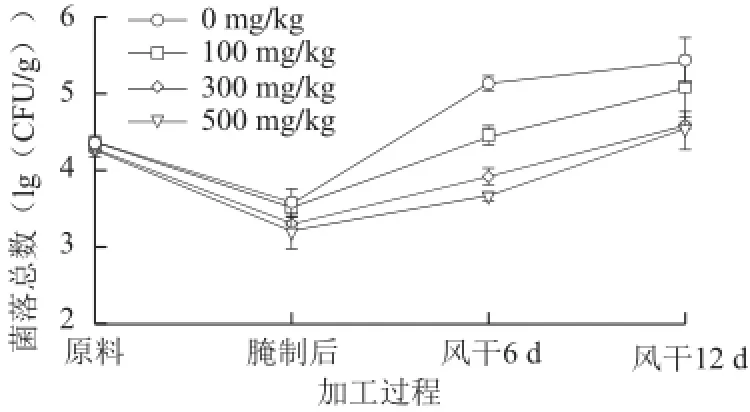
图2 姜辣素不同添加量对风干培根加工过程中菌落总数的影响Fig.2 Changes in total plate count during dry-curing of bacons affected by adding different amounts of gingerol
由图2可知,与对照组相比,在腌制和风干成熟前期(6 d),姜辣素能显著降低菌落总数(P<0.05)。腌制后菌落总数呈下降趋势,可能是由于氯化钠改变了细胞膜渗透压等环境因素,使水分活度降低,导致了微生物的新陈代谢减缓,从而抑制了大量微生物的繁殖[16]。在风干成熟阶段,微生物数量均呈明显的增加趋势,此时姜辣素对微生物的抑制作用开始凸显,且质量浓度越高,抑制作用越明显。300 mg/kg与500 mg/kg添加量的抑菌作用显著优于100 mg/kg,在风干12 d时,300 mg/kg与500 mg/kg的抑菌效果并无显著差异(P>0.05)。赵晋[8]通过抑菌实验表明,姜辣素能够激活单核细胞的分泌功能,使溶菌酶大量释放,水解细胞壁中的黏多糖使其死亡或裂解,起到抑菌作用,特别是对具有氨基酸脱酸酶活性的金黄色葡萄球菌和枯草芽孢杆菌的抑制作用明显。Bover-Cid等[17]报道,微生物数量在6~10(lg(CFU/g))就可认为是肉制品开始腐败,风干结束对照组和300 mg/kg处理组菌落总数分别为5.43、4.58(lg(CFU/g)),均在此标准之下,可见姜辣素能显著抑制微生物的繁殖,延长肉制品腐败变质时间。

图3 姜辣素不同添加量对风干培根加工过程中肠杆菌数的影响Fig.3 Changes in Enterobacteriaceae during dry-curing of bacons affected by adding different amounts of gingerol
由图3可知,风干过程显著影响肠杆菌的数量(P<0.05),原料中肠杆菌为3.0(lg(CFU/g)),腌制结束各处理组降低到2.0(lg(CFU/g))左右,在风干成熟过程中,肠杆菌数先显著升高随后降低。姜辣素对肠杆菌数的影响在风干后期(12 d)时与对菌落总数的影响有所不同,呈明显的下降趋势,可能是风干后期次生代谢产物积累,肠杆菌生长繁殖能力与培根基质之间达到平衡,并对水分活度的快速降低及pH值升高等因素影响更加敏感,使其他微生物成为优势菌株。不同添加量的姜辣素对具有氨基酸脱羧酶阳性的肠杆菌均有不同程度的抑制作用,这种抑制作用可以减缓培根的pH值升高。在风干成熟结束,对照组和500 mg/kg处理组的肠杆菌数量分别为3.55、2.86 (lg(CFU/g))。de Mey等[18]指出,在发酵香肠中肠杆菌是生物胺累积的重要因素之一,大肠杆菌能在香肠生产的前期释放脱羧酶,酶催化氨基酸脱羧产生生物胺。腌腊肉制品中含有丰富的蛋白质,是生物胺产生的前体物质,姜辣素抑制具有高氨基酸脱羧酶活性微生物的繁殖,目前研究表明,肠杆菌是产生尸胺、腐胺的主要微生物,一些大肠杆菌也能产生大量的组胺[19]。实验结果表明,具有抗氧化活性的姜辣素能有效抑制培根中肠杆菌数量,减缓肉制品中化学物质氧化水解的速率,使生物胺前体物质氨基酸减少,从而抑制生物胺在肉制品加工和贮藏过程中的积累。
2.3不同姜辣素添加量对培根加工过程中生物胺含量的影响

图4 生物胺混合标准溶液的HPLC色谱图Fig.4 HPLC chromatogram for a standard mixture of biogenic amines
由图4可知,标准溶液中各种生物胺分离效果较好。由表2可知,风干培根样品中共检测到5 种生物胺,分别为:腐胺、尸胺、组胺、酪胺和精胺。生物胺是一类具有由氨基酸脱羧或醛和酮氨基化而形成的含氮脂肪族、芳香族或杂环类低分子质量有机化合物的总称。一般来说,它们都是由相应的氨基酸脱羧而产生的,如组胺、酪胺、腐胺、尸胺和精胺分别是由组氨酸、酪氨酸、鸟氨酸、赖氨酸和精氨酸经酶解脱羧而生成[20]。
不同姜辣素添加量能有效地控制风干培根样品中总生物胺的含量。风干过程对总生物胺含量有显著影响(P<0.05),风干12 d时各处理组与对照组总生物胺含量存在显著性差异(P<0.05),300 mg/kg添加量时总生物胺含量为94.13 mg/kg,相对于对照组降低了34.56%,为总生物胺含量最低的一组。风干培根样品中各种生物胺的含量存在差异,5 种生物胺中含量最高的是精胺,酪胺、腐胺和尸胺次之,组胺含量最低。样品中各种生物胺含量的不同可能是由于各类来源微生物产生的脱羧酶种类与数量不同以及样品中内源酶与各种氨基酸组成比例不同所致。除尸胺外,其余4 种生物胺的含量均随成熟时间的延长显著增加。就其毒性而言,组胺的毒性最大,酪胺次之;二胺中的腐胺和尸胺会增强组胺和酪胺的毒性,精胺作为生理多胺,对生物体内的代谢具有机能性作用[21]。

表2 姜辣素不同添加量对风干培根加工过程中生物胺含量的影响Table2 Changes in biogenic amine contents during dry-cured processing of bacons affected by adding different amounts of gingerol
风干成熟过程显著影响腐胺和尸胺含量(P<0.05),在原料肉中没有检测到尸胺,表明原料卫生状况良好。风干成熟结束时,尸胺含量增加到13.45 mg/kg(对照)和5.01 mg/kg(100 mg/kg处理组),说明姜辣素有效抑制了尸胺的积累。风干成熟中后期肠杆菌数显著降低,尸胺的含量也相应降低。尸胺通常被认为是有氨基酸脱羧酶阳性细菌-肠杆菌在肉品成熟发酵的过程中赖氨酸脱羧产生的[22]。在对照样品中腐胺含量最高,300 mg/kg姜辣素处理组腐胺含量最低,分别是18.01 mg/kg和13.22 mg/kg。蛋白水解程度对生物胺的生成具有显著性的影响,蛋白水解程度越高,生成的氨基酸量越大,即生物胺的前体物就越多[23]。姜辣素抑制腐败微生物的繁殖,降低蛋白质的分解,因此腐胺的前体物质也降低。
组胺毒性最强,在原料和风干成熟前期各姜辣素处理组中均未检测到组胺,可能是由于风干前期水分含量下降,水分活度降低,产胺菌在低水分活度下生长缓慢,内源酶活性降低,姜辣素的抑菌作用扰乱位于细胞膜上的微生物脱羧酶活性,抑制微生物组氨酸脱羧酶分泌,延缓组胺生成[24]。500 mg/kg姜辣素处理组显著延缓酪胺生长,风干结束相对于对照组降低了41.87%。Latorre-Moratalla等[25]认为食品中酪胺含量应低于100 mg/kg,100~800 mg/kg被认为是有毒性的,在培根样品中,酪胺含量显著低于此水平。原料中精胺含量为38 mg/kg,在风干成熟阶段有所增加,精胺本身对人体没有毒性,但是它可以和亚硝酸盐反应生成致癌物N-亚硝胺。
100 mg/kg姜辣素降低生物胺含量的作用均不如300 mg/kg与500 mg/kg明显,300 mg/kg与500 mg/kg的组间差异不显著。Maijala等[26]认为生物胺产量降低的最主要原因是低pH值的产生,较低的pH值实质上抑制了产生物胺脱羧酶阳性菌的活性,尤其是肠杆菌科的菌类,这与本实验结果相一致,当姜辣素添加量为300 mg/kg时,培根的pH值最低为6.22,而此时的生物胺总量也最低。综合腐胺、尸胺、组胺、酪胺及精胺的结果以及成本因素,300 mg/kg的添加量更适合应用于培根的生产。
3 结 论
不同姜辣素添加量对风干培根样品中水分含量的影响显著,能显著降低pH值和TVBN值,有效抑制微生物的生长繁殖,各指标的变化均在可接受范围内。在风干培根样品中共检测出5 种生物胺,添加姜辣素能显著降低总生物胺含量(P<0.05),当添加量为300 mg/kg时,对样品中TVBN和总生物胺含量的抑制率最高,分别为20.7%和34.56%,且对毒性相对较高的组胺和酪胺有较好的抑制效果;添加姜辣素(300、500 mg/kg)与对照组相比在没有显著降低感官品质的基础上,降低了风干培根样品的腐败程度,提高了肉品食用安全水平。实验选择具有抗氧化活性的姜辣素为添加剂,研究微生物及生物胺在培根生产过程中的变化规律,综合理化指标结果,选择300 mg/kg添加量应用于实际生产,为工业化应用提供理论依据。
[1] MAH J H, KIM Y J, HWANG H J. Inhibitory effects of garlic and other spices on biogenic amine production in Myeolchi-jeot, Korean salted and fermented anchovy product[J]. Food Control, 2009, 20(5): 449-454.
[2] SHALABY A R. Significance of biogenic amines to food safety and human health[J]. Food Research International, 1996, 29(7): 675-690.
[3] YURCHENKO S, MÖLDER U. The occurrence of volatile N-nitrosamines in Estonian m eat products[J]. Food Chemistry, 2007,100(4): 1713-1721.
[4] SUZZI G. Biogenic amines in dry fermented sausages: a review[J]. International Journal of Food Microbiology, 2003, 88(1): 41-54.
[5] FYENTES A, FERNANDEZ-SEGOVIA I, SERRA J A, et al. Development of a smoked sea bass product with partial sodium replacement[J]. LWT-Food Science and Technology, 2010, 43(9): 1426-1433.
[6] BOZKURT H. Utilization of natural antioxidants: green tea extract and Thymbra spicata oil in Turkish dry-fermented sausage[J]. Meat Science, 2006, 73(3): 442-450.
[7] KARRE L, LOPEZ K, GETTY K J K. Natural antioxidants in meat and poultry products[J]. Meat Science, 2013, 94(2): 220-227.
[8] 赵晋. 生姜姜辣素的提取及其功能性质研究[D]. 重庆: 西南大学,2008: 8-10.
[9] STOILOVA I, KRASTANOV A, STOYANOVA A, et al. Antioxidant activity of a ginger extract (Zingiber offi cinale)[J]. Food Chemistry,2007, 10 2(3): 764-770.
[10] ISO 1442:1997(E) Meat and Meat Products-Determination of Moisture Content[S].
[11] 陈莎莎, 陈中祥, 杨桂玲, 等. 水产调味品中挥发性盐基氮的测定[J].中国调味品, 2011, 36(9): 91-93.
[12] GB 4789.2—2010 食品微生物学检验 菌落总数测定[S].
[13] 卢士玲. 传统中式香肠中生物胺产生及其控制技术的研究[D]. 南京: 南京农业大学, 2010: 6.
[14] DESMOND K O. The role of microorganisms in soy sauce production[J]. Advances in Applied Microbiology, 1997, 45(3): 87-152.
[15] MASSON F, TALON R, MONTEL M C. Histamine and tyramine production by bacteria from meat products[J]. Intern ational Journal of Food Microbiology, 1996, 32(1/2): 199-207.
[16] ALIŇO M, GRAU R, TOLDR☒ F, et al. Physicochemical properties and microbiology of dry-cured loins obtained by partial sodium replacement with potassium, calcium and magnesium[J]. Meat Science, 2010, 85(3): 580-588.
[17] BOVER-CID S, HUGAS M, IZQUIERDO-PULIDO M, et al. Amino acid-decarboxylase activity of bacteria isolated from fermented pork sausages[J]. International Journal of Food Microbiology, 2001, 66(3): 185-189.
[18] de MEY E, de KLERCK K, de MAERE H, et al. The occurrence of N-nitrosamines, residual nitrite and biogenic amines in commercial dry fermented sausages and evaluation of their occasional relation[J]. Meat Science, 2014, 96(2): 821-828.
[19] DURLU-☒ZKAYA F, AYHAN K, VURAL N. Biogenic amine produced by Enterobacteriaceae isolated from meat products[J]. Meat Science, 2001, 58(2): 163-166.
[20] 刘景, 任婧, 孙克杰, 等. 食品中生物胺的安全性研究进展[J]. 食品科学, 2013, 34(5): 322-326.
[21] ZAMAN M Z, BAKAR F A, SELAMAT J, et al. Occurrence of biogenic amines and amines degrading bacteria in fish sauce[J]. Czech Journal of Food Sciences, 2010, 28(5): 440-449.
[22] KOMPRDA T, SLADKOVA P, DOHNAL V. Biogenic amine content in dry f ermented sausages as influenced by a producer, spice mix,starter culture, sausage diameter and time of ripening[J]. Meat Science,2009, 8(3): 534-542.
[23] LATORRE-MORATALLA M L, BOVER-CID S, VIDAL-CAROU M C. Technological conditions influence aminogenesis during spontaneous sausage fermentation[J]. Meat Science, 2010, 85(3): 537-541.
[24] SUMNER S S, ROCHE F, TAYLOR S L. Factors controlling histamine production in Swiss cheese inoculated with Lactobacillus buchneri[J]. Journal of Dairy Science, 1990, 73(11): 3050-3058.
[25] LATORRE-MORATALLA M L, VECIANA-NOGU☒S T, BOVERCID S, et al. Biogenic amines in traditional fermented sausages produced in selected European countries[J]. Food Chemistry, 2008,107(2): 912-921.
[26] MAIJALA R, EEROLA S. Contaminant lactic acid bacteria of dry sausages produce histamine and tyramine[J]. Meat Science, 1993,35(3): 387- 395.
Inhibition of Microorganism and Biogenic Amines Formation in Dry-Cured Bacons by Gingerol
WANG Yongli1, LI Feng2, QIAO Weiwei1, CHEN Xiao1,HUANG Mingming1, LI Lianghao1, ZHANG Jianhao1,*
(1. National Central of Meat Quality and Safety Control, College of Food Science and Technology, Nanjing Agricultural University,Nanjing 210095, China; 2. College of Food Science and Engineering, Shandong Agricultural University, Taian 271018, China)
Green bacon belly pieces were used to produce dry-cured bacons, and different concentrations of gingerol(100, 300, and 500 mg/kg) were added during the salting process. After curing and drying, the changes in physical and chemical indexes, microorganisms and biogenic amine content were analyzed to explore the inhibition of microorganism and biogenic amines in dry-cured bacons. The results showed that gingerol could significantly inhibit the total plate count and Enterobacteriaceae count as compared to the control group (P < 0.05). Five kinds of biogenic amines (putrescine,cadaverine, histamine, tyramine and spermine) were detected in dry-cured bacons. Total biogenic amines content increased significantly during the dry-ripening process (P < 0.05). Significant differences (P < 0.05) were observed in the treated groups as compared with the control group. The group treated with gingerol at 300 mg/kg had the lowest content of biogenic amines, which was 94.13 mg/kg and reduced by 34.56% compared with the control group. The contents of putrescine, cadaverine,tyramine, histamine and spermine were reduced by 26.60%, 40.59%, 37.08%, 72.19% and 23.59%, respectively, compared with control group, indicating a very effective inhibition. Adding gingerol could also reduced significantly the content of volatile base nitrogen in dry-cured bacon (P < 0.05), and was effective for improving the quality and safety of bacons.
bacons; curing and drying; gingerol; biogenic amines; microorganism
TS251.5
A
1002-6630(2015)03-0029-06
10.7506/spkx1002-6630-201503006
2014-04-22
“十二五”国家科技支撑计划项目(2012BAD28B01);公益性行业(农业)科研专项(201303082-2);国家自然科学基金青年科学基金项目(31201417)
王永丽(1983—),女,博士研究生,研究方向为畜产品加工与质量控制。E-mail:lily8941@163.com
章建浩(1961—),男,教授,博士,研究方向为畜产品加工与质量控制。E-mail:nau_zjh@njau.edu.cn

