基于聚间苯二胺为受体的UC-FRET传感器检测凝血酶
黎雪风, 黄 昱, 刘志洪
(生物医学分析化学教育部重点实验室,武汉大学化学与分子科学学院,湖北武汉 430072)
荧光共振能量转移(Fluorescence Resonance Energy Transfer,FRET)是指荧光供受体在1~10 nm距离内,因为供体发射光谱与受体吸收光谱有一定重叠,发生偶极-偶极作用而使供体激发态能量通过非辐射方式传递给受体[1]。FRET作为一种均相检测技术,它具有操作简单、分辨率高、灵敏度好等优点。但是传统的下转换发光材料(如有机染料)作为FRET能量供体存在两大局限:紫外光或可见光激发下引起的生物样品本底荧光及散射光对检测信号存在干扰;较小的Stokes位移导致供受体激发光谱有一定重叠,造成供受体的同时激发,影响灵敏度[2,3]。稀土掺杂的上转换发光材料(Up-Conversion Phosphors,UCPs)是一类长波激发、短波发射材料,具有Stokes位移大、发射光谱窄、光稳定性好等优良的特性[4],是极有发展前景的能量供体。目前,UC-FRET技术已经成功应用于复杂生物基质中的蛋白、酶、核酸等目标物的检测[5]。由于目前常用的UCPs粒径约为几十纳米,而FRET又是一个高度依赖供受体间距离的过程,这个特性使得只有UCPs表面及接近表面的发光中心能被荧光受体猝灭,因此,猝灭效率高的荧光受体对于UC-FRET灵敏度的提高具有重要意义。使用有机染料做UCPs能量受体,猝灭效率低影响检测灵敏度[6],而无机纳米材料因其较高的猝灭效率被引进UC-FRET体系中。Wang等[7]用纳米金做受体,对UCPs的猝灭效率可以达到60%,但是纳米金做受体时需要进行复杂的表面标记或功能化修饰,过程繁琐。碳材料由于猝灭效率高、生物无毒及免标记等优势也逐渐被用于UC-FRET技术中。Zhang 等[8]使用氧化石墨烯做荧光受体,对UCPs的猝灭效率可以达到81%;Wang[9]等利用碳球(Carbon Nanoparticles,CNPs)作为UCPs的能量受体其猝灭效率可达到80%,但碳材料本身水溶性较差,在一定程度上限制了它们的应用。近年来,聚合物材料作为荧光受体也开始用于荧光传感技术[10,11]。 Wang等[12]利用聚间苯二胺(Poly-m-phenylenediamine,PMPD)纳米球做UCPs受体检测核酸,PMPD通过π-π堆积作用与标记有核酸的UCPs组装到一起,其猝灭效率达到90%。相比碳材料,较多氨基和缺电子芳香环的存在使PMPD具有更好的水溶性和分析性能。
本研究构建了以PMPD为能量受体的UC-FRET凝血酶生物传感器,该传感器结合能量供体UCPs背景干扰小,以及能量受体PMPD的良好水溶性,免标记及强猝灭效率的优点,实现了对凝血酶的高灵敏度与高选择性检测。
1 实验部分
1.1 主要仪器与试剂
980 nm半导体近红外激光器(北京海特光电责任有限公司);RF5301型荧光分光光度计(日本,岛津公司);JEM-2010型透射电子显微镜(日本,电子株式会社);D8型X射线衍射仪(德国,Rucker公司);UV2550型紫外-可见分光光度计(日本,岛津公司);Legend-Micro-17R高速冷冻离心机(美国,Thermo-Scientific公司)。
Y2O3、Yb2O3和Er2O3均为光谱纯(国药集团化学试剂有限公司);4-羟乙基哌嗪乙磺酸(HEPES)为化学纯(Alfa-Aser);NaF为化学纯(中国长江化工厂);三羟甲基氨基甲烷(Tris)为分析纯(上海如吉生物科技发展有限公司);4-(N-马来酰亚胺甲基)环己烷-1-羧酸磺酸基琥珀酰亚胺酯钠盐(sulfo-SMCC,上海生工生物工程有限公司);凝血酶适配体(Aptamer,5′-SH-GGTTGGTGTGGTTGG -3′);聚乙烯亚胺(PEI)(分子量25 000,Sigma-Aldrich);IgG和牛血清白蛋白(BSA)为生化试剂(北京中杉金桥生物科技有限公司);HNO3、乙醇、(NH4)2S2O8、间苯二胺和NaCl均为分析纯(国药集团化学试剂有限公司)。实验所用水为高纯水。
1.2 PMPD的合成
PMPD的合成参照文献方法[10]:将1.8 mmol/L(NH4)2S2O8溶液加入到100 mL圆底烧瓶内,再向烧瓶中加入30 mL N-甲基吡咯烷酮(NMP),剧烈搅拌下快速加入0.6 mmol/L间苯二胺水溶液,搅拌反应24 h后,离心分离,将所得沉淀分别用乙醇、水洗涤3次,最后分散在水中,定容至1 mg/mL,冷藏备用。
1.3 PEI修饰NaYF4∶Yb,Er的合成
0.25 mmol的Ln2O3(Y/Yb/Er=0.78∶0.2∶0.02,摩尔比)溶解于热的浓HNO3(65 ℃),搅拌,待溶液澄清透明时升温至135 ℃蒸干水分得到Ln(NO3)3固体,用10 mL水溶解后加入到50 mL的聚四氟乙烯内衬中,再加入18 mL含680 mg PEI的乙醇溶液。上述反应液在快速搅拌的条件下,逐滴加入8 mL含3 mmol NaF溶液,滴加完后将内衬置于高压反应釜中,200 ℃反应10 h,自然冷却至室温,离心分离,收集沉淀物并用乙醇和水分别洗涤2~3次,定容至4 mL,超声分散后,冷藏备用。
1.4 UCPs与凝血酶适配体偶联
将2 mg的PEI-UCPs溶于2 mL 50 mmol/L的HEPES缓冲溶液(pH=7.2)中,加入0.4 mg sulfo-SMCC,常温下搅拌1 h,然后离心分离,将沉淀用HEPES缓冲溶液(pH=7.2)洗涤三次,除去多余的sulfo-SMCC有机小分子,最后分散于2 mL HEPES缓冲溶液(pH=7.2)中,加入20 nmol的凝血酶适配体(Aptamer)常温下孵育过夜后,离心分离,将沉淀用HEPES缓冲溶液(pH=7.2)洗涤三次后,分散在2 mL 50 mmol/L的Tris-HCl缓冲溶液(pH=7.2)中。将得到的1 mg/mL UCPs置于冰箱4 ℃保存备用。
1.5 UCPs-PMPD FRET传感器的构建
1.5.1猝灭剂浓度选择将1 mg/mL UCPs-aptamer用50 mmol/L Tris-HCl缓冲溶液(pH=7.2)稀释至0.1 mg/mL。在一系列2 mL EP管中加入100 μL UCPs-aptamer,再分别加入不同体积的1 mg/mL PMPD溶液,使PMPD的终浓度依次为0、0.017、0.067、0.1 、0.133、0.167、0.267 mg/mL,所有EP管中反应液总体积用50 mmol/L Tris-HCl(pH=7.2)定容至300 μL,于25 ℃下孵育反应1 h,让荧光得到充分的猝灭。在980 nm激发波长下测定上述各样品的上转换荧光强度,比较荧光强度的变化,得出最佳猝灭剂浓度。为了排除非特异性猝灭,分别测定未偶联适配体质量浓度0.033 mg/mL的UPCs在加入0.167 mg/mL PMPD前后荧光强度的变化。
1.5.2猝灭时间的选择在最佳供受体浓度条件下(UCPs-aptamer 0.033 mg/mL,PMPD 0.167 mg/mL),分别反应0、5、10、20、30、60 min,在相同条件下测量荧光强度。
1.5.3凝血酶定量检测取100 μL 0.1 mg/mL UCPs-aptamer加入到一系列2 mL EP管中,再加入终浓度依次为0、0.2、0.5、0.8、2、5、10、15、20 nmol/L的凝血酶,并用50 mmol/L Tris-HCl缓冲液(pH=7.2)定容至250 μL。将该混合液置于37 ℃下反应2 h,以便核酸与目标物充分反应。待反应液自然冷却至室温,然后加入50 μL 1 mg/mL PMPD,将反应液置于25 ℃下孵育反应1 h后,测定上转换荧光强度。
1.6 选择性
在体系中加入BSA、甘氨酸(Gly)以及葡萄糖等干扰物质,过程如下:将100 μL 0.1 mg/mL UCPs-aptamer加入到一系列2 mL EP管中,再分别加入5 nmol/L的凝血酶和干扰物质,并用Tris-HCl缓冲液(pH=7.2)定容至250 μL,于37 ℃下反应2 h,待其自然冷却至室温,再加入50 μL 1 mg/mL PMPD溶液,于25 ℃下孵育反应1 h。测定上述样品的上转换荧光强度。
2 结果与讨论
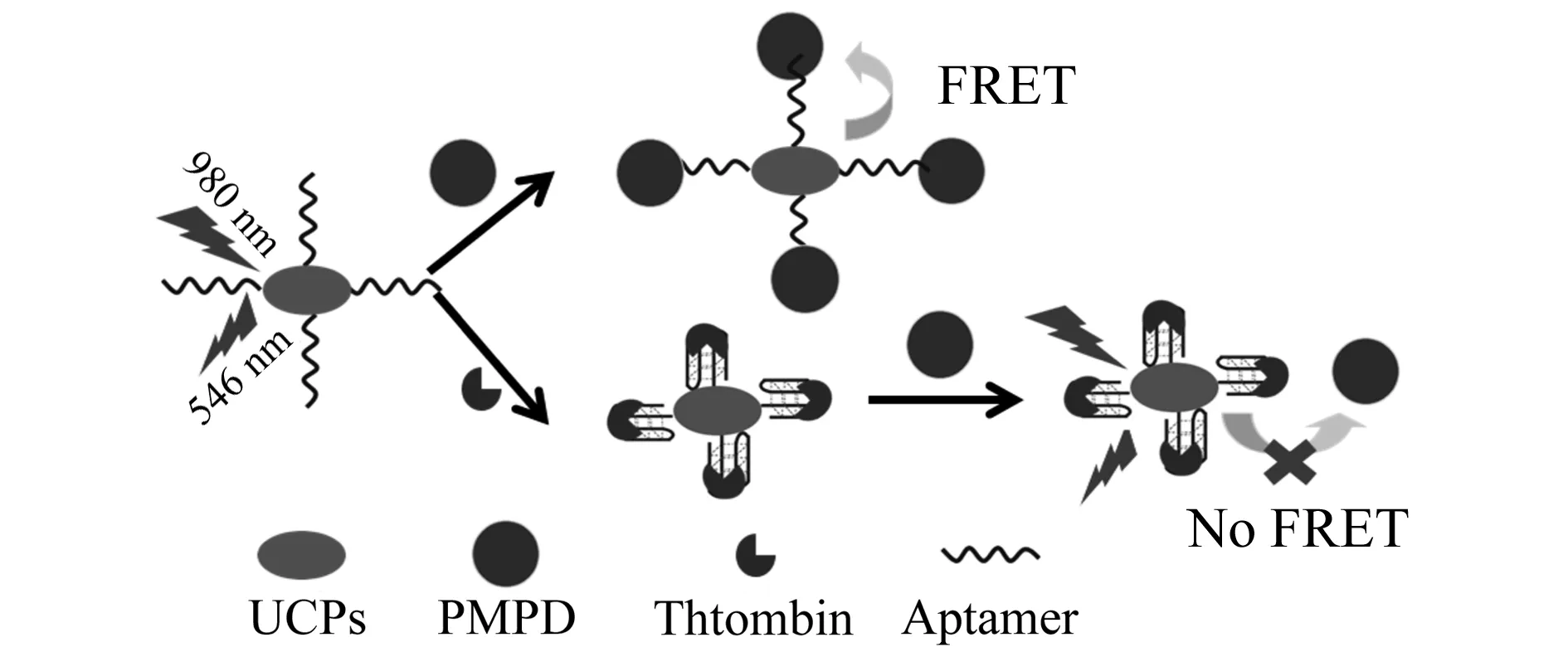
图1 基于PMPD做受体的UC-FRET生物传感器检测凝血酶的示意图
2.1 基于聚间苯二胺做受体的UC-FRET原理
如图1所示,将带有-SH的凝血酶核酸适配体共价修饰到带有-NH2的UCPs表面,偶联形成UCPs-aptamer复合物。研究表明,富含π电子的材料可以与单链DNA通过π-π堆积作用组装到一起[13],当体系中加入PMPD后,标记有凝血酶适配体的UCPs组装到PMPD表面,荧光供受体间距离被拉近,发生FRET,供体荧光被猝灭。当体系中加入凝血酶后,由于凝血酶与适配体有更高的亲和性,两者形成G -四链体结构[14], UCPs-aptamer脱离受体表面,供受体间距离增大,FRET消失,供体荧光得到恢复。同时,荧光恢复程度与凝血酶的浓度在一定范围内呈正比关系,从而可实现定量检测。
2.2 UCPs与PMPD的表征
由X射线衍射(XRD)(图2A)可以看出,采用一步水热法合成的PEI-UCPs是以六方相为主,并含少许立方相的混合晶相。由透射电镜(TEM)(图2B)表征结果可知,UCPs尺寸均一,粒径大约为30~40 nm,其形貌接近球形。图2C是PMPD的扫描电镜(SEM)图,结果表明所合成的PMPD为粒径分布在30~60 nm的均一球形纳米颗粒。

图2 (A)PEI-UCPs的X射线衍射(XRD)图(立方相,•六方相);(B)PEI-UCPs透射电镜(TEM)图;(C) PMPD的扫描电镜(SEM)图
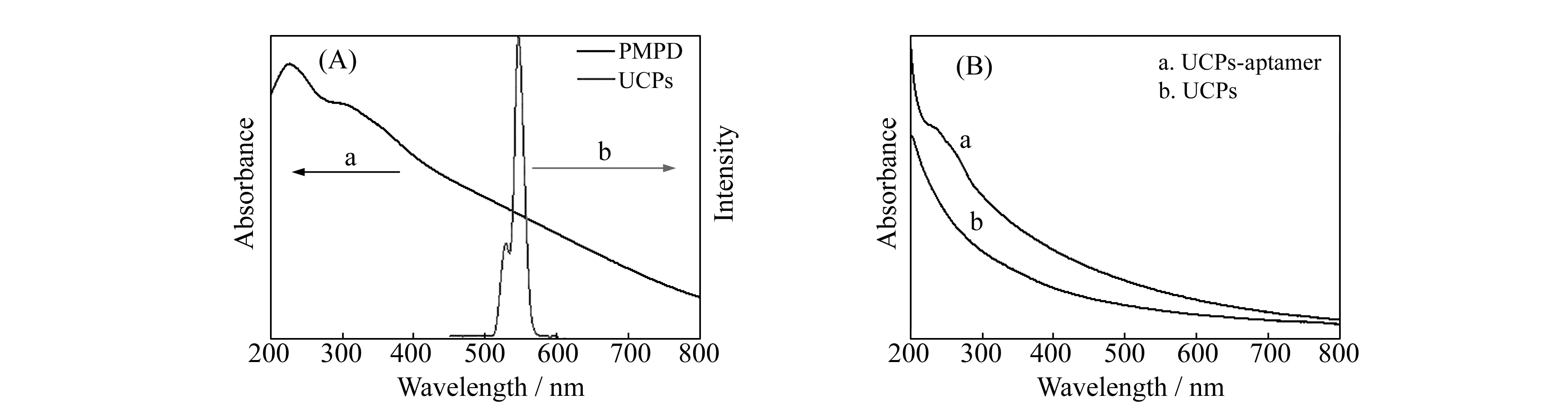
图3 (A) PMPD的紫外-可见吸收光谱(a) 和UCPs的荧光发射光谱(b);(B)UCPs标记适配体前后的紫外-可见吸收光谱
PMPD的紫外-可见吸收光谱如图3(A),PMPD在波长200~700 nm范围有明显的吸收,与UCPs在500~600 nm上转换发光有较好重叠,为后面FRET过程的发生提供了理论依据。UCPs标记凝血酶适配体前后紫外-可见吸收光谱如图3(B)所示,UCPs-aptamer在260 nm附近有明显的DNA吸收峰,表明核酸已成功标记在UCPs上。
2.3 PMPD对UCPs的荧光猝灭
在等量的UCPs-aptamer中加入不同量的PMPD,随着PMPD含量的增加,上转换荧光强度逐渐减小。如图4A,当PMPD在体系中浓度为0.167 mg/mL时,荧光猝灭效率达到最大,约为70%,且随着PMPD浓度的增大变化逐渐减小,最终达到平台。为验证上转换荧光的猝灭是由FRET引起的,对比了同浓度但是不进行适配体标记的UCPs,观察在UCPs中加入0.167 mg/mL PMPD后荧光变化(图4B),可以看出未标记的UCPs仅10%的荧光被PMPD猝灭,相较标记后70%的荧光猝灭可知UCPs与PMPD的非特异性猝灭较小,荧光猝灭主要由PMPD与适配体之间的π-π堆积作用发生FRET引起。同时,通过考察反应时间对荧光猝灭效率的影响(图4C)可知,在供体UCPs-aptamer体系中加入0.167 mg/mL PMPD后,供体的荧光随着时间的延长而逐渐猝灭,在约30 min后即可达到猝灭平台。为了获得稳定的猝灭效率和荧光信号,在此后的回升实验中,统一选定荧光猝灭时间为1 h。
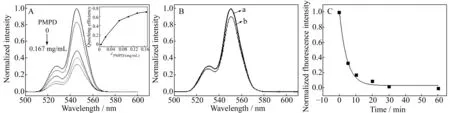
图4 (A)不同浓度PMPD对荧光的猝灭(0,0.017,0.067,0.133,0.167 mg/mL);(B) PMPD对UCPs的非特异性猝灭(a.UCPs,b.UCPs-PMPD);(C)PMPD对UCPs荧光猝灭随时间变化图
2.4 凝血酶的定量检测
由图5A可以看出,当凝血酶加入到UCPs-aptamer-PMPD体系中时,由于与适配体DNA形成G -四链体结构,核酸与PMPD之间的π-π堆积作用减弱,从而导致荧光供体UCPs-Aptamer远离PMPD表面,FRET消失,供体的荧光得到恢复,且随着目标物凝血酶浓度的不断增大,供体的荧光恢复程度增大。图5B显示相对荧光强度((F-F0)/F0(其中F0代表没有凝血酶存在时供体的荧光强度,F代表加入不同浓度凝血酶后供体的荧光强度)逐渐增大,且在凝血酶浓度0.2~5.0 nmol/L浓度范围内呈线性关系(图5B),线性相关系数R=0.995,对目标凝血酶的检测限(3S0/k)为0.18 nmol/L。
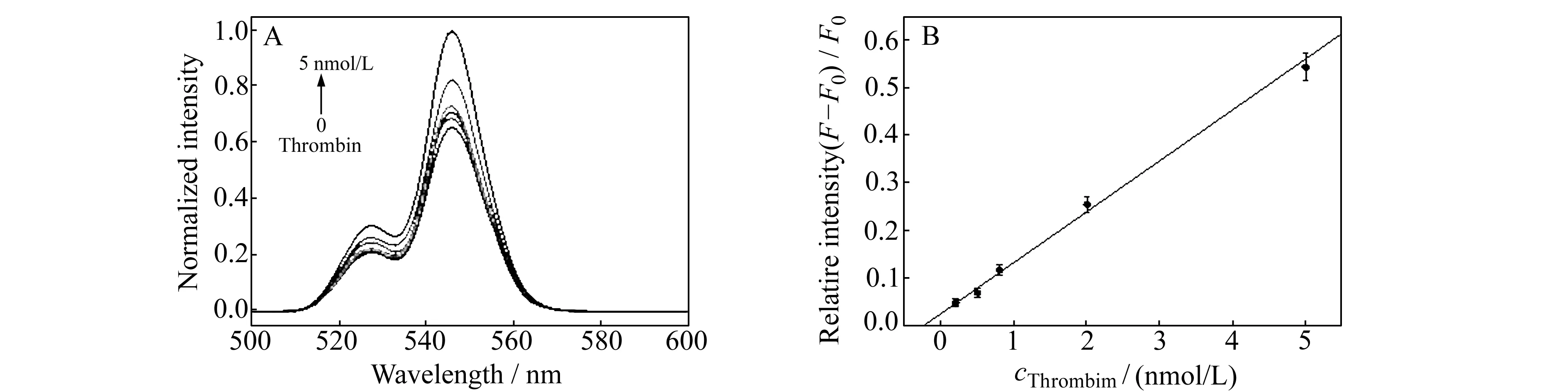
图5 (A)不同浓度凝血酶加入体系后荧光恢复图;(B)相对荧光强度与凝血酶浓度的线性关系图
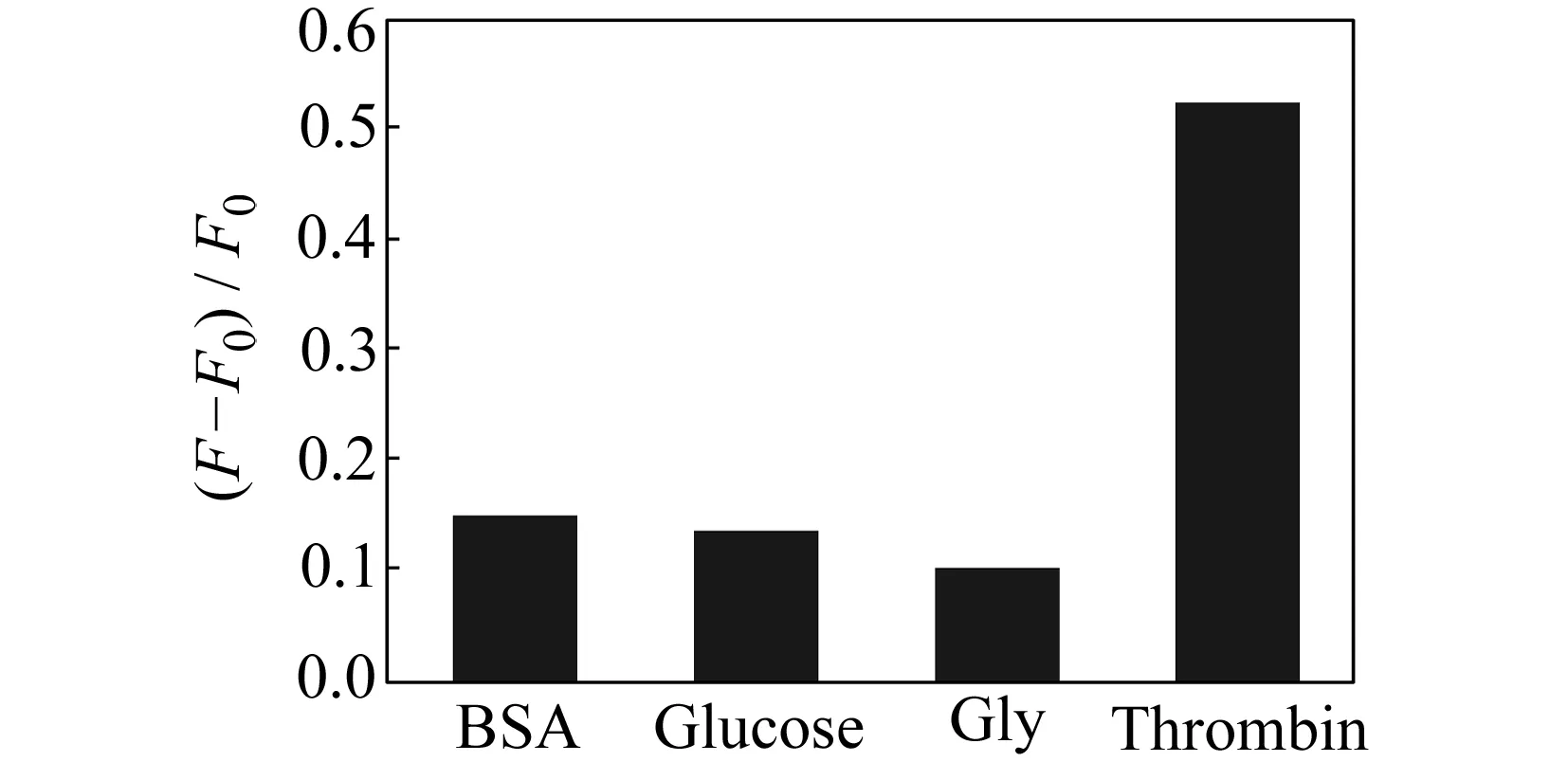
图6 其他物质的干扰性考察
2.5 UC-FRET凝血酶适配体传感器的选择性
为了验证UC-FRET凝血酶适配体传感器对凝血酶的选择性,考察了葡萄糖、氨基酸(Gly)和蛋白质(BSA)对传感器的影响。如图6所示,在加入的蛋白浓度与凝血酶相同的情况下,只有加入凝血酶后供体荧光强度才得到明显的恢复,而干扰物质对传感器的荧光没有明显影响,与空白值接近,证明该传感器对凝血酶具有很好的选择性。
3 结论
本文构建了基于UC-FRET的凝血酶生物传感器。当PMPD浓度为0.167 mg/mL时,荧光猝灭效率可以达到70%,在体系中加入目标物凝血酶后,荧光恢复程度与凝血酶浓度在0.2~5.0 nmol/L范围内呈较好的线性关系,检出限为0.18 nmol/L。良好的猝灭效率,水溶性及免标记的特性使得PMPD成为FRET技术中极具竞争性的受体。

