信号分子与叶锈菌诱导下小麦病程相关蛋白1基因的表达分析
栗小英等

摘要:病程相关蛋白1(pathogenesis-related proteins1,PR1)是一类以基因家族形式存在的重要病程相关蛋白,在前期研究中,在小麦抗叶锈病近等基因系材料TaLr35中成功获得了1个小麦病程相关蛋白1基因TaLr35PR1,具有植物防御体系中的SCP保守结构域。利用生物信息学方法进一步明确,该基因含有信号肽,定位于细胞间隙,可能含有跨膜结构域,相对分子量为17.3 ku,与多个植物病程相关蛋白1序列具有较高同源性;利用半定量RT-PCR方法结合genetools、SPSS软件分析TaLr35PR1基因表达模式,结果表明,信号分子水杨酸(salicylic acid,SA)、脱落酸(abscisic acid,ABA)明显诱导该基因表达,且用信号分子预处理后接种叶锈菌,基因表达量明显增加;构建了TaLr35PR1基因的原核表达载体pEASY-PR1,在大肠杆菌中高效表达分子量约为17 ku的融合蛋白,明确其最佳诱导条件为在 0.8 mmol/L IPTG下于25 ℃诱导8 h。
关键词:叶锈菌;信号分子;病程相关蛋白1;表达分析;原核表达
中图分类号: Q756文献标志码: A文章编号:1002-1302(2015)09-0028-04
收稿日期:2014-08-27
基金项目:国家重点基础研究发展计划(编号:2013CB127700);河北省自然科学基金(编号:C2012204005)。
作者简介:栗小英(1988—),女,河北张家口人,硕士研究生,研究方向为分子植物病理。E-mail:506112516@163.com。
通信作者:王海燕,副教授,主要从事分子植物病理学研究。E-mail:ndwanghaiyan@163.com。植物在长期的进化过程中,为了抵抗病害对自身生长的不良影响,在一定程度上发展了感受生物胁迫信号的机制,通过体内的信号传导途径,激发转录因子与相应的顺式作用元件的结合,进而启动特定基因的转录和表达,最后导致植物对胁迫作出反应[1]。病程相关(pathogenesis-related,PR)蛋白质在信号传递与胁迫应答中起调节作用。PR 基因的最初发现主要是由于它们在植物受到病原物侵染时会大量表达。PR蛋白质除了在抗病反应中发挥重要作用外,在植物抗衰老、伤害、非生物逆境胁迫和激素处理,以及正常生长中也发挥重要作用。在PR蛋白家族中,PR1是一类重要的蛋白,但对其作用机制以及靶物质还尚不了解[2]。水杨酸(salicylic acid,SA)或乙烯(ethylene) 可诱导PR1基因的表达,常被作为系统获得性抗性(systemic acquired resistance,SAR)的分子标记[3],因此,PR1基因编码的蛋白质成为目前的研究热点。
PR1蛋白最早从烟草中发现,随后从许多单子叶和双子叶植物中鉴定出PR1基因。PR1是一类可经病原菌和SA大量诱导表达的PR蛋白,蛋白分子量为14~17 ku,有酸性和碱性,大多呈碱性。PR1 被证实具有抗病毒扩散、限制真菌入侵和保护植物抵御逆境胁迫等功能[4-5]。Agrawal 等研究证明OsPR1a、OsPR1b基因受茉莉酸(jasmonic acid,JA)、SA、过氧化氢(H2O2)、蛋白酶抑制剂斑蝥素(cantharidin,CN)、草藻灭(endothall,EN)和稻瘟病菌(Magnaporthe grisea)的诱导,对光伤害及磷酸酶抑制剂等环境胁迫和化学处理作出反应[6-8]。杨德翠等研究发现,PR1基因表达量与水杨酸的积累密切相关,表达量的升高增强了牡丹对柱枝孢叶斑病(Cylindrocladium canadense)的抗性,并且发现该病侵染牡丹 24 h 后,PR1基因的表达显著提高[9]。
小麦(Triticum aestivum)是重要的粮食作物,是全世界一半以上人口的主粮。小麦生产经常受到病虫害的威胁,尤其由小麦叶锈菌(Puccinia triticina)引起的小麦叶锈病是威胁全球小麦稳产高产的主要病害之一。小麦抗叶锈病基因Lr35,其抗性从2叶期开始表达,6叶期完全表达,是1个十分有效的成株抗叶锈病基因。笔者前期利用RT-PCR和cDNA末端快速扩增技术(rapid amplification of cDNA ends,RACE)技术从含有小麦抗叶锈病基因Lr35的近等基因系材料TcLr35中获得1个PR1基因的cDNA全长,命名为TaLr35PR1[10]。本研究拟利用半定量RT-PCR明确TaLr35PR1基因在受叶锈菌和信号分子诱导后核酸水平的表达特征,为进一步探究其在生物与非生物胁迫过程中的功能及了解生物胁迫应答机理提供线索。
1材料与方法
1.1试验材料
供试植物材料为携带小麦抗叶锈病基因Lr35的回交6代近等基因系材料TcLr35,及与其遗传背景相同的感病亲本“Thatcher”;供试小麦叶锈菌菌株为07-10-426-1(PHNT),该菌株对TcLr35呈非亲和反应(反应型为1型),对Thatcher呈亲和反应(反应型为4型)。各种限制性内切酶、质粒、胶回收试剂盒、Taq DNA聚合酶购自生工生物工程上海(股份)有限公司;原核表达载体pEASYTM-E1购自北京全式金生物技术有限公司。
1.2试验方法
化学试剂处理:参考Zambounis等的方法[11]配制50 μmol/L SA溶液、50 μmol/L ABA溶液,喷洒于六叶期的成株小麦叶片表面至溶液滴下,于18~25 ℃、光照时间10~14 h的温室培养,处理3 d后,开始接种叶锈菌07-10-426-1(孢子萌发率为80%以上),以未接菌处理为对照,分别在接种后0、6、12、24、36、48、72、120 h取0.1 g叶片,液氮速冻后于-80 ℃储藏备用。
1.3总RNA的提取和cDNA第1链的合成
采用Bio-Flux公司的BIOZOL试剂盒提取小麦各处理样品总RNA,按照宝生物工程(大连)有限公司的反转录酶试剂盒说明书合成cDNA第1链。反转录合成的模板直接用于PR1基因的半定量RT-PCR分析。
1.4小麦TaLr35PR1生物信息学分析
利用SignalP(http://www.cbs.dtu.dk/services/SignalP/)、TMHMM(http://www.hsls.pitt.edu/obrc/index.)、ProtScale(http://expasy.org/tools/)和Spidey(http://www. nebi. nlm. nih. Gov/spidey)在线工具完成对基因结构模式的分析。分别利用SOPMA程序和Phyre2在线工具完成对蛋白质二级、三级结构的预测。
1.5小麦TaLr35PR1基因表达模式分析
根据TaLr35PR1基因开放阅读框(open reading frame,ORF)设计特异引物TaLr35PR1-F、TaLr35PR1-R(TaLr35PR1-F:5′- CCCAAGCTTTTAGTATGGTTTCTGTCCAATGAT-3′;TaLr35PR1-R:5′-CGCGGATCCAACTCGCCTCAGGACTAC-3′),以小麦中组成型表达的基因甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)基因(GenBank登录号:AF251217;GAPDH-F:5′-AACTGCCTTGCTCCTCTTGC-3′;GAPDH-R:5′-CTGTTGTCACCCTGGAAGTCA-3′)作为内标基因。以叶锈菌、ABA,SA处理后不同时间点的小麦叶片的cDNA为模板进行半定量RT-PCR。PCR反应条件为:94 ℃预变性1 min;94 ℃变性30 s,51 ℃退火1 min,72 ℃延伸2 min,35个循环。每个样品设3个重复。试验数据通过genetools软件得出表达量大小,利用SPSS软件计算方差和显著性,综合进行分析,获得TaLr35PR1基因的相对表达量。
1.6小麦TaLr35PR1原核表达载体的构建与诱导表达
设计原核表达特异引物YTaLr35PR1-F:5′-CGCGGATCCAACTCGCCTCAGGACTAC-3′、YTaLr35PR1-R:5′-CCCAAGCTTTTAGTATGGTTTCTGTCCAATGAT-3′;PCR产物与表达载体pEASY-E1进行连接并转化。首先使用PCR扩增用引物验证目的片段与载体连接是否成功,再利用上游引物YTaLr35PR1-F和载体自带T7终止子引物T7terminator(5′-TAGTTATTGCTCAGCGGTGG-3′)验证目的片段插入的方向性,然后转入表达载体BL21(DE3)感受态细胞后进行诱导表达。
2结果与分析
2.1小麦TaLr35PR1基因特征分析
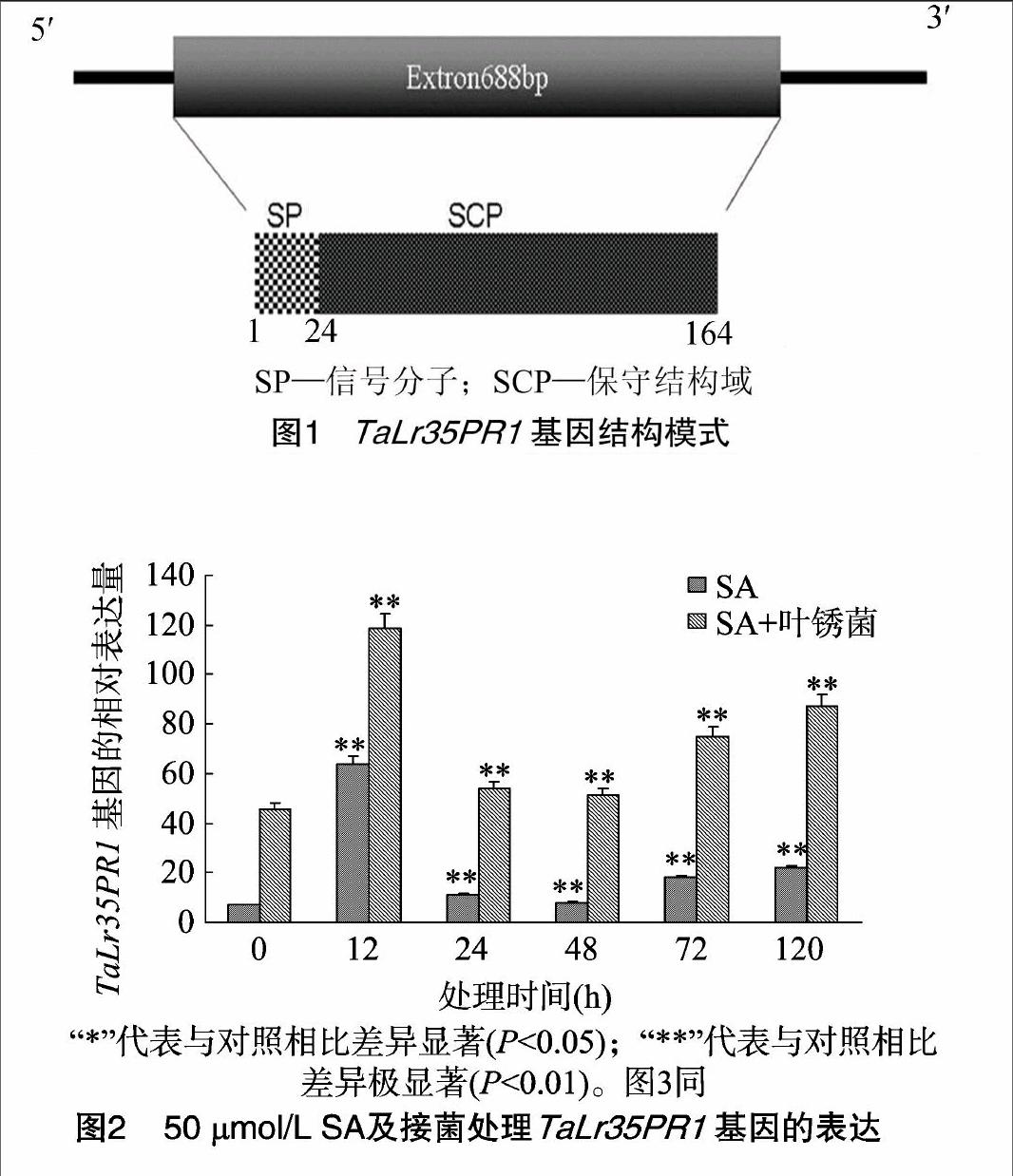
ProtScale软件[12]预测TaLr35PR1编码的蛋白总体表现为疏水性;SignalP 4.1[13]预测TaLr35PR1氨基酸序列具有信号肽,信号肽酶切位点在第1~24个氨基酸残基之间。利用 SMART在线软件对TaLr35PR1基因进行结构分析,结果表明该基因具有保守的抗真菌结构域SCP(图1);利用Phyre2软件分析,结果表明该基因由4条α螺旋、4条β折叠构成,呈三明治般的ɑβɑ结构。
2.2小麦TaLr35PR1基因表达模式
2.2.1SA诱导叶片中TaLr35PR1基因的表达谱分析50 μmol/L SA胁迫处理后,TaLr35PR1基因表达量在处理 12 h 明显增加,并达到最大,约为对照组(0 h)表达量的7.6倍;之后随着时间延长,表达量减少,到120 h又略有增加,约为对照组(0 h)表达量的2.6倍(图2)。为了明确信号分子与叶锈菌的协调作用,50 μmol/L水杨酸胁迫处理3 d后,再接种叶锈菌,TaLr35PR1基因表达量在接种12 h极显著增加并达到最大(P<0.01),约为对照组(0 h)的2.6倍;之后随着接种时间延长,表达量显著减少,到120 h又略有增加,约为未接种对照组(0 h)表达量的1.8倍。水杨酸预处理后再接种叶锈菌的表达趋势与未接菌处理基本一致,但整体表达水平高于未接菌处理,接菌0 h后,TaLr35PR1基因表达量约为未接菌处理5.9倍。上述结果均扣除了Thatcher的表达量。
2.2.2ABA诱导叶片中TaLr35PR1基因的表达谱分析50 μmol/L ABA胁迫处理后,TaLr35PR1基因表达量在处理 12 h 明显增加,72 h达到表达高峰,约为对照组(0 h)表达量的3.6倍,至120 h表达量减少(图3)。为了明确信号分子与叶锈菌的协调作用,在50 μmol/L脱落酸胁迫预处理后,再接种叶锈菌。结果表明,TaLr35PR1基因表达量在接种12 h后显著增加,至72 h达到最大(P<0.05),约为未接种对照组(0 h)的1.8倍;之后随着接种时间延长,表达量稍有减少,整体表达趋势与未接菌处理一致,但表达量明显高于未接菌处理;接菌0 h后,TaLr35PR1基因表达量约为脱落酸处理(0 h)的3.2倍。上述结果均扣除了Thatcher的表达量。
2.3TaLr35PR1基因原核表达载体的构建
利用pEASY-E1表达试剂盒构建表达载体TaLr35PR1-pEASY,为验证目的片段是否与载体成功连接,利用YTaLr35PR1-F、YTaLr35PR1-R引物进行PCR扩增,对重组子进行初筛,获得约420 bp左右的片段,与该引物对TcLr35总RNA的PCR扩增产物大小一致,说明目的基因已经整合到pEASY-E1载体上。为验证目的片段插入载体的方向是否正确,使用YTaLr35PR1-F、T7terminator重组引物对重组子进行筛选,预期扩增产物为目的片段与载体序列的重组片段,获得约500 bp左右的片段(图4),证明插入载体的方向正确。测序结果进一步表明,目的片段插入表达载体的位置和读码框正确。
2.4TaLr35PR1基因的体外诱导表达
以不同温度、不同IPTG浓度、不同时间诱导转化了表达载体pEASY-PR1的大肠杆菌BL21(DE3)。经SDS-PAGE
分析可见,在25 ℃温度下,诱导的pEASY-PR1在17 ku左右产生1条新的诱导条带,大小与理论值推算相符,而在27 ℃温度下未见明显诱导条带(图5-A);以未经诱导的pEASY-PR1为对照,0.01~0.80 mmol/L IPTG诱导菌体均产生1条约17 ku的新条带,确定0.80 mmol/L IPTG为最佳的诱导浓度(图5-B);随着诱导时间的延长,诱导2 h蛋白表达量增加明显,6 h至过夜趋于稳定,最佳诱导时间为8 h(图5-C)。结果表明,小麦TaLr35PR1基因在大肠杆菌中得到了高效表达,获得了分子量约为17 ku的融合蛋白,最佳诱导条件为在0.8 mmol/L IPTG下于25 ℃诱导8 h。
3结论与讨论
有报道证明拟南芥在抵抗病原物后的茉莉酸(JA)、SA信号转导网络协调拟南芥抗病性[14]。此外,在病原物侵染前用SA处理拟南芥,发现可以诱导SAR反应以及PR蛋白的表达,以增强抗病能力[15]。PR1基因能被病菌侵染和信号分子胁迫所诱导[16-17],PR1基因的表达增强了植物抵御病害和其他各种胁迫的能力。机械损伤、植物激素(JA、SA、ET)、蛋白磷酸酶抑制剂斑蝥素(CN)、草藻灭(EN)都能诱导水稻OsPR1a基因的表达[18]。SA介导的SAR反应主要对活体营养型病菌起作用,而JA/ET介导的抗病信号途径对抵抗腐生型真菌侵染起到作用[19]。棉花的PR3、PR10、GST18基因在转录水平上不仅受JA、SA的诱导,而且受棉花枯萎病菌(Fusarium oxysporum f. sp. vasinfectum)诱导后表达水平显著上调[11]。小麦叶锈菌为典型的活体营养型病菌。本研究旨在明确SA和叶锈菌诱导对TaLr35PR1基因表达的影响,结果发现TaLr35PR1基因表达受SA单独诱导;同时,在SA胁迫处理后再接种叶锈菌,TaLr35PR1基因表达趋势与SA诱导表达趋势一致,而且SA与叶锈菌协同作用显著增加了TaLr35PR1表达量,且其表达量明显高于叶锈菌单独诱导。
ABA是调节植物生长发育的一种激素。当植物面临不利的自然环境时,植物体内ABA的含量会增加,进而促进植物生长。植物体内存在ABA、非ABA 2种调节系统[20]。实现这种调节必须能够顺利完成从刺激到准确反应的一系列信号转导过程,这主要包括以受体为中心的脱落酸信号的细胞识别、以第二信使为中心的胞内信号转换,以及以蛋白磷酸化为中心的信号放大与传导等过程[14]。在前期研究中证明ABA可以诱导病程相关蛋白的表达[21],在本研究中发现TaLr35PR1基因表达受ABA诱导,而且脱落酸与叶锈菌协同作用明显诱导TaLr35PR1基因的表达,而且表达量显著高于SA和叶锈菌单独诱导。基于2种信号分子对TaLr35PR1基因的诱导表达模式,推测小麦TaLr35PR1基因在参与小麦抗叶锈病防御反应时,可能通过SA、ABA 2种信号途径,但具体作用机制还需进一步探讨。
水稻、小麦等作物中关于病程相关蛋白从蛋白水平验证抗病性的研究报道较多。李雪姣等研究发现,在水稻与白叶枯病菌互作时,病程相关蛋白1家族在接菌后不同时间点、不同生长期都发挥作用[22];关明俐等的研究有力地证明了不同的病程相关蛋白在水稻与白叶枯病菌互作时发挥作用[23];此外,牛吉山等应用RT-PCR和cDNA文库筛选技术,从抗白粉病小麦-簇毛麦6VS/6AL易位系中分离到1个小麦类甜蛋白基因的全长cDNA,Western分析表明其可能与小麦 6VS/6AL 易位系的抗白粉病性相关[24];余宇克隆得到了小麦类甜蛋白基因的全长序列,并利用原核表达得到纯度较高的类甜蛋白[25]。后续研究将进一步制备单克隆抗体,从蛋白水平分析其表达模式,并分析其他信号分子对该基因的影响,探析信号传递途径。
参考文献:
[1]Fujita M,Fujita Y,Noutoshi Y,et al. Crosstalk between abiotic and biotic stress responses:a current view from the points of convergence in the stress signaling networks[J]. Current Opinion in Plant Biology,2006,9(4):436-442.
[2]Hou M,Xu W,Bai H,et al. Characteristic expression of rice pathogenesis-related proteins in rice leaves during interactions with Xanthomonas oryzae pv. oryzae[J]. Plant Cell Reports,2012,31(5):895-904.
[3]van Loon L C,van Strien E A. The families of pathogenesis-related proteins,their activities and comparative analysis of PR-1 type proteins[J]. Physiological and Molecular Plant Pathology,1999,55(2):85-97.
[4]Cutt J R,Harpster M H,Dixon D C,et al. Disease response to tobacco Mosaic virus in transgenic tobacco plants that constitutively express the pathogenesis-related PR1b gene[J]. Virology,1989,173(1):89-97.
[5]Rauscher M,Adám A L,Wirtz S,et al. PR-1 protein inhibits the differentiation of rust infection hyphae in leaves of acquired resistant broad bean[J]. The Plant Journal,1999,19(6):625-633.
[6]Agrawal G K,Jwa N S,Rakwal R. A novel rice(Oryza sativa L.) acidic PR1 gene highly responsive to cut,phytohormones,and protein phosphatase inhibitors[J]. Biochemical and Biophysical Research Communications,2000,274(1):157-165.
[7]Agrawal G K,Rakwal R,Jwa N S. Rice(Oryza sativa L.) OsPR1b gene is phytohormonally regulated in close interaction with light signals[J]. Biochemical and Biophysical Research Communications,2000,278(2):290-298.
[8]Agrawal G K,Rakwal R,Jwa N S,et al. Signalling molecules and blast pathogen attack activates rice OsPR1a and OsPR1b genes:a model illustrating components participating during defence/stress response[J]. Plant Physiology and Biochemistry,2001,39(12):1095-1103.
[9]杨德翠,张玉喜,郑国生. 牡丹病程相关蛋白1基因的克隆及表达分析[J]. 园艺学报,2013,40(8):1583-1590.
[10]王海燕,刘大群,杨文香,等. TcLr35小麦中病程相关蛋白1基因的克隆及分析[J]. 植物遗传资源学报,2007,8(1):16-20,29.
[11]Zambounis A G,Kalamaki M S,Tani E E,et al. Expression analysis of Defense-Related genes in cotton(aossypium hirsutum) after Fusarium oxysporum f. sp. vasinfectum infection and following chemical elicitation using a salicylic acid analog and methyl jasmonate[J]. Plant Molecular Biology Reporter,2012,30(1):225-234.
[12]Kyte J,Doolittle R F. A simple method for displaying the hydropathic character of a protein[J]. Journal of Molecular Biology,1982,157(1):105-132.
[13]Nielsen H,Engelbrecht J,Brunak S,et al. Identification of prokaryotic and eukaryotic signal peptides and prediction of their cleavage sites[J]. Protein Engineering,1997,10(1):1-6.
[14]Berrocal-Lobo M,Molina A. Arabidopsis defense response against Fusarium oxysporum[J]. Trends in Plant Science,2008,13(3):145-150.
[15]Edgar C I,Mcgrath K C,Dombrecht B,et al. Salicylic acid mediates resistance to the vascular wilt pathogen Fusarium oxysporum in the model host Arabidopsis thaliana[J]. Australas Plant Pathology,2006,35(6):581-591.
[16]Tang Y,Kuang J F,Wang F Y,et al. Molecular characterization of PR and WRKY genes during SA- and MeJA-induced resistance against Colletotrichum musae in banana fruit[J]. Postharvest Biology and Technology,2013,79:62-68.
[17]Agrawal G K,Jwa N S,Rakwal R. A novel rice(Oryza sativa L.) acidic PR1 gene highly responsive to cut,phytohormones,and protein phosphatase inhibitors[J]. Biochemical and Biophysical Research Communications,2000,274(1):157-165.
[18]von Dahl C C,Baldwin I T. Deciphering the role of ethylene in plant herbivore interactions[J]. Journal of Plant Growth Regulation,2007,26:201-209.
[19]Glazebrook J. Contrasting mechanism of defence against biotrophic pathogens[J]. Annual Review of Phytopathology,2005,43:205-227.
[20]Chinnusamy V,Schumaker K,Zhu J K. Molecular genetic perspectives on cross-talk and specificity in abiotic stress signalling in plants[J]. Journal of Experimental Botany,2004,55(395):225-236.
[21]栗小英,高琳,张艳俊,等. 叶锈菌及信号分子诱导小麦 TcLr35中β-1,3-葡聚糖酶基因的表达分析[J]. 中国农业科学,2014,47(14):2774-2783.
[22]李雪姣,范伟,牛东东,等. 水稻病程相关PR1家族蛋白质在叶片生长及与白叶枯病菌互作反应中的表达[J]. 植物学报,2014,49(2):127-138.
[23]关明俐,窦世娟,李雪姣,等. 病程相关蛋白质在水稻与白叶枯病菌互作过程中的表达[J]. 中国农业科学,2013,46(20):4179-4188.
[24]牛吉山,于玲,陈佩度,等. 小麦-簇毛麦6VS/6AL易位系叶片cDNA文库构建及鉴定[J]. 南京农业大学学报,2001,24(1):5-8.
[25]余宇. 小麦类甜蛋白TLP基因的克隆与原核表达[D].

