巴美肉羊M yHC荧光定量检测方法的优化
张 静,郭月英,任 霆,程海星,王 乐,靳 烨
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
巴美肉羊M yHC荧光定量检测方法的优化
张静,郭月英,任霆,程海星,王乐,靳烨*
(内蒙古农业大学食品科学与工程学院,内蒙古呼和浩特010018)
通过相对荧光定量的方法,以18S rRNA做管家基因,探索MyHC基因家族是否可用于巴美肉羊的研究,并确定最佳退火温度。研究发现引物可用于巴美肉羊MyHC基因表达量的研究;当退火温度为57℃时各基因的峰值单一,Ct值最稳定,且扩增效率好。此方法确定的实验条件可以用于测定巴美肉羊MyHCmRNA表达量的分析。
肌球蛋白重链(MyHC),18S rRNA,荧光定量PCR
随着人们消费水平的提高,人们对肉制品的要求已从量的需求转变为对质的提高。肉品质成为大家关注的焦点。肉品质是一个复杂的性状,众多因素共同决定了肉质的优劣,如:动物品种、饲养管理、营养状况、屠宰时间以及基因效应等[1]。巴美肉羊是我国第一个具有自主知识产权的培育肉用品种,它的出现缓解了我国优质肉用种羊严重不足的压力,促进了肉羊良种繁育和产业化发展[2],但关于巴美肉羊的研究却鲜见。MyHC基因家族(myosin heacy chain)又称肌球蛋白重链基因家族,MyHC家族的Ⅰ型、Ⅱa型、Ⅱx型和Ⅱb型基因分别对应Ⅰ型(慢速氧化型)、Ⅱa型(快速氧化型)、Ⅱx型(中间型)和Ⅱb型(快速酵解型)四种肌纤维类型[3]。大量研究表明,MyHC基因可以通过控制肌纤维的类型来影响肉质的优劣。关于MyHC基因家族在鱼、猪和牛这些动物方面的研究较多,在羊特别是巴美肉羊方面的研究几乎没有。荧光定量是通过荧光染料或荧光标记的特异性的探针,对PCR产物进行标记跟踪,实时在线监控反应过程,结合相应的软件可以对产物进行分析,计算待测样品模板的初始浓度,从而实现了由定性技术向定量技术的飞跃。本实验以巴美肉羊为实验动物,以MyHC基因家族及管家基因18S rRNA为实验基因,采用荧光相对定量的方法进行mRNA相对表达量的研究,通过此实验确定MyHC基因在相对表达量实验中的最佳实验条件,为下一步的研究提供依据。
1 材料与方法
1.1材料与仪器
4月龄巴美肉羊的股二头肌选用来自内蒙古巴彦淖尔市,现代畜牧业示范基地(常见食用部位且容易取得);RNAiso Plus、Prem ix Taq®Version2.0(Loading dye mix)、PrimeScriptTMRT reagent Kit with gDNA Eraser(Perfect Real Time)、SYBR®Prem ix Ex TaqTMII、pMD19-T Vector Kit大连宝生物工程有限公司;AxyPrep DNA Gel Extraction Kit AXYGEN、Trans1-T1 Phage Resistant感受态细胞北京全式金生物技术有限公司;RNase-free水北京天根生物技术有限责任公司;氯仿分析纯,国药集团化学试剂有限公司;异丙醇、无水乙醇分析纯,天津市风船化学试剂科技有限公司。
ZHJH-C1112C超净工作台上海智城分析仪器制造有限公司;Eppendorf 5430R低温台式冷冻离心机、移液枪1000、200、100、20、10、2.5μLEppendorf生物公司,德国;BG-power5000型稳压稳流电泳仪
北京百晶生物技术有限公司;水平电泳槽北京百晶生物技术有限公司;凝胶成像系统、核酸蛋白分析仪、实时定量PCR仪(CFX96TMReal-Time PCR Detection System)Bio-rad,美国;普通PCR仪App lied Biosystems(AB),美国;R134A生化培养箱SHEL LAB;ZWYR-240摇床上海智城仪器。
1.2RNA用样品处理
将宰后1h内巴美肉羊的股二头肌肌肉100mg左右放入2m L无酶管中,并迅速将其投入液氮中保存,带回实验室后,置于-80℃冰箱中保存。将采回的肉样进行RNA提取,并进行表达量的研究,从而得出巴美肉羊中MyHCI、MyHCIIa、MyHCIIb、MyHCIIx及管家基因18S rRNA的最佳实验条件。
1.3总RNA的提取和反转录
1.3.1总RNA的提取总RNA的提取按照RNAiso Plus、Prem ix Taq®Version2.0(Loading dye m ix)试剂盒说明书进行,用1%琼脂糖凝胶电泳测定RNA质量,最后置于-80℃冰箱保存。
1.3.2反转录测定RNA的OD值和浓度,OD260/ OD280均在1.7~2.0范围,稀释成约1000ng/μL的浓度。反转录按照PrimeScriptTM RT reagent Kit with gDNA Eraser(Perfect Real Time)试剂盒说明书进行。反转录后的默认cDNA浓度为50ng/μL。
1.4引物的设计与合成
管家基因18S rRNA、MyHCI、MyHCIIa、MyHCIIx引物引用参考文献[4],MyHCIIb引物由内蒙古农业大学郭月英提供,由上海生工生物工程有限公司合成引物。引物信息如表1所示。

表1 实时定量引物Table 1 Primers of real-time PCR
1.5实验方法
荧光定量PCR按照SYBR®Premix Ex TaqTMII说明书的CFX96TMReal-Time PCR Detection System二步法操作。为了筛选最佳反应条件,本实验做了温度梯度实验,温度梯度范围为52~61℃,最终选择的最佳退火温度为57℃,反应条件为:

1.6PCR产物的胶回收纯化
用1.2%的琼脂糖凝胶做胶回收纯化,胶回收纯化操作步骤按照AxyPrep DNA Gel Extraction Kit试剂盒说明书进行。
1.7目的基因的克隆
1.7.1目的基因的连接目的基因与pMD19-T连接载体连接,操作步骤按照pMD19-T Vector Kit说明书进行。
1.7.2目的基因的转化重组质粒转化到感受态细胞中,操作步骤按照Trans1-T1 Phage Resistant感受态细胞说明书进行。
1.7.3筛选阳性克隆及测序将有转化好的感受态细胞的菌液200μL均匀涂布于含有AMP、IPTG和x-Gal的LB琼脂培养基上,把平板置于37℃至液体被吸收,倒置平板,37℃过夜培养。选取单个漂亮的阳性菌落放入装有10μL灭菌水的PCR管中,1μL用于菌落PCR,菌落PCR的产物经琼脂糖凝胶检测后,把条带清晰明亮且单一的菌落PCR产物对应的剩余9μL的带有菌落的灭菌水加入含有AMP和甘油的LB液体培养基中,送去测序。
2 结果与分析
2.1RNA提取结果
经凝胶成像结果如图1,由图1可看出28、18和5S处的三条带清晰明亮,基本没有降解。用核酸蛋白分析仪测得OD260/OD280均在1.7~2.0之间,没有被DNA或蛋白污染(当OD260/OD280小于1.7时,说明被蛋白污染;当OD260/OD280大于2.0时,说明被DNA污染),可用于反转录及荧光定量。

图1 RNA提取结果Fig.1 The resultof total RNA
2.2PCR产物电泳结果
PCR产物经琼脂糖凝胶电泳检测结果如图2。

图2 PCR产物结果图Fig.2 The result of PCR
从图2可以看出,MyHCⅠ、Ⅱa、Ⅱb和Ⅱx基因和18S rRNA的PCR扩增产物经凝胶电泳后条带单一且清晰明亮,无引物二聚体和其他杂质产生。通过与Marker条带比较,其大小与所设计引物相符,说明引物符合实时定量PCR实验要求。
2.3测序结果
通过对阳性菌液的测序比对,证实所设计引物即为目的基因引物,各引物均符合实时定量PCR实验要求,可用于后续实验。
2.4溶解曲线分析
如图3~图7所示,分别为MyHCII x、II a、II b,I基因和管家基因18S rRNA在退火温度为57℃时的溶解曲线图。溶解曲线顶点对应的温度为溶解温度(Tm),可部分代表序列的特异性。由图3~图7可知,溶解曲线的峰值单一,重复性好,说明无引物二聚体和非特异性扩增产物;Tm分别为86、85.3、81.5、90和84℃,数值稳定且均位于80~90℃之间,可用于后续实验。当出现杂峰时,可通过改变引物浓度,退火温度和镁离子浓度来解决问题;若仍然有杂峰,说明引物特异性差,要换特异性好的引物。
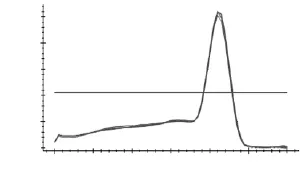
图3 MyHC IIx溶解曲线Fig.3 Melting curve ofMyHC IIx

图4 MyHC IIa溶解曲线Fig.4 Melting curve ofMyHC IIa

图5 MyHC IIb溶解曲线Fig.5 Melting curve ofMyHC IIb
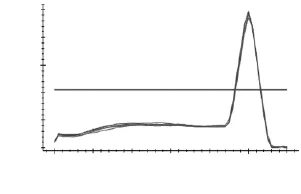
图6 MyHC I溶解曲线Fig.6 Melting curve ofMyHC I
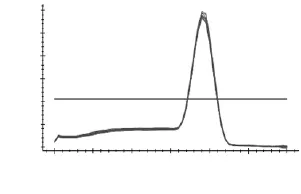
图7 18S rRNA溶解曲线Fig.7 Melting curve of 18S rRNA
2.5扩增曲线分析
如图8~图12所示,分别为MyHCII x、IIa、IIb、I基因和管家基因18S rRNA在退火温度为57℃时的扩增曲线图。理论上扩增曲线为2n的曲线图,但实际反应中呈“S”型,反应前的基线相当于准备时间,如温度升高或双链变性等,指数期开始复制,平台期是由于底物消耗完所致,因此为“S”型。其中“S”型曲线与荧光阈值的交点为ct值,即荧光信号达到设定阈值时的循环数。由图8~图12可知,扩增曲线成典型“S”型,拐点清晰,指数期明显,平台期平行性好,无扫尾现象,每条扩增曲线的重复性好;平行样的ct值差异小于0.5,重复性好,ct值的平均值分别为14.03、17.00、13.97、18.20和10.63,可用于后续实验。

图8 MyHC IIx扩增曲线Fig.8 Quantification curve ofMyHC IIx

图9 MyHC IIa扩增曲线Fig.9 Quantification curve ofMyHC IIa

图10 MyHC IIb扩增曲线Fig.10 Quantification curve of MyHC IIb

图11 MyHC I扩增曲线Fig.11 Quantification curve ofMyHC I
2.6标准曲线分析
分别以2倍梯度将cDNA稀释成5个浓度,经过荧光定量分析得出表2。
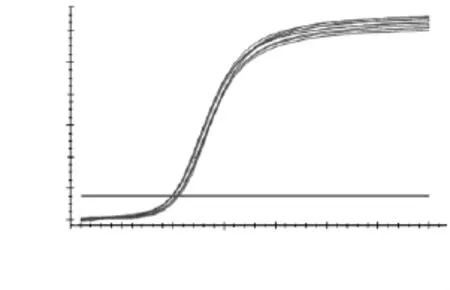
图12 18S rRNA扩增曲线Fig.12 Quantification curve of 18S rRNA

表2 MyHC和18SrRNA标准曲线Table 2 Standard curve of MyHC and 18S rRNA
经实时定量PCR仪分析得MyHCⅡx、Ⅱa、Ⅱb、Ⅰ和18S rRNA的扩增效率(E)、相关性系数(R2)及标准曲线(y)。由表2可知MyHCⅡx、Ⅱa、Ⅱb、Ⅰ和18S rRNA各基因的相关系数分别为0.995、0.997、0.998、0.994和0.993均大于0.99,故相关性好;扩增效率分别为106.9%,96.8%,96.5%,93.0%和108.2%,均位于90%~110%之间,说明扩增效率好,可用于后续实验。
3 结论与讨论
结果显示,MyHC基因家族及管家基因18S rRNA经相对荧光定量实验得到的溶解曲线均在80~90℃范围内出峰,平行样的溶解温度相同,峰值单一,没有杂峰,重复性好,说明没有引物二聚体和非特异性扩增产物;扩增曲线成典型“S”型,平台期平行性好,无扫尾现象,平行样的ct值差异小于0.5,重复性非常好;标准曲线相关性系数全部大于0.99,扩增效率介于90%~110%之间,表明扩增产物特异性非常好,荧光曲线能够准确反映目的产物的扩增[5]。由上述可知,标准曲线中相关系数接近1,扩增效率为90%~110%,实验符合通过2-△△Ct方法分析相对基因表达差异[6-7]的条件。故此相对实时荧光定量方法可用于巴美肉羊MyHC基因mRNA表达量的测定,从而为进一步实验提供依据。
能够影响肉品质的基因有很多,例如MRFs家族又称生肌调节因子基因家族,此家族基因能够作用于整个肌肉生成的过程[8];MSTN又称肌肉生成抑制素,是近年来发现的能够影响产肉率,改善肉质性状的基因[9];CAST(calpastatin)基因又称钙蛋白酶抑制蛋白,是与嫩度密切相关的基因[10],诸如此类的基因还有很多。MyHC基因家族(myosin heacy chain)又称肌球蛋白重链基因家族,MyHC基因家族在哺乳动物中有8种亚型,均由独立的基因编码。Weydert等(1983)研究说明,小型啮齿动物的MyHC只有四种亚型分别为MyHCⅠ、Ⅱa、Ⅱx/d和Ⅱb型[11],在人、猪[12]和牛中也有相同结论。MyHC家族的Ⅰ、Ⅱa、Ⅱx和Ⅱb型基因分别对应Ⅰ(慢速氧化型)、Ⅱa(快速氧化型)、Ⅱx(中间型)和Ⅱb(快速酵解型)四种肌纤维类型[3]。大量研究表明,MyHCⅠ的mRNA表达量越高,即Ⅰ型肌纤维含量高的肉质优良,鲜嫩多汁,口味极佳[5,13];相反,IIb型纤维似乎与较差肉质有关[14-15],IIb型肌纤维的增加甚至可能导致PSE肉的产生[16]。由上述可知此家族基因与肌纤维有着极其密切的关系,而肌纤维的类型又是影响肉品质的重要因素之一,也就是说MyHC基因可以通过控制肌纤维的类型来影响肉质的优劣,故MyHC家族的Ⅰ、Ⅱa、Ⅱx和Ⅱb型基因的mRNA表达能准确、客观地评价肉品质量。
[1]赵琣,李金泉,张文广,等.影响山羊肉质差异候选基因的研究进展[J].安徽农业科学,2013,41(16):7180-7181.
[2]郏建梅.巴美肉羊在河套地区肉羊产业中的支撑作用[J].中国草食动物,2010(1):130-132.
[3]刘志军,董佩佩,贾俊静,等.肌球蛋白重链MyHC基因与肉品质的关系[J].兽药与饲料添加剂,2009,14(6):28-31.
[4]Hemmings K M,Parr T,Daniel Z,etal.Examination ofmyosin heavy chain isoform expression in ovine skeletal muscles[J]. Journal of Animal Science,2009,87(12):3915-3922.
[5]呼红梅,王继英,朱荣生,等.莱芜猪和杜洛克猪肌肉肌球蛋白重链组成对肉质性状的影响[J].中国科学:C辑,2008,38(1):60-65.
[6]Livak K J,Schmittgen TD.Analysisof relative gene expression data using real-time quantitative PCR and the 2-ΔΔCTmethod[J].Methods,2001,25(4):402-408.
[7]Larionov A,Krause A,Miller W.A standard curve based method for relative real time PCR data processing[J].BMC Bioinformatics,2005,6(1):62.
[8]杨明娟,陈宏.牛MRFs基因家族研究进展[J].中国牛业科学,2010,36(6):51-55.
[9]江昱.MSTN基因的研究进展及其应用[J].四川理工学院学报:自然科学版,2010,23(4):449-452.
[10]左北瑶,钱宏光.CAST基因研究进展[J].中国草食动物,2012,31(6):64-68.
[11]Weydert A,Daubas P,Caravatti M,et al.Sequential accumulation ofmRNAs encoding differentmyosin heavy chain isoforms during skeletal muscle development in vivo detected with a recombinant plasmid identified as coding for an adult fast myosin heavy chain from mouse skeletal muscle[J].Journal of Biological Chemistry,1983,258(22):13867-13874.
[12]Hu H M,Wang JY,Zhu R S,et al.Effect ofmyosin heavy chain composition ofmuscles on meat quality in Laiwu pigs and Duroc[J].Science in China Series C:Life Sciences,2008,51(2):127-132.
[13]史新娥.FoxO1调控猪骨骼肌纤维类型分化的作用及分子机理[D].杨凌:西北农林科技大学,2011.
[14]Gentry JG,McGlone J J,Blanton JR,et al.Impact of spontaneous exercise on performance,meat quality,and muscle fiber characteristics ofgrowing/finishing pigs[J].Journalof Animal Science,2002,80(11):2833-2839.
[15]Ryu Y C,Kim B C.The relationship between muscle fiber characteristics,postmortem metabolic rate,and meat quality of pig longissimus dorsi muscle[J].Meat Science,2005,71(2):351-357.
[16]李媛.C2C12细胞中FHL3对不同肌纤维类型MyHC基因表达的影响[D].武汉:华中农业大学,2011.
Optim ization of the detection of the fluorescentquantitative PCRmethod of the meat quality gene MyHC in BaMeisheep
ZHANG Jing,GUO Yue-ying,REN Ting,CHENG Hai-xing,WANG Le,JIN Ye*
(Collage of Food Science and Engineering Inner Mongolia Agricultural University,Hohhot 010018,China)
The op tim izing reac tion condition ofMyHCwas found by real-time PCR,and 18S rRNAwas housekeep ing gene.The result showed that these p rimers could be used in the searching MyHC gene in BaMei sheep. Besides,when the PCR annealing temperature was 57℃,the peak of PCR melting curve was sing le,the cyc le threshold was at the same leveland the efficiency of PCR was high.So thismethod could be used in searching mRNA exp ression of the meatquality gene MyHC in BaMeisheep.
MyHC;18S rRNA;real-time PCR
TS251.1
A
1002-0306(2015)06-0053-05
10.13386/j.issn1002-0306.2015.06.002
2014-06-16
张静(1988-),女,在读硕士研究生,研究方向:畜产品加工。
靳烨(1964-),男,博士,教授,研究方向:畜产品安全生产。
国家自然基金项目(31160330);国家自然基金项目(31360393)。

