细胞外组蛋白在酸吸入性急性肺损伤发病中的作用研究
张雁林 毛丽君 李树强 陈明 郭利霞 赵赞梅 关里 温韬 赵金垣
DOI:10.3760/cma.j.issn.1671-0282.2015.03.004
基金项目:国家自然科学基金(30571551,81241060)
作者单位:100191 北京,北京大学第三医院职业医学研究中心(张雁林、毛丽君、李树强、陈明、郭利霞、赵赞梅、关里、赵金垣);首都医科大学附属北京佑安医院北京市肝病研究所(温韬)
通信作者:赵金垣,Email:zhaojinyuan@sina.com
【摘要】目的 研究细胞外组蛋白是否是盐酸吸入性急性肺损伤(ALI)发病过程中的重要炎症介质,是否可作为干预的靶标。 方法 选取生理盐水和4个浓度的盐酸(0.01、0.1、0.3和0.5 mol/L)来研究小鼠吸入盐酸与血浆组蛋白水平的相关性;选取吸入盐酸后共6个时间点(1、3、6、12、24和72 h)观察组蛋白的变化规律;采用抗组蛋白中和抗体研究特异拮抗组蛋白对小鼠病死率、血气分析、肺水肿、肺组织MPO活力、肺病理的影响。结果 小鼠吸入盐酸后血浆中组蛋白水平明显升高,而且吸入盐酸浓度与血浆中组蛋白H4水平具有明显的正相关性(r=0.874 6, P=0.031 7) 。抗组蛋白H4中和抗体可减少病死率(P=0.034 5),血气分析结果有所改善,肺水肿、肺组织髓过氧化物酶(MPO)活力、肺组织病理均有改变。结论 细胞外组蛋白是一种新的内源性炎性介质,在介导酸吸入性ALI中起重要作用;它既可作为反映损伤严重程度的指标,还可作为干预治疗的靶标。
【关键词】细胞外组蛋白;急性肺损伤;酸吸入;炎症;中和抗体
Study in the role of extracellular histones in the pathogenesis of acute lung injury caused by acid aspiration
Zhang Yanlin, Mao Lijun, Li Shuqiang, Chen Ming, Guo Lixia, Zhao Zanmei, Guan Li, Wen Tao, Zhao Jinyuan.
Research Center of Occupational Medicine, Third Hospital of Peking University, Beijing 100191, China
Corresponding author:Zhao Jinyuan,Email:zhaojinyuan@sina.com
【Abstract】Objective To investigate the effects of extracellular histones as a major mediator and the target for intervention in the pathogenesis of ALI in the wake of acid aspiration. Methods The correlation of circulating histones and aspiratory acid was determined with normal saline and 4 different concentrations of acid (0.01 mol/L,0.1 mol/L,0.3 mol/L and 0.5 mol/L). The dynamic change of circulating histones was observed at 6 intervals of 1,3,6,12,24 and 72 h after injury. The protection of anti-histone-4 antibody was assessed by survival rates, blood gas, lung edema, MPO activity and lung pathological change.Results After acid aspiration, extracellular histone H4 increased significantly. The circulating histone levels were closely correlative with the concentrations of aspiratory acid(r=0.874 6, P=0.031 7). The anti-histone-4 antibody could decrease mortality (P=0.034 5) and improve blood gas, lung edema, MPO activity and lung pathological change. Conclusions The results showed that extracellular histones were not only the key mediators in the pathogenesis of ALI but also the target for intervention.
【Key words】Extracellular histones;Acute lung injury;Acid aspiration;Inflammation;Neutralizing antibody
急性肺损伤(acute lung injury,ALI)/ 急性呼吸窘迫综合征(acute respiratory distress syndrome,ARDS) 是以肺毛细血管内皮细胞通透性增加所致的非心源性渗透性肺水肿和顽固性低氧血症为特点的临床综合征[1-2]。ARDS属于ALI的终末階段, 是重症监护病房的主要致死原因,多数文献报道其病死率高达40 %左右。ALI的主要病因包括感染、酸吸入以及严重创伤[3-4]。职业性化学性毒物吸入同样是ALI的重要病因,如氯气、氨气、火灾中的烟雾等[5]。
目前对于ALI/ARDS的预防和治疗,还没有特效的手段,主要治疗策略集中在机械通气上。居高不下的病死率提示目前对ARDS的发病机制仍不十分清楚,以致治疗针对性不强[6-7]。因此深入研究ALI/ARDS的发病机制尤其是核心启动环节是重中之重。
研究发现,细胞凋亡或坏死时染色质发生降解,释放核小体入外周血,核小体再分解为组蛋白和DNA,少量组蛋白可迅速被单核巨噬细胞清除。但在严重损伤情况下,死亡细胞释放大量组蛋白,超过了机体的清除能力,过剩的细胞外组蛋白便会作为内源性损伤相关分子(damage-associated molecular pattern, DAMP)启动炎症反应导致进一步的损伤[8-10]。Xu等[11]研究表明,在小鼠感染模型中,组蛋白是导致细胞损伤和器官功能障碍的主要介质,而且直接给小鼠注射组蛋白即可致死;而给予抗组蛋白特異抗体则有明显的保护作用,其中起关键作用的是组蛋白H4。Abrams等[12]研究证实在创伤患者血浆中的组蛋白浓度与创伤损伤程度有明显的正相关性,组蛋白可引起远隔部位器官的损伤,以肺损伤最常见。以上研究显示细胞外组蛋白是重要的炎症介质,在ALI等炎症性疾病的发生、发展中具有关键作用[13]。
本课题以盐酸吸入引起的ALI小鼠模型为实验对象,研究组蛋白在ALI发病过程中的变化规律以及与肺损伤程度的相关性,并且采用特异性抗组蛋白抗体进行干预,以探讨组蛋白是否是酸吸入性ALI的重要炎症介质。
1 材料与方法
1.1 实验动物和试剂
本研究中所有的动物实验均得到北京大学医学部动物管理和应用委员会的许可。健康6~8周龄的成年雄性C57BL/6小鼠 (体质量18~20 g) 购自北京大学医学部实验动物中心, 在实验前饲养3 d使动物适应环境,给予小鼠饲料并自由饮水。分析纯盐酸购自北京化工厂。羊抗小鼠组蛋白H4多克隆抗体购自美国Santa Cruz公司;组蛋白H4检测试剂盒(ELISA法)购自武汉浩轩凯文生物技术公司;蛋白定量试剂盒(Bicinchoninic Acid,BCA法)购自美国Sigma公司;髓过氧化物酶 (myeloperoxidase, MPO) 检测试剂盒购自南京建成生物公司;特异性抗组蛋白H4中和抗体(anti-H4)由北京佑安医院温韬博士惠赠,非特异性的IgG抗体用作对照。
1.2 模型制备和动物分组
实验前小鼠禁食12 h但不禁水,用戊巴比妥钠(50 mg/kg)腹腔注射麻醉,将小鼠保持在60°的头高位,用9号注射针在环状软骨部位穿刺气管缓慢注射盐酸 (2 mL/kg 体质量),时间不少于30 s以防窒息;对照组仅注射等量生理盐水[14]。根据预实验结果,选取生理盐水、0.01、0.1、0.3和0.5 mol/L盐酸5个浓度水平检测酸吸入性ALI血浆中的组蛋白浓度;选取注射后1、3、6、12、24和72 h共6个时间点观察血浆中的组蛋白质量浓度变化。每组动物6只,在设定的时间点取标本检测。
1.3 血浆中组蛋白含量测定
ELISA方法:在设定的时间点,用枸橼酸钠抗凝的注射器穿刺小鼠腹主动脉取血,经低速离心后分离血浆,采用ELISA试剂盒检测血浆中组蛋白H4的浓度。Western blot方法:用蛋白检测试剂盒(BCA法)测定血浆中蛋白含量,等量的血浆蛋白(100 μg)与载样缓冲液混合后,加入12% (w/v) SDS-聚丙烯酰胺凝胶后电泳,用吸光度法测定蛋白条带的相对亮度。
1.4 血气分析
插入肝素化的腹主动脉导管取小鼠颈动脉血0.3 mL,在37 ℃条件下用Ciba Corning-170型血气分析仪进行检测。
1.5 肺组织MPO活性检测
实验程序结束后,迅速取下小鼠的左下肺叶,加入生理盐水进行匀浆并离心,取上清液。加入MPO检测试剂,用1601型紫外-可见分光光度计(Shimadzu, Japan) 在460 nm波长进行检测。
1.6 肺湿质量/干质量的比值的检测
实验程序结束后,迅速取下小鼠的右上肺叶,用生理盐水冲洗除去黏有的血污,再用组织试纸吸去附着的生理盐水,称湿质量。然后把标本放在60 ℃的恒温干燥箱中72 h,称干质量。肺湿质量/干质量的比值作为肺水肿程度的指标。
1.7 肺组织病理学检测
取自小鼠右下肺叶的组织浸泡在10%甲醛溶液中24 h,用石蜡包埋,切成4 μm的切片,经HE染色。根据下列情况对显微镜下的损伤评分[15]:出血、间质水肿、坏死、中性粒细胞浸润和肺膨胀不全。肺损伤的严重程度依据以下标准判断:基本无损伤,0分;损伤区域小于25%,1分;损伤区域小于50%,2分;损伤区域小于75%,3分;弥漫性损伤,4分。每张病理切片随机选取3个显微视野。
1.8 统计学方法
计量资料用均数±标准差(x±s)表示。总体的组间差异用方差分析计算,与同一组比较采用Dunnet-t检验,组内两组间的比较用Student-Newman-Keuls计算。动物生存分析用log-rank检验,相关分析用Pearson检验(GraphPad Software, V5)。以P<0.05 为差异具有统计学意义。
2 结果
2.1 一般情况
在剂量-反应实验中,笔者发现盐酸吸入浓度可直接影响小鼠肺损伤程度:0.01 mol/L浓度组损伤轻微,小鼠均存活;0.1 mol/L浓度组出现明显的呼吸困难如呼吸急促、皮肤发绀,有2只小鼠于24 h死亡;0.3 mol/L浓度组损伤严重,5只小鼠于24 h内死亡;0.5 mol/L浓度组损伤最重,全部6只小鼠均于24 h内死亡。
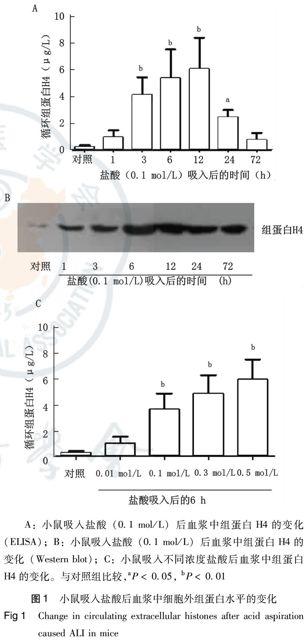
2.2 小鼠酸吸入后血浆中的细胞外组蛋白变化
如图1A所示,小鼠吸入盐酸后1 h,血浆中组蛋白H4浓度开始增加,在3~6 h明显升高,在约12 h达到峰值,以后逐渐下降,72 h仍高于正常范围。与对照组相比,小鼠吸入盐酸3、6、12 h后,血浆中组蛋白H4浓度升高差异有统计学意义(P<0.01);吸入盐酸24 h后,仍差异有统计学意义(P<0.05);而吸入盐酸1 h和72 h后,血浆中组蛋白H4浓度虽升高但差异无统计学意义。小鼠血浆中组蛋白的变化除用ELISA方法检测外,Western blot同样证实血浆中组蛋白的上述变化规律(图1B)。而且小鼠吸入盐酸的浓度越高,血中组蛋白H4的浓度越高,二者具有明显的正相关性(图1C)。在0.01 mol/L至0.5 mol/L浓度范围内,血浆中组蛋白水平与吸入盐酸浓度的相关系数r为0.874 6, 具有统计学意义(P=0.031 7) 。
2.3 抗组蛋白H4抗体对致死浓度盐酸吸入病死率的影响
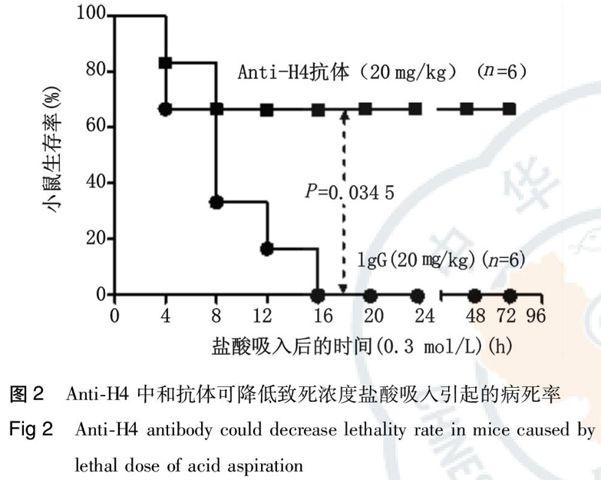
小鼠吸入致死浓度盐酸(0.3 mol/L, 2 mL/kg)后出现明显的呼吸窘迫症状,未经干预的小鼠在24 h内全部死亡。而在酸吸入损伤前,经尾静脉注射给予anti-H4中和抗体预处理可降低病死率,小剂量(2.5~5 mg/kg)中和抗体保护作用不明显(结果未显示),大剂量中和抗体(10~20 mg/kg)可明显降低病死率(与对照抗体组相比,P=0.034 5)。但是无中和作用的对照抗体IgG在小剂量和大剂量时均无保护作用(图2)。以上结果提示anti-H4中和抗体可通过拮抗炎症介质组蛋白来减轻损伤程度,从而减少致死浓度盐酸吸入引起的病死率。
2.4 Anti-H4中和抗体对酸吸入性ALI血气的影响
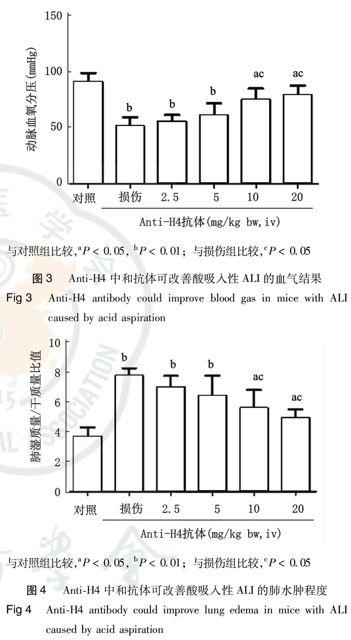
小鼠吸入致伤浓度盐酸(0.1 mol/L, 2 mL/kg)后(常压下FiO2为21%),动脉血氧分压(PaO2)明显下降[38~61 mmHg,(52.6±8.7)mmHg],达到ALI(PaO2/FiO2<300 mmHg)乃至ARDS(PaO2/FiO2<200 mmHg)標准(1 mmHg=0.133 kPa)。而给予anti-H4中和抗体预处理,可改善PaO2,小剂量(2.5~5 mg/kg)效果较弱,大剂量(10~20 mg/kg)效果较明显(P<0.05);但是无中和作用的对照抗体IgG在小剂量和大剂量时均无保护作用(图3)。小鼠吸入盐酸后,动脉血二氧化碳分压(PaCO2)升高不明显,与小鼠呼吸频率增快、加速CO2排出有关;动脉血pH值降低至(7.23±0.11),与缺氧导致的代谢性酸中毒有关(具体数值未列出)。
2.5 Anti-H4中和抗体对酸吸入性ALI肺水肿的作用
小鼠吸入致伤浓度盐酸(0.1 mol/L, 2 mL/kg)后,肺水肿明显,表现为肺湿质量/干质量比值显著增加。给予anti-H4中和抗体预处理,可改善肺水肿程度,小剂量(2.5~5 mg/kg)效果不明显,大剂量(10~20 mg/kg)效果明显(P<0.05);但是无中和作用的对照抗体IgG无保护作用(图4)。
2.6 Anti-H4中和抗体对ALI肺组织中性粒细胞MPO活性的影响
小鼠吸入致伤浓度盐酸(0.1 mol/L, 2 mL/kg)后,激活了机体炎症反应,表现为中性粒细胞MPO活性显著增加。而给予Anti-H4中和抗体预处理,可减轻炎症反应,小剂量(2.5 mg/kg)效果较差,5~10 mg/kg剂量已有较强的抗炎效果 (P<0.05),而大剂量(20 mg/kg)效果明显(P<0.01);无中和作用的对照抗体IgG无保护作用(图5)。
2.7 Anti-H4中和抗体对酸吸入肺组织病理改变的影响
盐酸吸入(0.1 mol/L, 2 mL/kg)后1 h,肺组织病理切片可见肺内炎症细胞浸润, 肺泡间隔增宽, 点状出血,肺泡上皮细胞和血管内皮细胞肿胀;在12~24 h最为严重,可见大量炎症细胞浸润,小片状或灶状出血,肺水肿明显,肺泡内大量纤维蛋白渗出。给予anti-H4中和抗体预处理,可改善病理表现,小剂量效果较弱,大剂量(10~20 mg/kg)效果较明显;对照抗体IgG无保护作用(图6)。
3 讨论
化学毒物吸入是ALI的主要病因之一,可通过直接和间接效应导致肺和全身脏器损伤。毒物吸入气道造成的肺损伤可分为两个时相,第一时相是毒物直接对肺泡上皮毛细血管膜的损伤,即时发生,损伤范围有限;第二时相则是由第一时相损伤引起的广泛且持续的炎性损伤,其核心即失控的炎症反应,涉及全身器官,而且存在正反馈加剧恶化,能产生多器官系统功能障碍乃至死亡等严重后果[16]。在第二时相损伤过程中,内源性炎症介质无疑是损伤发生的关键,细胞外组蛋白即是其中重要的一员。
组蛋白是真核生物染色质的基本结构蛋白,在进化中高度保守。组蛋白主要包括5种类型: H1、H2A、H2B、H3 和H4,后4种组蛋白组成八聚体结构,和外周环绕的双螺旋DNA 片段结合成组蛋白-DNA 复合物,即核小体(nucleosome) 。
本文以盐酸吸入引起的ALI模型为实验对象,研究组蛋白在ALI发病过程中的变化规律以及与肺损伤程度的相关性,并且采用特异性抗组蛋白抗体进行干预。研究结果显示小鼠吸入盐酸后1 h,血浆中组蛋白H4浓度明显增加,在约12 h达到峰值,以后逐渐下降,72 h仍高于正常范围。而且小鼠吸入盐酸的浓度越高,血中组蛋白H4的浓度越高,二者具有明显的正相关性。Anti-H4中和抗体可减少致死浓度盐酸吸入的病死率,同时对血气分析、肺水肿、炎症细胞MPO活力、肺组织病理有明显改善作用。小剂量(2.5~5 mg/kg)时中和抗体保护作用较弱,大剂量(10~20 mg/kg)效果较明显。但是无中和作用的对照抗体IgG在小剂量和大剂量时均无保护作用。以上结果提示anti-H4中和抗体可通过拮抗组蛋白这种炎症介质来抑制失控的炎症反应,从而减轻组织、器官损伤程度,最终降低盐酸吸入引起的病死率。
细胞外组蛋白在损伤中明显升高,与致伤因素和损伤程度有良好的相关性;而且针对细胞外组蛋白给予干预,可减轻炎症损伤。可见,细胞外组蛋白是一种重要的内源性炎症致伤介质,在启动和加重炎症性损伤反应中起重要作用。细胞外组蛋白不仅可作为反映疾病严重程度的标志物,还可作为抗体或药物的分子标靶用于临床干预治疗,为ALI/ARDS的防治提供了新的手段。
参考文献
[1]Ware LB, Matthay MA. The acute respiratory distress syndrome [J]. New Engl J Med, 2000,342(18):1334-1349.
[2] 刘松桥, 邱海波. 急性呼吸窘迫综合征诊治进展[J]. 中华急诊医学杂志, 2014,23(3): 248-251.
[3] Ranieri VM, Rubenfeld GD, Thompson BT, et al. Acute respiratory distress syndrome: the Berlin Definition[J]. JAMA, 2012,307(23):2526-2533.
[4] Knight PR, Rutter T, Tait AR, et al. Pathogenesis of gastric particulate lung injury: a comparison and interaction with acidic pneumonitis [J]. Anesth Analg, 1993, 77(4): 754-760.
[5] 杜燮伟, 张敏, 王焕强, 等. 1989至2003年全国刺激性气体重大急性职业中毒的特征[J]. 中华劳动卫生职业病杂志, 2006,24 (12):716-719.
[6] Matthay MA, Zemans RL. The acute respiratory distress syndrome: pathogenesis and treatment [J]. Annu Rev Pathol, 2011,6(1):147-163.
[7] Matthay MA, Zimmerman GA. Acute lung injury and the acute respiratory distress syndrome: Four decades of inquiry into pathogenesis and rational management [J]. Am J Respir Cell Mol Biol, 2005,33(4):319-327.
[8] Zeerleder S, Zwart B, Wuillemin WA, et al. Elevated nucleosome levels in systemic inflammation and sepsis [J]. Crit Care Med, 2003, 31(7):1947-1951.
[9]Chaput C, Zychlinsky A. Sepsis: the dark side of histones [J]. Nat Med, 2009, 15(11): 1245-1246.
[10]温韬, 勾春燕, 卢静, 等. 细胞外组蛋白在急性肝衰竭小鼠中的变化及意义[J]. 中华急诊医学杂志, 2013, 22(2):148-152.
[11] Xu J, Zhang X, Pelayo R, et al. Extracellular histones are major mediators of death in sepsis [J]. Nat Med, 2009,15(11):1318-1321.
[12] Abrams ST, Zhang N, Manson J, et al. Circulating histones are mediators of traumaassociated lung injury [J]. Am J Respir Crit Care Med, 2013,187(2):160-169.
[13] Zhang H, Villar J, Slutsky AS. Circulating histones: a novel target in acute respiratory distress syndrome? [J].Am J Respir Crit Care Med, 2013,187(2):118-120.
[14] Matute-Bello G, Frevert CW, Martin TR. Animal models of acute lung injury [J]. Am J Physiol Lung Cell Mol Physiol, 2008,295(3):L379-L399.
[15]Su X, Bai C, Hong Q, et al. Effect of continuous hemofiltration on hemodynamics, lung inflammation and pulmonary edema in a canine model of acute lung injury [J]. Intensive Care Med, 2003, 29(11):2034-2042.
[16] Wakabayashi G, Ueda M, Aikawa N, et al. Release of ANP and its physiological role in pulmonary injury due to HCl [J]. Am J Physiol, 1990,258(3 Pt2):690-696.
(收稿日期:2014-09-30)
(本文編辑:郑辛甜)
P247-252

