射波刀治疗原发性肝癌的临床研究
彭 巍 冯国生 梁 平 陆合明 卢幻真
(广西壮族自治区人民医院临床肿瘤中心,广西 南宁 530021)
射波刀治疗原发性肝癌的临床研究
彭 巍 冯国生 梁 平 陆合明 卢幻真
(广西壮族自治区人民医院临床肿瘤中心,广西 南宁 530021)
目的 通过观察射波刀(Cyber Knife)治疗原发性肝癌的临床疗效及不良反应,探讨射波刀在原发性肝癌治疗上的临床应用价值。方法 回顾性分析2008年1月至2011年8月收治的78例未经手术、肝移植等治疗的原发性肝癌患者,其中单纯射波刀治疗38例,射波刀联合灌注栓塞化疗(transcatheter arterial chemoembolization,TACE)40例。观察患者治疗后不良反应、疾病控制率(disease control rate,DCR)、无疾病进展时间(progression free survival,PFS)、患者1年和2年的总生存率(Overall survival,OS)。结果 接受射波刀治疗的肝癌患者均显示出较好耐受性,不良反应率低,多数为1~2级不良反应。78例患者经治疗后3例CR,18例PR,47例SD,10例PD,DCR为87.2%,中位PFS 11个月。患者1年和2年OS分别是78.2%和66.9%。在亚组分析中,射波刀联合TACE治疗患者中2例CR,10例PR,24例SD,4例PD,DCR为90.0%,中位PFS 15个月,1年和2年OS分别是82.1%和76.2%。单纯射波刀治疗患者中1例CR,8例PR,23例SD,6例PD,疾病控制率DCR为84.2%,中位PFS 7个月,1年和2年OS分别是73.3%和53.3%。两组患者的DCR、中位PFS、1年及2年OS差异无统计学意义(P值分别为0.670、0.105、0.241和0.164)。结论 单纯射波刀及射波刀联合TACE治疗原发性肝癌均取得较好的治疗效果,不良反应小,提示射波刀在肝癌治疗上有重要作用。
射波刀;立体定向放疗;TACE;肝癌
原发性肝癌(primary hepatic carcinoma,PHC)是进展快速、对多种治疗耐受的癌症种类之一[1]。其病死率在我国已上升为癌症病死率的第二位[2]。原发性肝癌确诊时多为晚期,失去手术机会,手术切除率不足30%[3],非手术治疗方式如肝动脉灌注栓塞化疗、射频消融、经皮无水酒精注射、局部放疗等均被广泛于运用于肝癌患者的治疗[4]。肝动脉栓塞化疗是不能手术的中晚期肝癌首选治疗方法。但是由于肝癌血供的特殊性,栓塞后门脉供血及侧支循环形成,单纯TACE术难以使肿瘤完全坏死,难以提高远期生存率。近十余年来,随着计算机技术及影像学的发展,尤其是三维适形放疗及射波刀在临床上的应用,精确放疗在肝癌的综合治疗中起到了一定的作用[5-7]。放疗联合TACE治疗原发性肝癌的临床研究取得了一定疗效[8-10]。本研究将进一步探讨射波刀治疗原发性肝癌的临床疗效、安全性、不良反应。现将2008年1月至2011年8月收治的78例经射波刀或射波刀联合TACE治疗的原发性肝癌患者,报道如下。
1 资料与方法
1.1 研究对象:收集2008年1月至2011年8月在广西中医药大学附属瑞康医院收治的78例原发性肝癌患者,所有病例均满足以下条件:①体力状态ECOG评分≤2分。②经病理学诊断或临床诊断证实为原发性肝癌。③因各种原因不能手术切除及肝移植或不愿行手术切除的肝癌患者。④根据Child-Pugh分级标准分为A级或B级。⑤未经过手术切除、肝移植、无水酒精注射等治疗,仅经过射波刀治疗或TACE联合射波刀治疗的患者。⑥无肝外转移的患者。⑦无弥漫性肝癌、肝癌伴大量腹腔积液及晚期恶液质患者。
在78例原发性肝癌患者中,男73例,女5例,年龄33~74岁,中位年龄53岁,肿瘤最大径2.0~18.0cm,合并门脉癌栓16例。行TACE次数1~5次,射波刀治疗次数1~2次。78例患者中经单纯射波刀治疗38例,射波刀联合TACE治疗40例。
1.2 研究方法
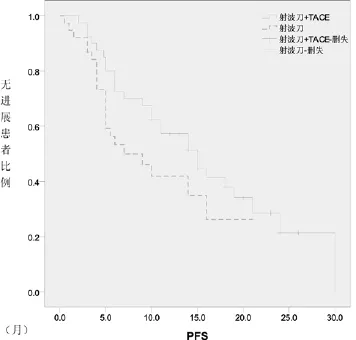
图1 两亚组患者PFS的比较
1.2.1 射波刀治疗:使用G3型射波刀,TPS 2.0.5版本设计治疗计划,射波刀治疗总放疗剂量(42.2±7.27)Gy,(4.1±1.91)分割,单次放疗剂量为(12.3±5.0)Gy,按照L-Q模式中生物效应剂量(biologically effective dose,BED)计算公式,肿瘤组织(早反应组织)取α/β值为10,总放疗剂量相当于常规放疗剂量(77.0±16.03)Gy。
1.2.2 肝动脉插管栓塞化疗:采用Seldinger技术经皮穿刺股动脉插管至肝动脉,造影确定肿瘤供血动脉,导管超选择至肝固有动脉、肝右动脉或肝左动脉后行灌注化疗和栓塞术。化疗药物:8~9 mg平阳霉素(pingyangmycin,PYM)。栓塞剂为40% 10~30 mL碘化油和明胶海绵颗粒。间隔约1个月行第2次TACE术,多数患者栓塞1~2次。
1.3 观察指标:治疗近远期疗效、治疗相关不良反应及其严重程度。进行生存率随访(6、12、18、24个月)。
1.4 统计学方法:运用SPSS17.0软件包,1、2年生存率及生存时间计算采用Kaplan-Meier法。P<0.05为差异有统计学意义。
2 结 果
2.1 近期疗效:治疗后复查CT,78例患者经治疗后3例CR,18例PR,47例SD,10例PD,DCR为87.2%。在亚组分析中,射波刀联合TACE治疗患者中2例CR,10例PR,24例SD,4例PD,疾病控制率DCR为90.0%。单纯射波刀治疗患者中1例CR,8例PR,23例SD,6例PD,DCR为84.2%。两组患者的DCR差异无统计学意义(P值为0.670)。
2.2 远期疗效:全部患者自治疗开始后即开始随访,随访至2013年2月,随访时间最短22个月,最长62个月,中位随访期35个月。全体患者中位PFS 11个月,1年和2年OS分别是78.2%和66.9%。亚组分析中,射波刀联合TACE治疗的患者中位PFS 15个月,1年和2年OS分别是82.1%和76.2%。单纯射波刀治疗的患者中位PFS 7个月,1年和2年OS分别是73.3%和53.3%,联合治疗较单纯射波刀治疗似乎有更好的生存获益,但两组患者PFS、1年和2年总生存率比较P值分别为0.105、0.241和0.164,差异无统计学意义。两组的PFS及生存曲线见图1、2。
2.3 不良反应
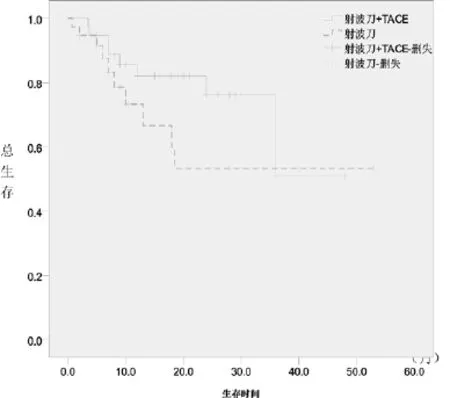
图2 两亚组患者生存曲线的比较
2.3.1 急性不良反应(治疗后1个月内发生):不良反应均为1~2级,出现肝功能损害加重10例(12.8%),腹泻腹胀10例(12.8%),腹痛10例(12.8%),纳差8例(10.2%),乏力6例(7.8%),胃部不适4例(5.1%),低热4例(5.1%),骨髓抑制2例(2.6%)。对症治疗后好转,均未影响后续治疗。
2.3.2 亚急性不良反应(治疗后1个月至3个月发生):放射性胃炎及放射性肠炎多在射波刀治疗完成后约1个月后出现。出现放射性胃炎6例(7.8%),出现放射性肠炎2例(2.6%)。亚急性不良反应发生率较低,且大部分患者对治疗的不良反应均耐受均良好。
3 讨 论
肝癌的放疗经历了局部放疗、全肝放疗和全肝移动照射等阶段,由于正常肝组织放疗耐受性差,易导致放射性肝损害,肝脏的全肝放射耐受量仅为25~40 Gy,而肝癌常规放疗根治剂量需要60 Gy,全肝放疗很难给予肝癌根治剂量,仅能起到抑制肿瘤作用,因此疗效不明显。但随着影像技术的发展,放疗的精确度不断提升,肝癌靶区剂量得以提高,周边正常肝组织受照剂量锐减,确保了肝癌放疗的治疗效果并且降低了放疗相关不良反应的发生率。放疗在肝癌中的地位有了新的提升[11-12]。
Price[13]进行了单纯立体定向放疗治疗肝癌的临床研究,2005年~2008年入组26例患者,中位放疗总剂量42 Gy,3~5次分割。CR+PR率达73%,1年及2年生存率分别为77%和60%。Andolino[14]为评价立体定向放疗在原发性肝癌治疗中的有效性及安全性,从2005年~2009年入组了60例患者,其中Child-Pugh评级A级36例,中位放疗剂量44Gy,3次分割;评级B级24例,中位放疗剂量40 Gy,5次分割。2年的PFS及OS分别为48%和67%,中位疾病进展时间(Time to disease progression,TTP)47.8个月。未见3级以上非血液学毒性。13%患者大于1级血液学毒性或肝功能损害。23例患者接受了肝移植。研究表明立体定向放疗在原发性肝癌治疗中安全有效,并可作为等待肝移植前的治疗方式之一。Huang[15]2012年报道了射波刀治疗36例不能手术的肝癌患者,中位总剂量37 Gy(25~48 Gy),4~5次分割。2年的生存率达72.6%,与对照组(未接受射波刀治疗)的42.1%相比有统计学意义。射波刀治疗的不良反应轻微,患者多可耐受。
本研究中接受射波刀治疗的患者不良反应发生率较低,未出现放疗后严重急性肝脏反应,患者均耐受良好。可能的原因有以下几点:①射波刀放疗定位精准,减少了对肝脏正常组织的照射。②放疗多为大分割,照射次数少,患者易接受。③治疗过程中两组均运用了祖国医学中药对不良反应进行对症处理,使得大部分不良反应得到减轻[16]。
本研究入组的多为巨块型肝癌患者,诊断时多数已失去手术切除机会。完成射波刀治疗后观察近期疗效,显示了较好的疾病控制率。国内外相关研究中亦看到较高的疾病控制率,如Goyal[6]的研究中单纯射波刀治疗局部控制率为82%。与国内外研究结果对比,本研究疾病控制率略高。本研究中患者1年和2年生存率分别是78.2%和66.9%。在Louis[5]研究中射波刀治疗肝癌1年及2年生存率分别为79%和52%,Dewas[17]研究中射波刀治疗肝脏肿瘤患者1年及2年生存率分别为80.4%和72.5%。本研究疗效结果与国外研究结果相近。本研究对疗效结果进行亚组分析,显示接受单纯射波刀治疗与射波刀联合TACE治疗的患者在近远期疗效上无明显差异,故射波刀联合何种治疗方式能提高疗效有待进一步探讨。
Yoon[18]报道三维适形放疗联合TACE治疗肝癌门静脉侵犯的患者412例,中位生存期10.6个月,1年、2年生存率分别为42.5%和22.8%。10%患者出现3-4度放射性肝损害,3.6%患者出现2-3度放射性胃肠道反应。何汉平[19]进行了三维适形放疗联合TACE治疗对比单纯TACE治疗中晚期肝癌的临床研究,单纯介入组30例,联合治疗组27例。放疗为1次/天,2~2.5 Gy/次,5次/周,放疗总剂量为52~62 Gy。介入组与联合组1,2年生存率分别为53.3%,43.3%及70.7%,55.5%(P=0.023)。三维适形放疗联合TACE治疗肝癌有一定疗效,但与射波刀治疗肝癌研究中报道的生存率相比较低。不良反应发生率及严重程度较射波刀治疗高,可能有以下几个方面原因:①射波刀总治疗时间明显缩短,减少了治疗期间肿瘤细胞再增值对疗效的影响。根据时间-剂量因子学说,即相同的照射剂量,因照射次数和时间不同其疗效也不同。为提高放疗效果,提倡在不引起正常组织急性放疗反应的前提下,尽量缩短治疗总时间。射波刀治疗周期短,一般治疗不超过5次,多能在1周内完成治疗。②增加分次剂量会加重晚反应组织的损伤,以往均将肿瘤组织作为早反应组织看待,由于肿瘤组织的不均质性,肿瘤组织中完全可能存在类似晚反应组织的部分,所以增加分次剂量同样会增加对这部分肿瘤组织的杀伤。③国内外多项研究证实原发性肝癌放射治疗剂量是影响肝癌患者预后的重要因素。肝癌细胞的放疗常规根治剂量需要60Gy/30次,6周左右,按照L-Q模式中生物效应剂量计算公式,取α/β值为10,射波刀治疗总照射剂量一般为38~45 Gy,约相当于常规放疗剂量71~94 Gy,均达到或超过根治剂量。④靶体积的确定:放疗的有效率在一定程度上取决于对肿瘤体积的准确判断,为了准确确定放射靶区,有必要采用多种影像诊断技术,如CT、MRI和PET技术的融合。射波刀采用了CT与MRI影像融合技术确定靶区,可大大提高了靶区定位的正确性。
本研究中死亡病例数未达到一半,目前无法统计出中位生存期,需要继续进行随访观察。单纯射波刀或射波刀联合TACT治疗原发性肝癌能取得较好的治疗效果,不良反应小,提示射波刀在肝癌治疗上有重要作用。
[1] Okuda K.Hepatocellular carcinoma[J].J Hepatol,2000,32(1 Suppl): 225-237.
[2] 王建华.肝癌综合介入治疗的现状[J].中华肝脏病杂志,2005,13(10):721-723.
[3] 常旭,陈积圣,区庄嘉,等.原发性肝癌的治疗[M].郑州:河南医科大学出版社,1999:5-6.
[4] Cheng JW,Lv Y.New progress of non-surgical treatments for hepatocellular carcinoma[J].Med Oncol,2013,30(1):381.
[5] Louis C,Dewas S,Mirabel X,et al.Stereotactic radiotherapy of hepatocellular carcinoma: preliminary results[J].Technol Cancer Res Treat,2010,9(5):479-487.
[6] Goyal K,Einstein D,Yao M,et al.Cyberknife stereotactic body radiation therapy for nonresectable tumors of the liver:preliminary results[J].HPB Surgery,2010.pii: 309780.
[7] Zhao JD,Xu ZY,Zhu J,et a1.Application of active breathing control in 3-dimensional conformal radiation therapy for hepatocelular carcinoma:the feasibility and benefit[J].Radiother Oncol,2008,87(3):439.
[8] Cupino AC,Hair CD,Angle JF,et al.Does external beam radiation therapy improve survival following transarterial chemoembolization for unresectable hepatocellular carcinoma? [J].Gastrointest Cancer Res,2012,5(1):13-17.
[9] Xu LT,Zhou ZH,Lin JH,et al.Clinical study of transarterial chemoembolization combined with 3-dimensional conformal radiotherapy for hepatocellular carcinoma[J].Eur J Surg Oncol,2011,37(3):245-251.
[10] Ren ZG,Zhao JD,Gu K,et al.Three-dimensional conformal radiation therapy and intensity-modulated radiation therapy combined with transcatheter arterial chemoembolization for locally advanced hepatocellular carcinoma: an irradiation dose escalation study[J].Int J Radiat Oncol Biol Phys,2011,79(2):496-502.
[11] 黎功.肝癌放疗研究进展[J].肿瘤学杂志,2010,16(7):516-519.
[12] Ursino S,Greco C,Cartei F,et al.Radiotherapy and hepatocellular carcinoma: update and review of the literature[J].Eur Rev Med Pharmacol Sci,2012,16(11):1599-1604.
[13] Price TR,Perkins SM,Sandrasegaran K,et al.Evaluation of response after stereotactic body radiotherapy for hepatocellular carcinoma[J]. Cancer,2012,118(12):3191-3198.
[14] Andolino DL,Johnson CS,Maluccio M,et al.Stereotactic body radiotherapy for primary hepatocellular carcinoma[J].Int J Radiat Oncol Biol Phys,2011,81(4):e447-453.
[15] Huang WY,Jen YM,Lee MS,et al.Stereotactic body radiation therapy in recurrent hepatocellular carcinoma[J].Int J Radiat Oncol Biol Phys,2012,84(2):355-361.
[16] 白广德,吴洁.中药联合射波刀治疗原发性肝癌25例临床研究[J].江苏中医药,2012,44(5):20-22.
[17] Dewas S,Bibault JE,Mirabel X,et al.Prognostic factors affecting local control of hepatic tumors treated by stereotactic body radiation therapy[J].Radiat Oncol,2012,7(1):1-9.
[18] Yoon SM,Lim YS,Won HJ,et al.Radiotherapy plus transarterial chemoembolization for hepatocellular carcinoma invading the portal vein: long-term patient outcomes[J].Int J Radiat Oncol Biol Phys,2012,82(5):2004-2011.
[19] 何汉平,黄志勇,郭友全,等.介入联合三维适形放疗治疗中晚期肝癌的临床研究[J].现代肿瘤医学,2011,19(4):724-726.
Clinical Study of CyberKnife T reatment for Patients with Primary Hepatic Carcinoma
PENG Wei, FENG Guo-sheng, LIANG Ping, LU He-ming, LU Huan-zhen
(Clinical Cancer Center, the People’s Hospital of Guangxi Zhuang Autonomous Region, Nanning 530021, China)
Objective By observing the clinical efficacy and adverse reactions of CyberKnife treatment for patients with inoperable primary hepatic carcinoma(PHC), this study was to explore the clinical value of CyberKnife for PHC. Methods This retrospective analysis enrolled 78 cases of primary liver cancer patients treated without surgery or liver transplantation from January 2008 to August 2011. 38 patients were treated with CyberKnife, 40 patients were treated with CyberKnife combined with TACE. We observed the toxicity, disease control rate (DCR), progression free survival (PFS), 1 year and 2 years overall survival (OS) after the treatment of CybeKnife. Results After the treatment of CyberKnife, patients showed well tolerability. Adverse reaction rate was low. Most adverse reactions were I-II degree. All patients: 3 CR,18 PR,47 SD,10 PD,DCR 87.2%, median PFS was 11 months, 1 year and 2 years OS were 78.2% and 66.9%. In the subgroup analysis: The combined therapy: 2 cases CR, 10 cases PR, 24 cases SD, 4 cases PD, DCR 90.0%,median PFS was 15 months, 1 year and 2 years OS were 82.1% and 76.2%. The simple CyberKnife therapy: 1 case CR, 8 cases PR, 23 cases SD, 6 cases PD, DCR 84.2%,median PFS was 7 months, 1 year and 2 years OS were 73.3% and 53.3%. Between two subgroups, DCR, PFS, 1-year and 2-year OS were no significant difference (P=0.670,0.105,0.241,0.164). Conclusion CyberKnife treatment for PHC can achieve good therapeutic effect and low toxicity, showed that CyberKnife played an important role in the treatment of PHC.
CyberKnife; Stereotactic radiotherapy; TACE; Liver cancer
R735.7
B
1671-8194(2015)14-0001-03
E-mail:fengguosheng88988@163.com

