一株解淀粉芽孢杆菌的分离鉴定及其抑菌条件研究
张超 王祥红 徐涛 李帅 钱浩 李帅 张增虎
(中国海洋大学海洋生命学院,青岛 266003)
一株解淀粉芽孢杆菌的分离鉴定及其抑菌条件研究
张超 王祥红 徐涛 李帅 钱浩 李帅 张增虎
(中国海洋大学海洋生命学院,青岛266003)
旨在从海洋环境中分离筛选抑制鲈鱼病原鳗弧菌的拮抗菌,进行菌种鉴定,并对其抑菌条件及药物敏感性进行研究。采用十字交叉划线法和平板点种法筛选鲈鱼病原鳗弧菌的拮抗菌,采用形态学、生理生化反应及16S rDNA基因序列的系统发育分析方法对分离拮抗菌进行鉴定,采用单因子变量法对拮抗菌WTD的最佳抑菌条件进行研究,采用平板药敏纸片法对其药物敏感性进行研究。结果显示,从海洋环境样品中分离出126株细菌,筛选出19株拮抗菌。其中菌株WTD的拮抗效果最强,细菌鉴定结果表明,该菌为解淀粉芽孢杆菌(Bacillus amyloliquefaciens)。最佳抑菌条件研究表明,该菌在温度35℃、pH7、盐度为1% NaCl的时候,拮抗效果最好。药敏实验结果表明,该菌对麦迪霉素等29种抗生素敏感,而对多粘菌素具有抗性。拮抗菌解淀粉芽孢杆菌WTD对鲈鱼病原菌鳗弧菌有较强的抑制作用,具有潜在的应用价值。
解淀粉芽孢杆菌;鳗弧菌;抑菌作用;拮抗菌
近年来,我国的水产养殖业得到了迅速发展,养殖规模不断扩大。由于养殖动物的残饵、排泄物和死亡残体等对近岸海水的污染,使养殖水域生态环境遭到破坏,直接危害了养殖对象,是暴发性病害频繁发生的重要原因,给整个水产养殖业造成了巨大的经济损失,制约了水产养殖业的发展[1-5]。目前,为了防止病害发生,人们大量使用抗生素和化学药物,但只能暂时抑制病害的发生,抗生素杀死或抑制了敏感细菌而保留了耐药性的细菌[6,7],破坏和干扰了养殖环境中自然微生物生态系统的平衡及养殖动物的微生态平衡[8,9],反而增加了养殖动物感染病菌的机会。抗生素在养殖动物体内的残留影响了养殖产品的质量,在环境中的残留会造成环境污染并最终对人类造成危害[10]。
通过在养殖水体及饵料中加入有益微生物(Probiotics)来调节和改善养殖海水生态环境及养殖生物微生态环境,提高养殖动物的免疫力,抑制病原微生物来控制和减少养殖动物病害的发生,是解决水产养殖病害问题的根本途径[11]。
本研究从海洋环境中分离细菌,从中筛选出对养殖鱼类病原菌鳗弧菌W-1有抑制作用的拮抗菌,并对抑菌作用较强的菌株WTD的抑菌条件和药物敏感性进行研究,旨在为今后在水产养殖中的应用提供参考。
1 材料与方法
1.1 材料
1.1.1 病原弧菌 鳗弧菌(Vibrio anguillarum)W-1菌株由本实验室分离于患病的日本花鲈(Lateolabrax japonicus)鱼苗。
1.1.2 培养基 2216E海洋培养基:蛋白胨5 g,酵母粉1 g,磷酸铁0.01 g,琼脂粉20 g,陈海水1 000 mL,pH调节至7.6。高铁碳水化合物培养基:每1升培养基中含有酵母膏10 g,蛋白胨5 g,可溶性淀粉20 g,琼脂粉30 g,磷酸铁5 g,pH调节至7.6。
1.2 方法
1.2.1 微生物的分离 用无菌采样瓶采取样水样、泥样和砂样,样品来自青岛沿海海滨及养殖场、厦门和石岛沿海。取水样和泥样用灭菌生理盐水作10倍系列稀释;无菌操作涂布2216E海洋琼脂平板,置28℃温箱培养2-7 d,取平板上的优势菌落进行平板划线纯化,获得的菌种置于-80℃冰箱保藏。
1.2.2 拮抗菌的筛选
1.2.2.1 十字交叉划线法 将海水养殖鱼类病原菌(敏感菌)鲈鱼致病鳗弧菌W-1在28℃培养24 h,在2216E海洋琼脂平板上划直线,划线后马上将待筛实验菌株与敏感菌株垂直相交划线,在28℃培养1-2 d,观察有无抑菌区,有抑菌现象的为拮抗细菌。
1.2.2.2 平板点种法 将海水养殖鱼类病原菌(敏感菌)鲈鱼致病鳗弧菌在28℃培养24 h,用灭菌生理盐水将斜面上的菌液洗下,用血球计数板将菌悬液浓度调至106Cell/mL的数量级,取0.1 mL菌液涂布于2216E海洋琼脂平板上,将待筛菌株在此平板上点种或划线,在28℃培养2-4 d,观察有无抑菌圈,有抑菌圈的为拮抗细菌。
1.2.3 拮抗菌的细菌鉴定 根据《常见细菌系统鉴定手册》中的实验方法,对菌株形态及理化特性进行鉴定[12]。利用分子生物学方法对细菌的16S rDNA进行提取与测序。抽取细菌DNA所用的试剂盒为上海生工生物工程技术服务公司生产的细菌基因组DNA抽提试剂盒(UNIQ-10柱式),具体方法参见说明书。PCR扩增16S rDNA基因采用通用引物,正向引物为:5'-AGAGTTTGATCCTGGCTCAG-3';反向引物为:5'-ACGGCTACCTTGTTACGACT-3'。PCR反应体系为:TaKaRa Taq(5 U/μL)0.25 μL,10×PCR Buffer(Mg2+Free)5 μL,MgCl2(25 mmol/L)3 μL,dNTP Mixture(各2.5 mmol/L)4 μL,模板DNA 1 μL,两种引物各1 μL,双蒸水34.75 μL。PCR反应条件为:96℃ 5 min,94℃ 1 min,56℃ 1 min,72℃1 min,30个循环;72℃ 5 min,-20℃保存。所得到的样品序列送由上海生工生物工程技术服务有限公司进行测序,利用NCBI进行blast分析,同现有细菌序列作比对。所用测序仪器为ABI-PRISM3730,测序试剂为BigDyeterminator v3.1。利用Mega5.2软件绘制系统进化树,确定菌株的系统进化地位。
1.2.4 拮抗菌抑菌条件的研究
1.2.4.1 pH对拮抗菌抑菌作用的影响 制备pH值分别为6、7、8和9的海洋琼脂平板,分别取0.1 mL敏感菌W-1菌液(106Cell/mL)涂布于各种pH的2216E海洋琼脂斜面上,将实验菌株在此平板上点种,在28℃培养2-4 d,观察抑菌圈大小,以抑菌圈直径与菌落直径比作为抑菌能力强弱标准。
1.2.4.2 温度对拮抗菌抑菌作用的影响 取0.1 mL敏感菌W-1菌液(106Cell/mL)涂布于2216E海洋琼脂平板上,将实验菌株在此平板上点种,分别在15℃、20℃、25℃、30℃、35℃和40℃培养2-4 d,观察抑菌圈大小,以抑菌圈直径与菌落直径比作为抑菌能力强弱标准。
1.2.4.3 盐度对拮抗菌抑菌作用的影响 制备盐度分别为0%NaCl、1%NaCl、2%NaCl、3%NaCl、4% NaCl、5%NaCl和6%NaCl的2216E海洋琼脂平板,分别取0.1 mL敏感菌W-1菌液(106Cell/mL)涂布于各种盐度的2216E海洋琼脂平板上,将实验菌株在此平板上点种,在28℃培养2-4 d,观察抑菌圈大小,以抑菌圈直径与菌落直径比作为抑菌能力强弱标准。
1.2.5 拮抗菌的药敏实验 菌株WTD的药敏实验方法参照文献[13]的方法进行。将海水养殖鱼类病原菌(敏感菌)鲈鱼致病鳗弧菌在28℃培养24 h,用灭菌生理盐水将斜面上的菌液洗下,用血球计数板将菌悬液浓度调至106Cell/mL的数量级,取0.1 mL菌液涂布于2216E海洋琼脂平板上,然后将药敏片用镊子轻轻夹住放在平板上,倒置在28℃培养相应的时间,观察抑菌圈大小,并按照说明书确定是否有抑菌效果。
2 结果
2.1 拮抗菌的筛选
以鳗弧菌W-1为敏感菌对分离的菌株进行逐一进行拮抗实验,共筛选到19株拮抗菌,其中菌株1-B2、1-B1、2-A1、5-C1、5-C2和5-C3分离自青岛石老人海水养殖场的海水,菌株SMD、SMB2-2和SN1D分离自石岛海水,菌株XM5-2、XM8-1和XM9-2分离自厦门海水,菌株QX、QE、QF和QQ分离自青岛栈桥海泥,菌株CB分离自青岛近海海水,菌株WTE和WTD分离自青岛第二海水浴场的海水。从细菌采集的地点及分离得到的拮抗菌数目来看,可以得出在海水养殖场中拮抗菌的数目最多,其中菌株5-C3、XM5-2、XM9-2和WTD拮抗能力比较强,而菌株WTD的拮抗抑菌能力最强,作为进一步研究的菌株(表1)。菌株WTD对敏感菌W-1在2216E海洋琼脂培养基平板上的抑菌效果,见图1和图2。
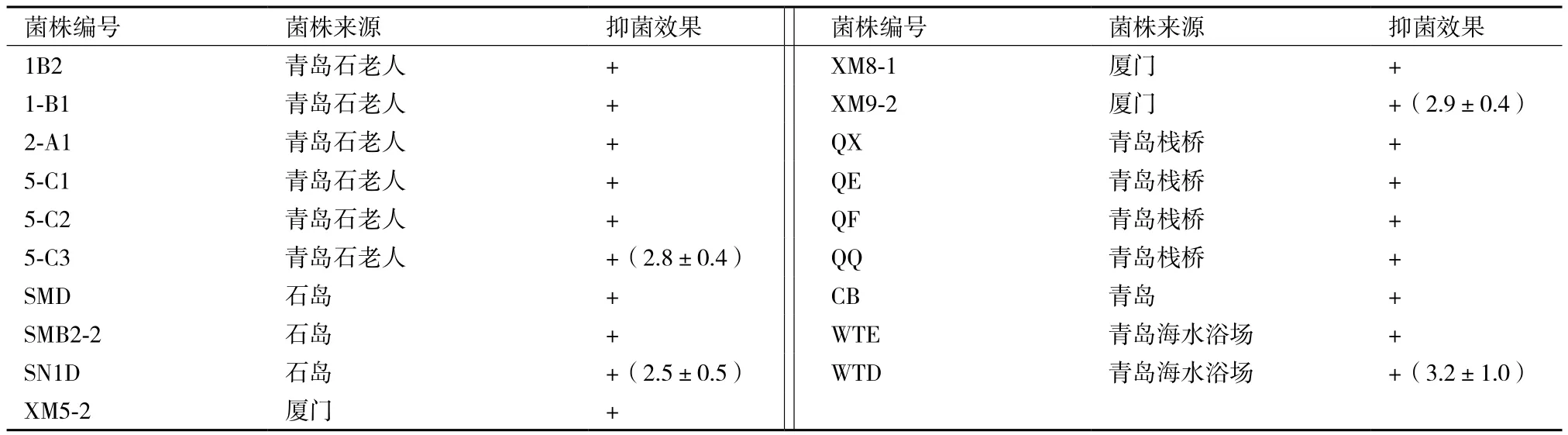
表1 拮抗菌菌株来源及对敏感鳗弧菌w-1的抗菌效果
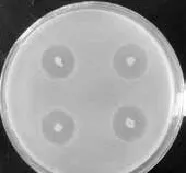
图1 拮抗菌菌株WTD抑制敏感菌株W-1生长的抑菌圈照片(平板点种法,点种的菌为WTD)
2.2 拮抗菌WTD的菌种鉴定
2.2.1 拮抗菌WTD的形态特征 菌株在2216E海洋琼脂平板上培养24 h后,菌体呈长杆状,Gram染色为阳性,染色均匀,有鞭毛,鞭毛周生,具运动性,专性好氧,可形成内生芽孢,芽孢椭圆形,不膨大,位于菌体中央。菌落圆形,白色,不透明,边缘不整齐,在2216E海洋琼脂培养基上不产生色素,在含高铁的碳水化合物培养基中可以产生普切明红色色素。
2.2.2 拮抗菌WTD的生理生化反应特征 细菌WTD的部分生理生化反应结果(表2)表明,菌株WTD不发光、发酵葡萄糖产气、产生吲哚、柠檬酸盐利用阴性、V. P. 反应阳性、甲基红反应阴性、硫化氢产生阳性,过氧化氢酶、氧化酶、淀粉酶阳性、明胶酶弱阳性,苯丙氨酸脱氢酶、藻胶酶阴性、卵磷脂酶、酪蛋白酶、脲酶阳性,O/F反应葡萄糖为氧化型,D-半乳糖、麦芽糖、乳糖、鼠李糖、棉籽糖、蔗糖和D-蕈糖为F型。
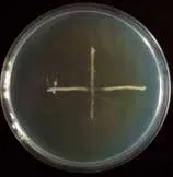
图2 拮抗菌菌株WTD抑制敏感菌株W-1生长的抑菌圈照片(十字交叉划线法,横线为W-1)
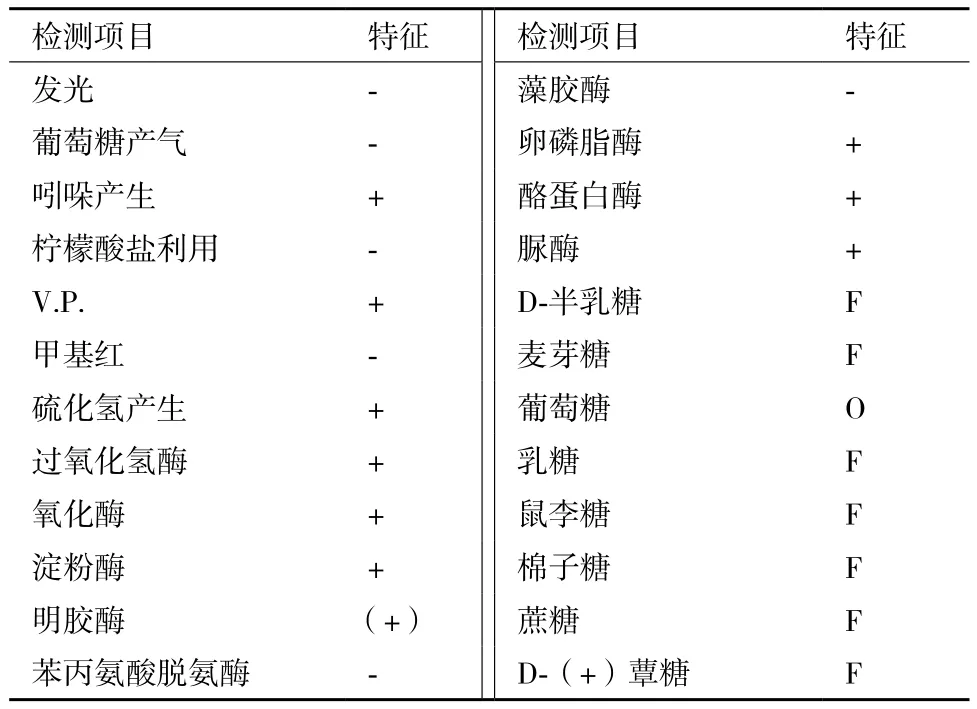
表2 菌株WTD的部分生理生化反应特征
2.2.3 细菌的16S rDNA序列的分析 菌株WTD的16S rDNA序列经过测定后提交至GenBank数据库,登录号是HM146083,利用NCBI的Blast程序与数据库中的16S rDNA序列进行比对,确定为芽孢杆菌属细菌。其中与其拟合度为96%以上的细菌种类有枯草芽孢杆菌(Bacillus subtilis)拟合度99%,解淀粉芽孢杆菌(Bacillus amyloliquefaciens)拟合度99%,地衣芽孢杆菌(Bacillus licheniformis)拟合度97%,短小芽孢杆菌(Bacillus pumilus)拟合度96%。利用Mega.5.2软件进行分析,基于Neibour-Joining法构建进化树(对于序列中的空缺部分,采用完全删除的方法处理)。结果(图3)显示,细菌WTD株与解淀粉芽孢杆菌的亲缘关系较近。
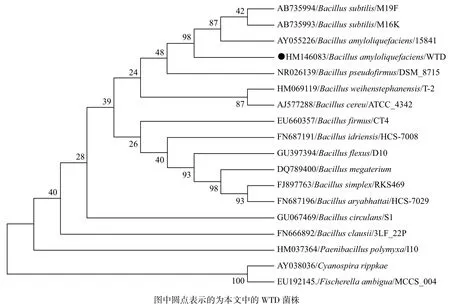
图3 基于16S rRNA基因的进化分析
2.2.4 细菌种的确定 由16S rDNA的分析、形态及生理生化反应实验结果,可以得出WTD属于芽孢杆菌属,可能属于枯草芽孢杆菌或者是解淀粉酶芽孢杆菌,但是根据伯杰氏手册第8版,枯草芽孢杆菌不产生卵磷脂酶,所以WTD属于解淀粉酶芽孢杆菌。
2.3 拮抗菌抑菌作用条件分析
2.3.1 pH对细菌拮抗效果的影响 不同pH条件下WTD对敏感菌株W-1的拮抗作用(图4)显示,在pH值为7时菌株的抑菌作用最大,并随着pH值得升高或降低,抑菌作用减小。
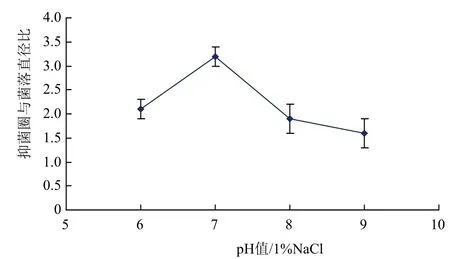
图4 不同pH条件下菌株WTD拮抗效果
2.3.2 盐度对细菌拮抗效果的影响 不同盐度下WTD对敏感菌株W-1拮抗作用(图5)显示,在盐度为1%NaCl的时候拮抗效果最好,随着盐度减小或者增大,拮抗效果均减弱。
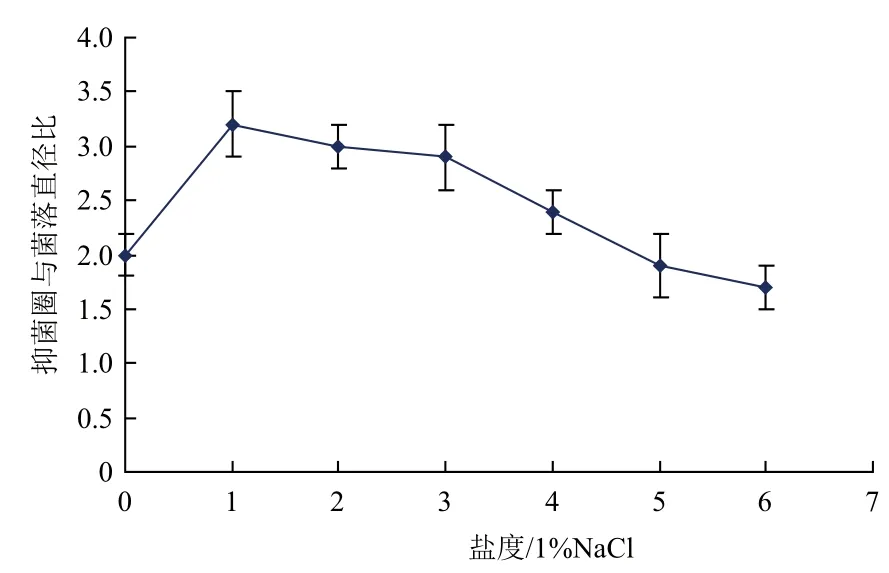
图5 不同盐度条件下菌株WTD的拮抗效果
2.3.3 温度对细菌拮抗效果的影响 不同温度下WTD对敏感菌株W-1拮抗作用(图6)显示,在温度为35℃的时候拮抗效果最好,随着温度的上升和下降,拮抗效果均下降。而在温度为15℃和20℃的时候,鳗弧菌W-1和菌株WTD均生长良好,没有拮抗效果。
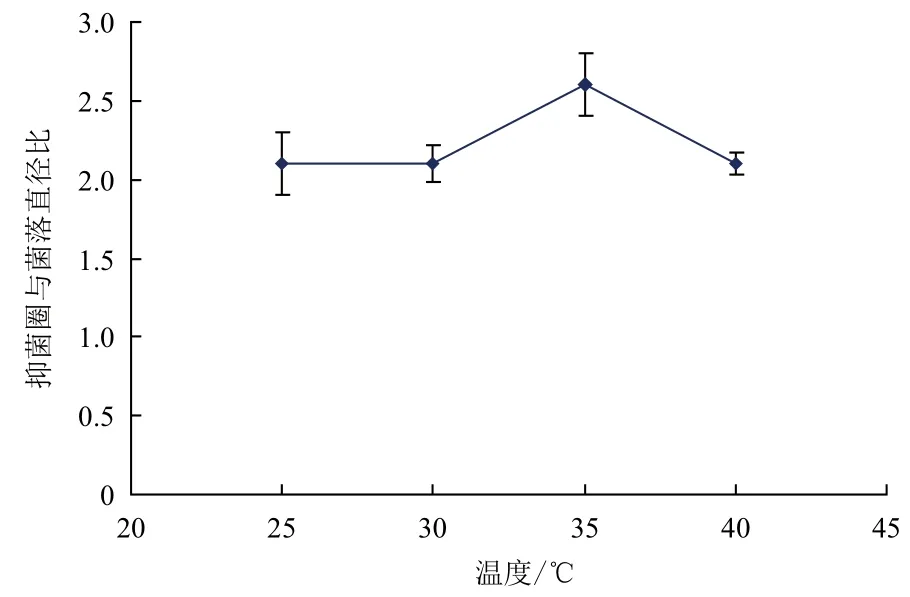
图6 不同温度下菌株WTD的拮抗效果
2.4 拮抗菌的药敏实验
拮抗菌WTD的药敏实验结果(表3)显示,菌株WTD对麦迪霉素、氟哌酸、奥复星、丙氟哌酸、万古霉素、复方新诺明、痢特灵、氯霉素、氯洁霉素、菌必治、先锋必素、丁胺卡那霉素、庆大霉素、卡那霉素、新霉素、复达欣、强力霉素、美满霉素、红霉素、青霉素、苯唑青霉素、氨苄青霉素、氧哌嗪青霉素、羧苄青霉素、先锋霉素、先锋霉素V、先锋霉素VI、头孢肤肟和四环素敏感,而对多黏菌素具有抗性。
3 讨论
分离的所有拮抗菌中,菌株1-B2、1-B1、2-A1、5-C1、5-C2和5-C3是采自青岛石老人养殖场的海水样本,菌株SMD、SMB2-2和SN1D采自石岛样本,菌株XM5-2、XM8-1和XM9-2来自厦门海水样,菌株QX、QE、QF和QQ取自青岛栈桥泥样,菌株CB取自青岛近海水样,菌株WTE、WTD取自青岛第二海水浴场的水样。从细菌采集的地点及分离得到的拮抗菌数目来看,可以得出在海水养殖场中拮抗菌的数目最多,这可能与养殖场病原细菌数目较多有关。其中SN1D 鉴定为芽孢杆菌属,WTD、XM9-2和5-C3均被鉴定为解淀粉酶芽孢杆菌,但是从及生理生化反应上三者均存在着差异,可能是菌株本身存在差异。
对解淀粉芽孢杆菌的报道多见于对真菌的抑制,王英国等[14]从堆肥中分离到一株解淀粉酶芽孢杆菌,可以产生抗菌多肽类物质抑制尖孢镰刀菌、草莓蛇病菌、毛霉和黑曲霉等多种真菌。郝建安等[15]发现解淀粉芽孢杆菌的抗真菌物质是一种蛋白质分子,抑真菌作用是在孢子萌发阶段使真菌新生菌丝畸形。王德培等[16]从青贮玉米秸秆饲料中分离得到一株解淀粉芽孢杆菌BI2,该菌主要抑制丝状真菌,对细菌无抑制作用,其培养36 h的上清液能明显抑制黄曲霉孢子萌发及菌丝生长。段春华等[17]从核桃林地土壤中分离得到一株拮抗解淀粉芽孢杆菌SDF-005,该菌对5种植物炭疽病菌丝生长均具有较强的抑制作用,其代谢产物可以破坏病原菌菌丝壁结构,引起菌丝膨大、畸变、扭曲、菌丝壁消解。冯金龙等[18]对解淀粉芽孢杆菌S27的生物学功能进行了研究,结果表明该菌对马铃薯枯萎病菌(Fusarium tricinctum)、马铃薯丝核病菌(Rhizoctonia solani)和马铃薯炭疽病菌(Colletotrichum coccodes)都有良好的抑制作用,可致菌丝膨大,断裂及溶解等。经实验检测本研究分离的解淀粉芽孢杆菌WTD菌株对青霉和曲霉的生长无抑制作用,需要进一步的实验确定其对病原真菌有无抑制作用。
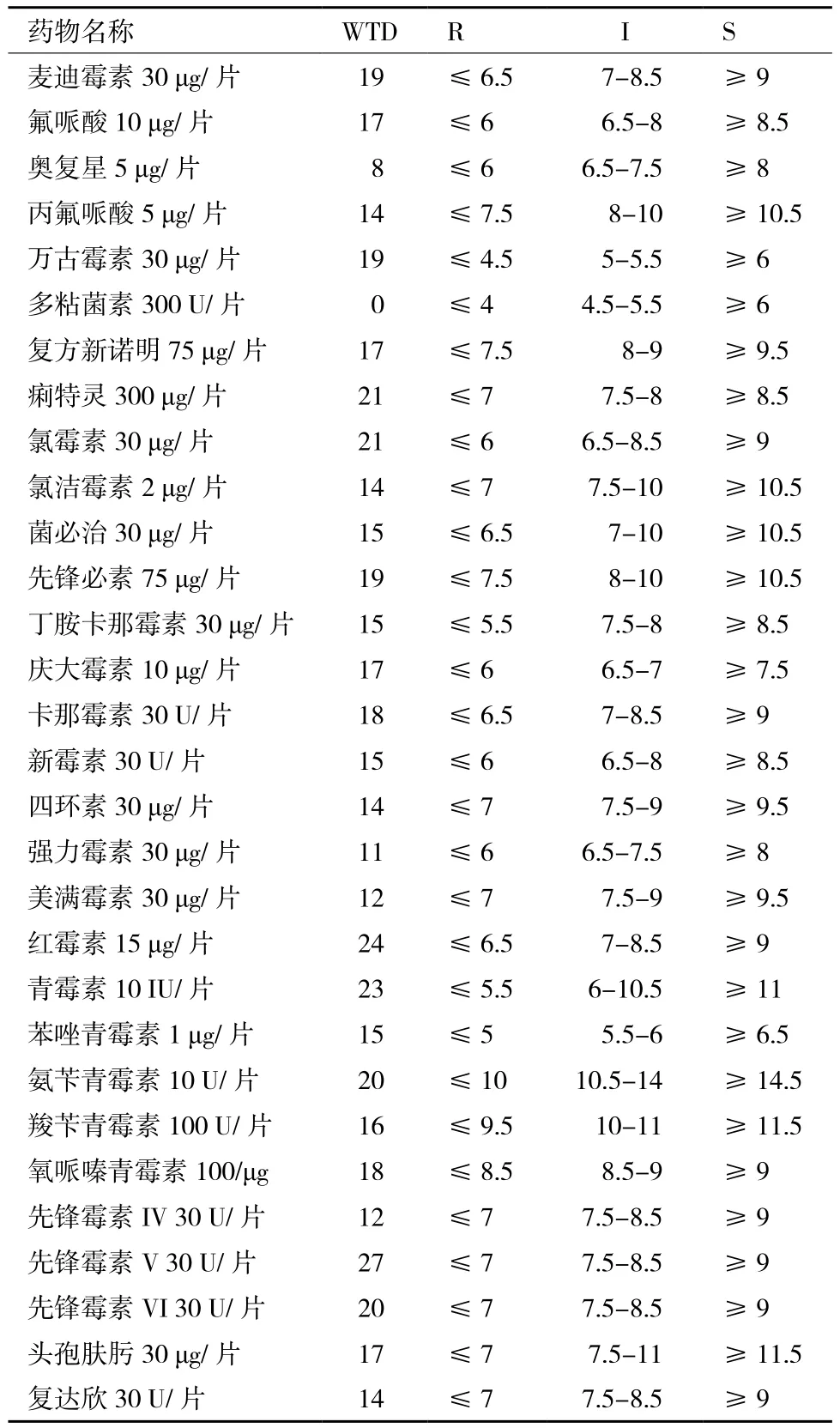
表3 拮抗菌WTD的药敏试验结果
利用拮抗微生物抑制水体中病原微生物的生长,使病原菌的浓度低于其致病浓度,进行水产养殖病害的防治,是国内外水产养殖病害控制的热点[19-22]。曹海鹏等[19]从养殖池污泥中分离筛选了一株解淀粉芽孢杆菌G1,该菌表现出了对鲟源病原性嗜水气单胞菌的良好拮抗作用,其最适生长pH为7,最适生长温度为30℃,与本研究报道菌株WTD生长条件相近。本实验采用平板点种法从分离菌株中筛选对病原菌鳗弧菌W-1的拮抗菌,即将待测菌株直接点种到涂有病原菌的平板上,此方法不仅可以直接观察到拮抗菌通过分泌拮抗物质产生的抑菌区,还可通过抑菌圈的大小,定量比较拮抗菌抑菌活性的强弱[21]。在以不同pH、盐度、温度比较拮抗菌抑菌活性的强弱时,应当同时考虑不同培养条件对病原菌的生长的影响。傅松哲等[22]从海洋沉积物中分离到两株拮抗弧菌,短小芽孢杆菌H2和地衣芽孢杆菌H4,它们对需钠弧菌的生长都具有显著的抑制作用,对凡纳滨对虾的现场实验结果表明,加入菌株短小芽孢杆菌H2可显著提高凡纳滨对虾的存活时间。需要对本研究分离的解淀粉芽孢杆菌菌株WTD进行模拟养殖实验证明该菌的生物安全性。
解淀粉芽孢杆菌可产生抑菌蛋白类、脂肽类抗生素、大环内酯类、寡肽酶、肽类和聚酮化合物等[23,24],可抑制病原真菌和细菌的生长,另外,解淀粉芽孢杆菌是一种对人畜相对安全的细菌,使其有望作为益生菌在畜牧水产养殖中得到应用。本研究分离的解淀粉芽孢杆菌菌株WTD对鲈鱼病原菌鳗弧菌W-1具有较强的抑制作用,实验中发现其冷冻干燥的上清液对鳗弧菌W-1具有明显的拮抗效果,拮抗物质在50℃、80℃和100℃处理后依然表现出拮抗效果,说明该物质对热具有稳定性,同时用蛋白酶K处理后也依旧表现出抑菌活性。说明该抑菌物质不是蛋白质类物质,需要对菌株拮抗鳗弧菌物质进行进一步的研究才能确定其性质。必须对分离菌株WTD的拮抗机理、菌种拮抗条件及菌种安全性实验等进一步的研究才有望进入应用阶段。
4 结论
本研究从青岛、厦门和石岛的海洋环境中分离了126株细菌,从中筛选出19株对鲈鱼病原菌鳗弧菌W-1具有拮抗作用的细菌,其中抑菌作用较强的菌株WTD鉴定为解淀粉芽孢杆菌。该菌的最佳抑菌作用条件为温度35℃,pH值为7,盐度为1%NaCl。药敏实验结果表明,该菌对麦迪霉素等29种抗生素敏感,而对多黏菌素具有抗性。
[1]Egidius E. Vibriosis:pathogenicity and pathology, a review[J]. Aquaculture, 1987, 67:15-28.
[2]杨嘉龙, 周丽, 战文斌. 杀鲑气单胞菌杀日本鲑亚种胞外产物毒性及免疫原性分析[J]. 渔业科学进展, 2009, 30(3):20-24.
[3]陈萍, 王清印, 李健, 等. 溶藻弧菌对三疣梭子蟹溶菌酶和磷酸酶活性的影响[J]. 渔业科学进展, 2009, 30(2):78-82.
[4]沈锦玉, 余旭平, 潘晓艺, 等. 网箱养殖大黄鱼假单胞菌病病原的分离与鉴定[J]. 渔业科学进展, 2008, 29(1):1-6.
[5]肖慧, 李军, 王祥红, 等. 鲈鱼苗烂鳃烂尾病病原菌的研究[J].青岛海洋大学学报, 1999, 29(1):87-93.
[6]Muroga K, Higashi M, Keitoku H. The isolation of intestinal m icroflora of farmed red seabream(Pagrus major)and black seabream(Acanthopagrus schlegeli)at larval and juvenile stages[J]. Aquaculture, 1987, 65:79-88.
[7]Li J, Yie J, Rita WT, Ling L, et al. Antibiotic resistance and plasmid profiles of Vibrio isolates from cultured silver sea bream, Sparus sarba[J]. Marine Pollution Bulletin, 1999, 39(4):245-249.
[8]Nicolas JL, Robic E, Ansque D. Bacterial flora associated with a tropic chain consisting of microalgae, rotifers and turbot larvae:influence of bacteria on larval survival[J]. Aquaculture, 1989,83:237-248.
[9]Austin B, AI-Zahrani AMJ. The effect of antimicrobial compounds on the gastrointestinal microflora of rainbow trout, Salmo gairdneri Richardson[J]. Journal of Fish Biology, 1988, 33:1-14.
[10]Garrett ES, Santos CL, Jahncke ML. Pub lic, animal and environmental health implications ofaquaculture[J]. Emerging Infection Disesses, 1997, 3(4):453-457.
[11]王祥红, 杜宗军, 李筠, 等. 有益细菌A18在海湾扇贝(Argopecten irradians)育苗中的应用[J]. 高技术通讯, 2002, 12(8):84-88.
[12]东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京:科学出版社, 2001.
[13]李雅军, 张斌, 王华. 2006年CLSI/NCCLS药敏标准的更新(CLSI/NCCL M100-S16代替M100-S15)[J]. 江西医学检验,2006, 2(4):355-356.
[14]王英国, 王军华, 权春善, 等. 解淀粉芽孢杆菌抗菌活性物质的分离纯化及抑菌活性研究[J]. 中国生物工程杂志, 2007,27(12):41-45.
[15]郝建安, 曹志辉, 赵凤梅, 等. 解淀粉芽孢杆菌NK10. BAhjaWT抑真菌作用的研究[J]. 微生物学通报, 2008, 35(6):903-908.
[16]王德培, 孟慧, 管叙龙, 等. 解淀粉芽孢杆菌BI2的鉴定及其对黄曲霉的抑制作用[J]. 天津科技大学学报, 2010, 25(6):5-9.
[17]段春华, 刘幸红, 牛赡光, 等. 一株拮抗细菌的鉴定及对植物炭疽病菌作用效果测定[J]. 江西农业学报, 2014, 26(3):94-97.
[18]冯金龙, 杨成德, 陈秀蓉, 等. 解淀粉芽孢杆菌S27的鉴定、生物学功能测定及其对马铃薯病原真菌拮抗作用研究[J].甘肃农业大学学报, 2013, 48(4):56-61.
[19]曹海鹏, 何珊, 刘丽玲, 等. 鲟源病原性嗜水气单胞菌拮抗芽孢杆菌的鉴定及其生物学特性[J]. 微生物学通报, 2011, 38(9):1377-1384.
[20]刘亚楠, 习丙文, 梁利国, 等. 1株嗜水气单胞菌的拮抗菌鉴定及其特性研究[J]. 水生态学杂志, 2014, 35(3):82-87.
[21]王娟, 封永辉, 蔡立胜, 等. 来自大黄鱼(Pseudosciaena crocea)肠道的弧菌拮抗菌的筛选与鉴定[J]. 海洋与湖沼, 41(5):707-713.
[22]傅松哲, 宋奔奔, 刘鹰, 等. 弧菌拮抗菌的筛选及其对凡纳滨对虾的抑菌防病作用[J]. 中国环境科学, 2009, 29(8):867-872.
[23]张娟, 杨彩梅, 曹广添, 等. 解淀粉芽孢杆菌极其做为益生菌的应用[J]. 动物营养学报, 2014, 26(4):863-867.
[24]孙力军, 陆兆新, 别小妹, 等. 培养基对解淀粉芽孢杆菌ES-2菌株产抗菌脂肽的影响[J]. 中国农业科学, 2008, 41(10):3389-3398.
(责任编辑 马鑫)
Isolation and Identification of Bacillus amyloliquefaciens WTD and the Optimal Conditions of Its Antim icrobial Activity
Zhang Chao Wang Xianghong Xu Tao Li Shuai Qian Hao Li Shuai Zhang Zenghu
(College of Marine Life,Ocean University of China,Qingdao266003)
This work is to isolate and screen the antagonistic bacteria from sea environment which can inhibit the growth of the seaperch’s pathogenic bacterium Vibrio anguillarum W-1, and investigate the optimal conditions of its antimicrobial activity as well as the drug sensitivity. The methods of plate crossing streaking and point-inoculating were used to screen the antagonistic bacteria. The morphology,physiological and biochemical reactions and 16S rDNA phylogenetic analysis were applied for the identification of antagonistic bacteria. The onevariable method was utilized to optimize the antimicrobial conditions of the antagonistic bacteria. Total 126 strains of bacteria were isolated from the coast of Qingdao, Xiamen and Shidao, and 19 antagonistic bacteria were screened. The bacterial strain WTD with the optimal antagonistic activity was identified as Bacillus amyloliquefaciens. Under the optimal conditions of 35℃, salinity 1% NaCl, and pH 7, the antagonistic effect was the best. The drug sensitivity test revealed that the bacterium was sensitive to 29 antibiotics such as midecamycin, but resistant to polymyxin. As a conclusion, the antagonistic strain B. amyloliquefaciens WTD can efficiently inhibit the growth of the seaperch’s pathogenic bacterium V. anguillarum, and has the potential application value in the aquaculture.
Bacillus amyloliquefaciens;Vibrio anguillarum;antimicrobial activity;antagonistic bacteria
10.13560/j.cnki.biotech.bull.1985.2015.09.024
2014-12-25
张超,男,博士研究生,研究方向:海洋有益菌及病毒学;E-mail:zhangchao@ips.ac.cn
王祥红,男,博士,研究方向:海洋微生物学;E-mail:xhwang@ouc.edu.cn

