基于改良ERIC-PCR技术快速鉴别人参和西洋参
王 锐,杨 果,王昊楠,李明华,姚仕鑫(辽宁工程技术大学理学院,辽宁阜新123000)
基于改良ERIC-PCR技术快速鉴别人参和西洋参
王锐,杨果,王昊楠,李明华,姚仕鑫
(辽宁工程技术大学理学院,辽宁阜新123000)
为建立快速、准确的鉴定人参和西洋参并测定二者在混合物中含量的方法,将ERIC-PCR(Enterobacterial Repetitive Intergenic Consensus-Polymerase chain reaction)引物改良进行温度梯度PCR扩增,分析人参(Panax ginseng C.A.Mey,PG)和西洋参(Panax quinquefolium L.,PQ)电泳条带并寻找其特异性条带,结果发现一对特异性引物ER1和EL2,当退火温度为46.0℃时,只出现2.8 kb条带为西洋参,而出现2.8 kb和3.4 kb条带为人参。通过对混合样品中3.4 kb条带的定量分析,可以准确的定量西洋参的含量,系统误差仅为5.2%,RSD为3.5%,说明该方法可以快速、准确的鉴定西洋参和人参,并且可以准确测定混合物中西洋参的含量。
ERIC-PCR,西洋参,人参,DNA条形码
人参(Panax ginseng C.A.Mey,PG)和西洋参(Panax quinquefolium L.,PQ)均为五加科(Araliaceae)人参属(Panax)植物,两者形状和化学成分相似,又都是著名的强壮滋补药,易于混淆,人参性温偏于助阳,西洋参性凉偏于滋阴,药效差异很大[1-4]。随着人们对美容、延缓衰老类滋补品需求的不断增加,西洋参及其制品消费量大,价格昂贵,货源偏紧,市场上伪品不断出现,尤其以人参掺入或冒充西洋参,并加工成饮片、粉末或胶囊,传统的性状鉴别法、显微鉴别法鉴别难度很大,依靠分析检测人参中某些化学成分的理化性状鉴别法快速、准确地鉴别人参和西洋参制品尚有一定的局限性[5]。因此需要建立一种适用于各种人参、西洋参形态的快速、客观、稳定、易重复的鉴定方法。
ERIC-PCR被广泛应用于细菌的分类和鉴定[6-9]。ERIC-PCR属于半随机扩增,即当基因组中含有ERIC时,扩增产物通常一端含有ERIC,另一端随机匹配;当基因组中不存在ERIC时,扩增产物具有特殊的随机扩增:其引物较长(22 bp),可产生具有较高可重复性和一定特异性的指纹图谱[10]。Gillings发现ERIC可以在植物和动物中扩增出相应的特征产物[11]。基于此本文首次将ERIC-PCR引物末端碱基进行随机化改良,通过对比每对引物温度梯度PCR结果,寻找人参或西洋参的特异条带,建立准确、快速、稳定的人参和西洋参鉴别和定量方法,有利于在功能性食品行业中快速准确地鉴定西洋参。
1 材料与方法
1.1材料与仪器
人参、西洋参药材各10批样品,每批样品的状态、产地见表1;植物基因组DNA提取试剂盒NEP003-1北京鼎国昌盛生物技术有限责任公司;DNA marker Ladder III 100 bp北京鼎国昌盛生物技术有限责任公司;100g-Biowest agarose琼脂糖上海浩然生物技术有限公司;实验所用其他试剂均为分析纯或优级纯;水灭菌超纯水。
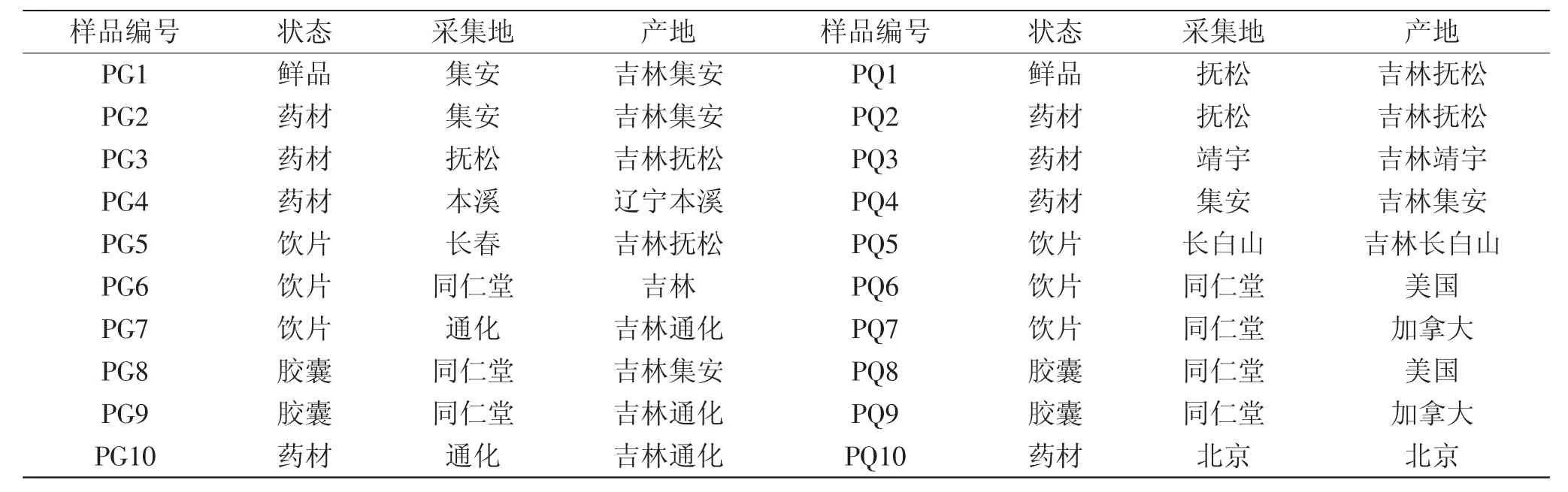
表1 供试人参(PG)和西洋参(PQ)样品来源Table 1 Resources of Panax ginseng(PG)and Panax quinquefolium(PQ)
TC-512型PCR扩增仪北京众益中和生物技术有限公司;LG2020D型电泳凝胶成像系统上海圣科仪器设备有限公司;HC-3018R高速冷冻离心机安徽科大中佳;LDZX-50FBS翻盖型压力蒸汽灭菌器上海申安医疗器械厂。
1.2实验方法
1.2.1DNA的提取用70%乙醇漂洗人参和西洋参药材或饮片,擦干,60℃干燥,粉碎,过筛(40目)制成粉末;胶囊直接将人参或西洋参粉末倒出用于实验。按批次取人参和西洋参粉末各100 mg,放入液氮冷冻过的研钵内,加入适量液氮研磨成细粉。严格按照植物基因组DNA提取试剂盒说明书操作提取DNA,并以1%琼脂糖凝胶电泳检测DNA的完整性;取少量DNA样品稀释100倍,用紫外分光光度计测定波长在260 nm处的吸光度值A,通过公式浓度(μg·mL-1)= A260×50×稀释倍数,计算DNA的浓度,并使DNA模板终浓度为200 ng。
1.2.2人参和西洋参的鉴定参照文献[12]的方法,对人参和西洋参药材、饮片和胶囊进行品种鉴定。
1.2.3ERIC-PCR扩增引物的改良将ERIC-PCR的引物:ER和EL的末位碱基C和G分别随机化[13],并对引物重新编号,结果见表2。所有引物均由上海生工生物技术有限公司合成,并经聚丙烯酰胺凝胶电泳(PAGE)纯化。

表2ERIC-PCR改良引物Table 2 The modified primers of ERIC-PCR
1.2.4人参和西洋参特异性条带的确定以人参和西洋参标准品PG1和PQ1的DNA为模板,以改良的引物两两配对进行温度梯度PCR扩增,25 μL反应体系中含有10×PCR Buffer(+Mg2+)2.5 μL,dNTP(2.5 mmol·L-1)2.0 μL,引物10 μmol·L-1各1 μL,TaqE(5 U·μL-1)0.3 μL,模板DNA 200 ng,加ddH2O至25 μL。
ERIC-PCR扩增程序:预变性95℃,7 min;变性温度94℃,1 min;退火温度40~62℃,50 s;延伸65℃,8 min;总延伸65℃,16 min;4℃保温30 min结束反应。每对改良引物重复三次温度梯度PCR,分别取10 μL反应产物在含EB的1.0%的琼脂糖凝胶上电泳(100 V)1 h,用电泳凝胶成像系统观察、拍照。对照片进行比对分析,确定人参和西洋参可能的特异性引物和退火温度。
1.2.5适用范围实验以PG1和PQ1为标准品,按照1.2.4项确定的特异性引物和退火温度、扩增程序,检验其余西洋参和人参样品基因组DNA的扩增频率和特异性。
1.2.6人参和西洋参混合样品的测定将西洋参(PQ1)和人参(PG1)粉末按不同比例混合,总重量为100 mg,其中西洋参分别占0%、10%、20%、40%、60%、80%和100%。按1.2.1项下方法提取人参和西洋参混合样品DNA,用紫外分光光度计测定DNA浓度,并调节浓度使标准品DNA浓度和5批待测的混合样品DNA浓度一致,以1.2.5项下方法进行PCR扩增,精确量取PCR产物10 μL在含EB的1.0%的琼脂糖凝胶上电泳(100 V)1 h,用电泳凝胶成像系统观察、拍照。用Quantity One 4.6.2软件分析照片,测定特异性条带的峰密度(Peak Density),以峰密度值为纵坐标,以西洋参的百分含量为横坐标做标准曲线。
准确称量5个批次(PQ1、PQ4、PQ6、PQ9和PQ10)的西洋参粉末各50 mg,共5份;在每一份西洋参粉末中随机加入任意批次的人参粉末50 mg,分别编号为PGQ1、PGQ4、PGQ6、PGQ9和PGQ10。按标准曲线方法进行PCR和电泳、测定特异条带的峰密度值,计算人参的百分含量。
2 结果与分析
2.1人参和西洋参的鉴定
参照文献[12],将采集或购买的人参和西洋参样品的ITS2(Internal Transcribed Spacer 2,内部转录间隔区2)序列在中药材DNA条形码鉴定系统(http:// www.tcmbarcode.cn)上进行物种鉴定,鉴定结果显示采集或购买的人参和西洋参样品均为真品。
2.2人参和西洋参特异条带的确定
通过对比西洋参和人参的温度梯度照片,找出PQ1或PG1的特异性条带,该特异性条带对应的引物和相应的退火温度就是快速鉴别PQ1和PG1的特异性引物和退火温度,将该条件下的PCR产物放在同一块琼脂糖凝胶上进行电泳,结果见图1。从图1可以看出改变ERIC-PCR引物末尾碱基和退火温度可以在PQ1和PG1中产生更多的、可重复、稳定的特异性指纹图谱,这也在一定程度上反映PQ1和PG1基因组的单核苷酸多态性(SNP)。单核苷酸多态性(SNP)具有分布广泛、数量众多、易于批量检测等优点。在物种鉴定、物种起源与亲缘关系、遗传育种等领域得到了广泛的应用,特别是在区分近缘种的研究中非常有效[14]。

图1 西洋参和人参可能特异性引物鉴别电泳图Fig.1 The electrophoretograms of P.ginseng and P.quinquefolius possible specific primers.
2.3适用范围实验结果
选用不同产地、不同药店出售药材、饮片和胶囊作为实验材料,具有广泛的代表性。对收集到的代表性样品各10批进行检测,结果显示:只有一对特异引物ER1和EL2在退火温度为46.0℃条件下按照1.2.4项操作,才能将PQ和PG完全清晰地区分开(图2)。从图2中可看出2.8 kb条带为PQ和PG共有带,3.4 kb条带为人参特异性带。这与PQ和PG的IST2条形码鉴定结果一致。实验重复三次,结果均相同,说明特异性引物ER1和EL2在退火温度为46.0℃条件下可准确、快速而稳定鉴别PQ和PG,而且不受物种产地和形态的影响,说明该方法重复性、稳定性很好,适用范围广。

图2 西洋参和人参鉴别电泳图Fig.2 The identification electrophoretogram of P.quinquefolius and P.ginseng
2.4人参和西洋参混合样品的测定结果
图3显示了西洋参和人参混合样品的测定结果。利用Quantity One 4.6.2软件分析照片,读取3.4 kb条带的峰密度(Peak Density)值,以峰密度值为横坐标,以西洋参的百分含量为纵坐标,用Origin 9.4绘制标准曲线,标准方程为y=-0.03x+0.98,r=0.9991,说明西洋参含量在0%~100%线性关系良好。

图3 不同比例PQ和PG混合物电泳图Fig.3 The electrophoretogram of different ratio mixtures of P.quinquefolius and P.ginseng
待测样品(PGQ1、PGQ4、PGQ6、PGQ9和PGQ10)测定结果见表3。由表3可知,采用特异性引物(ER1和EL2)和退火温度(46.0℃)进行ERIC-PCR扩增,用Quantity One 4.6.2软件测定特异性条带峰密度值的方法测定西洋参和人参混合物中的西洋参的含量准确度较高,平均加样回收率为105.2%,相对标准偏差为3.5%,系统误差率仅为5.2%。因此该方法不仅可以快速、准确、稳定的鉴别西洋参和人参,而且可以准确的测定西洋参的百分含量。

表3 西洋参和人参混合物中PQ含量的测定Table 3 The determination of PQ in the mixture of P.quinquefolius and P.ginseng
3 结论
通过ERIC-PCR技术找到鉴别西洋参和人参的一对特异性引物——ER1和EL2,当退火温度为46.0℃时,人参的PCR产物有一条特异性条带,其长度为3.4 kb。通过这对引物可以准确的对人参和西洋参混合物中的人参或西洋参进行定量,无需昂贵的仪器和测序。从DNA的提取、特异性PCR扩增到数据分析可在一日内完成。该方法在食品药品领域还具有较大的潜在应用前景,特别是在功能性食品行业中通过快速准确检测物种近缘种,为规范保健食品市场服务提供理论基础。
[1]詹鑫婕,田程,张媛,等.基于ITS2条形码SNPs的人参和西洋参PCR-SSCP分子鉴别研究[J].中国中药杂志,2012,37(24):3748-3751.
[2]中华人民共和国卫生部药典委员会.中华人民共和国药典中药薄层色谱集[M].北京:人民卫生出版社,2010:20-23.
[3]Li W,Gu C,Zhang H,et al.Use of high-performance liquid chromatography-tandem mass spectrometry to distinguish Panax ginseng CA Meyer(Asian ginseng)and Panax quinquefolius L.(North American ginseng)[J].Analytical chemistry,2000,72(21):5417-5422.
[4]曹智,张燕娣,许永华,等.人参有效成分及其药理作用研究新进展[J].人参研究,2012,24(2):39-43.
[5]宋沁馨,冯芳,张心悦,等.SNP测定结合芯片电泳法快速鉴别人参和西洋参[J].药物分析杂志,2009(1):1-5.
[6]Sharples G J,Lloyd R G.A novel repeated DNA sequence located in the intergenic regions of bacterial chromosomes[J]. Nucleic acids research,1990,18(22):6503-6508.
[7]廖永红,任文雅,孙宝国,等.米醋沉淀中Bacillus subtilis DNA提取及ERIC-PCR体系条件优化[J].食品工业科技,2011(6):212-215.
[8]丁久法,潘迎捷,陈洪友,等.副溶血性弧菌ERIC-PCR分型及毒力基因检测研究[J].食品工业科技,2010(8):137-141.
[9]郭丹凤,张昭寰,肖莉莉,等.不同耐药性致病性副溶血性弧菌的生长特性比较研究[J].食品工业科技,2014,35(19):137-141.
[10]陈迎春,曹又方,赵立平.大肠杆菌MG1655菌株ERIC-PCR图谱主带序列组成分析[J].微生物学通报,2002,29(6):28-32.
[11]Gillings M,Holley M.Repetitive element PCR fingerprinting(rep-PCR)using enterobacterial repetitive intergenic consensus(ERIC)primers is not necessarily directed at ERIC elements[J]. Letters in applied microbiology,1997,25(1):17-21.
[12]陈士林,姚辉,韩建萍.中药材DNA条形码分子鉴定指导原则[J].中国中药杂志,2013,38(2):141-148.
[13]Versalovic J,Koeuth T,Lupski R.Distribution of repetitive DNA sequences in eubacteria and application to finerpriting of bacterial enomes[J].Nucleic acids research,1991,19(24):6823-6831.
[14]邹喻苹,葛颂.新一代分子标记——SNPs及其应用[J].生物多样性,2004,11(5):370-382.
Study on rapid identification of Panax quinquefolius and Panax ginseng based on improved ERIC-PCR
WANG Rui,YANG Guo,WANG Hao-nan,LI Ming-hua,YAO Shi-xin
(College of Science,Liaoning Technology University,Fuxin 123000,China)
Studied on the rapid identification and quantification of PQ and PG using improved ERIC-PCR,and a pair of new primers(ER1 and EL2)was found.When the annealing temperature was 46.0℃,the genome DNA PCR results showed one specific 2.8 kb band for PQ while two bands of 2.8 kb and 3.4 kb repectively for PG. It also was possible to quantify PG in mixed PQ and PG sample by quantification of the 3.4 Kb band,and the systematic error was only 5.2%and RSD was 3.5%.The study showed that this method was rapid and accurate to identify PQ and PG and to quantify PG in mixed PQ and PG.
improved ERIC-PCR;Panax quinquefolius;Panax ginseng;DNA barcodes
TS252.1
A
1002-0306(2015)20-0080-04
10.13386/j.issn1002-0306.2015.20.008
2015-02-05
王锐(1978-),女,硕士,讲师,研究方向:功能性食品开发,E-mail:527021510@qq.com。
国家大学生创新创业训练计划项目(201410147045);十二五农村领域国家科技计划课题(2012BAD22B00)。

