兰州百合鳞茎贮藏腐烂病原菌的鉴定及生物学特性
巩慧玲,孙爱洁,李 茜,汤国纲,袁惠君,冯再平,李善家(.兰州理工大学生命科学与工程学院,甘肃兰州730050;.甘肃集森片装鲜百合有限公司,甘肃兰州730000)
兰州百合鳞茎贮藏腐烂病原菌的鉴定及生物学特性
巩慧玲1,孙爱洁1,李茜1,汤国纲2,袁惠君1,冯再平1,李善家1
(1.兰州理工大学生命科学与工程学院,甘肃兰州730050;2.甘肃集森片装鲜百合有限公司,甘肃兰州730000)
为确定引起兰州百合鳞茎贮藏期间腐烂的病原菌,应用柯赫氏法则测定了从病样中分离的纯培养物的致病性,根据形态学特性和ITS序列分析对病原菌进行鉴定,并对病原菌的生物学特性进行了研究。结果表明,引起兰州百合鳞茎腐烂的病原菌分别是黄曲霉和米根霉。两种病原菌的最适生长条件相同,最适宜菌丝生长和产孢的培养基均是百合培养基和百合葡萄糖培养基,葡萄糖和蛋白胨为菌丝生长及产孢的最适碳源和氮源,最适生长温度为25℃,在pH5~9范围内都可生长,光照有利于菌丝的生长和产孢。
兰州百合,腐烂病,黄曲霉,米根霉,生物学特性
百合(Lilium spp.)是百合科百合属多年生球根草本植物,全世界约有90多种。根据用途可分为观赏用百合、食用百合和药用百合[1]。我国食用百合主要有甘肃兰州百合、湖南邵阳百合和江苏宜兴百合,各品系不仅营养成分的含量有明显差异,品质和风味也各不一样,其中兰州百合口味香甜,瓣大肉厚,品质极佳[2]。据产地调查,兰州百合鳞茎每年仅在10月中旬至11月中旬和2月上旬至3月上旬采收,采收后的百合鳞茎在贮运过程易腐烂变质,从而造成较大经济损失,已成为遏制百合生产的重要因素之一。
百合鳞茎贮藏期间的病害主要有真菌性和细菌性病害,真菌性病害主要有鳞茎基腐病、鳞茎青霉腐烂病、鳞茎根霉软腐病、鳞茎斑点病、鳞茎炭疽病等,细菌性病害主要有软腐病[3-7]。据报道,引起百合鳞茎贮藏期腐烂症状的真菌性病原菌主要有尖镰孢菌(Fusarimoxysporum)、三隔镰孢菌(Fusarium tricinctum)、层生镰刀菌(Fusarium proliferatum)、黑曲霉(Aspergillus niger)、匍枝根霉(Rhizopus stolonifer)、圆孤青霉(Penicilliumcyclopium)和簇状青霉(Penicillium corymbiferum)等[5-10]。这些病原菌多是从观赏百合腐烂鳞茎上分离得到的,而对引起食用百合鳞茎腐烂的病原菌的研究较少。因此,本研究对食用百合-兰州百合鳞茎贮藏期腐烂病的病原进行分离和鉴定,并对其生物学特性进行研究,从而为生产实践中有效控制食用百合鳞茎贮藏腐烂病的发生提供理论基础。
1 材料与方法
1.1材料与仪器
兰州百合鳞茎腐烂病病害样本采自兰州市七里河区西果园镇米家山百合保鲜冷库和黄裕乡百合保鲜冷库;马铃薯葡萄糖培养基(PDA)、马铃薯蔗糖培养基(potato sucrose agar,PSA)、马铃薯麦芽糖培养基(potato maltose agar,PMA)、百合培养基(lily agar,LA)、百合葡萄糖培养基(lily dextrose agar,LDA)和查氏培养基(Czapek Dox agar,CDA)实验室自制;葡萄糖、蔗糖、麦芽糖均为分析纯,购自天津市大茂化学试剂厂。
AB104-N电子分析天平梅特勒-托利多仪器上海有限公司;CJ-10超净工作台天津市泰斯特仪器有限公司;SHZ-82型恒温振荡器常州国华电器有限公司;SYQ-DSX-280B型手提式不锈钢压力蒸汽灭菌器上海申安医疗器械厂;RH-250-HS型珠江牌培养箱韶关市泰宏市医疗器械有限公司。
1.2实验方法
1.2.1病原菌的分离和致病性测定采集新近腐烂的百合鳞茎,采用组织分离法[11]在病健交界组织处切取4 mm×4 mm小块,用75%酒精表面消毒30 s,再用2%次氯酸钠消毒7 min,无菌水冲洗3次,然后置于PDA培养基上28℃黑暗培养,待长出菌丝后,挑取菌落边缘进行纯化,纯化后的菌落再进行单孢分离培养。
病原菌致病性测定根据柯赫氏法则[11-12],用灭菌的接种针在消毒后的鳞茎片上刺孔,将浸有菌液的滤纸片贴在孔上作为有伤接种,同时将浸有菌液的滤纸片贴在未刺孔的鳞茎片上作为无伤接种,将浸无菌水的滤纸片贴在孔上作为对照。接种处理完成后将鳞茎片置于培养皿中保湿培养,5 d后观察并记录发病情况,确定病原菌对百合鳞茎的致病性。对接种发病的鳞茎片再次进行病原菌的分离。
1.2.2病原菌鉴定
1.2.2.1病原菌形态学观察将病原菌接种到PDA平板,28℃黑暗培养2~5 d,观察菌落形态,并在显微镜下观察病原菌的菌丝及孢子的形态特征,测量孢子大小。
1.2.2.2ITS序列分析将供试菌株接种于PDA培养基中;28℃恒温培养4 d,收集菌丝体,采用CTAB法提取病原菌基因组DNA[13-14]。
ITS通用扩增引物为TS1(5’-TCCGTAGGTGAAC CTGCGG-3’)和TS4(5’-TCCTCCGCTTATTGATAT GC-3’)。
扩增体系:50 μL,基因组模板DNA 1 μL、10 μmol/L上下游引物各1 μL、2 mmol/L dNTPs 5 μL、KOD DNA聚合酶1 μL、10×KOD Buffer 5 μL,加ddH2O补足体积。
PCR扩增反应程序为94℃预变性3 min;94℃变性30 s;58℃复性30 s;72℃延伸3 min,35个循环;72℃延伸10 min。
扩增产物经1%琼脂糖凝胶电泳检测后,由北京信诺金达生物技术有限公司测序。所得测序结果在NCBI网站上用BLAST软件进行同源性比较后,下载同源序列,用MEGA(molecular evolutionary genetics analysis,Version 6.0)软件将病原菌ITS序列与同源序列进行比对,并采用邻接法(Neighbor joining,NJ)构建系统发育树,自举法(bootstrap)对系统发育树进行检验,500次重复。
1.2.3病原菌生物学特性将直径5 mm的病原菌菌块分别接种于供试培养基平板(直径9 cm)中央,于培养箱中培养,分析培养基种类、碳源、氮源、温度、pH和光照时间对病原菌菌丝生长和产孢量的影响。采用PDA、PSA、PMA、LA和LDA培养基;培养温度分别为5、15、25、35℃;pH分别为5、6、7、8和9;全光照、全黑暗和光照/黑暗各12 h;等量葡萄糖、果糖、乳糖和淀粉置换查氏基本培养基中的蔗糖,等量硫酸铵、硝酸铵、硝酸钾和蛋白胨,置换查氏基本培养基中的硝酸钠,并设空白对照。病原菌菌株Z1和Z2分别在以上各条件下培养5、2 d后(因菌株Z2生长速度较快,因此缩短培养时间统计菌落生长状况),采用十字交叉法测量菌落生长直径作为菌丝生长状况指标,7 d后采用血球计数板法测量孢子产量[15-16]。
1.3数据分析
采用SPSS 20.0统计软件进行单因素方差分析,Duncan氏新复极差法检验处理间差异显著性。显著水平p=0.05,每个处理3个重复。

图1 兰州百合鳞茎腐烂病症Fig.1 Sympton of Lanzhou lily rot
2 结果与分析
2.1百合鳞茎腐烂病症状及致病性
兰州百合鳞茎腐烂病的发生一般从鳞茎表面破损处开始,初侵染时在破损处形成略显褐色的侵染点,逐渐扩展形成近圆形或不规则形状的褐色病斑,病斑中央呈腐烂状,并逐渐向四周扩大,病斑上可见灰绿色霉层,腐烂组织不断增加,严重时导致整个鳞茎软化腐烂。
从兰州百合鳞茎腐烂病斑上分离纯化得到五株菌株,分别编号为Z1、Z2、Z3、Z4和Z5。致病性结果表明,仅菌株Z1、Z2单独接种健康百合鳞茎片后,在接种部位出现腐烂病斑,并伴随菌丝体大量繁殖,菌株Z2比Z1的侵染能力强,无伤接种也可导致鳞茎片腐烂(图1-b、c)。菌株Z1和Z2混合接种鳞茎片后,使鳞茎片腐烂更为严重(图1-d),其病症与百合鳞茎自然条件下的发病症状相同。从接种发病部位可分别重新分离到与接种菌相同的菌株,表明所分离到的菌株Z1、Z2均为兰州百合鳞茎腐烂病病原菌。
2.2病原菌鉴定
2.2.1病原菌形态从兰州百合腐烂鳞茎上分离到的病原菌菌株Z1,在PDA培养基上菌丝质地致密丝绒状,中央部分呈絮状,菌株形成少量菌核,同时伴有渗出液(图2-a);菌落反面为无色至淡褐色,后期产生菌核时,会显现黑褐色斑点(图2-b);分生孢子头初为球形,后呈辐射形;分生孢子梗多生自基质,孢子梗200~800 μm×8~20 μm,壁厚,无色,粗糙;产孢结构为双层;分生孢子为近球形,直径为2.4~6.4 μm,壁略粗糙(图2-c)。病原菌菌株Z2在PDA培养基上生长迅速,菌丝疏松,最初呈白色,后变为灰黑色(图2-d),菌落背面呈白色棉絮状(图2-e);假根发达,分枝呈指状或根状,呈深褐色。孢子囊呈球形或近球形,初期呈白色,老后呈黑色,直径25~200 μm,孢囊孢子呈椭圆形或近球形,淡褐色(图2-f)。
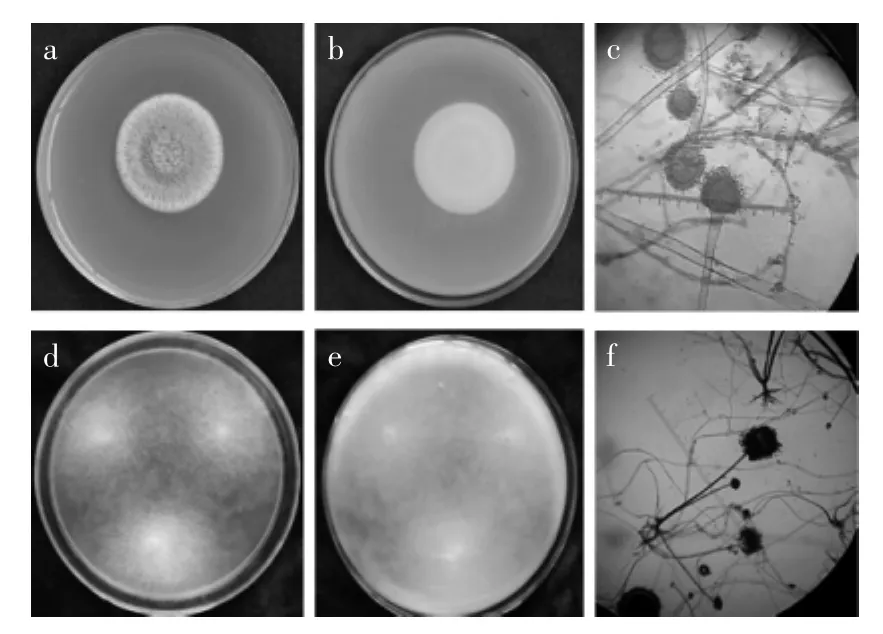
图2 兰州百合鳞茎腐烂病病原菌形态特征Fig.2 Morphologic characteristic of pathogens causing Lanzhou lily rot disease
2.2.2ITS序列分析用ITS通用引物扩增出病原菌的通用引物序列,长度分别为594 bp(GenBank登录号:KP172534)和627 bp(Gen Bank登录号:KP172533)。经BLAST分析,菌株Z1、菌株Z2的rDNA-ITS序列分别与黄曲霉和米根霉的同源性最高。在同源性最高的序列中各挑选10个菌株的ITS序列分别与供试菌株构建系统发育树。如图3所示,菌株Z1序列与Aspergillus flavus(JF754467.1)的序列亲缘关系最近,且与A.flavus相聚于同一群。如图4所示,菌株Z2的序列与Rhizopus oryzae(JQ683242.1)的序列亲缘关系最近,且与R.oryzae相聚于同一群。菌株Z1、Z2的ITS序列在NCBI上BLAST结果与A.flavus和R.oryzae的相似性为分别为99%和99%~100%,进而从系统分类学上进一步验证了菌株Z1和菌株Z2;再结合病原菌的形态特征,可以确定菌株Z1为黄曲霉(A.flavus),菌株Z2为米根霉(R.oryzae)。
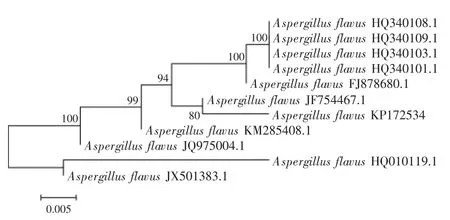
图3 基于ITS序列构建的百合鳞茎腐烂病原菌Z1的系统发育树Fig.3 Phylogenetie tree of pathogen Z1 based on ITS sequences
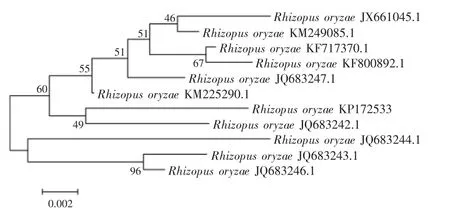
图4 基于ITS序列构建的百合鳞茎腐烂病原菌Z2的系统发育树Fig.4 Phylogenetie tree of pathogen Z2 based on ITS sequences
2.3病原菌的生物学特性
2.3.1培养基种类对病原菌菌丝生长和产孢量的影响A.flavus和R.oryzae两种病原菌在供试的五种培养基上都能生长,两种病原菌在百合培养基和百合葡萄糖培养基上菌丝生长和产孢量最大,且在这两种培养基上的差异不显著。A.flavus在LA上培养5 d后菌落直径达19.0 mm,R.oryzae在LA上培养2 d后,菌落直径达40.5 mm,7 d后产孢量分别为10.35× 106个/mL和8.06×106个/mL(图5)。
2.3.2碳源、氮源对病原菌菌丝生长和产孢量的影响两种病原菌对供试碳源均可利用。A.flavus在葡萄糖为碳源的培养基上菌丝生长速度最大,培养5 d后菌落直径达20.0 mm,而在果糖、乳糖和淀粉为碳源的培养基上菌丝生长速度次之,且三者间差异不显著。A.flavus在葡萄糖和果糖为碳源的培养基上产孢量最高,而两者间差异不显著;在淀粉为碳源的培养基上产孢量次之,在乳糖为碳源的培养基上产孢量最低(表1)。R.oryzae在葡萄糖和果糖为碳源的培养基上菌丝生长和产孢量最大,且两者间产孢量差异不显著;在乳糖和淀粉为碳源的培养基上菌丝生长和产孢量次之,且两者间菌落直径差异也不显著(表1)。
A.flavus在蛋白胨和硝酸铵为氮源的培养基上菌丝生长速度最大,且两者间差异不显著,但在蛋白胨为氮源的培养基上产孢量高于硝酸铵为氮源的培养基,在硫酸铵和硝酸钾为氮源的培养基上菌丝生长速度和产孢量都较低(表1)。R.oryzae在蛋白胨为氮源的培养基上,菌丝生长和产孢量都最大,在硫酸铵和硝酸钾为氮源的培养基上菌丝生长较好,在硝酸铵为氮源的培养基菌丝生长较差,与无氮培养基差异不显著,但在硝酸铵为氮源的培养基上产孢量高于硫酸铵和硝酸钾为氮源的培养基(表1)。
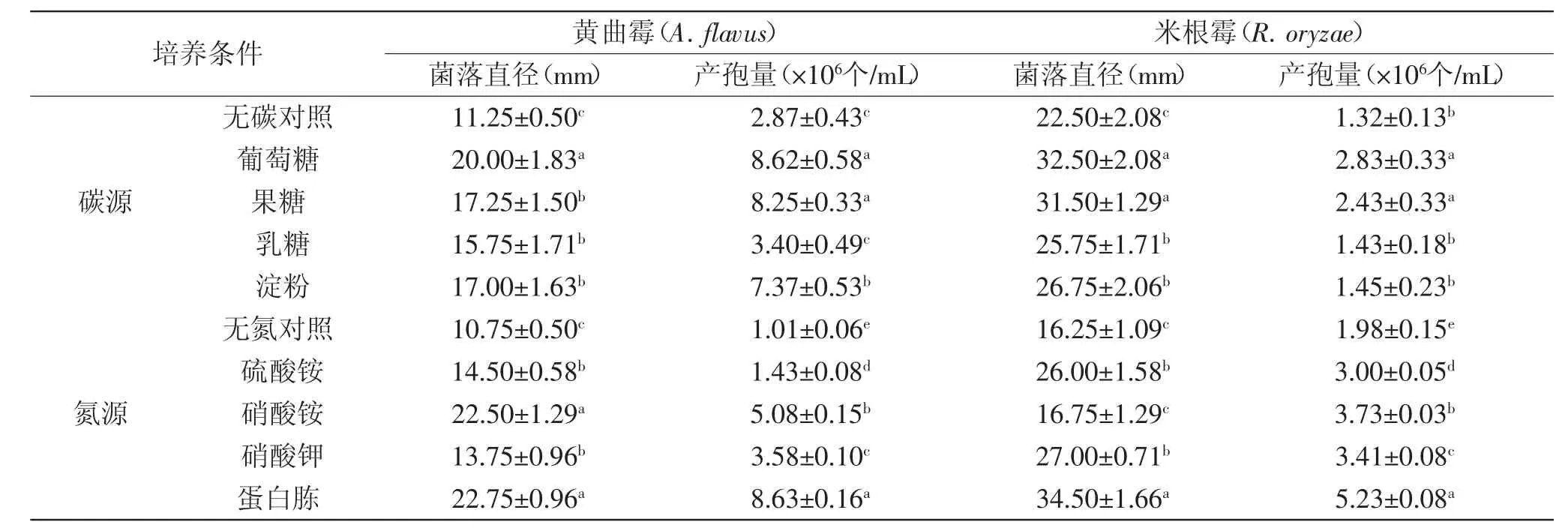
表1 碳、氮源对病原菌菌丝生长和产孢量的影响Table 1 Effect of carbon source and nitrogen source on the mycelia growth and sporulation of pathogens
2.3.3培养条件对病原菌菌丝生长和产孢量的影响由表2可知,两种病原菌的菌丝生长和产孢的最适温度是25℃。A.flavus和R.oryzae在pH为5~9范围内的PDA培养基上均能生长,A.flavus在pH为5、8和9的PDA培养基的菌丝生长速度均较快,5 d后菌落直径差异不显著,而在pH为6时产孢量最大,7 d后产孢量为9.85×106个/mL。R.oryzae在pH为6时菌丝生长速度和产孢量最快,2 d后菌落直径达35.5 mm,7 d后产孢量为3.75×106个/mL。光照可促进两种病原菌的菌丝生长和产孢,A.flavus在全光照条件下生长5 d后,其菌落直径达23.00 mm,而R.oryzae在全光照条件下生长2 d后,菌落直径达24.00 mm,7 d后产孢量分别达13.03×106个/mL和6.33×106个/mL。
3 讨论
本研究通过致病性测定、形态学特性和ITS序列分析,确定引起兰州百合鳞茎贮藏腐烂病的病原菌是A.flavus和R.oryza,表明此腐烂病害是根霉腐烂病和曲霉腐烂病混合发生,这两种腐烂病害在百合鳞茎腐烂的相关研究中也有报道,但与本研究中分离到的病原菌不同,其病原菌是A.niger和R.stolonifer[17]。此外,也有较多研究表明圆弧青霉菌、簇状青霉菌也可导致百合鳞茎腐烂[18],在兰州百合鳞茎贮藏病害调查时也发现大多腐烂严重的百合鳞茎表面生有青霉菌菌丝,而且在分离病原菌时也分离到两种青霉菌,但致病性测定表明,这两种青霉菌均不引起百合腐烂,仅可在刺破表皮的百合鳞茎表面繁殖,表明分离到两种青霉菌仅是腐生菌,而不是病原菌。
生物学特性研究表明,A.flavus和R.oryzae两种病原菌的最适生长条件基本相同,这可能也是两种菌可以共生而侵染百合导致其发生腐烂病的原因。此外,这两种病原菌在LA和LDA培养基上的菌丝生长速度和产孢量均高于PDA和PSA(在LA和LDA上的菌丝生长速度和产孢量差异不显著),表明百合鳞茎本身的营养有利于这两种菌的繁殖而侵染百合鳞茎导致发生腐烂病害。
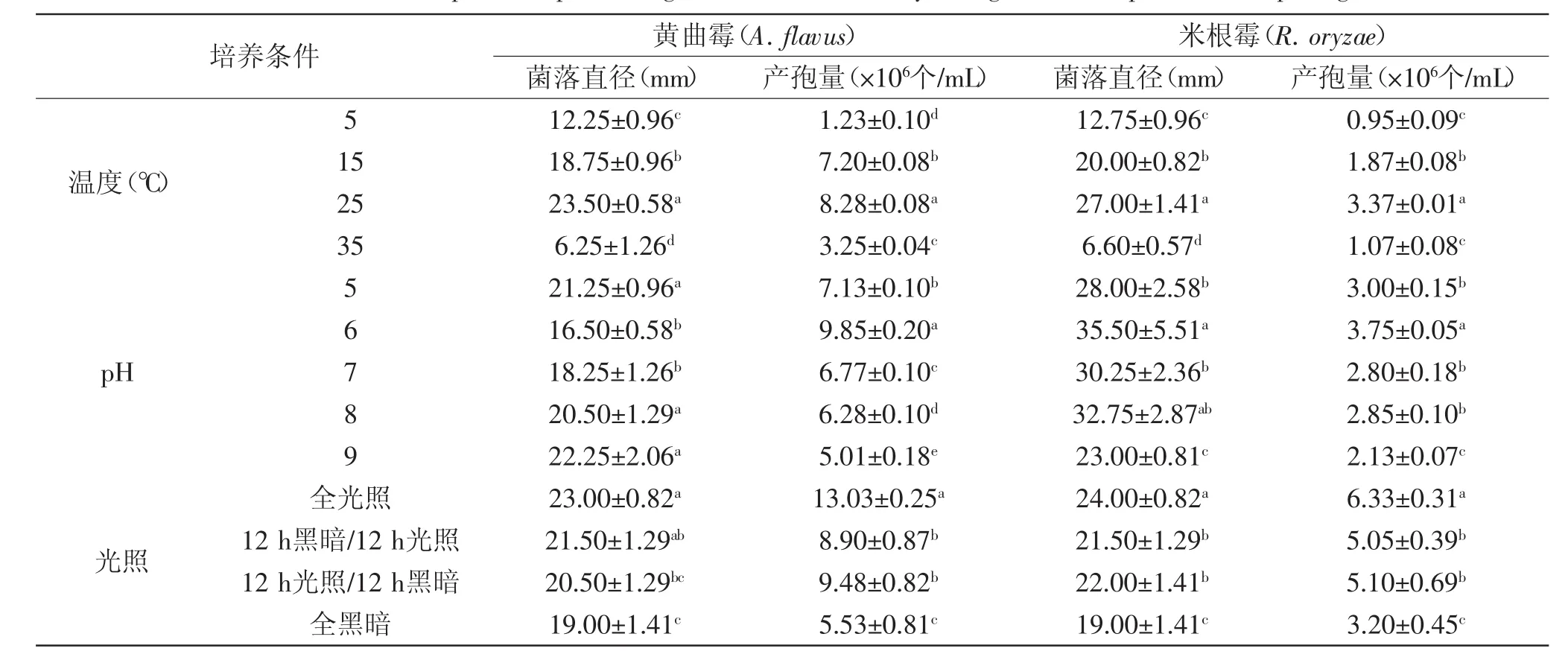
表2 温度、pH和光照条件对病原菌菌丝生长和产孢量的影响Table 2 Effect of temperature,pH and light treatment on the mycelia growth and sporulation of pathogens
目前,国内外食用百合的种植面积远低于观赏用百合,因此对百合鳞茎腐烂病的研究大多关注观赏用百合鳞茎种球在生长发育过程中的腐烂对出苗率和花卉品质的影响[19-20],而尖镰孢菌是引起观赏用百合鳞茎种球腐烂的主要病原菌[9,21],这与导致兰州百合鳞茎贮藏期间腐烂的病原菌不同,因此,防治花卉百合种球腐烂病的方法对食用百合也无借鉴作用。而作为食用的兰州百合鳞茎在原产地的贮藏方式,目前多采用低温冷库在零下4℃条件下贮藏,通常不采用其他防腐措施,导致贮藏期间腐烂病的发生较为严重,本研究通过对其病原菌的分离和生物学特性的研究,为下一步开展采用安全的方法消毒百合贮藏冷库以及预处理百合鳞茎来防治腐烂病害的发生奠定了必要的基础。
4 结论
从兰州百合腐烂鳞茎上分离鉴定得到黄曲霉和米根霉两种病原菌。对这两种病原菌的生物学特性研究表明,它们的最适生长条件相同,百合培养基和百合葡萄糖培养基最适宜菌丝生长和产孢,葡萄糖和蛋白胨为菌丝生长及产孢的最适碳源和氮源,最适生长温度为25℃,在pH5~9范围内都可生长,光照有利于菌丝生长和产孢。
[1]李谋智.食用百合组织培养快繁技术研究[J].北方园艺,2006(1):101-102.
[2]林玉红,石有太,崔文娟,等.不同肥料配比对旱地兰州百合产量、品质及养分累积的影响[J].干旱地区农业研究,2013,31(5):186-190.
[3]Lawson RH,Hsu HT.Lily disease and their control[J].Acta Horticulturae,1996,414:175-188.
[4]唐祥宁,游春平,刘福秀,等.江西百合病害调查与鉴定[J].江西农业学报,1997,9(4):1-8.
[5]叶世森,林芳,宋建英.百合病害的研究综述[J].西南林学院学报,2005,25(3):84-88.
[6]尚巧霞,周丽丽,刘素花,等.百合鳞茎腐烂病病原菌分离鉴定[J].北京农学院学报,2005,20(1):27-29.
[7]王拱辰,寿绍贤.百合鳞茎斑点病病原菌鉴定[J].植物病理学报,1994,24(3):212-217.
[8]吴祝华,詹德智,施季森,等.百合尖孢镰刀菌鳞茎腐烂病研究进展[J].江苏农业科学,2013,41(6):1-4.
[9]Sara LM,Orly E,Marcel M,et al.Bulb and Root Rot in Lily(Lilium longiflorum)and Onion(Alliumcepa)in Israel[J]. Journal of Phytopathology,2014,162:466-471.
[10]Shang QH,Zhao X,Li YY,et al.First Report of Fusarium tricinctum Causing Stem and Root Rot on Lanzhou Lily(Lilium davidii var.unicolor)in China[J].American Phytopathological Society,2014,98(7):999-1000.
[11]方中达.植病研究方法[M].第三版.北京:中国农业出版社,2007:124-126.
[12]唐文娟,陈君慧,任雷厉,等.库尔勒香梨“黑头病”病原菌的分离和初步鉴定[J].食品工业科技,2011,32(3):367-369.
[13]易润华,朱西儒,周而勋.简化CTAB法快速微量提取丝状真菌DNA[J].湛江海洋大学学报,2003,23(6):72-73.
[14]Liu SH,Lu JP,Zhu RL,et al.A rapid and simple extraction method for plant pathogenic fungi[J].Acta Phytopathologica Sinica,2005,35(4):362-365.
[15]卢松茂,罗金水,张汉荣,等.柑橘黑斑病菌生物学特性研究[J].植物保护,2012,38(5):46-50.
[16]易润华,甘罗军,晏冬华,等.火龙果溃疡病病原菌鉴定及生物学特性[J].植物保护学报,2013,40(2):102-108.
[17]陈秋萍.福建省百合病害调查初报[J].福建林学院学报,2000,20(2):97-100.
[18]朱明德,潘其云,邓建玲,等.百合贮藏病害及其防腐措施的研究[J].上海农业科技,2004(2):92-93.
[19]Straathof TP,Löffler HJM.Resistance to Fusarium oxysporum at different developmental stages of Asiatic hybrid lilies[J]. Journal of the American Society for Horticultural Science,1994,119(5):1068-1072.[20]Lim JH,Rhee HK,Kim YJ,et al.Resistance to Fusarium oxysporum f.sp.lilii in Lilium[J].Acta Horticulturae,2003,620:311-318.
[21]Bald JG,Suzuki T,Doylea A.Pathogenicity of Fusarium oxysporum to Easter lily,Narcissus and Gladiolus[J].Annals of Applied Biology,1971,67(3):331-342.
IdentificationofthepathogenfromstoredLanzhoulilybulbrotdiseaseand biological characteristics
GONG Hui-ling1,SUN Ai-jie1,LI Xi1,TANG Guo-gang2,YUAN Hui-jun1,FENG Zai-ping1,LI Shan-jia1
(1.College of Life Science and Engineering,Lanzhou University of Technology,Lanzhou 730050,China;2.Gansu Unionsum Sliced Fresh Lily Bulb Co.,Ltd.,Lanzhou 730000,China)
In order to confirm the pathogen of stored Lanzhou lily bulb rot disease,the pathogenicity of pure culture isolated from the samples of disease tissue was tested according to Koch’s law,the pathogens were identified according to morphological characteristics and ITS sequence analysis,and biological characteristics were determined.The results showed that Lanzhou lily rot disease was caused by Aspergillus flavus and Rhizopus oryzae.The optimal growth condition of the two pathogens was not different.For the mycelia growth and sporulation of A.flavus and R.oryzae,the optimum medium were lily agar and lily dextrose agar,the optimum carbon source and nitrogen source were glucose and peptone separately,the optimum temperature was 25℃ and they could grow on the medium from pH5 to pH9.Light could improve mycelia growth and sporulation of A.flavus and R.oryzae.
Lanzhou lily;rot disease;Aspergillus flavus;Rhizopus oryzae;biological characteristics
TS255.1
A
1002-0306(2015)20-0097-06
10.13386/j.issn1002-0306.2015.20.011
2015-01-20
巩慧玲(1973-),女,博士,副教授,主要从事果蔬采后生理与保鲜方面的研究,E-mail:gonghl@lut.cn。
兰州市科技局项目(2012-2-138)。

