一种米曲霉蛋白酶的分离纯化及酶解特性研究
宗 红,冯颖杰,陆信曜,诸葛斌,*,方慧英,孙 进,冯 倩,楼笑笑,程英雀(1.江南大学糖化学与生物技术教育部重点实验室,江苏无锡141;.江南大学工业生物技术教育部重点实验室,工业微生物研究室,江苏无锡141;.浙江正味食品有限公司,浙江省调味食品制造工程技术研究中心,浙江义乌000)
一种米曲霉蛋白酶的分离纯化及酶解特性研究
宗红1,2,冯颖杰1,2,陆信曜1,2,诸葛斌1,2,*,方慧英1,2,孙进3,冯倩3,楼笑笑3,程英雀2
(1.江南大学糖化学与生物技术教育部重点实验室,江苏无锡214122;2.江南大学工业生物技术教育部重点实验室,工业微生物研究室,江苏无锡214122;3.浙江正味食品有限公司,浙江省调味食品制造工程技术研究中心,浙江义乌322000)
对米曲霉固态发酵所产蛋白酶分离纯化,采用硫酸铵盐析、DEAE-FF层析、Butyl-HP层析和Superdux 75 10/300GL凝胶层析得到一种电泳纯的蛋白酶,SDS-PAGE显示分子量大小为27 ku左右。以酪蛋白为底物时,该蛋白酶Km=1.23 g·L-1,Vm=27.03 μg·mL-1·min-1,最适反应条件为50℃,pH9.0。该蛋白酶对酪蛋白水解活性最高,而对牛血清蛋白的水解活性很低;对牛胰岛素B链上-Phe-Val-,-Cys-Gly-,-Glu-Ala-和-Arg-Gly-组成的肽键有较强的切割能力,酶切位点较多,对疏水性氨基酸具有较高的选择性,为米曲霉所产蛋白酶在食品上的应用提供有力的参考。
米曲霉,蛋白酶,分离纯化,酶切位点
微生物法产蛋白酶以其生长繁殖快、培养条件简单、生产成本低廉以及便于生产控制等优势而逐渐成为蛋白酶制剂的主要生产方式[1],越来越多的微生物蛋白酶应用于食品生产。由于食品安全日益受到全球人们的重视,因此,对于安全微生物所产蛋白酶的研究显得尤为重要。米曲霉作为美国FDA公布的安全菌株广泛应用于食品行业[2],其蛋白酶酶系丰富,具有广泛的应用范围。
目前米曲霉蛋白酶的研究大多集中在提高酶活及初步分离等方面[3-5],曾小波等[6]从米曲霉所产酶系中初步分离出了一种内肽酶和一种外肽酶,马俊阳等[7]获得了两种不同蛋白酶并对其酶学性质进行了初步研究,除此之外关于米曲霉各蛋白酶组分酶解特性及其酶切方式的深入研究较少,从而影响了对米曲霉蛋白酶的充分利用。不同的蛋白酶作用于蛋白质肽链的不同位置,对氨基酸残基形成的肽键有其酶解专一性,不同的蛋白酶作用于同一底物时,会产生不同的氨基酸或肽水解物,从而使蛋白水解物呈现不同的口味及功能特性,因此,为应对不同的生产需求,需要发现更多的蛋白酶,不同食品用安全蛋白酶的获得及其酶解特性研究对于蛋白酶食品业应用的深度开发具有重要意义。
本研究对一株米曲霉所产蛋白酶系进行了分离纯化,并对获得的蛋白酶组分进行酶解特性及酶切方式研究,为米曲霉所产蛋白酶在食品上的应用提供指导。
1 材料与方法
1.1材料与仪器
米曲霉(Aspergillus oryzae)为本研究中心筛选和保藏;牛胰岛素氧化B链购自Sigma公司;酪蛋白、牛血清白蛋白购自国药集团化学试剂公司;麸皮、豆粕、马铃薯为市售;其他试剂均为国产分析纯。
AKTA蛋白纯化仪GE公司;可见光分光光度计WFJ7200 Unic上海仪器有限公司。
1.2实验方法
1.2.1培养基米曲霉固态发酵培养基:麸皮5 g,豆粕5 g,水10 mL,装瓶于500 mL三角瓶,搅拌混匀。
1.2.2粗酶液的制备将制备好的孢子悬浮液接种于固态培养基中,30℃静置培养36 h,每隔6 h翻曲一次。发酵结束后加入3倍质量的无菌生理盐水,40℃浸提1 h,用八层纱布过滤后,滤液经冷冻离心机8000 r/min离心30 min,取上清即为粗酶液。
1.2.3蛋白酶的分离纯化将粗酶液加入(NH4)2SO4至40%饱和度去除杂质,用70%饱和度的(NH4)2SO4沉淀蛋白酶,透析后的样品上样于用20 mmol/L Tris-HCl(pH8.5)平衡过的DEAE-FF层析柱,待穿透蛋白充分洗下后,用含0.5 mol/L NaCl的缓冲液线性洗脱,收集酶活组分并等体积加入3 mol/L(NH4)2SO4溶液,上样于1.5 mol/L(NH4)2SO4-20 mmol/L Tris-HCl(pH7.5)缓冲液平衡好的Butyl-HP层析柱,用不含(NH4)2SO4的缓冲液线性洗脱,收集蛋白酶活性组分;得到的样品继续上样于20 mmol/L Tris-HCl平衡后的Superdux 75 10/300GL凝胶层析柱,收集酶活组分。
1.2.4蛋白酶酶活测定采用Folin-酚法[8],以2%的酪蛋白为底物。
1.2.5蛋白含量测定采用Brad-Ford法[9],以牛血清白蛋白为标准。
1.2.6蛋白酶分子量及酶谱检测分子量检测采用SDS-PAGE测定分子量[10];酶谱检测按照SDS-PAGE稍加改进[11],样品与上样缓冲液混合后不经煮沸处理,低温(冰浴)电泳后,脱色摇床上用2%Triton X-100的振荡30 min以脱去凝胶中的SDS,0.1 mol/L pH7.2磷酸盐缓冲液洗胶3次,置于2%酪蛋白溶液中40℃水解30 min后,染色及脱色。
1.2.7酶学性质测定
1.2.7.1最适温度与温度稳定性在不同的温度下测定蛋白酶酶活,测定最适酶反应温度;把蛋白酶分别放置于不同温度(30、40、50、60℃)保温30、60、90、120 min后,40℃下测定酶活,测定酶的温度稳定性。
1.2.7.2最适pH与pH稳定性用不同的缓冲系统,柠檬酸-柠檬酸钠(pH4.0~6.0),Tris-HCl(7.0~8.0),硼砂-NaOH(9.0~11.0),配制成酪素溶液,测定蛋白酶的最适pH;用不同的pH的缓冲液调节酶液pH到3.0~10.0,40℃保持1 h,调节回最适pH测定酶活。以调节前的酶活作为100%酶活,计算相对酶活。
1.2.7.3金属离子的影响向酶液中分别加入不同的金属离子(Cu2+、Ca2+、Mn2+、Zn2+、Mg2+、Fe3+、Fe2+、Ni2+、Co2+),使金属离子终浓度分别达到5 mmol/L和10 mmol/L。40℃放置1 h后,测定酶活,以未加入金属离子时的酶活为100%,计算相对酶活。
1.2.7.4米氏常数测定在蛋白酶的最适条件下,以不同浓度的酪蛋白溶液(1、2、5、10、15、20 g/L)为底物测定酶活,以浓度的倒数1/[S]为横坐标,反应速率的倒数1/V为纵坐标,利用双倒数作图确定Vm与Km。
1.2.8底物选择性选择2%浓度的酪蛋白、牛血清白蛋白、大豆分离蛋白为底物,用Folin-酚法测定蛋白酶P酶活,底物浓度均为2%,以酪蛋白为底物时的酶活为100%,计算相对酶活。
1.2.9酶切位点测定用蛋白酶水解牛胰岛素氧化B链,水解液通过MALDI-TOF-MS检测酶解肽段分子量,与牛胰岛素氧化B链的随机片段比对,得到酶解肽段的氨基酸序列,与牛胰岛素氧化B链氨基酸序列对比,确定蛋白酶的酶切位点[12]。
2 结果与分析
2.1米曲霉蛋白酶的分离纯化
粗酶液经过硫酸铵盐析、透析后上样于DEAEFF层析柱、Butyl-HP层析柱和Superdux 75 10/300GL凝胶层析柱,最后经过透析、超滤,得到电泳纯的蛋白酶P(图1)。经过纯化,蛋白酶P的比活力达到了6450 U/mg,纯化倍数为6.26倍,回收率为4.5%(表1)。

表1 蛋白酶P纯化结果Table 1 Purification of protease P from Aspergillus oryzae
2.2米曲霉蛋白酶的分子量及酶谱分析
将纯化后的蛋白酶P进行SDS-PAGE和酶谱分析(图2),纯化出的蛋白酶P只有一条带,条带清晰,纯度达到电泳纯,分子量约为27 ku左右。相应的酶谱条带为单一的亮带,结合分析其SDS-PAGE条带,说明该蛋白酶为单亚基的蛋白,由一条肽链折叠形成。该酶分子量大小与Vishwanatha[12]、汤鸣强[13]和马俊阳等[7]纯化的蛋白酶均不相同,推测该酶是新发现的蛋白酶,这将为米曲霉蛋白酶的进一步应用提供依据。

图1 米曲霉蛋白酶的层析洗脱曲线Fig.1 Elution profile of Aspergillus oryzae protease on Chromatography
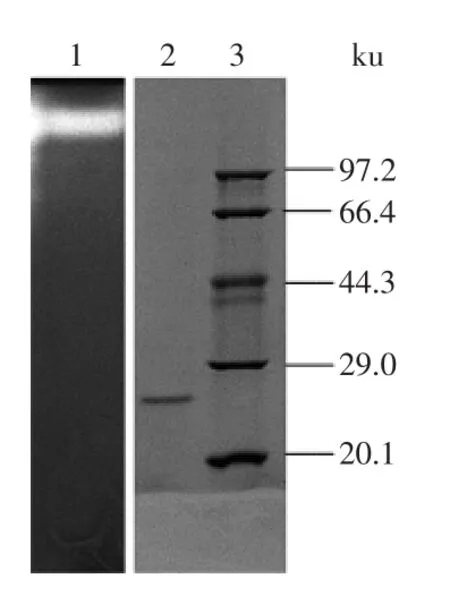
图2 蛋白酶P的SDS-PAGE与酶谱分析Fig.2 SDS-PAGE and zymography analysis of the purified P
2.3蛋白酶P的pH及温度特性
考察了pH、温度对蛋白酶P活性及稳定性的影响,结果如图3、图4所示。蛋白酶P的最适pH为9.0,最适温度为50℃。pH6~10条件下,酶活维持在90%以上;40℃放置120 min,酶活在95%以上,酶活稳定性较好。
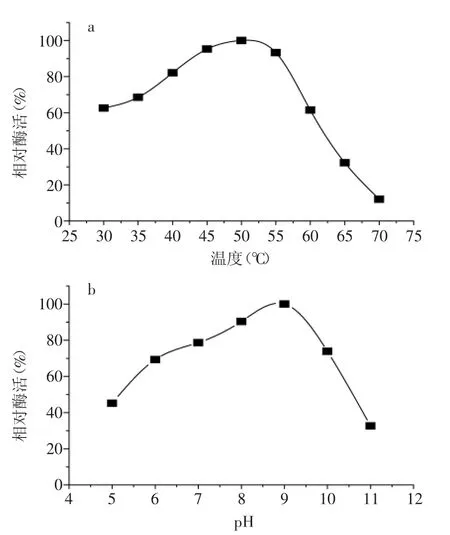
图3 pH、温度对蛋白酶P酶活的影响Fig.3 Effect of pH and temperature on enzyme activity of P
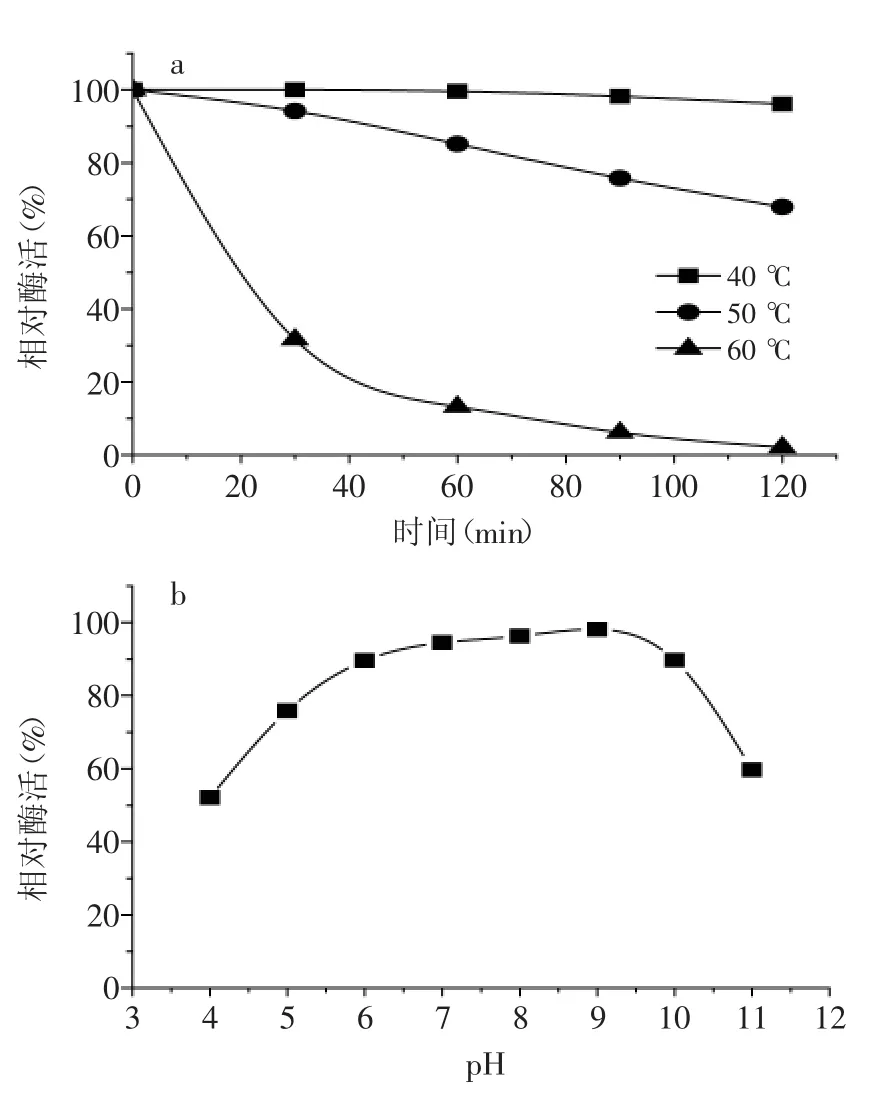
图4 pH、温度对蛋白酶P稳定性的影响Fig.4 Effect of pH and temperature on the enzyme stability of P
2.4蛋白酶P的动力学
以酪蛋白为底物,分别在不同底物浓度下测定蛋白酶P的活性。以底物浓度和产物(酪氨酸)生成量作图,以1/S为横坐标,1/V为纵坐标,得到蛋白酶P的双倒数曲线如图5所示,经米氏方程计算,得到P的表观米氏常数Km=1.23g·L-1,Vm=27.03 μg·mL-1·min-1。Km值反映了酶与底物的亲和力,较低的Km值说明蛋白酶P与酪蛋白具有较高的亲和力。

图5 蛋白酶P的米氏方程作图Fig.5 Plot of Michaelis-Menten equation of P
2.5金属离子对蛋白酶P酶活的影响
不同浓度金属离子对蛋白酶P酶活的影响如图6所示。Cu2+、Ca2+、Fe3+、Fe2+、Mg2+、Zn2+、Ni2+及Co2+对蛋白酶P均有不同程度的抑制作用,而Mn2+对蛋白酶P有激活作用,可以提高其酶活。
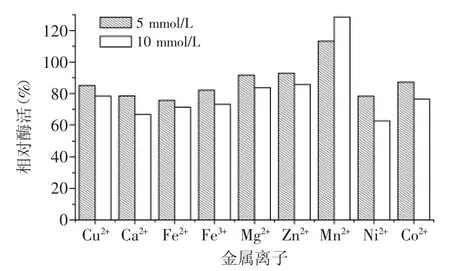
图6 金属离子对蛋白酶P酶活的影响Fig.6 Effect of metal ion on enzyme activity of P
2.6蛋白酶P的底物选择性及酶切位点
考察了蛋白酶P对酪蛋白(Casein)、牛血清白蛋白(BSA)和大豆分离蛋白(SPI)三种不同底物的水解活性(表2)。蛋白酶P对Casein的水解活性最高,其次为SPI,最差的是BSA。这与底物特性及蛋白酶的肽键选择性有密切联系,Casein是典型的疏水性蛋白,而BSA是一种亲水性蛋白,其肽链中疏水性氨基酸的比例相对较低,此表明蛋白酶P对疏水氨基酸构成的肽键有较强的选择性。

表2 蛋白酶P对不同蛋白底物的水解活性Table 2 Activity of P against different proteins
通过以上实验可知,蛋白酶P对于由疏水性氨基酸构成的肽键有相对较强的选择性。为了明确这一特性,以牛胰岛素氧化B链为底物,用MALDI-TOFMS测定牛胰岛素B链酶解后片断的分子量,并与牛胰岛素氧化B链随机片断的分子量比对,以此确定蛋白酶P在胰岛素B链上的酶切位点,如表3所示。可以看出蛋白酶P对牛胰岛素B链的-Phe-Val-,-Cys-Gly-,-Glu-Ala-和-Arg-Gly-组成的肽键有较强的切割能力,表明该蛋白酶对Phe、Val、Ala、Gly等疏水性氨基酸具有较高的选择性。

表3 蛋白酶P在胰岛素B链上的酶切位点Table 3 Cleavage sites of P on the oxidized insulin B chain
3 结论
米曲霉蛋白酶以其安全性高和酶系丰富等优点广泛应用于食品行业中,研究不同蛋白酶的酶解特性对于扩展其在食品中的应用具有重要意义。本文利用硫酸铵盐析、DEAE-FF层析、Butyl-HP层析和Superdux 75 10/300GL凝胶层析从米曲霉所产酶系中分离纯化出一种蛋白酶组分P,达到电泳纯,分子量约为27 ku左右,蛋白酶P的最适温度为50℃,最适pH为9.0,pH6~10内酶活稳定,40℃放置120 min,酶活仍能保持95%以上。
以Casein、SPI和BSA三种天然蛋白为底物时,蛋白酶P对疏水性蛋白Casein有较高的水解活性,说明该酶对蛋白底物中的疏水性肽键具有很强的切割能力;通过对蛋白酶P水解牛胰岛素氧化B链得到的肽段进行研究发现,蛋白酶P对牛胰岛素B链的-Phe-Val-,-Cys-Gly-,-Glu-Ala-和-Arg-Gly-组成的肽键有较强的切割能力,进一步表明该酶对疏水性氨基酸组成的肽键有较高的选择性。一般来说,多肽中疏水性氨基酸的含量越多苦味越强,而本研究分离纯化获得的蛋白酶P对疏水性氨基酸具有很强的选择性,因此可在一定程度上降低多肽的苦味,为其在食品中的应用提供理论指导。
[1]张树政.酶制剂工业[M].北京:科学出版社,1996:5.
[2]刘丽萍,刘丽华.米曲霉研究进展与应用[J].中国调味品,2008(4):28-32.
[3]傅力,章运,涂振东.米曲霉高产蛋白酶菌株的选育及在酱油酿造中的应用研究[J].新疆农业科学,2009,46(6):1274-1278.
[4]杨秋明,肖安风,杨远帆,等.米曲霉的定向发酵[J].重庆理工大学学报,2011,25(2):53-58.
[5]李艳丽,徐少春,徐尧兴.中性蛋白酶高产菌株的筛选及产酶酶系分析[J].生物技术,2007,17(1):20-23.
[6]曾小波,伍丽瑜,宋小焱,等.酱油曲蛋白酶的分离及催化性质研究[J].中国调味品,2010,35(1):50-52.
[7]马俊阳,诸葛斌,方慧英,等.米曲霉蛋白酶的分离纯化及酶学性质研究[J].微生物学通报,2014,41(1):83-89.
[8]Kembhavi AA,Kulkarni A.Pant A.Salt-tolerant and thermostable alkaline protease from Bacillus subtilis NCIM No. 64[J].Appl Biochem Biotechnol,1993(38):83-92.
[9]Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Anal Biochem,1976(72):248-254.
[10]汪家政,范明.蛋白质技术手册[M].北京:科学出版社,2000.
[11]Haddar A,Bougatef A,Agrebi R,et al.A novel surfactantstable alkaline serine-protease from a newly isolated Bacillus mojavensis A21.purification and characterization[J].Process Biochem,2009,44(1):29-35.
[12]Vishwanatha KS,Appu Rao AG,Singh SA.Characterisation of acid protease expressed from Aspergillus oryzae MTCC 5341[J].Food Chemistry,2009(114):402-407.
[13]汤鸣强,曾小芳.米曲霉F-81菌株产中性蛋白酶的分离纯化[J].生物技术通报,2010(4):194-197.
Purification and characterization of a protease from Aspergillus oryzae
ZONG Hong1,2,FENG Ying-jie1,2,LU Xin-yao1,2,ZHUGE Bin1,2,*,FANG Hui-ying1,2,SUN Jin3,FENG Qian3,LOU Xiao-xiao3,CHENG Ying-que2
(1.The Key Laboratory of Carbohydrate Chemisty and Biotechnology,Ministry of Education,Jiangnan University,Wuxi 214122,China;2.The Key Laboratory of Industrial Biotechnology,Ministry of Education,the Research Centre of Industrial Microbiology,Jiangnan University,Wuxi 214122,China;3.Zhejiang Zhengwei Food Co.Ltd.,Research Center of Seasoning Food Processing of Zhejiang,Yiwu 322000,China)
This study aimed to purify and characterize protease from Aspergillus oryzae.Ammonium sulfate precipitation,DEAE-FF anion exchange chromatography,Butyl-HP chromatography and Superdux 75 10/300GL gel filtration chromatography were used to purify the protease from A.oryzae.The molecular weights of the protease was approximately 27 ku.Using casein as a substrate,the Kmwas 1.23g·L-1,and the Vmwas 27.03 μg·mL-1·min-1.Moreover,the optimum conditions of the protease were 50℃ and pH9.0.The protease had the highest hydrolytic activity to casein while lowest activity to BSA(Bull Serum Albumin).The protease had cleavage ability between-Phe-Val-,-Cys-Gly-,-Glu-Ala and-Arg-Gly-residues in bovine insulin chain B,showing a wide range of residue specificity and high selectivity to hydrophobic amino acids.The results provided a reference for use of proteases from A.oryzae in food industry.
Aspergillus oryzae;protease;purification;cleavage site
TS201.1
A
1002-0306(2015)20-0210-05
10.13386/j.issn1002-0306.2015.20.036
2015-03-01
宗红(1981-),女,博士,讲师,研究方向:发酵工程,E-mail:zonghong163@163.com。
诸葛斌(1969-),男,博士,教授,研究方向:生物工程,E-mail:Bzhuge@163.com。
浙江省重大科技专项计划项目(2012C12004-3)。

