萝藦果壳多糖提取工艺优化及其抗氧化活性研究
白雨鑫,郭 斌,韩冠英,崔 錾(.辽宁医学院药学院,辽宁锦州000;.辽宁医学院附属第一医院,辽宁锦州000)
萝藦果壳多糖提取工艺优化及其抗氧化活性研究
白雨鑫1,郭斌2,*,韩冠英2,崔錾2
(1.辽宁医学院药学院,辽宁锦州121000;2.辽宁医学院附属第一医院,辽宁锦州121000)
在单因素实验基础上应用响应面法对萝藦果壳多糖提取条件进行优化并初步评价其体外抗氧化活性。优化的萝藦果壳多糖提取条件如下:料液比为1∶18(g/mL),提取温度为86℃,提取时间为3 h,提取次数为3次,此条件下的平均得率为11.22%;抗氧化活性实验结果表明萝藦果壳多糖对O2-、DPPH·的最高清除率分别为80.61%、73.01%。优化的萝藦果壳多糖提取工艺合理、可行,萝藦果壳多糖具有较强的抗氧化性。
萝藦果壳,多糖,响应面法,抗氧化活性
萝藦(Metaplexis japonica),萝藦科萝藦属,是多年生蔓性草本,在中国东北、西南、华南等地分布广泛。《本草汇言》中记载,“萝藦,温平培补,统治一切劳损力役之人,筋骨血脉久为劳力疲痹(惫)者,服此立安[1]”研究表明,其根、果壳、全草均可入药,现已发现其主要含有的强心苷、C21甾体、生物碱及多糖等成分均具有重要的生物活性[2-5]。目前对萝藦的研究主要集中在全草和根部,而对其果壳部位的研究较少。马寅达等采用水提醇沉的方法提取萝藦全草多糖,但多糖提取率为3.97%[6]。崔錾等从萝藦果壳部位提取多糖,发现其多糖提取率相对较高为4.97%[7],但未对多糖进行提取工艺优化及抗氧化活性等方面的研究。本文在前期研究基础上采用传统的水提醇沉方法提取萝藦果壳多糖,并应用响应面法(Response surface methodology,RSM)对多糖提取工艺影响较大的四个因素即料液比、提取温度、提取时间和提取次数进行优化,拟获得经济、科学的提取条件。采用DPPH法、邻苯三酚法和Fenton反应考察萝藦果壳多糖体外抗氧化活性,为进一步探讨其药理活性提供理论支持。
1 材料与方法
1.1材料与仪器
萝藦果壳辽宁省锦州市周边地区;1,1-二苯基-2-三硝基苯肼(DPPH) 购自美国sigma公司;邻苯三酚、三羟基甲基氨基甲烷(Tris)、水杨酸、硫酸亚铁(FeSO4) 均购自天津永晟精细化工有限公司;维生素C(VC) 购自国药集团,其他试剂均为国产分析纯。
UV-2550型紫外分光光度计日本岛津;真空干燥箱上海一恒公司;SHZ-D(Ⅲ)循环式真空泵上海东玺公司;BP 211D型电子分析天平德国Sartorius公司;恒温水浴锅上海腾方公司;旋转蒸发仪上海广英公司;LD4-2A(Ⅱ)离心机北京京力公司。
1.2实验方法
1.2.1萝藦果壳多糖的提取取一定量萝藦果壳粉碎并过40目筛,粉末经乙醚浸泡过夜,除去脂类、低聚糖、色素和小分子物质,挥发乙醚并干燥(55℃)[8]。在一定温度下用热水浸提干燥后的粉末,浸提后用300目筛网过滤,滤渣重复浸提数次,合并滤液。浓缩,醇沉使乙醇终浓度达到70%,4℃过夜,所得沉淀真空干燥后得萝藦果壳粗多糖。参照文献[9]采用苯酚-硫酸法测定多糖含量,绘制葡萄糖标准曲线为A=0.1624C+0.0039,相关系数r=0.9992,线性范围在0~100 μg/mL,并计算萝藦果壳粗多糖得率。

1.2.2单因素实验采用1.2.1下法提取萝藦果壳多糖,提取条件为:固定反应条件为提取温度60℃、提取时间2 h、提取次数2次,考察不同料液比(1∶10、1∶15、1∶20、1∶25、1∶30)对多糖得率的影响;固定反应条件为料液比1∶15、提取时间2 h、提取次数2次,考察不同温度(50、60、70、80、90℃)对多糖得率的影响;固定反应条件为料液比1∶15、提取温度60℃、提取次数2次,考察不同提取时间(1、2、3、4、5 h)对多糖得率的影响;固定每次反应条件为料液比1∶15、提取温度60℃、提取时间2 h,考察不同提取次数(1~5次)对多糖得率的影响。进行单因素实验,考察各因素变量对萝藦果壳多糖得率的影响。
1.2.3Box-Benhnken中心组合实验设计在单因素实验的基础上,每个因素选取三个对多糖得率影响较大的水平,建立四因素三水平的Box-Benhnken中心组合实验,以多糖得率为响应值,各因素的三个水平采用-1、0、1进行编码,如表1。
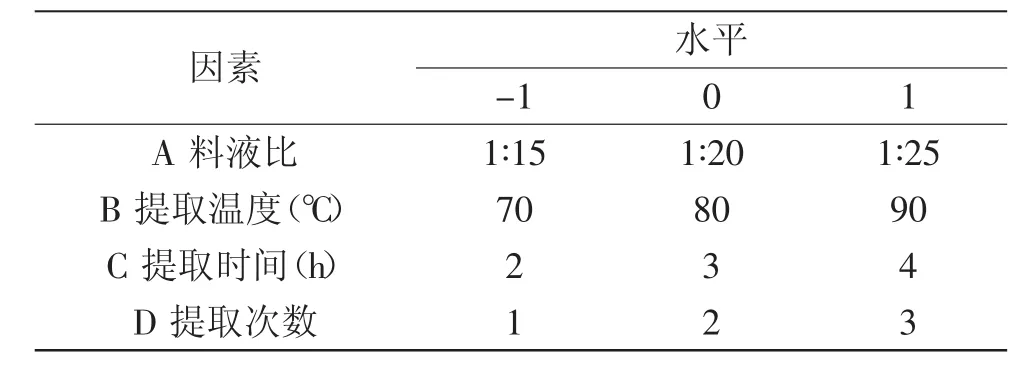
表1 响应曲面设计实验因素水平和编码Table 1 Independent variables and their levels used in the response surface design
1.2.4抗氧化性实验取一定量最佳工艺条件下制备的萝藦果壳多糖,进行抗氧化活性实验。
1.2.4.1DPPH·清除率的测定参照文献[10],用无水乙醇配制终浓度为20 μmol/L的DPPH·乙醇溶液,取1 mL该溶液与2 mL多糖溶液(0.25、0.5、1、2、4 mg/mL)暗处混合,室温反应30 min并测定混合液的吸光度(517 nm),样品溶液吸光度值记为A1,无水乙醇代替DPPH·乙醇溶液作为样品本底组,吸光度值记为A2,蒸馏水代替样品溶液作为空白组,吸光度值记为A0,VC作为阳性对照,清除率计算公式:
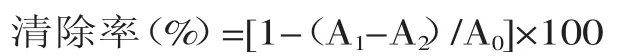
1.2.4.2超氧阴离子(O2-)清除率的测定参照文献[11],在10 mL比色管中加入4.5 mL Tris-HCl缓冲液(0.1 mol/L,pH8.2)、1 mL不同浓度多糖溶液(0.25、0.5、1、2、4 mg/mL)及2.4 mL蒸馏水混匀,10 min后加入0.1 mL的邻苯三酚(6 mmol/L)溶液,混匀,计时3 min后立即加入0.1 mL的HCl(10 mmol/L)终止反应,并测定混合溶液的吸光度(325 nm),样品溶液吸光度值记为A1,蒸馏水代替样品溶液作为空白组,吸光度值记为A0,VC作为阳性对照,清除率计算公式:

1.2.4.3羟自由基清除率的测定参照文献[12],在10 mL比色管中加入FeSO(46 mmol/L)、H2O(20.6 mmol/L)以及不同浓度的多糖溶液(0.25、0.5、1、2、4 mg/mL)各2mL摇匀静止10 min,之后加入2 mL水杨酸(6 mmol/L),摇匀静止30 min,并测定混合液的吸光度(510 nm),样品溶液吸光度值计为A1,蒸馏水代替H2O2作为样品本底组,吸光度值计为A2,以蒸馏水代替样品做空白组计为A0,VC作为阳性对照组,清除率计算公式如1.2.4.1。
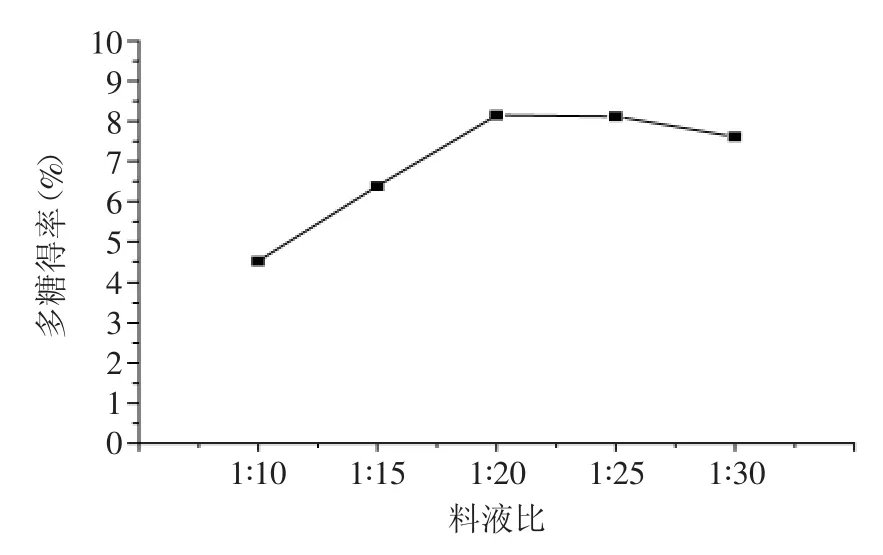
图1 料液比对多糖得率的影响Fig.1 Effect of ratios of water to material on extraction yield of polysaccharides
2 结果与分析
2.1单因素实验
2.1.1料液比对多糖得率的影响由图1可知,多糖得率随料液比的增加呈先增大后降低的趋势,料液比在1∶20时,多糖得率达到最大值,之后随料液比的增大而平缓下降。这是由于在一定范围内增加浸提液体积可以增大溶剂与浸提物的接触面积,使水溶性的多糖能够较多的溶出,但浸提液体积继续增大会使多糖的溶出达到饱和,得率趋于平稳或稍有降低[13]。考虑到浸提液体积过大会增加提取时间、消耗能量,浸提液体积过小又会使多糖提取不完全而浪费原料,所以,选择料液比在1∶15~1∶25之间最为合适。

图2 提取温度对多糖得率的影响Fig.2 Effect of temperature on extraction yieldof polysaccharides
2.1.2提取温度对多糖得率的影响由图2可知,多糖的得率随温度的升高而升高。温度较低时,多糖溶出缓慢,当温度大于70℃时,多糖得率明显增加,但继续增高温度多糖的得率增加缓慢,这可能因为高温会破坏多糖结构[14],并且温度过高会消耗能量,故选择提取温度为80℃左右较为合理。
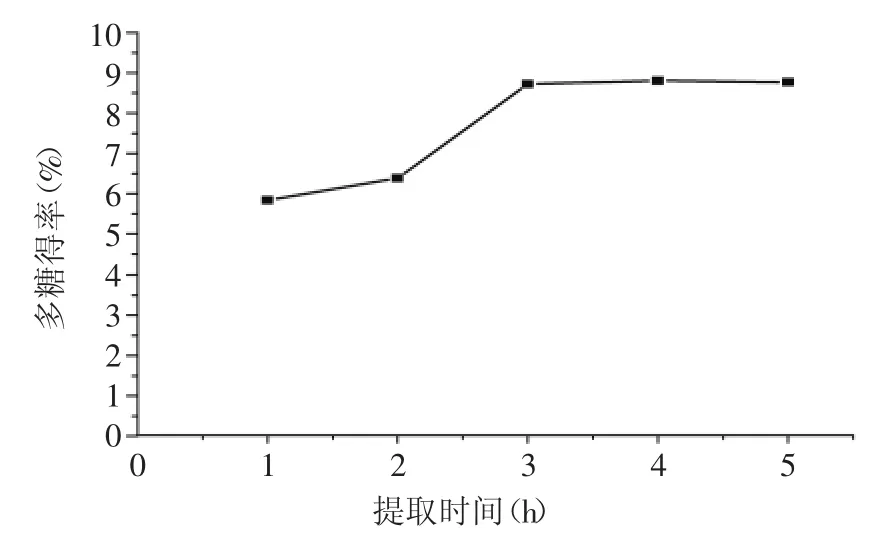
图3 提取时间对多糖得率的影响Fig.3 Effect of time on extraction yield of polysaccharides
2.1.3提取时间对多糖得率的影响由图3可知,多糖得率随时间的增加而增加。提取时间较短时,多糖溶出不完全,当提取时间为2~3 h时多糖的提取量明显增加,但继续延长提取时间,多糖的提取量趋于平稳,出于节约时间的考虑,选取提取时间为3 h左右。
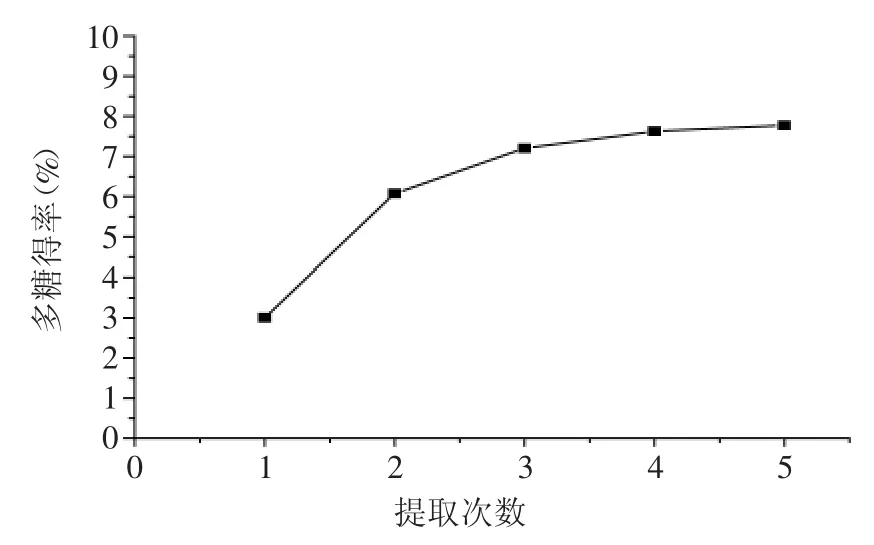
图4 提取次数对多糖得率的影响Fig.4 Effect of extraction on extraction yield of polysaccharides
2.1.4提取次数对多糖得率的影响由图4可知,多糖得率随提取次数的增加而呈先增加后趋于平缓的趋势。当提取次数小于3次时,多糖得率增加明显,提取4次时,多糖得率达到最大值,当第5次提取后得率基本保持平稳,这可能是因为多糖的提取量已达最大值,继续提取不会增加得率,反而增加时间和原料的消耗,故选择提取3次。
2.2BBD实验结果及数据分析
2.2.1BBD实验设计方案及结果根据单因素实验结果,由Design-Expert 8.0.6统计分析软件设计出的实验方案及实验结果如表2所示,以萝藦果壳多糖得率为响应值,以料液比(A)、提取温度(B)、提取时间(C)、提取次数(D)为自变量,建立四因素三水平中心组合实验设计共包括29个实验方案,其中24个析因实验点,5个中心实验点,用以计算实验误差。

表2 响应面实验设计及多糖得率Table 2 RSM design and polysaccharides yield
2.2.2回归方程拟合及方差分析采用Design Expert8.0.6统计软件对所得数据进行回归分析,回归分析结果见表3,对各因素回归拟合后,得到回归方程:
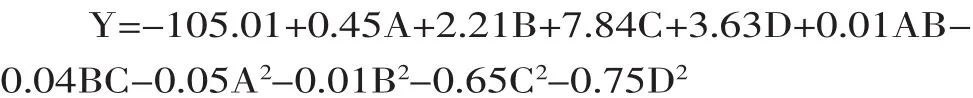
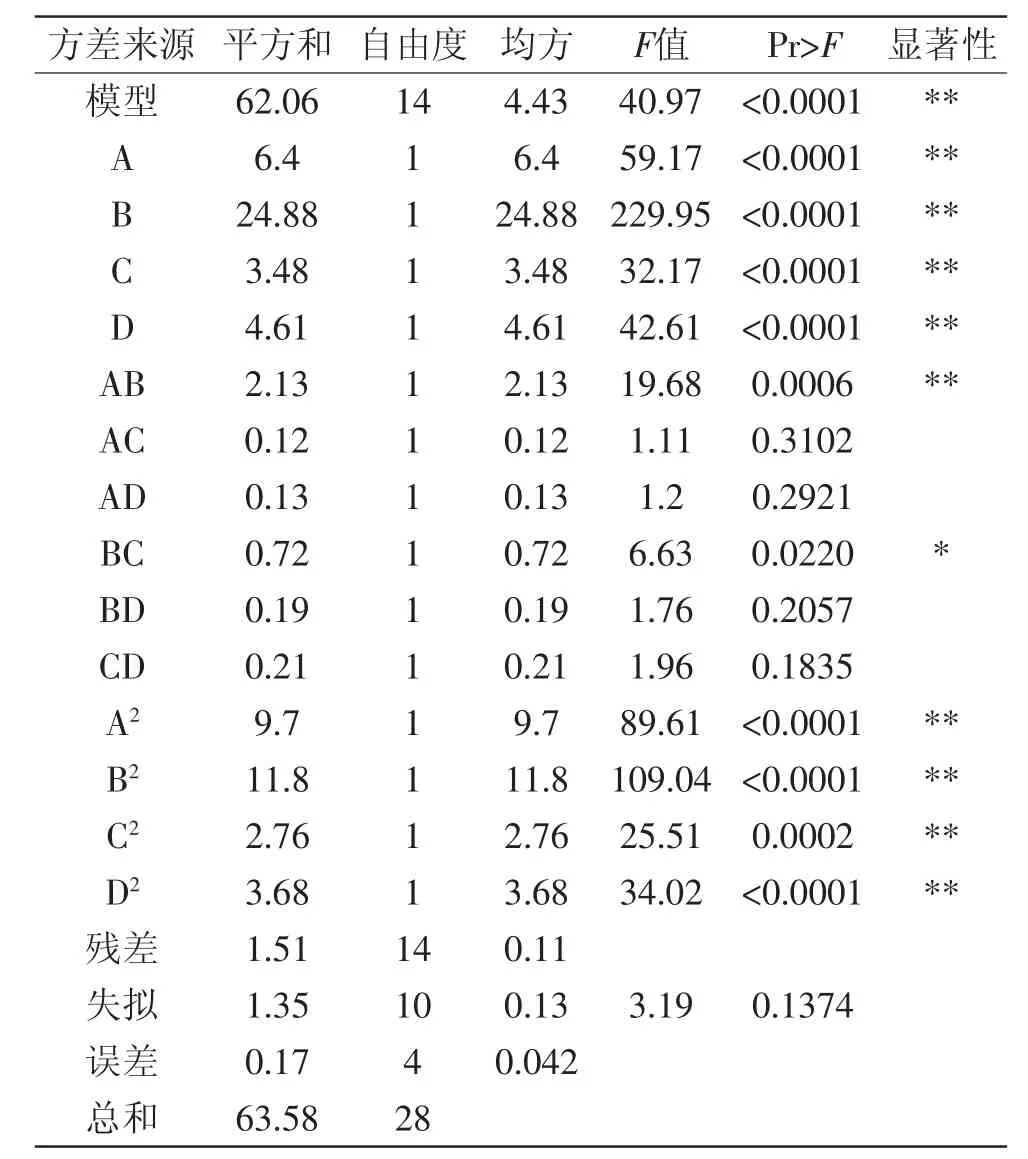
表3 回归模型及方差分析Table 3 Analysis of variance of regression equation
回归模型的R2=0.9762,R2Adj=0.9523,由方差分析可知回归方程模型极显著(p<0.0001),说明该模型与实际拟合良好,实验方法可靠,失拟项不显著(p>0.05),说明所得方程与实际拟合中非正常误差所占比例小,可用该回归方程代替实验真实点对实验结果进行分析。结果表明,料液比(A)、提取温度(B)、提取时间(C)、提取次数(D)、料液比与提取温度交互项(AB)、提取温度与提取时间交互项(BC)、料液比二次项(A2)、提取温度二次项(B2)、提取时间二次项(C2)、提取次数二次项(D2)对响应值影响显著,各因素对响应值显著性的排序为B>A>D>C。
2.2.3响应面图分析响应面法是优化存在多因素影响实验条件的寻优方法,通过固定数量的实验次数可以连续的对实验因素进行分析,并得到直观的3D曲面图进而评价各因素间的交互作用[15-16]。根据软件Design-Expert获得响应值的3D曲面,分析各因素对多糖得率的影响及各因素间的交互作用。图5中所示为当固定料液比、提取温度、提取时间、提取次数中任意两个因素为零水平时,其余两个因素间的交互作用及对多糖得率的影响。多糖得率随其中任意两个变量的增加均呈上升趋势,达到某一定值时,曲面稍下降或趋于平缓。结果如图5(a~f)所示,其中图5(a)和图5(b)曲面陡峭,说明料液比和提取温度、提取温度和提取时间之间交互作用较明显,与方差分析结果相符。
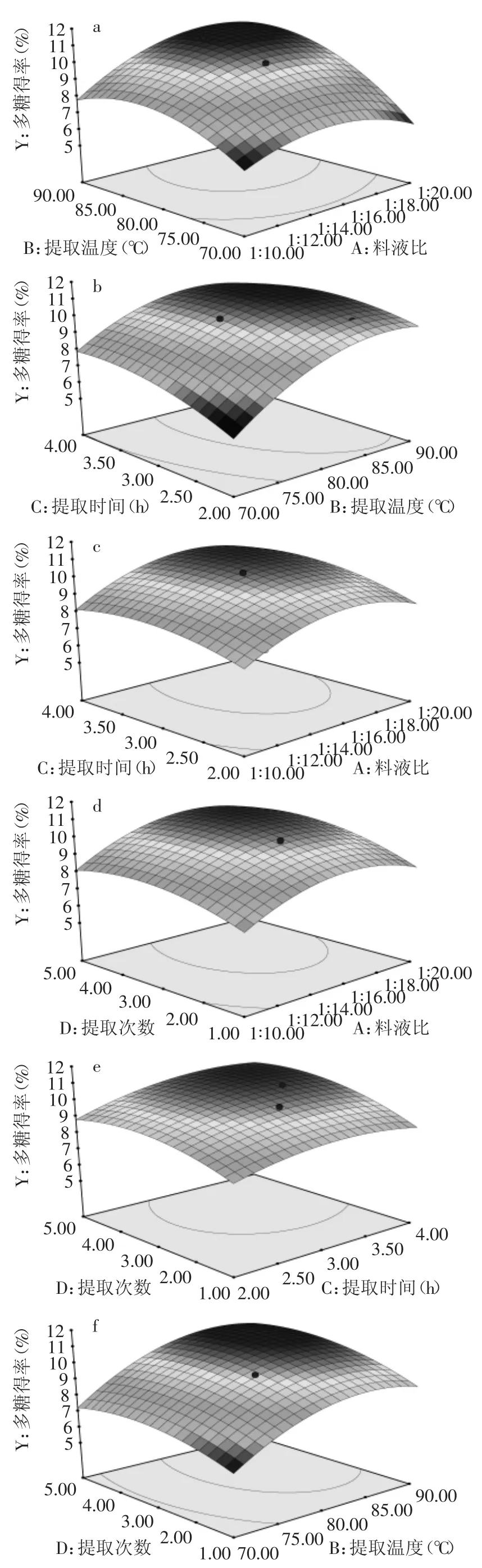
图5 两因素的交互作用对多糖得率的响应面图Fig.5 Response surface plots of variable parameters on the yield of polysaccharides
图5(a)所示为固定提取时间和提取次数为零水平,料液比和提取温度对多糖得率的影响和两者之间的交互作用。料液比较低时,得率随提取温度增加呈先上升后平缓下降的趋势,料液比较高时,得率随温度增加先上升,达到某一定值时趋于平缓;固定提取温度不变时,多糖得率随料液比增加呈先上升后平缓下降的趋势。综合响应面图可以看出,提取温度上升的幅度较料液比稍陡峭,说明提取温度对多糖得率的影响较料液比稍大。图5(b)所示为固定料液比和提取次数为零水平,提取温度和提取时间对多糖得率的影响和两者之间的交互作用。多糖得率随提取温度和提取时间的增加呈先上升后平缓下降的趋势,且提取温度的上升幅度明显大于提取时间的上升幅度,说明提取温度对多糖得率的影响较大。
2.2.4验证实验对回归方程求解,即得率达到最大值时的提取条件为料液比为1∶17.87、提取温度为86.32℃、提取时间为2.9 h、提取次数为2.95次,最大多糖得率达到11.18%,为方便实际操作将实验条件定为料液比为1∶18、提取温度为86℃、提取时间为3 h、提取次数为3次。取三等份萝藦果壳多糖的干燥粉末进行平行验证实验,验证实验所得平均得率为11.22%,平均多糖含量为26.91%。结果表明,经过响应回归方程拟合出的理论值与实际值相吻合,证明用响应面法可以有效的优化萝藦果壳多糖提取工艺。
2.2.5DPPH·清除率测定结果DPPH·具有单电子,在517 nm处有强吸收,其醇溶液呈紫色,当体系中加入抗氧化性物质时,该物质能与DPPH·的单电子配对,使其吸收逐渐消失,进而评价清除剂的清除能力[17]。萝藦果壳多糖对DPPH·的清除作用结果如图6所示,以VC作为对照,在浓度低于1 mg/mL时,萝藦果壳多糖对DPPH·的清除作用随多糖浓度的增加呈递增趋势,大于1 mg/mL后,多糖清除DPPH·的能力趋于稳定,多糖浓度为4 mg/mL时清除作用达到最大值73.01%,结果表明萝藦果壳多糖具有较好的清除DPPH·自由基的作用。
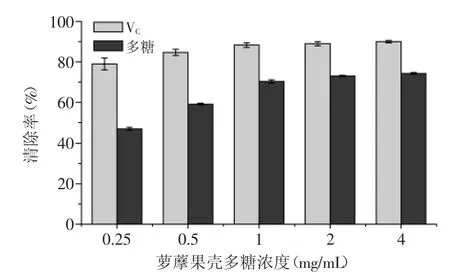
图6MJNP对DPPH·的清除作用Fig.6 DPPH radical-scavenging activities of MJNP
2.2.6O2-清除率测定结果体外生成O2-的方法为邻苯三酚法,其本质是邻苯三酚在碱性环境中发生自氧化链式反应并释放大量的O2,O2又进一步加速邻苯三酚氧化,生成一系列在可见光区有特征吸收的中间产物,若反应体系中加入抗氧化物质,在325 nm处的吸光度变小,进而间接评价其抗氧化活性[18]。萝藦果壳多糖清除O2-的作用结果如图7所示,多糖浓度在0~1 mg/mL之间时,清除O2-的能力明显递增,但多糖浓度1 mg/mL时O2-清除率达到最大值80.61%,随后清除率趋于平稳,说明萝藦果壳多糖有较好的清除O2-的能力。

图7 MJNP对O2-的清除作用Fig.7 O2-radical-scavenging activities of MJNP
2.2.7·OH清除率测定结果·OH是一种氧化能力很强的活性氧自由基,会使机体产生氧化损伤,与多种疾病的发生有关。体外生成·OH的方法为Fenton反应,其实质是H2O2在Fe2+的催化作用下生成具有高反应活性的羟自由基(·OH),水杨酸能有效捕捉·OH并生成有色物质,在510 nm处有最大吸收,当加入具有清除作用的物质时会使510 nm处的吸光度降低,进而评价其抗氧化能力[19]。萝藦果壳多糖清除·OH的能力如图8所示,清除能力随多糖浓度增加而增加,浓度达到0.5 mg/mL后清除率能达到50%左右,说明萝藦果壳多糖具有一定的清除·OH作用,但清除能力明显低于阳性对照组VC。
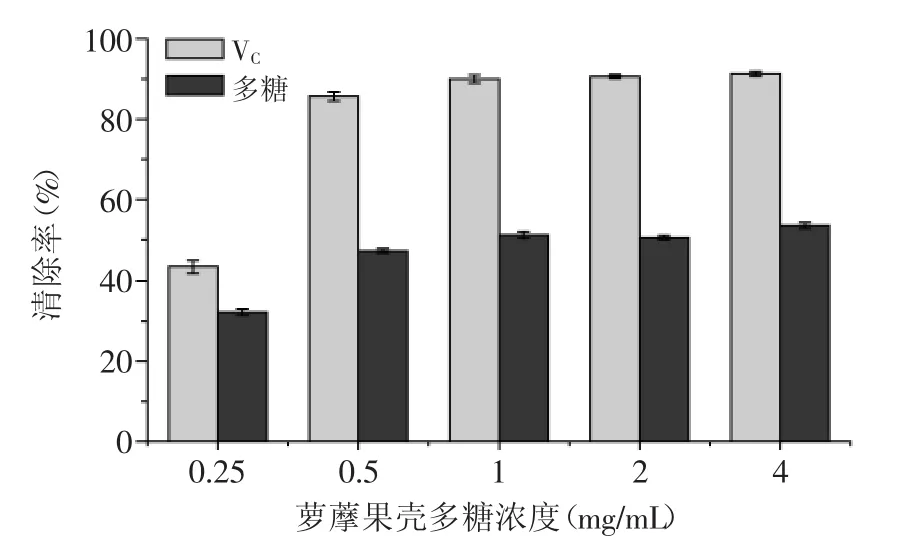
图8MJNP对·OH的清除作用Fig.8·OH radical-scavenging activities of MJNP
3 结论
采用响应面法对萝藦果壳多糖的提取条件进行优化,建立了多糖得率的回归模型,由该模型优化的多糖提取条件为料液比1∶18、提取温度86℃、提取时间3 h、提取次数3次。此条件下,萝藦果壳多糖的平均得率为11.22%,与模型预测结果相近,进一步验证了该模型的可靠性。通过苯酚-硫酸法测定最优工艺条件下制备的多糖中总糖含量为26.91%,高于前期研究。这可能因为提取时间、提取次数及提取温度较前期研究均有提高,多糖得率增加,故多糖百分含量较高。抗氧化活性实验表明萝藦果壳多糖对DPPH·、O2-、·OH均具有一定的清除能力,其中对O2-、DPPH·清除作用明显,说明萝藦果壳多糖具有较好的抗氧化活性。
[1]张浩东,马传福.萝藦药用成分与药用价值研究进展[J].吉林工商学院学报,2013,29(2):97-99.
[2]杨蕾,陈强,宋洁琼,等.中药萝藦中C21甾苷的含量测定[J].安徽农业科学,2012,40(2):12-15.
[3]李晓誉.两种萝藦科植物的C21甾体苷类成分和免疫活性研究[D].杭州:浙江大学,2006.
[4]陈聪颖.催吐白前和萝藦科植物Tylophora tanakae中菲并吲哚里西啶生物碱对敏感的或耐药癌细胞株的体外细胞毒活性[J].国外医药(植物药分册),2003,65(3):118-119.
[5]曹阳阳.萝藦多糖的分离纯化及萝藦多糖对CCl4诱导的小鼠肝损伤的保护研究[D].锦州:辽宁医学院,2013.
[6]马寅达,郭斌.萝藦总多糖的提取工艺优化[J].中国生化药物杂志,2012,33(2):163-165.
[7]崔錾,韩冠英,马寅达,等.萝藦果壳多糖脱蛋白方法研究[J].中国现代应用药学,2013,13(8):856-859.
[8]Agata Z,Corinne R M,Catherine G,et al.Alkaline extractability of pectic arabinan and galactan and their mobility in sugar beet and potato cell walls[J].Carbohydrate Polymers,2006,65(2):510-520.
[9]李海平,陈瑞战,金辰光,等.黄芩多糖的超声提取工艺优化及抗氧化活性研究[J].食品工业科技,2014,16(36):237-242.
[10]Zhao Z,Xu X,Ye Q,et al.Ultrasound extraction optimization of Acanthopanax senticosus polysaccharides and its antioxidant activity[J].International Journal of Biological Macromolecules,2013,59(12):290-294.
[11]任雪峰,李帅,刘军军,等.酶解-超声协同提取茄蒂多糖及抗氧化研究[J].食品工业,2014,71(4):246-250.
[12]李亚辉,马艳弘,黄开红,等.响应面法优化复合酶提取芦荟多糖工艺及其抗氧化活性分析[J].食品科学,2014,35(18):63-68.
[13]Bendahou A,Dufresen A,Kaddami H,et al.Isolation and structuralcharacterizationofhemicellulosesfrompalmof Phonenix dactylifera L[J].Carbohydrate Polymers,2007(68):601-605.
[14]Ye C L,Jiang C J.Optimization of extraction process of crude polysaccharides from Plantago asiatica L.by response surface methodology[J].Carbohydrate Polymers,2011,84(6):495-502.
[15]Liu C L,Lin T H,Juang R S.Optimization of recombinant hexaoligochitin-producing chitinase production with response surface methodology[J].Carbohydrate Polymers,2013,62(10):518-522.
[16]Ghorbel B O,Hajji S,Younes I,et al.Optimization of chitin extraction from shrimp waste with Bacillus pumilus A1 using response surface methodology[J].International journal of biological macromolecules,2013,61(2):243-250.
[17]Zhou S H,Fang Z X,Yuan Lü.Phenolics and antioxidant properties of bayberry(Myrica rubra Sieb.et Zucc.)pomace[J]. Food Chemistry,2009,112(2):394-399.
[18]Kan Y G,Chen T Q,Wu Y B.Antioxidant activity of polysaccharide extracted from Ganoderma lucidum using response surfacemethodology[J].InternationalJournalofBiological Macromolecules,2015,72(8):151-157.
[19]王应男,张公亮,刘洋,等.榆耳菌丝体多糖的体外抗氧化活性研究[J].食品工业科技,2012,33(12):194-213.
Optimization of extraction process of polysaccharides from Metaplexis japonica Makino nutshell and evaluation of antioxidative activity
BAI Yu-xin1,GUO Bin2,*,HAN Guan-ying2,CUI Zan2
(1.School of Pharmaceutical Sciences,Liaoning Medical University,Jinzhou 121000,China;2.The NO.1 Affiliated Hospital of Liaoning Medical University,Jinzhou 121000,China)
Based on the single factor experiments,the response surface methodology(RSM)was employed to optimize the extraction conditions of polysaccharides from Metaplexis japonica Makino nutshell(MJNP)and its antioxidant activity was primarily evaluated.The results of optimum extraction conditions were as follow:the ratio of water to raw material 1∶18(g/mL),extraction temperature 86℃,extraction time 3 h and number of extraction 3 times.Under these conditions,the average extraction yield was 11.22%.The results of antioxidation experiments showed that the highest scavenging capacity of polysaccharides against O2-,DPPH was 80.61%,73.01%respectively.The optimization of MJNP extraction process technology was reasonable and feasible,MJNP had stronger antioxidant activity.
Metaplexis japonica Makino nutshell;polysaccharide;response surface;antioxidant activity
TS201.1
B
1002-0306(2015)20-0278-06
10.13386/j.issn1002-0306.2015.20.049
2015-03-01
白雨鑫(1990-),女,硕士研究生,研究方向:多糖物质的研究,E-mail:15134156949@163.com。
郭斌(1969-),男,教授,研究方向:海洋药物资源的开发研究,E-mail:jyguobin@126.com。
辽宁省科技厅科技攻关计划(2013225305)。

